Оксиды неметаллов
бывают солеобразующими и несолеоб-разующими.
К несолеобразующим относят оксиды
некоторых неметаллов в низких степенях
окисления (+1 и +2). Например:
,
N+2O,
C+2O
и др. Они не взаимодействуют с водой и
не образуют соли с основными и амфотерными
гидроксидами.
Солеобразующие
оксиды образуют неметаллы, находящиеся,
как правило, в высоких степенях окисления
(+3 и выше). Например:
,
,
,
S+4O2,
S+6O3
и др. Все солеобразующие
оксиды неметаллов являются кислотными.
1) Большинство
кислотных оксидов неметаллов
взаимодействуют с водой с образованием
кислот:
SO3
+ H2О
= H2SО4
P2O5
+ H2О
= 2H3PО4
В
этой связи кислотные оксиды иногда
называют ангидридами
(SO3
серный ангидрид, P2O5
фосфорный ангидрид).
2) Кислотные
оксиды неметаллов
реагируют с гидроксидами металлов,
образуя соль и воду:
SО2
+ 2NaOH = Na2SO3
+ H2O
P2O5
+ 6KOH = 2K3PO4
+ 3H2O
3) Кислотные
оксиды неметаллов
реагируют с основными и амфотерными
оксидами с образованием солей:
CO2
+ Na2O
= Na2СO3
Al2O3
+ 3SO3
= Al2(SO4)3
2.2. Гидроксиды
Гидроксидами
называют сложные вещества состава
HxЭyOz.
I. Гидроксиды металлов.
Как и
оксиды, гидроксиды металлов делятся на
оснóвные,
амфотерные
и кислотные.
2.2.1. Получение гидроксидов металлов
Растворимые
гидроксиды металлов (щелочи) получают
взаимодействием металлов или их оксидов
с водой:
2Na
+ 2H2O
= 2NaOH
+ H2↑
CaO
+
H2O
= Ca(OH)2
Малорастворимые
гидроксиды металлов получают, действуя
щелочами на водные растворы соответствующих
солей:
FeSO4
+ 2NaOH = Fe(OH)2↓
+ Na2SO4
AlCl3
+ 3KOH = Al(OH)3↓
+ 3KCl
1. Оснóвные гидроксиды.
Основные
гидроксиды образуют металлы в степенях
окисления +1 и +2. Например: Na+1OH,
Ca+2(OH)2,
Fe+2(OH)2
и др. Основные гидроксиды металлов
называют основаниями.
Растворимые в воде гидроксиды металлов
называют щелочами.
Щелочи
полностью диссоциируют в воде с
образованием гидроксид-ионов OH:
NaOH
Na+
+ OH
Ba(OH)2
Ba2+
+ 2OH
Названия
основных гидроксидов металлов включают
слово гидроксид и название металла.
Если металл проявляет различные степени
окисления, то она указывается в скобках
римскими цифрами:
NaOH
гидроксид натрия;
Fe(OH)2
гидроксид железа (II).
Наиболее
важными свойствами оснований являются
следующие:
1) Малорастворимые
основания при нагревании разлагаются
с образованием оксидов металлов:
Cu(OH)2
= CuO + H2O
2Fe(OH)3
= Fe2O3
+ 3H2O
2) Все
основания взаимодействуют с кислотами,
образуя соль и воду:
КОН
+ НСl
= КСl
+ Н2О
Cu(OH)2
+ H2SO4
= CuSO4
+ 2H2O
Взаимодействие
кислот с основаниями называется реакцией
нейтрализации.
3) Основания
реагируют с кислотными оксидами, образуя
соль и воду:
Са(ОH)2
+ СО2
= СаСО3
+ H2O
2. Кислотные гидроксиды.
Кислотные
гидроксиды образуют металлы в высоких
степенях окисления +5 и выше. Например:
H2Cr+6O4,
HMn+7O4.
Кислотные гидроксиды называют кислотами.
Они диссоциируют в воде с образованием
ионов H+:
H2CrO4
2H+
+ CrO42
HMnO4
H+
+ MnO4
и могут
образовывать соли с металлами:
Na2CrO4
хромат натрия; KMnO4
перманганат калия.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Оксиды — это сложные вещества, состоящие из атомов двух элементов, один из которых — кислород со степенью окисления -2. При этом кислород связан только с менее электроотрицательным элементом.
В зависимости от второго элемента оксиды проявляют разные химические свойства. В школьном курсе оксиды традиционно делят на солеобразующие и несолеобразующие. Некоторые оксиды относят к солеобразным (двойным).
Двойные оксиды — это некоторые оксиды , образованные элементом с разными степенями окисления.
Солеобразующие оксиды делят на основные, амфотерные и кислотные.
Основные оксиды — это оксиды, обладающие характерными основными свойствами. К ним относят оксиды, образованные атомами металлов со степень окисления +1 и +2.
Кислотные оксиды — это оксиды, характеризующиеся кислотными свойствами. К ним относят оксиды, образованные атомами металлов со степенью окисления +5, +6 и +7, а также атомами неметаллов.
Амфотерные оксиды — это оксиды, характеризующиеся и основными, и кислотными свойствами. Это оксиды металлов со степенью окисления +3 и +4, а также четыре оксида со степенью окисления +2: ZnO, PbO, SnO и BeO.
Несолеобразующие оксиды не проявляют характерных основных или кислотных свойств, им не соответствуют гидроксиды. К несолеобразующим относят четыре оксида: CO, NO, N2O и SiO.
Классификация оксидов
Тренировочные тесты по теме Классификация оксидов.
Получение оксидов
Общие способы получения оксидов:
1. Взаимодействие простых веществ с кислородом:
1.1. Окисление металлов: большинство металлов окисляются кислородом до оксидов с устойчивыми степенями окисления.
Например, алюминий взаимодействует с кислородом с образованием оксида:
4Al + 3O2 → 2Al2O3
Не взаимодействуют с кислородом золото, платина, палладий.
Натрий при окислении кислородом воздуха образует преимущественно пероксид Na2O2,
2Na + O2 → Na2O2
Калий, цезий, рубидий образуют преимущественно надпероксиды состава MeO2:
K + O2 → KO2
Примечания: металлы с переменной степенью окисления окисляются кислородом воздуха, как правило, до промежуточной степени окисления (+3):
4Fe + 3O2 → 2Fe2O3
4Cr + 3O2 → 2Cr2O3
Железо также горит с образованием железной окалины — оксида железа (II, III):
3Fe + 2O2 → Fe3O4
1.2. Окисление простых веществ-неметаллов.
Как правило, при окислении неметаллов образуется оксид неметалла с высшей степенью окисления, если кислород в избытке, или оксид неметалла с промежуточной степенью окисления, если кислород в недостатке.
Например, фосфор окисляется избытком кислорода до оксида фосфора (V), а под действием недостатка кислорода до оксида фосфора (III):
4P + 5O2(изб.) → 2P2O5
4P + 3O2(нед.) → 2P2O3
Но есть некоторые исключения.
Например, сера сгорает только до оксида серы (IV):
S + O2 → SO2
Оксид серы (VI) можно получить только окислением оксида серы (IV) в жестких условиях в присутствии катализатора:
2SO2 + O2 = 2SO3
Азот окисляется кислородом только при очень высокой температуре (около 2000оС), либо под действием электрического разряда, и только до оксида азота (II):
N2 + O2 = 2NO
Не окисляется кислородом фтор F2 (сам фтор окисляет кислород). Не взаимодействуют с кислородом прочие галогены (хлор Cl2, бром и др.), инертные газы (гелий He, неон, аргон, криптон).
2. Окисление сложных веществ (бинарных соединений): сульфидов, гидридов, фосфидов и т.д.
При окислении кислородом сложных веществ, состоящих, как правило, из двух элементов, образуется смесь оксидов этих элементов в устойчивых степенях окисления.
Например, при сжигании пирита FeS2 образуются оксид железа (III) и оксид серы (IV):
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
Сероводород горит с образованием оксида серы (IV) при избытке кислорода и с образованием серы при недостатке кислорода:
2H2S + 3O2(изб.) → 2H2O + 2SO2
2H2S + O2(нед.) → 2H2O + 2S
А вот аммиак горит с образованием простого вещества N2, т.к. азот реагирует с кислородом только в жестких условиях:
4NH3 + 3O2 →2N2 + 6H2O
А вот в присутствии катализатора аммиак окисляется кислородом до оксида азота (II):
4NH3 + 5O2 → 4NO + 6H2O
3. Разложение гидроксидов. Оксиды можно получить также из гидроксидов — кислот или оснований. Некоторые гидроксиды неустойчивы, и самопроизвольную распадаются на оксид и воду; для разложения некоторых других (как правило, нерастворимых в воде) гидроксидов необходимо их нагревать (прокаливать).
гидроксид → оксид + вода
Самопроизвольно разлагаются в водном растворе угольная кислота, сернистая кислота, гидроксид аммония, гидроксиды серебра (I), меди (I):
H2CO3 → H2O + CO2
H2SO3 → H2O + SO2
NH4OH → NH3 + H2O
2AgOH → Ag2O + H2O
2CuOH → Cu2O + H2O
При нагревании разлагаются на оксиды большинство нерастворимых гидроксидов — кремниевая кислота, гидроксиды тяжелых металлов — гидроксид железа (III) и др.:
H2SiO3 → H2O + SiO2
2Fe(OH)3 → Fe2O3 + 3H2O
4. Еще один способ получения оксидов — разложение сложных соединений — солей.
Например, нерастворимые карбонаты и карбонат лития при нагревании разлагаются на оксиды:
Li2CO3 → CO2 + Li2O
CaCO3 → CaO + CO2
Соли, образованные сильными кислотами-окислителями (нитраты, сульфаты, перхлораты и др.), при нагревании, как правило, разлагаются с с изменением степени окисления:
2Zn(NO3)2 → 2ZnO + 4NO2 + O2
Более подробно про разложение нитратов можно прочитать в статье Окислительно-восстановительные реакции.
Химические свойства оксидов
Значительная часть химических свойств оксидов описывается схемой взаимосвязи основных классов неорганических веществ.
Химические свойства основных оксидов
Подробно про химические свойства оксидов можно прочитать в соответствующих статьях:
Химические свойства основных оксидов.
Химические свойства кислотных оксидов.
Химические свойства амфотерных оксидов.
Классификация оксидов
Материал по химии
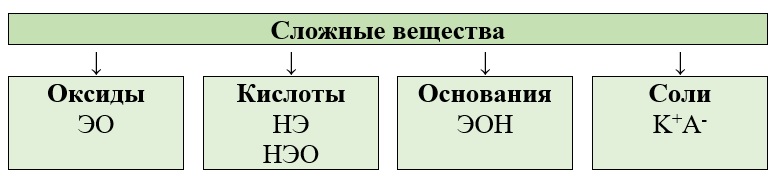
Все сложные неорганические вещества можно разделить на следующие группы:
Классификация оксидов
Классификация веществ
Рассмотрим эти классы по отдельности, начиная с оксидов.
Оксиды – это соединения кислорода в степени окисления «‒2» с другими элементами. Но не все соединения кислорода с элементами будут являться оксидами, степень окисления кислорода очень важна!
Таб. «Соединения кислорода»
* Так как фтор принимает только отрицательную степень окисления (так как может выступать только в качестве окислителя), кислород во фториде кислорода может быть только положительным. Положительные ионы записываются первыми в формуле, поэтому правильнее писать OF2.
** Hадпероксид калия состоит из ионов K+ и O2-1.
Зачем нужно знать классификацию оксидов?
Рассмотрим несколько уравнений:
- K2O + H2O = 2KOH
- CaO + H2O = Ca(OH)2
- FeO + H2O ≠
- CuO + H2O ≠
Почему какие-то оксиды реагируют с водой, а другие – нет? Нужно знать классификацию оксидов на растворимые и нерастворимые.
- CaO + N2O3 = Ca(NO3)2
- CaO + Cs2O ≠
Как определить, какие оксиды реагируют друг с другом, а какие нет? Для ответа на этот вопрос нужно знать, какие оксиды относятся к кислотным, а какие к основным, амфотерным или несолеобразующим.
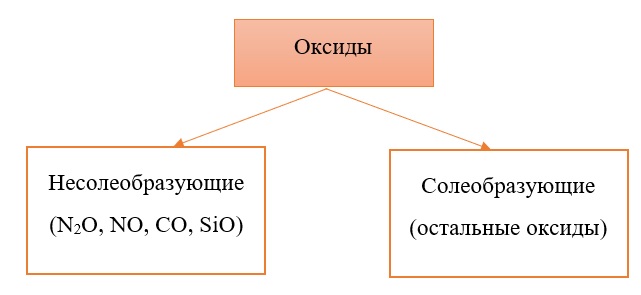
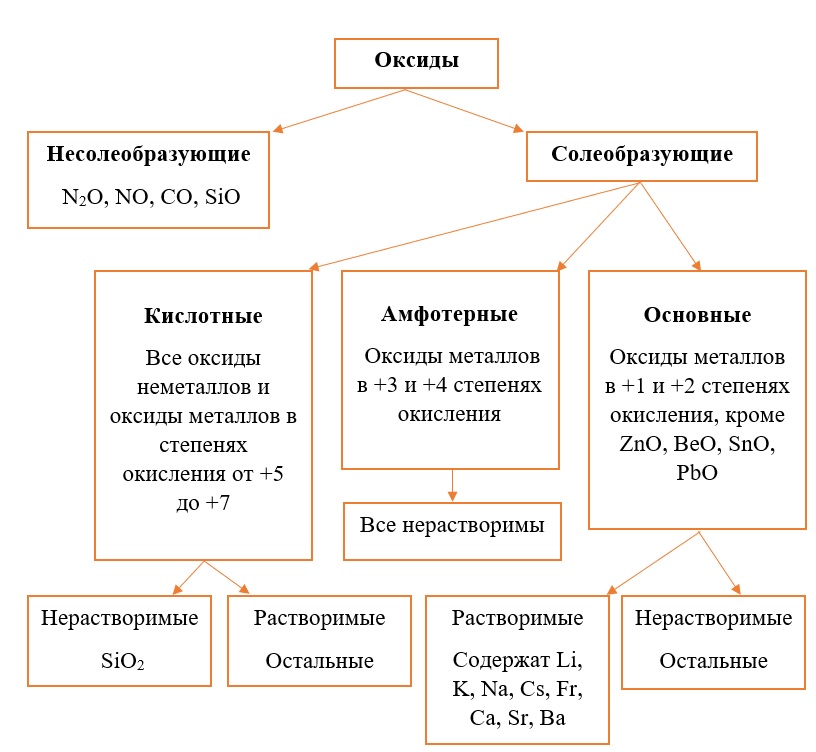
Классификация оксидов на солеобразующие и несолеобразующие
Существует две группы оксидов – те, что при взаимодействии с кислотами/основаниями или друг с другом образуют соли и те, что не вступают в типичные реакции оксидов и не способны образовывать соли (несолеобразующие), их свойства рассматриваются отдельно.
Самыми распространёнными несолеобразующими оксидами являются: N2O, NO, CO, SiO, остальные оксиды считаем солеобразующими (с типичными свойствами).
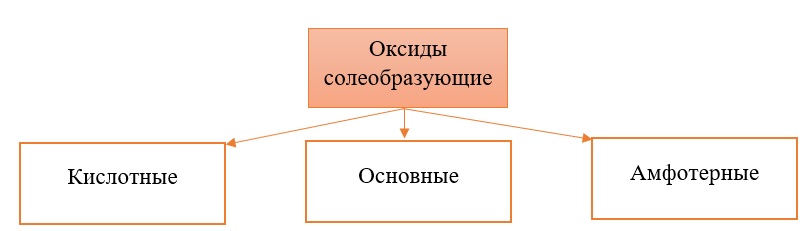
Классификация солеобразующих оксидов
Все солеобразующие оксиды делятся на основные, кислотные и амфотерные.
Кислотные оксиды соответствуют определенным кислотам, они легко взаимодействуют со своими противоположностями – основными веществами.
Основные оксиды соответствуют определенным основаниям, они легко взаимодействуют со своими противоположностями – кислотными веществами.
Амфотерные оксиды, соответствуют определённым гидроксидам, имеют двойственную природу: с кислотными веществами реагируют как основные соединения, а с основными – как кислотные соединения.
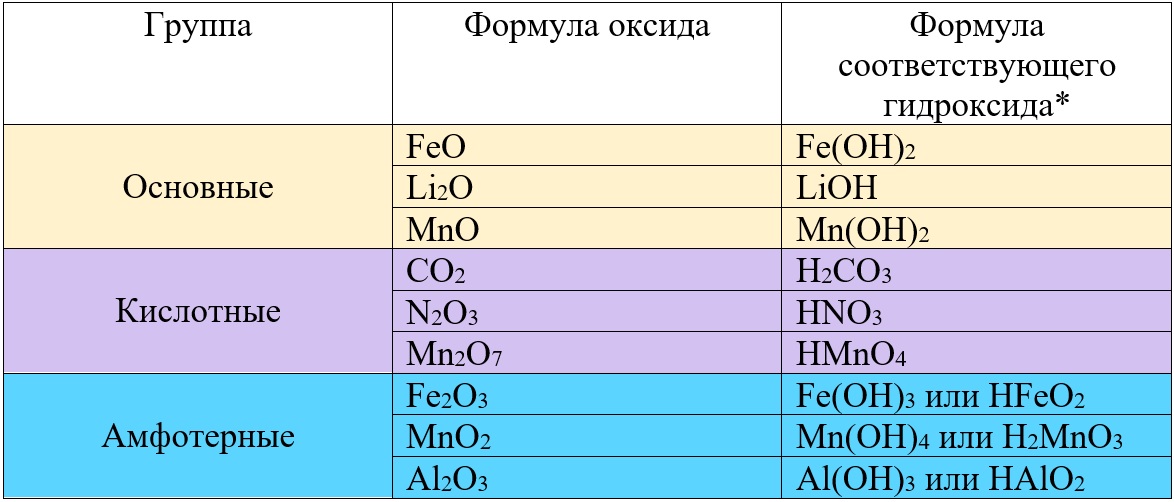
Таб. «Некоторые оксиды и соответствующие им гидроксиды»
* Гидроксид – соединение элемента с гидроксо-группой (OH‒).
Проанализировав таблицу, Вы заметите, что разные оксиды железа могут быть основными или амфотерными, а разные оксиды марганца оказались во всех трех группах. Что бы лучше понимать, от чего зависит принадлежность к тому или иному виду оксидов, необходимо глубже разобраться в классификации этих веществ.
Классификация оксидов неметаллов.
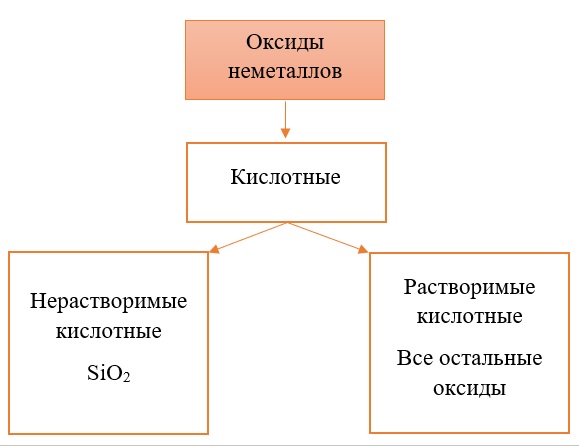
Все солеобразующие оксиды неметаллов относятся к кислотным. Большая часть из них являются растворимыми:
Классификация оксидов металлов.
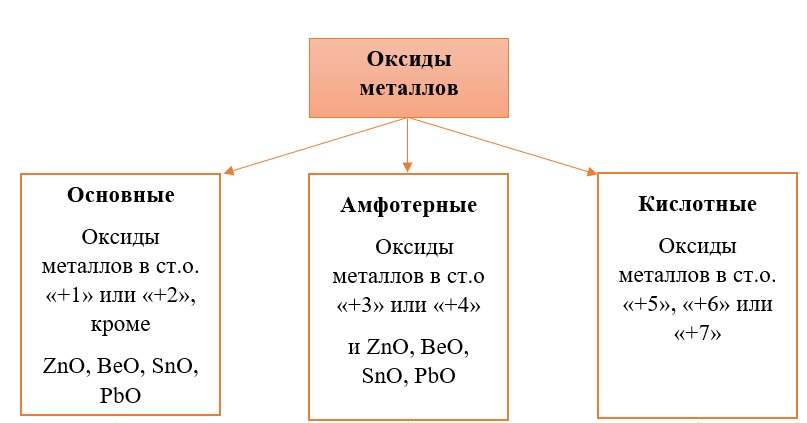
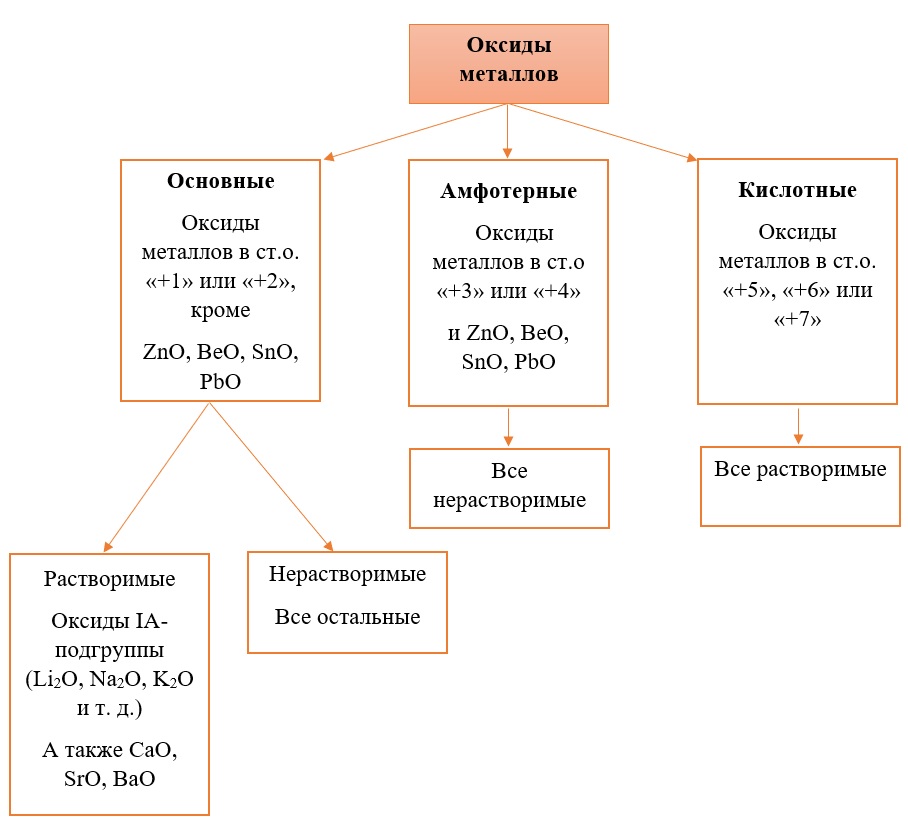
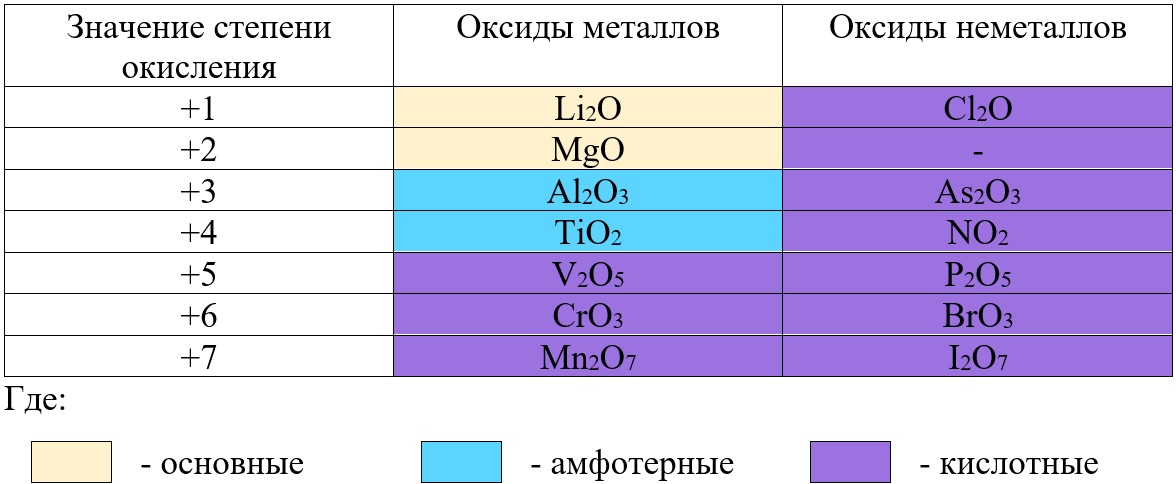
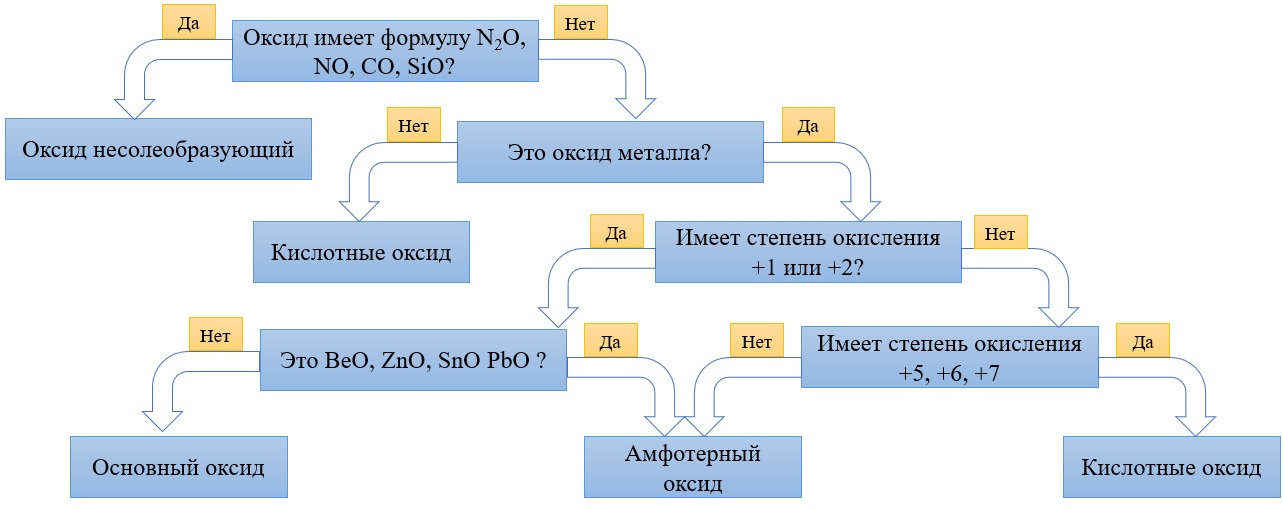
В отличие от предыдущей группы, в этой не так всё однозначно. Среди оксидов металлов встречаются как основные, так и амфотерные, и даже кислотные. А принадлежность к определённой группе зависит он степени окисления металла, который входит в состав оксида.
Основные оксиды – это оксиды, в которых металл имеет степень окисления «+1» или «+2» (для элементов с большим диапазоном возможных степеней окисления это будут низшие степени окисления). Есть исключения, например, BeO, ZnO хоть и имеют в своём составе металлы в степени окисления «+2», проявляют амфотерные свойства. Список таких оксидов гораздо шире (SnO, PbO, CuO), но в ЕГЭ остальные примеры исключений игнорируются.
Амфотерные оксиды содержат металлы в степени окисления «+3» и «+4» (промежуточные значения степеней окисления для веществ с большим диапазоном возможных степеней окисления), и два примера оксидов с металлами в ст. о. «+2», написанных выше (BeO, ZnO).
Кислотные оксиды содержат металлы в степени окисления «+5», «+6» и «+7» (для элементов с большим диапазоном возможных степеней окисления это будут высшие степени окисления).
Все кислотные оксиды металлов растворяются в воде и реагируют с ней. Все амфотерные оксиды не растворяются в воде и не реагируют с ней. Среди основных оксидов большинство нерастворимы и только оксиды, образованные кальцием, стронцием, барием, а также всеми металлами IА-подгруппы являются растворимыми.
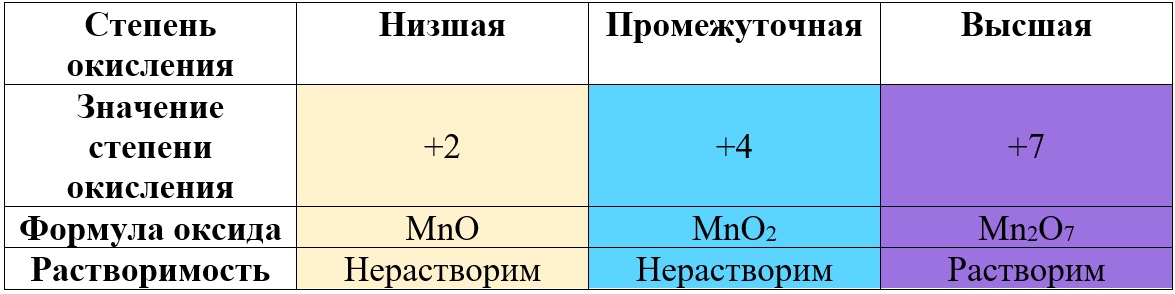
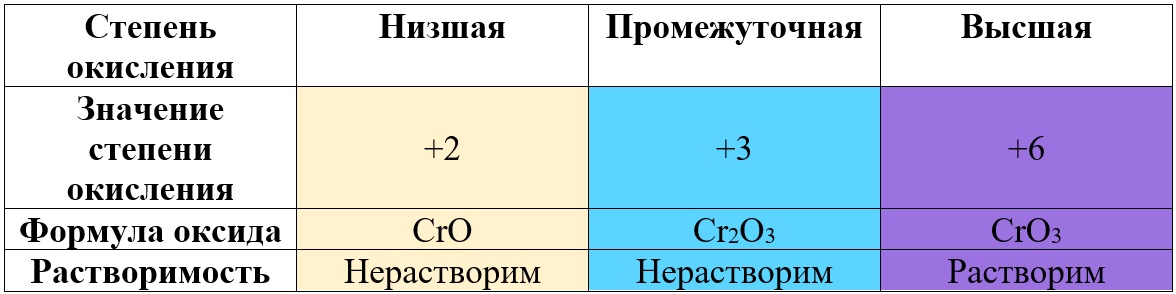
Таким образом металлы, имеющие большой диапазон возможных степеней окисления, могут образовывать совершенно разные по характеру оксиды, например оксиды марганца и хрома:
Таб. «Зависимость характера оксида от степени окисления марганца» (рассмотрены только наиболее распространённые степени)
Таб. «Зависимость характера оксида от степени окисления хрома» (рассмотрены только наиболее степени)
Не следует путать оксиды металлов и неметаллов: у оксидов металлов степень окисления определяет характер оксида, а у оксида неметалла – нет.
Таб. «Зависимость характера оксида от степени окисления элемента»
Обобщим всю классификацию оксидов одной схемой:
Алгоритм для определения характера оксида:
Простая таблица для определения принадлежности к группе оксидов:
|
Какие вещества называют оксидами? Из приведённого перечня формул веществ выпишите формулы оксидов металлов и оксидов неметаллов и дайте им названия: Na₂O, H₂S, K₂SO₄, PbO₂, ZnO, LiOH, SO₂, P₂O₅, O₂, Cl₂O₇, OsCl₃. (Габриелян. Химия. 8 класс. Параграф 14, № 1) Согласно классическому определению из школьного учебника по химии оксидами называются сложные вещества, молекула которых состоит из двух атомов, один из которых — обязательно атом кислорода. Исходя из этого определения, из предложенного списка можно сразу исключить сероводород H²S и хлорид осмия OsCl³, так как в них нет атома кислорода, а также сульфат калия K²SO⁴ (это соль, а не оксид, поэтому в нем атомы трёх элементов, а не двух), LiOH (это гидроксид лития, а не оксид, в нем тоже атомы трёх элементов) и O² (это собственно газ кислород в чистом виде). А теперь из оставшихся нужно выбрать оксиды металлов. Принадлежность к металлам проще всего определить по таблице Менделеева — их символы выделены черным. Исходя из этого выпишем оксид натрия Na²O, оксид свинца PbO² и оксид цинка ZnO. Оставшиеся в списке будут оксидами неметаллов: оксид серы SO², пентаоксид фосфора P²O⁵ и оксид хлора Cl²O⁷. автор вопроса выбрал этот ответ лучшим Знаете ответ? |
Смотрите также: ВПР по химии 8 класс 2020, задания, ответы, демоверсии, где найти? Химия 8 класс учебник Аббасов, где читать онлайн, краткое содержание? Химия 8 класс учебник Усманова, Сакарьянова, где читать онлайн? Химия 8 класс учебник Григорович, где читать онлайн, краткое содержание? Химия 8 класс учебник Еремин, Кузьменко, Дроздов, Лунин, где читать онлайн? Химия 8 класс учебник Габриелян, где читать онлайн, краткое содержание? Химия 8 класс учебник Кузнецова, Титова, Гара, где читать онлайн? ВПР 2022, химия, 8 класс, все варианты с ответами — где найти, скачать? ВПР по химии 8 класс 2021, задания, ответы, демоверсии, где найти? ВПР по химии 8 класс с ответами 2019 год все варианты — где найти/скачать? |
Соединения неметаллов
Оксиды неметаллов и кислородсодержащие кислоты.
Водородные соединения неметаллов. Общая характеристика подгруппы галогенов.
Здравствуйте, ребята.
Сегодня на уроке нам потребуется рабочая тетрадь, учебник, письменные принадлежности.
На уроке вы познакомитесь со свойствами оксидов неметаллов и водородных соединений.
Научитесь писать уравнения химических реакций неметаллов как окислителей , так и восстановителей.
Вспомните закономерность изменения свойств соединений неметаллов в периоде и группе.
На уроке нам понадобятся тетрадь рабочая и учебник.
Шаг 1. Ознакомьтесь с теорией по оксидам неметаллов и водородным соединениям неметаллов, свойствами галогенов. В тетради запишите дату и тему урока. Сделайте краткий конспект.
Оксиды неметаллов и кислородсодержащие кислоты
Оксиды неметаллов и кислородсодержащие кислоты
ТЕОРЕТИЧЕСКИЙ МАТЕРИАЛ ДЛЯ САМОСТОЯТЕЛЬНОГО ИЗУЧЕНИЯ
Соединения неметаллов с кислородом и водородом
Неметаллы (углерод, кислород, азот, сера, галогены) могут образовывать соединения как с кислородом (оксиды), так и с водородом. Водородные соединения являются газами или жидкостями, например, вода, аммиак, сероводород, соляная кислота. Оксиды могут быть газами (углекислый или сернистый газ), жидкостями (оксид хлора(VI) и (VIII)) или твёрдыми телами (оксид фосфора(V)).
Оксиды неметаллов
Типичными примерами оксидов неметаллов являются:
Сернистый газ (SO2), серный газ (SO3), угарный газ (CO), углекислый газ (CO2), оксид фосфора V (P2O5), оксид азота I (NO), оксид азота II (NO2).
Оксиды неметаллов подразделяют на две группы – несолеобразующие (SiO, N2O, NO, CO, S2O, H2O) и солеобразующие (остальные).
Несолеобразующих оксидов немного, их обыкновенно образуют одновалентные и двухвалентные неметаллы.
Солеобразующие оксиды неметаллов при взаимодействии с водой дают соответствующую им кислоту. Исключение составляет оксид кремния IV, который нерастворим в воде. Соответствующую ему кремниевую кислоту получают косвенным путём — взаимодействием растворимых силикатов щелочных металлов с кислотами.
Высшие оксиды – это оксиды, в которых неметалл проявляет степень окисления, равную номеру группы.
Кислотные свойства оксидов. В пределах одного периода с увеличением номера группы наблюдается увеличение кислотных свойств высших оксидов и соответствующих им кислот. Например, для неметаллов третьего периода, кремниевая кислота является слабой, а хлорная кислота является одной из самых сильных.
Такая закономерность вытекает из периодического закона Менделеева. В периоде радиус атома неметалла уменьшается с увеличением номера группы, а заряд неметалла при этом увеличивается. Поэтому при движении по периоду слева направо связь между неметаллом и кислородом упрочняется, а связь неметалл-водород ослабевает, что даёт увеличение диссоциации кислоты.
В пределах одной главной подгруппы происходит ослабление кислотных свойств оксидов и кислот с увеличением номера периода.
Водородные соединения неметаллов
Водородные соединения неметаллов
Кроме соединений с кислородом, неметаллы образуют соединения с водородом. Например, метан (CH4), аммиак (NH3), вода (H2O), плавиковая кислота (HF), соляная кислота (HCl). Эти соединения представляют собой газы или жидкости.
В периодах слева направо кислотные свойства водородных соединений неметаллов в водных растворах усиливаются. Это связано с тем, что в этом направлении у атомов элементов увеличивается заряд ядра и уменьшается радиус.
В группах сверху вниз, по мере увеличения атомного радиуса, отрицательно заряженные анионы неметаллов всё слабее притягивают положительно заряженные ионы водорода. Таким образом, отщепление ионов водорода происходит проще и кислотность увеличивается.
Шаг 2. Выполнить упражнение. Сделайте это обязательно. Нажмите на ссылку.
Шаг 3. Сдаем зачет по теме :«Электролиз» Киселев М., Миннебаев А., Минуллина К., Слепцова К. Соколова А. Выполняем задание 22 из РЕШУ ЕГЭ, химия, № 4 и 7 с написанием уравнений.
По теме»Реакции ионного обмена» Герасимов Е., Киселев М.,Миннебаев А., Минуллика К., Слепцова., Назарова П.,Суханов Я, Чикин Д.. Пишем РИО между:
-
гидроксидом алюминия и соляной кислотой;
-
гидроксидом алия и фосфорной кислотой;
-
Фторидом натрия и азотной кислотой.
Фото зачетных работ присылаем сегодня до 15.00 на почту simba20026@gmail.com
Больше исправлений не будет.
Домашняя работа: изучить п 31.32
Химиков жду сегодня на видеоконференции в 19.00 с решенным 15 вариантом.
До свидания.