Weltzien в Annalen der Chemie und Pharmacie Юстуса Либиха , 1867 г.
Карл Weltzien ввел термины орто , мета и пункт кислоту около 1865. В контексте его работы над силикатами и соответствующими кремнеземами , Weltzin определяет орто кислоты , как те кислоты , которые содержат так много водорода , как атомы кислорода (относится только к Si).
Позднее Вельтцин обобщил этот термин на кислоты других элементов и предложил термин Metasäure для группы кислот, которые будут использоваться, которые можно проследить до (внутримолекулярной) дегидратации по крайней мере трехосновной орто-кислоты. Он описывает кислоты, которые образуются из двуосновных или многоосновных орто-кислот в результате межмолекулярной дегидратации, как парасислоты (см. Примеры в оригинальной работе).
Он рассматривает орто- кислоты как нормальную форму кислоты, метакислоты как менее водянистую форму и пара-кислоты как продукты их конденсации.
Стабильность орто-кислот
В случае орто-кислот отчетливо видна разница между элементами второго периода и их высшими гомологами. Из углерода и азота известны только метакислоты: H 2 CO 3 , диоксид углерода (известный, но также нестабильный) и HNO 3 , азотная кислота . Свободный орто кислоты Н 4 СО 4 и Н 3 NO — не известны или только известно в виде производных ( сложных эфиров ортоугольных кислот , кислых эфиров orthocarboxylic , смотрите также правило Эрленмейера ).
Однако с третьего периода орто- кислоты часто являются более стабильной формой ( кремнезем H 4 SiO 4 , фосфорная кислота H 3 PO 4 ). Если координационное число (KOZ) 4 превышено или если несколько атомов кислорода связаны двойной связью, пространство, необходимое для гидроксильных групп, превышает пространство вокруг центрального иона. В случае хлора стабильна только метакислота HClO 3 . Только в более поздние периоды образование орто- кислот возможно снова с увеличением размера центрального атома ( периодическая кислота H 5 IO 6 , KOZ 6).
Очевидным исключением является борная кислота B (OH) 3 , которая встречается в форме орто-кислоты. Однако здесь присутствует кислота Льюиса с KOZ 3.
Индивидуальные доказательства
- ↑ Парасацид сегодня — необычный термин, вместо него используется префикс ди- или пиро- . Например, см. Пиросерную кислоту .
- ↑ Генрих Уилл : Годовой отчет о прогрессе химии , 1865 г., стр. 212 ( Google Книги ).
- ↑ Weltzien: «Об образовании озона», в: Новый ежегодник по минералогии, геологии и палеонтологии 1865 г. , стр. 418 ( Google Книги ).
- ↑ Weltzien: «Об образовании озона», в: Annalen der Chemie und Pharmacie Юстуса Либиха 1867 г. , стр. 110 ( Google Книги ).
Суффиксы кислот в зависимости от степени окисления
Общая формула кислот HnAc, где n – число атомов водорода, равное заряду иона кислотного остатка, Ac – кислотный остаток.
Названия кислородных кислот образуются от названия элемента с прибавлением окончаний -ная, -вая, если степень окисления его соответствует номеру группы короткой формы Периодической системы, и слова «кислота». По мере понижения степени окисления суффиксы меняются в следующем порядке: -оватая, -истая, -оватистая.
Например, HCl +7 O4 – хлор ная кислота,
HCl +5 O3 – хлорн оватая кислота,
HCl +3 O2 – хлор истая кислота,
HCl +1 O – хлорн оватистая кислота.
Если элемент в одной и той же степени окисления образует несколько кислородсодержащих кислот, то к названию кислоты с меньшим содержанием кислородных атомов добавляется приставка мета-, при наибольшем числе – приставка орто-.
Например, HBO2 – мета борная кислота, H3BO3 – орто борная кислота;
HPO3 – мета фосфорная кислота, H3PO4 – орто фосфорная кислота.
Названия бескислородных кислот образуются от названия элемента с окончанием на —о и прибавлением слова «водородная».
Например, HF – фторо водородная ; HCl – хлоро водородная , H2S – серо водородная .
Помимо этих названий, в русском языке применяются традиционные названия для некоторых важных и часто применяемых соединений.
Номенклатура (названия) неорганических веществ
Номенклатура оксидов
В соответствии с номенклатурой ИЮПАК любое бинарное соединение, в котором присутствует кислород со степенью окисления -2, называют словом «оксид», затем указывают название элемента в родительном падеже. Если для элемента характерна постоянная валентность, то больше ничего указывать не нужно. Если для элемента характерна переменная валентность, то после названия необходимо указать в скобках его валентность в данном оксиде; валентность указывают римскими цифрами.
Например : WO3 — оксид вольфрама (VI); Li2O — оксид лития.
Если вы не знаете, что такое валентность, и как ее определять, то необходимо изучить соответствующую статью.
Номенклатура оснований и амфотерных гидроксидов
Названия оснований и амфотерных гидроксидов строятся аналогично, только вместо слова «оксид» используют слово «гидроксид«, затем указывают название металла в родительном падеже. Если для металла (или металлоподобного иона) характерна постоянная валентность, то больше ничего указывать не нужно. Если для металла характерна переменная валентность, то после названия необходимо указать в скобках его валентность в данном гидроксиде; валентность указывают римскими цифрами.
Например : KOH – гидроксид калия; Fe(OH)3 – гидроксид железа (III).
Номенклатура кислот и солей
Название кислот строятся так: к корню названия центрального элемента на русском языке добавляют постфиксы -ная, -нистая или -водородная, в зависимости от степени окисления центрального элемента.
Если вы не помните, что такое степень окисления, и как ее определять, то сначала необходимо изучить соответствующую статью.
Названия солей строятся так: к корню названия центрального элемента на латинском языке добавляют постфиксы -ат, -ит или -ид, в зависимости от степени окисления центрального элемента. Затем указывают название металла в родительном падеже. Если для металла (или металлоподобного иона) характерна постоянная валентность, то больше ничего указывать не нужно. Если для металла характерна переменная валентность, то после названия необходимо указать в скобках его валентность в данной соли; валентность указывают римскими цифрами.
Корни латинского названия у большинства элементов совпадают с корнями русского названия. Для некоторых элементов они отличаются. Их следует запомнить:
C – карб, S – сульф, N – нитр и др.
Рассмотрим основные случаи.
1. Если центральный элемент в кислоте имеет высшую степень окисления, т.е. в кислотном остатке этой кислоты содержится максимальное количество атомов кислорода, то к названию кислоты добавляют постфикс -ная или -вая.
Например : H2S +6 O4 – серная кислота, H3P +5 O4 – фосфорная кислота.
При этом в названии соли используют постфикс -ат.
Например: Na2S +6 O4 – сульфат натрия, K2C +4 O3 – карбонат калия.
2. Если центральный элемент в кислоте имеет промежуточную степень окисления, т.е. в кислотном остатке этой кислоты содержится не максимальное количество атомов кислорода, то к названию кислоты добавляют постфикс -нистая.
Например : H2S +4 O3 – сернистая кислота, H3P +3 O3 – фосфористая кислота.
При этом в названии соли используют постфикс —ит.
Например , Na2S +4 O3 – сульфит натрия, KN +3 O2 – нитрит калия.
3. Если центральный элемент в кислоте имеет низшую степень окисления, т.е. в кислотном остатке этой кислоты не содержатся атомы кислорода, то к названию кислоты добавляют постфикс -водородная.
Например : H2S -2 – сероводородная кислота, HCl — – хлороводородная кислота.
При этом в названии соли используем постфикс -ид.
Например , Na2S -2 – сульфид натрия, KCl — – хлорид калия .
Номенклатура кислых солей.
Если в кислой соли на один кислотный остаток приходится один атом водорода, то к названию кислотного остатка добавляют префикс гидро-. Если на один кислотный остаток приходится два атома водорода, то добавляют префикс дигидро-.
Например , K2HPO4 – гидрофосфат калия, KH2PO4 – дигидрофосфат калия. Но: Ca(HCO3)2 – гидрокарбонат кальция.
Номенклатура основных солей.
Если в основной соли на один катион металла приходится одна гидроксо-группа, то к названию кислотного остатка добавляют префикс гидроксо-. Если на один катион металла приходится две гидроксо-группы, то добавляют префикс дигидроксо-.
Например , AlOHCl2 – гидроксохлорид алюминия, Al(OH)2Cl – дигидроксохлорид алюминия. Но: (CuOH)2CO3 – гидроксокарбонат меди (II).
В названии двойной соли катионы металлов перечисляют через дефис. В названии смешанных солей анионы кислотных остатков перечисляются через дефис.
Например , KAl(SO4)2 – сульфат алюминия-калия, CaClBr – бромид-хлорид кальция.
Также применяется тривиальная номенклатура. Тривиальные названия неорганических необходимо выучить наизусть.
Номенклатура комплексных солей*
Комплексное соединение может состоять из комплексного катиона, комплексного аниона или может быть нейтральным.
Комплексные соединения состоят из внутренней и внешней сферы. Центральная частица, вокруг которой расположены окружающие ее лиганды, называется комплексообразователем. Число лигандов комплексообразователя называется координационным числом. Как правило (но не обязательно!), число лигандов в 2 раза больше, чем степень окисления центральной частицы.
Соединения с комплексными катионами. Вначале называют анион внешней сферы, затем перечисляют лиганды, затем называют комплексообразователь в родительном падеже (ему дается русское название данного элемента). После названия комплексообразователя в скобках римской цифрой указывается его степень окисления.
К латинскому названию анионного лиганда добавляется окончание “о” (F — — фторо, Cl — -хлоро, ОН — — гидроксо, CN — — циано и т.д). Аммиак обозначают термином “аммин”, СО – карбонил, NO – нитрозил, H2O – аква.
Число одинаковых лигандов называют греческим числительным: 2 –ди, 3 – три, 4 – тетра, 5 – пента, 6 – гекса, 7 – гепта и т.д.
Например:
[Cu(NH3)4]SO4 – сульфат тетраамминмеди (II),
[Ni(H2O)6]Cl2 – хлорид гексаакваникеля (II).
Вначале перечисляют лиганды анионные, затем нейтральные, затем катионные.
Например:
[Pt(NH3)5Cl]Cl3 – хлорид хлоропентаамминплатины (IV) .
Если в комплексе имеются несколько лигандов одинакового знака заряда, то они называются в алфавитном порядке:
[CoCl2(H2O)(NH3)3]Cl – хлорид дихлороакватриамминкобальта (III).
Соединения с комплексными анионами. Вначале называют комплексный анион в именительном падеже: перечисляют лиганды, затем комплексообразователь (ему дается латинское название и к названию добавляется окончание “ат”). После названия комплексообразователя указывается его степень окисления. Затем в родительном падеже называется внешнесферный катион.
Например:
Na2[Zn(OH)4] – тетрагидроксоцинкат (II) натрия;
K4[Fe(CN)6] – гексацианоферрат (II) калия;
K2[СuCl4] – тетрахлорокупрат (II) калия.
Соединения без внешней сферы. Вначале называют лиганды, затем комплексообразователь в именительном падеже с указанием его степени окисления. Все название пишется слитно.
[Ni(CО)4] – тетракарбонилникель (0);
* материалы с портала onx.distant.ru
Добавить комментарий Отменить ответ
Этот сайт использует Akismet для борьбы со спамом. Узнайте, как обрабатываются ваши данные комментариев.
Варианты классификации кислот в химии
Кислоты в химии
С точки зрения состава, кислоты — сложные вещества, образованные кислотным остатком и атомами водорода, способными замещаться на атомы металла.
С точки зрения теории электролитической диссоциации, кислоты — соединения, которые диссоциируют в водном растворе на отрицательные ионы кислотного остатка и положительные ионы H+, что обуславливает изменение цвета индикатора (например, фиолетовый лакмус в кислой среде становится красным).
Все кислоты едкие и имеют кислый вкус. При нормальных условиях находятся в газообразном или жидком виде, кроме некоторых твtрдых: кремниевой кислоты H2SiO3, ортоборной кислоты H3BO3 и органических кислот с большим количеством атомов углерода.
Классификация кислот
Кислоты делятся на две группы:
Неорганические кислоты имеют общую формулу HnK, где K — кислотный остаток. Классифицируют их по нескольким показателям:
- Наличие кислорода в кислотном остатке: кислородсодержащие ( H 3 P O 4 , H N O 3 ) и бескислородные ( H 2 S , H C l ).
- Основность (количество атомов водорода, способных заместиться на металл): одноосновные ( H B r , H N O 3 ), двухосновные ( H 2 S O 4 , H 2 C O 3 ), трехосновные ( H 3 P O 4 ).
- Летучесть: летучие ( H 2 S , H N O 3 ), нелетучие ( H 2 S O 4 , H 3 P O 4 ).
- Степень диссоциации: сильные ( H N O 3 , H C l ) и слабые ( H 2 C O 3 , H C l O ).
- Устойчивость: стабильные ( H 2 S O 4 , H 3 P O 4 ) и нестабильные (распадаются, H 2 S O 3 , H 2 C O 3 ).
- Растворимость в воде: нерастворимые ( H 2 S i O 3 и H 3 B O 3 ) и растворимые — все остальные.
- Агрегатное состояние, в котором могут быть: газообразные ( H 2 S , H C l ) , жидкие ( H 2 S O 4 , H N O 3 ) и твердые ( H 3 P O 4 , H 3 B O 3 , H 2 S i O 3 ).
Органические кислоты: наиболее широко распространены карбоновые кислоты — соединения, в состав которых входит карбоксильная группа -COOH. Общая формула: R-COOH, где R — углеводородный радикал. Они играют важную роль в биохимии живых организмов, участвуют в процессах обмена веществ.
1. Карбоновые кислоты классифицируют по следующим признакам:
- число карбоксильных групп:
- одноосновные: муравьиная H — C O O H и уксусная C H 3 — C O O H ;
- двухосновные: щавелевая H O O C — C O O H , малоновая; H O O C — C H 2 — C O O H
- многоосновные: лимонная кислота ( H O O C — C H 2 ) 2 — C ( O H ) — C O O H .
- тип углеводородного радикала:
- предельные: C H 3 C H 2 C H 2 C O O H масляная кислота;
- непредельные: C H 2 = C H — C H 2 C O O H акриловая кислота;
- ароматические: C 6 H 5 C O O H бензойная кислота;
- алициклические: C 4 H 6 O 2 циклопропанкарбоновая кислота;
- гетероциклические: C 6 H 5 N O 2 никотиновая кислота:
- замещенные карбоновые кислоты, в состав которых входит карбоксильная группа — C O O H , углеводородный радикал R и различные функциональные группы. Некоторые из них:
- галогены → галогенкарбоновые кислоты, H a l — R — C O O H (хлоруксусная кислота С l С Н 2 С О О Н , трифторуксусная кислота C F 3 C O O H );
- — O H → гидроксикислоты, O H — R — C O O H (гликолиевая кислота H O C H 2 C O O H , молочная кислота С H 3 C H ( O H ) C O O H ) ;
- -NH2 → аминокислоты, H 2 N — R — C O O H (аминоуксусная кислота C H 2 N H 2 — C O O H глицин; 1,2- амино-3-метилпентановая кислота H O 2 C C H ( N H 2 ) C H ( C H 3 ) C H 2 C H 3 изолейцин). Аминокислоты — главная составная часть белков.
2. Серосодержащие органические кислоты (сульфокислоты) содержат сульфогруппы и имеют общие формулы кислот: R S O 3 H → сульфоновые; R S O 2 H → сульфиновые; R S O H → сульфеновые. Наиболее известны: 2-аминоэтансульфоновая кислота C 2 H 7 N O 3 S таурин и 2-амино-3-меркаптопропановая кислота H O 2 C C H ( N H 2 ) C H 2 S H цистеин.
3. Нуклеиновые кислоты — высокомолекулярные соединения, состоящие из нуклеотидов. Играют важную роль в биологии: находятся в клетках всех организмов, являются носителями генов, участвуют в передаче и реализации наследственной информации через синтез белка. Типы нуклеиновых кислот в зависимости от моносахарида-основы:
- дезоксирибонуклеиновая кислота (ДНК) — дезоксирибоза ( C 5 H 10 O 4 );
- рибонуклеиновая кислота (РНК) — рибоза ( C 5 H 10 O 5 ).
Номенклатура кислот
Названия бескислородных кислот: корень русского названия элемента, образующего кислоту + суффикс «о» + «-водородная кислота», например: H B r — бромоводородная кислота, H C l — хлороводородная кислота, H 2 S — сероводородная кислота.
Названия кислородсодержащих кислот: русское название образующего элемента + «кислота», с учетом правил:
Если элемент находится в высшей степени окисления, то окончание будет «-ная» или «-овая»: H 2 S O 4 — серная кислота, H 3 A s O 4 — мышьяковая кислота. Окончание меняется с понижением степени окисления в последовательности: «-оватая» ( H C l O 3 — хлорноватая кислота), «-истая» ( H C l O 2 — хлористая кислота), «-оватистая» ( H C l O — хлорноватистая кислота).
Если оксиду соответствует не одна кислота, то к названию кислоты с минимальным числом атомов кислорода, добавляется приставка «мета», а к названию кислоты с максимальным числом атомов кислорода — «орто», например, H P O 3 — метафосфорная кислота, H 3 P O 4 — ортофосфорная кислота.
Часто используемые (распространенные) кислоты:
| Формула и название кислоты | Название кислотного остатка, переходящего в соль |
| HAlO2 метаалюминиевая | метаалюминат |
| H3AlO3 ортоалюминиевая | ортоалюминат |
| HAsO3 метамышьяковая | метаарсенат |
| H3AsO4 ортомышьяковая | ортоарсенат |
| H3BO3 ортоборная | ортоборат |
| HBr бромоводородная | бромид |
| HBrO бромноватистая | гипобромит |
| HBrO3 бромноватая | бромат |
| HCN циановодородная (синильная*) | цианид |
| H2CO3 угольная | карбонат |
| HCl хлороводородная (соляная*) | хлорид |
| HClO хлорноватистая | гипохлорит |
| HClO2 хлористая | хлорит |
| HClO3 хлорноватая | хлорат |
| HClO4 хлорная | перхлорат |
| HF фтороводородная (плавиковая*) | фторид |
| HJ йодоводородная | йодид |
| HMnO4 марганцовая | перманганат |
| HNO2 азотистая | нитрит |
| HNO3 азотная | нитрат |
| HPO3 метафосфорная | метафосфат |
| H3PO4 ортофосфорная (фосфорная*) | ортофосфат |
| H2S сероводородная | сульфид |
| H2SO3 сернистая | сульфит |
| H2SO4 серная | сульфат |
| H2SiO3 метакремниевая | метасиликат |
| H3SiO4 ортокремниевая | ортосиликат |
| *В скобках приведены тривиальные названия кислот |
Номенклатура органических кислот
Для органических кислот чаще используют тривиальные названия (приведены в таблице 2), которые определяются по источнику, откуда впервые была получена кислота.
| Формула | Общепринятое название кислоты | Тривиальное название кислоты | Название соли |
| HCOOH | Метановая | Муравьиная | формиат |
| CH3COOH | Этановая | Уксусная | ацетат |
| C2H5COOH | Пропановая | Пропионовая | пропионат |
| C3H7COOH | Бутановая | Масляная | бутират |
| C4H9COOH | Пентановая | Валериановая | валерат |
| C5H11COOH | Гексановая | Капроновая | капронат |
| НООССН2СН(ОН)СООН | Гидроксибутандиовая | Яблочная | малат |
| СH3CH(OH)COOH | 2-гидроксипропановая | Молочная | лактат |
| CH2NH2-COOH | Аминоуксусная | Глицин | глицинат |
| HOOC-COOH | Этандиовая | Щавелевая | оксалат |
| (HOOC-CH2)2-C(OH)-COOH | 2-гидроксипропан-1,2,3-трикарбоновая кислота | Лимонная | цитрат |
Систематическое название карбоновой кислоты складывается из названия самой длинной углеродной цепи, включающей группу -СООН, и названия углеводородного радикала + окончание «-овая» и слово «кислота». Отсчет ведется от первого атома углерода, входящего в состав карбоксильной группы. В случае аминокислот допускается нумерация со второго от -COOH атома углерода, при этом вместо чисел используют буквы греческого алфавита: α — альфа, β — бета, γ — гамма и т.д. Примеры:
- C 2 H 5 C O O H — пропановая кислота;
- C H 3 — C ( C H 3 ) 2 — C O O H — 2,2-диметилпропановая кислота;
- C H 3 — C H 2 — C H ( N H 2 ) — C O O H 2 -аминобутановая (как вариант альфа-аминомасляная) кислота;
- C H 3 — C H ( N H 2 ) — C H 2 — C O O H 3 -аминбутановая (как вариант бета-аминомасляная) кислота.
Еще один способ — рациональная номенклатура, в соответствии с которой к названию углеводорода добавляют окончание «карбоновая кислота», включающее один атом углерода карбоксильной группы. Нумерация начинается со следующего в цепочке атома углерода (C5H9COOH циклопентанкарбоновая кислота).
Названия серосодержащих органических кислот: название самой длинной цепочки + окончание — сульфоновая, сульфиновая или сульфеновая кислота: 2-аминоэтансульфоновая кислота C2H7NO3S:
Общие химические свойства кислот (в уравнениях реакций для органических кислот используется стандартная формула R — C O O H ):
- Меняют окраску индикатора за счет образования катионов Н+ при диссоциации (фиолетовый лакмус → красный).
- + основания (реакция нейтрализации) → соль:
- 2 F e ( O Н ) 3 + 3 H 2 S O 4 → F e 2 ( S O 4 ) 3 + 6 H 2 O ;
- R C O O H + N a O H → R C O O N a + H 2 O .
3. + металлы, стоящие левее водорода в ряду активности → соль и водород:
- F e + 2 H C l → F e C l 2 + H 2 ↑ ;
- 2 R C O O H + M g → ( R C O O ) 2 M g + H 2 ↑ .
4. + оксиды оснóвные и амфотерные → соль и вода:
- C a O + H 2 S O 4 → C a S O 4 + H 2 O ;
- 2 R C O O H + C a O → ( R C O O ) 2 C a + H 2 O ;
- Z n O + H 2 S O 4 → Z n S O 4 + H 2 O ;
- 2 R C O O H + N a 2 O → 2 R C O O N a + H 2 O .
5. + соли более слабых кислот → новая соль + кислота (угольная кислота распадается на H 2 O и C O 2 ↑):
- H 2 S O 4 + N a 2 C O 3 → N a 2 S O 4 + H 2 O + C O 2 ↑ ;
- R C O O H + N a H C O 3 → R C O O N a + H 2 O + C O 2 ↑ .
Реакции, характерные для:
Неорганических кислот:
Окислительно-восстановительные: H 2 S O 3 + C l 2 + H 2 O → H 2 S O 4 + 2 H C l ;
P b + 4 H N O 3 (конц) → P b ( N O 3 ) 2 + 2 N O 2 ↑ + 2 H 2 O .
Органических кислот:
1. Образование функциональных производных путем замещения гидроксильной группы:
- R – C ( O ) — O H + P C l 5 → R – C ( O ) — C l (хлорангидрид) + P O C l 3 + H C l ;
- R – C ( O ) — O H + H — O — C ( O ) — R → R – C ( O ) – O – C ( O ) – R (ангидрид);
- C H 3 C O O H + C H 3 — C H 2 — O H → C H 3 — C ( O ) — O — C 2 H 5 (этилацетат (сложный эфир)) + H 2 O ;
- C H 3 C O O H + С H 3 – N H 2 → C H 3 — C ( O ) — N H — C H 3 (амид) + H 2 O (при нагревании).
C H 3 – C H 2 — C O O H + B r 2 → C H 3 – C H B r – C O O H + H B r (катализатор – Pкр).
R — C O O H + L i A l H 4 (водный раствор, подкисленный H C l ) → R — C H 2 — O H + A l C l 3 + L i C l .
C H 2 = C H — C H 2 — C O O H → C O 2 ↑ + C H 2 = C H — C H 3 .
источники:
http://chemege.ru/nom-neorg/
http://wika.tutoronline.ru/himiya/class/8/varianty-klassifikaczii-kislot-v-himii
Общая характеристика ортофосфорной кислоты
Ортофосфорная кислота – наиболее известная без приставки «орто», как фосфорная кислота, представляет собой неорганическое соединение, обладающее комплексом физико-химических свойств характерных для кислот. Кислота имеет условное обозначение (химическую формулу) H3PO4 или H3O4P. В России под понятием фосфорная (ортофосфорная кислота) чаще имеется ввиду водный раствор 85%. С такими характеристиками жидкость представляет собой густой бесцветный раствор без запаха. Данная кислота является стабильным соединением в ряду кислот фосфора с содержанием кислорода.
В мировой практике может иметь альтернативные названия:
- Фосфорная кислота
- Ортофосфорная кислота
- О-фософорная кислота
- 7664-38-2
- Полифосфорная кислота
- Orthophosphoric acid
- Гидроген фосфат
- H3PO4
- H3O4P
В базе данных химических соединений и смесей Национального центра биотехнологической информации США (NCBI) PubChem имеет запись 1004, уникальный номер в реестре Chemical Abstracts Service 7664-38-2, уникальный номер в рамках Европейского сообщества 231-633-2.
В Российской Федерации фосфорную кислоту производят 8 заводов:
- АО «Воскресенские минеральные удобрения»
- АО «НИУИФ»
- ООО «Компонент-Реактив»
- АО «Апатит»
- ООО «НПФ Невский химик»
- ООО «Уфахимпроект»
- Славия
- ЕвроХим-БМУ
Не редким товаром на рынке химических кислот является ортофосфорная кислота из Республики Беларусь, Казахстана и Китая.
Смотрите, также: «Производство и продажа ортофосфорной кислоты: основные рынки»
Свойства ортофосфорной кислоты
Физические свойства
Если говорить о виде ортофосфорной кислоты то стоит знать, что чаще всего на рынке она представлена в растворах различных процентов содержания фосфора. Однако чистая фосфорная кислота представляет собой белый полупрозрачный кристаллический порошок, обладающий высокой степенью поглощения воды из воздуха, в связи, с чем характеризуется способностью видоизменяться на открытом воздухе. В растворах представлена в сиропообразной форме в следующих сочетаниях:
- 85% раствор ортофосфорной кислоты
- 80% раствор ортофосфорной кислоты
- 75% раствор ортофосфорной кислоты
Температура, при которой плавится чистая ортофосфорная кислота, составляет 42,35 °С. Фосфорная кислота растворима в воде, спирте и этанолах.
Основные показатели и физические свойства:
| Физическое состояние чистого вещества: | твердое |
| Наиболее часто встречающееся физическое состояние: | вязкое |
| Молярная масса: | 98,0 г/моль |
| Плотность раствора: | 1,75/см(куб) |
| Плотность вещества: | 1.9 г/см(куб) |
| Растворимость: | полная, 48 г/100 мл |
| Температура кипения | 158 °С |
| Динамическая вязкость | 2,4-9,4 сПуаз |
Химические свойства
Ортофосфорная кислота – вещество средней силы. В водных растворах ведет себя в различных вариациях. Может, как выделять, так и поглощать тепло. Образовывать фосфаты, кислые соли. При нагревании из водного раствора получают пирофосфорную и метафосфорную кислоты.
Отличительной особенностью ортофосфорной кислоты от других содержащих фосфор, является желтый осадок как реакция на нитрат серебра.
Характеристики процессов с участием ортофосфорной кислоты:
- При смешивании с нитратом серебра выпадает осадок желтого цвета.
- В воде происходит распад в три этапа.
- Выделение пирофосфатов при сильном нагреве.
- Взаимодействие с химическим индикатором меняет цвет на красный.
- Производная сильного уровня в сочетании с ортофосфорной кислотой дает многогранные соли.
Публикация по теме: Сферы применения фосфорной (ортофосфорной) кислоты
История открытия
Открытие фосфорной кислоты произошло в XVII веке сразу в нескольких независимых лабораториях.
Первые упоминания об открытии фосфора относятся к немецкому ученому Хенингу Брандту. Разорившийся предприниматель, увлекшись алхимическими опытами в поисках «философского камня», подверг тщательном у изучению продукты человеческой жизнедеятельности. Выпарив мочу, и нагрев оставшийся осадок, Брандт получил белое вещество. Дальнейшие опыты с этим веществом заключающиеся в нагревании без доступа кислорода, помогли выделить легкоплавкое вещество с неприятным запахами и парами, светящимися в темноте. Первое название этого вещества имело очень мистический характер. «Холодный огонь», — именно так назвал свое открытие Хенинг Бранд.
В лаборатории англо-ирландского химика Роберта Бойля известного в научных кругах тем, что предпочитал опыт, а не домыслы в 1680 году фосфор был выделен при помощи опытов с индикаторами. Бойль (с подсказки Крафта) проведя ряд экспериментов с жидкостями, кровью, мочой, волосами и костями, поставил производство фосфора на коммерческую основу.
Производство фосфора в XVII веке имело очень успешный коммерческий характер, из-за связи с алхимическими поисками, но в XVIII веке в связи с обнаружением еще одного способа получения (ученым Маргграфам Андреасам Зигизмундом) и его всесторонним раскрытием, перестало иметь коммерческую привлекательность.
Получение ортофосфорной кислоты
В XVII веке производство фосфорной кислоты происходило опытным путем. Через выпаривание и сжигание. Современный способ был найден около 100 лет назад, заключался в окислении фосфора азотной кислотой. Сейчас производство ортофосфорной кислоты происходит двумя способами: термическим и экстракционным.
Термический способ заключался в реакции фосфора на сжигание и воду. Сжигаемый при 2000 °C фосфор, переходит в оксид фосфора, поглощаемый фосфорной кислотой. Такая фосфорная кислота не содержит примесей фосфора в низших степенях окисления, но требует очистки от мышьяка.
Экстракционный способ в странах СНГ заключается в обработки хибинский апатитов и фосфоритов Кракатау природными фосфатами. Кроме ортофосфорной кислоты выделяется также дигидрат или гемигират сульфата кальция.
ООО «Эверест» осуществляет оптовые поставки фосфорной (ортофосфорной) кислоты по низким ценам. Подробнее по телефону: +7 (812) 448-47-55.
Ортокислота
Cтраница 1
Ортокислота выпадает в виде студенистого осадка при действии аммиака на соли циркония. Гель гидрата легко пеп-тизируется как кислотами, так и щелочами. При осаждении аммиаком из горячего раствора выпадает метакислота, трудно растворимая в кислотах. Ортоциркониевая кислота, так же как и ортотитановая, при нагревании обнаруживает свойство рекалесценции.
[1]
Ортокислота могла бы рассматриваться как ангядрокислота, считая Р ( НО) 5 за полный гидрат, если бы существовал РН5, но так как вообще нормальные гидраты отвечают существующим водородистым соединениям с прибавкою до 4 атомов кислорода, то РНЮ4 есть нормальная кислота, как 5НЮ и С1НО4, но HNO3, СН2О3 суть метакислоты или высшие нормальные NH3O и СНЮ4, с потерею частицы воды. Для того чтобы видеть отношение между орто -, пиро — и метафосфорными кислотами, прежде всего следует заметить, что в них ангидрид Р2О5 соединен с 3, 2 и I частицами воды. За отсутствием сведений о весе частицы орто — и пиро-фосфорной кислот, необходимо указать на то, что все сведения о метафос-форной кислоте показывают ( доп. Разъяснения вопросов, здесь представляющихся, мне кажется возможно ждать только чрез подробное изучение явлений полимеризации минеральных веществ и тех сложных ( комплексных) кислот, пример которых мы далее ( гл. Подобный же случай, вероятно, представляет растворимость гидрата кремнезема ( происходящего при действии SiF на воду) в сплавленной метафосфорной кислоте, причем происходит, по охлаждении, образование октаэдрических кристаллов ( уд.
[2]
Фосфористая ортокислота, как и фосфористый ангидрид, обладает сильными восстановительными свойствами.
[3]
Трехосновная фосфорная ортокислота ( / ( i7 6 — 10 — 3, / С26 2 — 10 — 8 и / Сз 4 2 — Ю-13) образует нормальные ортофосфаты, гидроортофос-фаты и дигидроортофосфаты.
[4]
Трехосновная фосфорная ортокислота ( / ( 7 6 — 10 — Ki 6 2 — 10 — 8 и / Сз4 2 — 10 — 13) образует нормальные ортофосфаты, гидроортофосфаты и дигидроортофосфаты. Все три типа солей, образованные щелочными металлами, растворимы в воде.
[5]
Производные ортокислот, по-видимому, образуются при взаимодействии сложных эфиров с алкоголятами, когда присоединение алкоголята идет по карбонильной связи, например ( см. также стр.
[6]
Такие ортокислоты чрезвычайно неустойчивы, немедленно по образовании выделяют воду, переходя в соответственные карбоксильные кислоты.
[7]
Моноэфиры ортокислот превращаются в обычные сложные эфиры, теряя элементы воды.
[8]
Эфирами ортокислот или ортоэфирами называют алкоксильные соединения, которые производятся неустойчивой гидратной формой к а р б о н о в ы х к и с л о т R С ( ОН) 3, так называемых ортокислот.
[9]
Взаимодействие эфиров ортокислот ( ортомуравьиного и ортоугольного эфира) с магнийорганическйми соединениями приводит к получению альдегидов и кетонов.
[10]
Взаимодействие эфиров ортокислот ( ортомуравьиного и ортоугольного эфира) с магнийорганическими соединениями приводит к получению альдегидов и кетонов.
[11]
Взаимодействие эфиров ортокислот ( ортомуравьиного или ортоугольного эфира) с магнийорганическими соединениями приводит к получению альдегидов и кетонов.
[12]
Изменение формы высших кислородных ортокислот неметаллов одной и той же группы объясняется тем, что с возрастанием порядкового номера неметалла увеличивается радиус его атома, а с увеличением радиуса атом может разместить вокруг себя большее число атомов кислорода.
[13]
Метатитановая кислота получается кипячением ортокислоты в растворе соляной кислоты или действием азотной кислоты плотности 1 25 на металлический титан. Метакислота не растворяется в кислотах, за исключением концентрированной серной при нагревании. При высокой температуре она теряет воду и превращается в двуокись титана, но рекалесценции при этом не происходит.
[14]
Напишите уравнение реакции получения фосфорной ортокислоты, учитывая, что в реакции принимает участие вода и что вторым продуктом реакции является оксид азота NO.
[15]
Страницы:
1
2
3
4
From Wikipedia, the free encyclopedia
Ortho effect refers mainly to the set of steric effects and some bonding interactions along with polar effects caused by the various substituents which are in a given molecule, resulting in changes in its chemical and physical properties. In a general sense, the ortho effect is associated with substituted benzene compounds.
There are three main ortho effects in substituted benzene compounds:[a][clarification needed]
- Ortho effect in substituted benzoic acid (first ortho effect): Ortho-substituted benzoic acids are stronger acids than their meta and para isomers, regardless of the nature of the substituent
- Ortho effect in substituted aniline (second ortho effect/SIP effect): Ortho-substituted anilines are weaker bases than their meta and para isomers, regardless of the nature of the substituent
- Ortho effect in electrophilic aromatic substitution of disubstituted benzene compounds (third ortho effect): It refers to the set of steric effects which determines the regioselectivity of an incoming electrophile in disubstituted benzene compounds where a meta-directing group is meta to an ortho–para-directing group.
First ortho effect in substituted benzoic acids[edit]
When any group is present at ortho to carboxyl group in substituted benzoic acid then the acidic character of that compound becomes at least more than benzoic acid. Generally ortho-substituted benzoic acids are stronger acids than their meta and para isomers also. The table given below shows pKa values of various monosubstituted benzoic acids.
- The ortho effect is large for the nitrobenzoic acids, which show nearly a 20 fold increase in acidity, roughly an 8 fold factor for the halobenzoic acids, and a 2.5 to 3 fold increase for methyl and cyano substituents.[1]
- The methoxybenzoic acids are exceptional, in that the ortho and meta isomers have nearly identical pKa‘s (ca. 4.1), presumably due to the exceptional p-π electron donation from oxygen.[1]
General explanation for first ortho effect[edit]
When a group is present ortho to carboxylic acid group in substituted benzoic acid, the steric hindrance forces the carboxyl group to twist out of the plane of the benzene ring. This inhibits the resonance of carboxyl group with phenyl ring which increases the acidity of carboxyl group which was otherwise reduced due to destabilizing cross conjugation. In-fact this destabilizing cross conjugation is also accounted as the reason for decreased acidity of benzoic acid as compared to formic acid.
Steric hindrance in ortho substituted benzoic acid
Also the presence of a hydrogen bond donor near a carboxyl group may act to enhance its acidity, as demonstrated by the three isomeric hydroxy-benzoic acids (refer the table above). Intramolecular hydrogen bonding of an ortho OH donor to the carbonyl oxygen of the carboxyl group, acting as an acceptor, increases the positive charge on the carbonyl carbon and consequently the acidity of the carboxyl OH.[1]
pKa values[edit]
| Substituent | Position on ring | ||
|---|---|---|---|
| Ortho | Meta | Para | |
| H | 4.2 | 4.2 | 4.2 |
| CH3 | 3.9 | 4.3 | 4.4 |
| F | 3.3 | 4.3 | 4.4 |
| Cl | 2.9 | 3.8 | 4.0 |
| Br | 2.8 | 3.8 | 4.0 |
| I | 2.9 | 3.9 | 4.0 |
| OMe | 4.1 | 4.1 | 4.5 |
| NO2 | 2.2 | 3.5 | 3.4 |
| OH | 2.98 | 4.08 | 4.58 |
Second ortho effect in substituted aniline (steric inhibition of protonation)[edit]
When any group is present at ortho to NH2 in aniline then the basic character of that compound becomes at least less than aniline. For example, see the order of basicity of following substituted aniline:-
- p-Toluidine > m-Toluidine > Aniline > o-Toluidine
- Aniline > m-Nitroaniline > p-Nitroaniline > o-Nitroaniline
- Aniline > p-Haloaniline > m-Haloaniline > o-Haloaniline
- p-Aminophenol pKb=8.50 > o-Aminophenol pKb=9.28 > Aniline pKb=9.38 > m-Aminophenol pKb=9.80
General explanation for second ortho effect[edit]
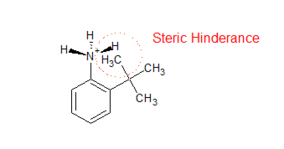
- The protonation of Substituted aniline is inhibited due to steric hindrance. Upon protonation the hybridization of Nitrogen in amino group changes from sp2 to sp3 making the group non planar. This causes the steric hindrance between the ortho substituted group and H atom of amino group which makes the conjugate acid less stable, hence decreases the basicity of substituted aniline (see the figure on right).
Steric Inhibition of Protonation
Third ortho effect in electrophilic aromatic substitution of disubstituted benzene compounds[edit]
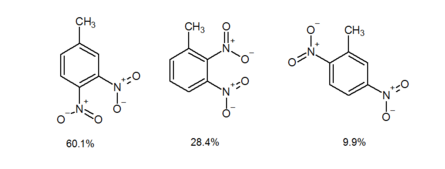
Nitration of m-Nitrotoluene
When a meta-directing group is meta to an ortho–para-directing group, the incoming group primarily goes ortho to the meta-directing group rather than para. This is called the ortho effect. There is no good explanation yet for the ortho effect, though possibly there is intramolecular assistance from the meta-directing group.[2] For example, the electrophilic aromatic nitration of 1-methyl-3-nitrobenzene affords 4-methyl-1,2-dinitrobenzene and 1-methyl-2,3-dinitrobenzene in 60.1% and 28.4% yields, respectively.[3] In contrast, 2-methyl-1,4-dinitrobenzene (2c) is isolated in only 9.9% yield.[3] As witnessed in the above example, when a π-acceptor substituent (πAS) is meta to a π-donor substituent (πDS), the electrophilic aromatic nitration occurs ortho to the πAS rather than para.
Nitration of 3-Methylbenzoic acid
Similar results were also observed on the nitration of 3-methylbenzoic acid in which 5-methyl-2-nitrobenzoic acid and 3-methyl-2-nitrobenzoic acid were obtained as the major compounds, whereas 3-methyl-4-nitrobenzoic acid was reported as a minor compound.[4] Also in nitration of the nitration of 3-bromobenzoic acid 5-bromo-2-nitrobenzoic acid (83%yield) was obtained as major product and 3-bromo-2-nitrobenzoic acid (13% yield) as minor. On an interesting note the potential isomer 3-bromo-4-nitrobenzoic acid was not detected.[5]
Ortho effect in Diels-Alder reactions[edit]
In normal electron demand Diels-Alder reactions, the Z-substituted dienophiles react with 1-substituted butadienes to give 3,4-disubstituted cyclohexenes, independent of the nature of diene substituents. This is also known as ortho effect.[6]
Notes[edit]
- ^ The terms «First Ortho effect» , «Second Ortho effect» and «Third Ortho effect» have been used for convenience in referring and reducing ambiguity in the use of the term «Ortho effect».
References[edit]
- ^ a b c «Supplemental Topics». www2.chemistry.msu.edu. Retrieved 2019-03-09.
- ^ Lin, Shu-kun; March, Jerry (2001-12-31). «March’s Advanced Organic Chemistry: Reactions, Mechanisms, and Structure, 5th Edition». Molecules. 6 (12): 1064–1065. doi:10.3390/61201064. ISSN 1420-3049. PMC 6236433.
- ^ a b Li, Hui-Jing; Wu, Yan-Chao; Dai, Jian-Hong; Song, b Yan; Cheng, Runjiao; Qiao, Yuanyuan (2014). «An «Ortho Effect» in Electrophilic Aromatic Nitrations: Theoretical Analysis and Experimental Validation». Journal of the Chinese Chemical Society. 61 (12): 1307–1312. doi:10.1002/jccs.201400092. ISSN 2192-6549.
- ^ Oxley, Jimmie C.; Smith, James L.; Moran, Jesse S.; Canino, Jonathan N.; Almog, Joseph (July 2008). «Aromatic nitration using nitroguanidine and EGDN». Tetrahedron Letters. 49 (28): 4449–4451. doi:10.1016/j.tetlet.2008.04.153. ISSN 0040-4039.
- ^ Holmes, Eric Leighton; Flürscheim, Bernhard (1928-01-01). «LXI.—The laws of aromatic substitution. Part VI. A quantitative method for the rapid determination of isomeric nitro-derivatives of laterally substituted toluenes». Journal of the Chemical Society (Resumed): 448–453. doi:10.1039/JR9280000448. ISSN 0368-1769.
- ^ Smith, Michael (2011). Organic synthesis (Third ed.). Boston: Academic Press. ISBN 978-0-12-415884-9. OCLC 787844634.
External links[edit]
- Supplemental Topics § The Ortho Effect – Department of Chemistry, Michigan State University