Осмотическое давление растворов
Все растворы
обладают способностью к диффузии.
Диффузией называется стремление
вещества равномерно распределиться по
всему предоставленному ему объёму.
Если разделить
раствор и растворитель полунепроницаемой
перегородкой, через которую проходят
молекулы растворителя, но не проходят
молекулы растворённого вещества, то в
этом случае возможна только диффузия
растворителя в раствор.
Процесс
односторонней диффузии растворителя
в раствор через полунепроницаемую
перегородку называется осмосом.
Осмотическим
давлением называется сила на единицу
площади (Н/м2), заставляющая
растворитель переходить через
полунепроницаемую перегородку в раствор,
находящийся при том же внешнем давлении,
что и растворитель. Осмотическое давление
разбавленных растворов подчиняется
законам идеального газа.
Закон Вант-Гоффа:
Осмотическое
давление разбавленных идеальных
растворов численно равно тому давлению,
которое оказывало бы растворённое
вещество, если бы при данной температуре
оно в виде идеального газа занимало тот
же объём.
π = СRT,
(71)
где C– молярная концентрация раствора,
моль/л;R– универсальная
газовая постоянная 8,314 Дж/(моль∙К);T– абсолютная температура, К.
В растворах
электролитов благодаря электролитической
диссоциации и увеличения числа частиц
экспериментальное значение осмотического
давления всегда выше, чем теоретически
вычисленное по уравнению (71). Степень
отклонения наблюдаемого осмотического
давления (πэксп) от вычисленной
величины (πвыч) выражается
изотоническим коэффициентом
i=
.
При вычислении
осмотического давления растворов
электролитов в уравнение (71) вводится
поправочный (изотонический) коэффициент
i> 1, учитывающий
увеличение числа частиц в растворе
вследствие электролитической диссоциации
молекул:
π = iСRT.
(72)
Для растворов
неэлектролитов изотонический коэффициент
равен 1. Изотонический коэффициент i
зависит от природы электролита и
степени диссоциации его молекул. В общем
случае при распаде электролита с
образованиемk– ионов
i
= 1 + (k – 1)α.
(73)
Если при распаде
молекулы образуется два иона k
= 2, то формула (73) примет более простой
вид:
i
= 1 + α. (74)
Пользуясь выражениями
(71- 74), можно рассчитать осотическое
давление, концентрацию, молекулярные
веса растворённых веществ, а также
степень диссоциации электролитов в
растворах.
Пример 10.Вычислить осмотическое давление 2%-ного
раствора глюкозы при 0ºС. Плотность
раствора принять равной единице.
Решение. Осмотическое давление вычисляем по
формуле (71). Концентрация раствора
выражается в моль/дм3,R= 8,314 Дж/(моль∙К), молекулярная масса
глюкозы С6Н12О6равна
180 г/моль.
В 100 г 2%-ного раствора
содержится 2 г глюкозы. Поскольку
плотность данного раствора равна 1, то
в 1дм3содержится 20 г глюкозы, а
это соответствует молярной концентрации
С =,
в результате получаем:
π =
252,2 кПа
Давление пара разбавленных растворов. Закон Рауля
Давление пара над
раствором нелетучего вещества в
каком-либо растворителе всегда ниже,
чем над чистым растворителем при одной
и той же температуре. Согласно закону
Рауля : давление насыщенного пара
i-того компонента
над раствором (Рi
) прямо пропорционально его молярной
доле в растворе (χi):
Рi
= Рi0·
χi,, (75)
где Рi0– коэффициент пропорциональности,
равный давлению насыщенного пара над
чистымi—тым
компонентом;
χi
=
,(76)
где ni
– число молей растворённого вещества,ns
– число молей растворителя.
Пример 11.
Вычислить давление пара 10%-ного
раствора мочевины СО(NH2)2при 50ºС. Давление паров воды при 50ºСРi0
= 12 320 Н/м2.
Решение. Для решения данной задачи используем
формулу (75):
Рi
= Рi0·
χi
В 100 г 10%-ного
раствора мочевины содержится 10 г мочевины
и 90 г воды: Мм(СО(NH2)2)
= 60 г/моль, Мм(Н2О) = 18 г/моль.
Определяем число
молей мочевины (ni)
и число молей воды (ns)
в 100 г 10%-ного раствора:
ni=;ns=
.
Согласно закону
Рауля
Рs
= Рi0—
Рi
Рi
= Рi0∙
Рi
=12 320 Н/м2·
398
Н/м2,
Рs= 12 320 Н/м2— 398 Н/м2= 11 922
Н/м2.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
From Wikipedia, the free encyclopedia
Osmosis in a U-shaped tube
Osmotic pressure is the minimum pressure which needs to be applied to a solution to prevent the inward flow of its pure solvent across a semipermeable membrane.[1]
It is also defined as the measure of the tendency of a solution to take in its pure solvent by osmosis. Potential osmotic pressure is the maximum osmotic pressure that could develop in a solution if it were separated from its pure solvent by a semipermeable membrane.
Osmosis occurs when two solutions containing different concentrations of solute are separated by a selectively permeable membrane. Solvent molecules pass preferentially through the membrane from the low-concentration solution to the solution with higher solute concentration. The transfer of solvent molecules will continue until equilibrium is attained.[1][2]
Theory and measurement[edit]
A Pfeffer cell used for early measurements of osmotic pressure
Jacobus van ‘t Hoff found a quantitative relationship between osmotic pressure and solute concentration, expressed in the following equation:
where 

For more concentrated solutions the van ‘t Hoff equation can be extended as a power series in solute concentration, c. To a first approximation,
where 
The Pfeffer cell was developed for the measurement of osmotic pressure.
Applications[edit]
Osmotic pressure on red blood cells
Osmotic pressure measurement may be used for the determination of molecular weights.
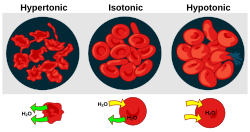
Osmotic pressure is an important factor affecting biological cells.[4] Osmoregulation is the homeostasis mechanism of an organism to reach balance in osmotic pressure.
- Hypertonicity is the presence of a solution that causes cells to shrink.
- Hypotonicity is the presence of a solution that causes cells to swell.
- Isotonicity is the presence of a solution that produces no change in cell volume.
When a biological cell is in a hypotonic environment, the cell interior accumulates water, water flows across the cell membrane into the cell, causing it to expand. In plant cells, the cell wall restricts the expansion, resulting in pressure on the cell wall from within called turgor pressure. Turgor pressure allows herbaceous plants to stand upright. It is also the determining factor for how plants regulate the aperture of their stomata. In animal cells excessive osmotic pressure can result in cytolysis.
Osmotic pressure is the basis of filtering («reverse osmosis»), a process commonly used in water purification. The water to be purified is placed in a chamber and put under an amount of pressure greater than the osmotic pressure exerted by the water and the solutes dissolved in it. Part of the chamber opens to a differentially permeable membrane that lets water molecules through, but not the solute particles. The osmotic pressure of ocean water is approximately 27 atm. Reverse osmosis desalinates fresh water from ocean salt water.
Derivation of the van ‘t Hoff formula[edit]
Consider the system at the point when it has reached equilibrium. The condition for this is that the chemical potential of the solvent (since only it is free to flow toward equilibrium) on both sides of the membrane is equal. The compartment containing the pure solvent has a chemical potential of 





Here, the difference in pressure of the two compartments 
In order to find 
We can write the left hand side as:
,
where 


where 
If the liquid is incompressible the molar volume is constant, 

The activity coefficient is a function of concentration and temperature, but in the case of dilute mixtures, it is often very close to 1.0, so
The mole fraction of solute, 





The mole fraction 





For aqueous solutions of salts, ionisation must be taken into account. For example, 1 mole of NaCl ionises to 2 moles of ions.
See also[edit]
- Gibbs–Donnan effect
References[edit]
- ^ a b Voet D, Aadil J, Pratt CW (2001). Fundamentals of Biochemistry (Rev. ed.). New York: Wiley. p. 30. ISBN 978-0-471-41759-0.
- ^ Atkins PW, de Paula J (2010). «Section 5.5 (e)». Physical Chemistry (9th ed.). Oxford University Press. ISBN 978-0-19-954337-3.
- ^ Lewis GN (1908-05-01). «The Osmotic Pressure of Concentrated Solutions and the Laws of the Perfect Solution». Journal of the American Chemical Society. 30 (5): 668–683. doi:10.1021/ja01947a002. ISSN 0002-7863. Archived from the original on 2022-06-18. Retrieved 2019-07-04.
- ^ Esteki MH, Malandrino A, Alemrajabi AA, Sheridan GK, Charras G, Moeendarbary E (December 2021). «Poroelastic osmoregulation of living cell volume». iScience. 24 (12): 103482. Bibcode:2021iSci…24j3482E. doi:10.1016/j.isci.2021.103482. PMC 8649806. PMID 34927026.
External links[edit]
- What is Osmosis? Explanation and Understanding of a Physical Phenomenon
Расчеты, связанные с осмотическим давлением
Осмотическое давление в растворах, содержащих несколько растворимых веществ
Задача 118.
В колбе налито 105 мл раствора, в котором содержится 0,37 г сахарозы и 0,27 г NaCl. В раствор добавили 0,23 г CaCl2. Температура в лаборатории 24 градуса по Цельсию. На сколько процентов изменилось осмотическое давление раствора по отношению к начальному?
Решение:
M(С12Н22О11) = 342,2965 г/моль;
М(NaCl) = 58,44 г/моль;
М(CaCl2) = 110,98 г/моль.
1. Рассчитаем осмотическое давление сахарозы
Осмотическое давление C12H22O11, как неэлектролита, рассчитывается по формуле:
Р = СМRT,
где СМ – молярная концентрация, R – газовая постоянная [8,314 Дж/(моль . К)], T – температура. СМ можно выразить через массу растворённого вещества (m) и его мольную массу (М). Массу сахара, содержащегося в 1000 мл раствора, найдём из пропорции:
0,37 : 105 = х : (1000;
х = 0,37 . 1000)/105 = 3,524 г.
Отсюда
Р(С12Н22О11) = [m(С12Н22О11)RT]/M(С12Н22О11) = (3,524 . 8,314 . 297)/342,2965 = 25,42 кПа.
2. Рассчитаем осмотическое давление электролитов NaCl и CaCl2
Массу NaCl, содержащегося в 1000 мл раствора, найдём из пропорции:
0,27 : 105 = х : (1000; х = 0,27 . 1000)/105 = 2,57 г.
Массу CaCl2, содержащегося в 1000 мл раствора, найдём из пропорции:
0,23 : 105 = х : (1000; х = 0,23 . 1000)/105 = 2,19 г.
Осмотическое давление электролита, рассчитывается по формуле:
Р = iCMRT,
где i — изотонический коэффициент.
Рассчитаем изотонический коэффициент электролитов из формулы:
а = (i — 1)/(k — 1);
i = (1 + a)(k — 1),
где a — степень диссоциации электролита, k — число ионов, на которые распадается электролит.
Отсюда
i(NaCl) = 1 + 1(2 — 1) = 2;
i(CaCl2) = 1 +1(3 — 1) = 3.
Тогда
Р(NaCl) = [i(NaCl) . m(NaCl)RT]/М(NaCl) = (2 . 2,57 . 8,314 . 297)/58,44 = 217,18 кПа;
Р(CaCl2) = [i(CaCl2) . m(CaCl2)RT]/М(CaCl2) = (3 . 2,1`9 . 8,314 . 297)/110,98 = 146,18 кПа.
3. Рассчитаем сумарное осмотическое давление начального раствора сазарозы и NaCl, получим:
Р1 = Р(С12Н22О11) + Р(NaCl) = 242,6 кПа.
4. Рассчитаем сумарное осмотическое давление конечного раствора сазарозы, NaCl и CaCl2, получим:
Р2 = Р1 + Р(CaCl2) = 242,6 + 146,18 = 388,78 кПа.
5. Рассчитаем на сколько процентов изменилось осмотическое давление раствора по отношению к начальному, получим:
388,78 : 100 = 146,18 : у;
у = (146,18 . 100)/388,78 = 37,6%.
Ответ: осмотическое давление увеличилось на 37,6%.
Осмотическое давление в живой природе
Задача 119.
Осмотическое давление в корневых волокнах равно 7,3 атм. Концентрация почвенного раствора имеет 0,18 моль. Будет ли вода поступать в корни?
Решение:
1 мм рт ст = 133,322 Па или 0,133322 кПа;
Р(корневых волокон) = 7,3 атм;
1 атм = 101,325 кПа.
1. Рассчитаем осмотическое давление почвенного раствора, получим:
Р = СМRT,
где СМ – молярная концентрация, R – газовая постоянная [8,314 Дж/(моль . К)], T – температура, К.
Тогда
Р(почвенного раствора) = 0,18 . 8,314 . (273 + 20) = 438,48 кПа или 4, 3 атм.
Так как Р(корневых волокон) > Р(почвенного раствора); 7,3 атм > 4, 3 атм, то вода будет стремиться в сторону большего давления, вода будет поступать в корни. Осмотическое давление почвенного раствора гипотонично по отношению к осмотическому давлению в корневых волокнах, поэтому происходит поступление воды из почвы в корневые волоски.
Задача 120.
В 1 мл воды растворили 80 мг белка. Осмотическое давление составило при 25 град. по Цельсию 12 мм рт ст. Каков молекулярный вес белка?
Решение:
1. Рассчитаем молекулярную массу белка
Молярность раствора рассчитаем из формулы: Р = СМRT.
Тогда
СМ = 0,133322/(8,314 . 298) = 0,0000457 = 4,57 . 10-5 моль.
2. Найдём, сколько милиграммов высокомолекулярного соединения содержится в 1 л раствора его из пропорции:
1 : 80 = 1000 : х;
х = 80000 мг = 80 г.
По условию задачи вытекает, что в 1 л раствора содержится 80 г вещества; это составляет 0,0000457 = 4,57 . 10-5 моль.
3.Теперь вычислим молекулярную массу соединения по формуле:
М(В) = m(B)/СМ(B),
где М(В) – молекулярная масса вещества, m(B) – масса растворённого вещества, СМ(B) — молярная концентрация.
Тогда
М(В) = Mr(белок) = 80/0,0000457 = 1750547 г/моль.
Ответ: Мr(белок) = 1750547 г/моль.
В этой статье мы обсудим пример осмотического давления. Осмос относится к перемещению молекул из области с более высокой концентрацией в область с более низкой концентрацией.
Движение происходит через полупроницаемую мембрану. Эта мембрана разделяет области более высокой концентрации и более низкой концентрации. В этой статье мы обсудим примечательные особенности осмоса, а затем обсудим осмотическое давление и его примеры.
- Транспорт питательных веществ в деревьях
- Пот
- Поглощение питательных веществ из почвы
- Поглощение воды смолой
- Перенос кислорода в кровь
- Картофель в сахарном растворе
- Рыбы поглощают воду через кожу и жабры
- Красные кровяные тельца помещают в пресную воду
- Сахар на клубнике
- Еда на консервации
- Всасывание переваренной пищи в толстом и тонком кишечнике
- Сухость глаз, вызванная контактными линзами
- Очистка воды
Что такое осмос?
Осмос относится к переносу молекул через полупроницаемую мембрану из области с более высокой концентрацией в область с более низкой концентрацией.
Осмос может происходить во многих областях, включая клетки нашего тела. Перенос молекул происходит до тех пор, пока концентрации в обоих местах не станут равными. Существует много типов осмоса и растворов для осмоса, мы обсудим эти типы в следующем разделе.
Кредиты изображений: OpenStax, 0307 Осмос, CC BY 4.0
Виды осмосных растворов
Осмотические растворы бывают трех типов. Они приведены в списке ниже-
- Изотонический раствор- Изотонический раствор – это такой раствор, в котором концентрация растворенных веществ одинакова как снаружи, так и внутри клетки.
- Гипертонический раствор– Гипертонический раствор – это такой раствор, в котором концентрация растворенного вещества снаружи выше, чем внутри.
- Гипотонический раствор – Гипотонический раствор имеет более высокую концентрацию растворенного вещества внутри, чем снаружи.
Типы осмоса
Осмос делится на два типа. Эти два типа обсуждаются в разделе ниже.
- эндосмоз– Когда мы помещаем вещество в гипотонический раствор, молекулы растворителя будут двигаться внутри клетки, делая клетку набухшей. Можно сказать, что он подвергается деплазмолизу. Этот тип переноса молекул называется эндосмозом.
- экзосмоз– При помещении вещества в гипертонический раствор молекулы растворителя будут выходить за пределы клетки, делая ее дряблой и негибкой. Можно сказать, что он подвергается плазмолизу. Этот тип переноса молекул называется экзосмозом.
Что такое осмотическое давление?
Перенос молекул через мембрану происходит самопроизвольно. То есть молекулы будут перемещаться сами по себе в силу разницы концентраций между двумя областями.
Чтобы остановить этот перенос молекул, необходимо определенное давление. Это давление называется осмотическим давлением. Осмотическое давление можно определить по концентрации растворенного вещества. Единственный способ остановить диффузию, кроме применения осмотического давления, — сделать концентрации в обоих местах равными.
Формула осмотического давления
В предыдущем разделе мы обсуждали, что для определения осмотического давления мы используем значение концентрации растворенного вещества. Формула для расчета осмотического давления приведена ниже:
Где,
Pi – осмотическое давление,
M — молярная концентрация растворенного вещества.
R — газовая постоянная
T — температура, при которой происходит перенос молекулы
Примеры осмотического давления
Примеры осмотического давления приведены в списке ниже:
Транспорт питательных веществ в деревьях
Транспорт питательных веществ от корней к другим ветвям дерева происходит посредством осмоса. Концентрация питательных веществ или воды выше на дне или корнях. Вода транспортируется в другие ответвления, где концентрация ниже.
Пот
Потоотделение у людей происходит, чтобы охлаждать тело, когда оно тренируется или подвергается воздействию тепла. Соленая вода выходит из организма через крошечные поры в нашей коже.
Поглощение питательных веществ из почвы
Питательные вещества поглощаются корнями путем осмоса. Концентрация питательных веществ в почве высокая. Вот почему рекомендуется добавлять удобрения в почву, чтобы почва оставалась богатой питательными веществами, что в конечном итоге будет способствовать росту растений.
Поглощение воды смолой
Когда мы погружаем смолу в воду, она через определенное время набухает. Это происходит из-за того, что внутри смол находится большее количество сахара. Так вода устремляется внутрь смолы.
Перенос кислорода в кровь
Перенос кислорода в кровь осуществляется путем диффузии или осмоса. Клетки имеют полупроницаемую мембрану, через которую происходит перенос кислорода.
Картофель в сахарном растворе
Когда мы помещаем картофель в сахарный раствор, размер картофеля уменьшается, потому что концентрация воды в картофеле выше, чем в сахарном растворе. Таким образом, вода вытекает из картофеля, уменьшая его размер.
Рыбы поглощают воду через кожу и жабры
Рыбы поглощают воду или кислород из воды через кожу и жабры. Они представляют собой полупроницаемые мембраны, через которые происходит перенос молекул воды.
Красные кровяные тельца помещают в пресную воду
Красные кровяные тельца имеют полупроницаемую мембрану, через которую может происходить перенос молекул. Красные кровяные тельца богаты ионами, и в воде эти клетки набухают из-за того, что молекулы воды начинают проникать в эритроциты.
Сахар на клубнике
Когда мы посыпаем клубнику сахаром, внешняя мембрана клубники будет действовать как полупроницаемая мембрана, поэтому вода будет двигаться к внешней поверхности клубники. Это происходит из-за того, что в интерьере есть натуральный сахар и вода.
Сохранение продуктов питания
Сохранение пищевых продуктов — это прямое применение осмоса. Пища обогащается сахаром, уксусом, маслами-консервантами, когда пища (например, рассол) помещается в банку с этими консервантами.
Всасывание переваренной пищи в толстом и тонком кишечнике
Пища, попадая в кишечник, превращается в густую полужидкость, называемую химусом. Когда эта густая полужидкость или химус попадает в тонкую кишку, происходит осмос.
Сухость глаз, вызванная контактными линзами
Когда мы держим линзы в воде, они мягкие и содержат влагу, а когда мы надеваем их на глаза, они поглощают влагу из глаза посредством осмоса.
Очистка воды
Водоочистители используют процесс обратного осмоса для фильтрации воды от примесей и нежелательных минералов. В процессе обратного осмоса прикладывается давление, превышающее осмотическое давление, из-за чего происходит разделение растворенного вещества с одной стороны и растворителя с другой. Здесь примеси являются растворенным веществом, а растворителем является вода.
Калькулятор осмотического давления — это инструмент, который поможет вам рассчитать давление, необходимое для полной остановки процесса осмоса. В этой статье мы предоставим вам все знания, необходимые для понимания того, как это работает: от уравнения осмотического давления до полного примера расчетов.
Вы также узнаете, что такое осмотическое давление по определению. Если вы когда-нибудь задавались вопросом, как рассчитать осмотическое давление, вы попали в нужное место.
Калькулятор осмотического давления
Уравнение осмотического давления
Если вы хотите рассчитать осмотическое давление, вам нужно использовать формулу осмотического давления в виде:
π = n * Φ * c * R * T
где:
π обозначает осмотическое давление. Измеряется в единицах давления — чаще всего в паскалях (символ Па) или барах.
n — количество ионов, образующихся при диссоциации растворенного вещества. Это также называют фактором диссоциации или фактором Вант Хоффа. Наиболее типично он колеблется от 1 (для веществ, которые не могут быть диссоциированы) до 3.
Φ — осмотический коэффициент данного растворенного вещества. Это единичный фактор, зависящий от типа вещества. Его значение чаще всего близко к 1. Вы можете найти значение этого коэффициента для наиболее распространенных веществ в конце этой статьи.
с обозначает молярную концентрацию раствора, измеренную в моль / литр. Вы можете либо ввести его напрямую, либо открыть расширенный режим, чтобы рассчитать его по массе растворенного вещества и объему раствора.
R — универсальная газовая постоянная. Он равен 8,314 Дж / (К * моль).
Т — температура, измеряемая в Кельвинах (символ К).
Как рассчитать осмотическое давление
Если вы хотите найти осмотическое давление, просто следуйте инструкциям ниже.
Выберите раствор для анализа — например, сульфат натрия (Na₂SO₄).
Скопируйте значения коэффициента диссоциации n, молекулярной массы M и осмотического коэффициента Φ из списка ниже. В этом случае n = 3, M = 142 и Φ = 0,74.
Определите температуру окружающей среды, при которой происходит осмос — например, 30 ° C, что эквивалентно 303,15 К.
Если вы знаете молярную концентрацию вашего раствора, вы можете ввести его непосредственно в калькулятор осмотического давления. Если нет, вам нужно определить массу растворенного вещества (например, 1 г) и общий объем раствора (допустим, 0,1 л).
Рассчитайте молярную концентрацию вашего раствора:
с = м / (М * V) = 1 / (142 * 0,1) = 0,07 моль / л.
Подставьте все эти данные в уравнение осмотического давления или просто введите их в наш калькулятор осмотического давления, чтобы получить результат — в этом случае давление равно 3940,56 гПа.
Коэффициенты для формулы осмотического давления
В приведенном ниже списке перечислены наиболее распространенные вещества, а также количество ионов, полученных путем диссоциации n, молекулярная масса M и коэффициент осмотического давления Φ.
NaCl: n = 2, М = 58,5, Ф = 0,93
KCl: n = 2, M = 74,6, Φ = 0,92
HCl: n = 2, M = 36,6, Φ = 0,95
NH2Cl: n = 2, M = 53,5, Φ = 0,92
NaHCO₃: n = 2, M = 84, Φ = 0,96
NaNO₃: n = 2, M = 85, Φ = 0,9
KH₂PO₄: n = 2, M = 136, Φ = 0,87
CaCl₂: n = 3, M = 111, Φ = 0,86
MgCl2: n = 3, M = 95,2, Φ = 0,89
Na2SO4: n = 3, M = 142, Φ = 0,74
K₂SO₄: n = 3, M = 174, Φ = 0,74
MgSO4: n = 2, M = 120, Φ = 0,58
Глюкоза: n = 1, М = 180, Ф = 1,01
Сахароза: n = 1, M = 342, Φ = 1,02
Мальтоза: n = 1, M = 342, Φ = 1,01
Лактоза: n = 1, M = 342, Φ = 1,01