найди число атомов каждого элемента в молекуле оксида углерода, если массовая доля углерода в нём равна (42,86) %, а массовая доля кислорода — (57,14) %.
1. Примем массу оксида равной (100) г. Масса углерода в такой порции равна (42,86) г, а масса кислорода — (57,14) г.
2. Находим относительные атомные массы элементов в Периодической таблице:
3. Обозначаем число атомов углерода как (x), а число атомов кислорода — (y), и записываем отношение масс:
.
4. Получаем выражение:
5. Находим отношение (x : y):
.
В молекуле оксида углерода на (1) атом углерода приходится (1) атом кислорода.
Массы атомов и молекул очень малы, и
использовать для численного выражения
их величин общепринятую единицу
измерения – килограмм –
неудобно. Поэтому для выражения масс
атомов и молекул используют другую
единицу измерения – атомную
единицу массы (а. е. м.).
Атомная единица массы (а. е. м.) –
единица измерения масс атомов, молекул
и элементарных частиц.
За атомную единицу массы принята 1 / 12
массы нуклида углерода 12C.
Масса этого нуклида в единицах СИ равна
1,9927 10–26 кг.
1 а. е. м. =
mc =
= 1,6606 10–27 кг.
Относительная атомная масса
(устаревший термин – атомный
вес) – масса атома, выраженная
в атомных единицах массы (а. е. м.).
Обозначается Ar .
Большинство
природных химических элементов
представляют собой смесь изотопов.
Поэтому за относительную атомную массу
элемента принимают среднее значение
относительной атомной массы природной
смеси его изотопов с учетом их содержания
в земных условиях. Именно эти значения
и приведены в Периодической системе.
Например, кислород имеет три изотопа
16O, 17O
и 18O, их атомные
массы и содержание в природной смеси
приведены в таблице 3.
Таблица 3
Изотопный
состав кислорода в природной смеси
|
Изотоп |
Содержание в % |
Атомная масса |
|
16O |
99,759 |
15,995 |
|
17O |
0,037 |
16,999 |
|
18O |
0,204 |
17,999 |
Среднее значение атомной массы с учетом
вклада каждого изотопа вычисляется по
следующей формуле:
Ar =
,
где Ar, j –
атомные массы соответствующих изотопов,
ni –
содержание их в природной смеси (в
мольных долях). Подставляя в эту формулу
соответствующие значения из таблицы
3 для атомной массы кислорода, получим:
Ar = 15,995 0,99759 + 16,999 0,00037 + 17,999 0,0024 =
= 15,999 а. е. м.
Обратите внимание на то, что атомная
масса и массовое число –
совершенно различные понятия: первое –
масса атома, выраженная в а. е. м.,
а второе – число нуклонов в
ядре. Атомная масса – дробная
величина (имеет целое значение только
для изотопа 12C), в
отличие от массового числа, которое
является всегда целым.
Численно эти величины очень близки;
например, для водорода атомная масса
равна 1,0078, а массовое число равно 1, для
гелия атомная масса равна 4,0026, а массовое
число – 4.
Относительные атомные массы имеют
дробные значения по следующим причинам:
1) большинство элементов, существующих
в природе, представляют смесь нескольких
изотопов, и в Периодической системе
указывается среднее значение относительной
атомной массы смеси природного изотопного
состава.
2) для моноизотопных элементов (например,
23Na) это значение
будет также дробным, т. к. масса
нуклонов, выраженная в а. е. м.,
не является целым числом (см. табл. 3)
и при образовании ядра часть массы
нуклонов переходит в энергию, в
соответствии с уравнением Eсвязи = m c2,
где c = 3 108 м/с –
скорость света в вакууме.
При образовании любой связи всегда
выделяется энергия, на что и расходуется
часть массы связывающихся частиц. В
случае образования химических связей
эта величина очень мала, поэтому
изменением массы здесь пренебрегают
и считают, что масса образовавшейся
частицы равна сумме масс частиц,
участвующих в ее образовании. При
образовании же ядра выделяется очень
большая энергия, и «дефект массы» хорошо
заметен.
Молекулярная масса –
масса молекулы, выраженная в а. е. м.
Масса молекулы практически равна сумме
относительных атомных масс входящих
в нее атомов.
Если же вещество состоит не из молекул,
а, например, из ионов (NaCl),
или является олигомером [(H2O)n],
то относительную молекулярную массу
указывают для формульной единицы
вещества. Под формульной единицей
вещества следует понимать химический
состав наименьшего количества данного
вещества.
Моль – единица измерения
количества вещества. Обозначается .
1 моль –
это такое количество вещества, в котором
содержится столько же структурных
единиц (атомов, молекул, ионов, радикалов),
сколько атомов содержится в 0,012 кг
изотопа углерода 12C,
а именно –
NA = 6,022 1023 моль–1 –
число Авогадро.
Молярная масса вещества (М)
равна отношению массы этого вещества
(m) к его количеству ():
M =
.
Прежнее определение: масса одного моля
вещества, численно равна его
молекулярной массе, но выражается в
единицах г/моль. Возможно, оно, на первых
порах, облегчит решение расчетных
задач.
Обратите внимание на различие в понятиях:
«молярная масса» и «молекулярная
масса», похожих по звучанию, но относящихся
к разному числу объектов: первое –
это масса одного моля вещества (т. е.
масса 6,022 1023
молекул), а второе – масса
одной молекулы, и выражены они в разных
единицах – г/моль и а. е. м.
соответственно.
Понятие «количество вещества» и,
соответственно, единица его измерения –
моль используются в большинстве
химических расчетов. Эта величина
однозначно связана с массой, числом
структурных единиц и объемом (если это
газ или пары) вещества. Если задано
количество вещества, то эти величины
легко рассчитать.
|
N = NA |
m = M |
|||
|
|
|
|||
|
|
||||
|
|
||||
|
|
Массовая доля вещества A
в системе – отношение его
массы к массе всей системы (часто эту
величину выражают в %):
A =
100%
Все задачи, связанные с расчетами по
массовым долям, следует решать, используя
эту формулу. Чтобы избежать досадных
технических ошибок, рекомендуем при
проведении расчетов сразу же % перевести
в доли.
Объемная доля компонента –
отношение объема компонента к объему
всей системы:
Мольная доля компонента –
отношение количества вещества (моль)
компонента A к общему
количеству молей всех компонентов
системы:
Закон сохранения энергии –
энергия не возникает из ничего и не
исчезает бесследно, но отдельные ее
виды могут переходить друг в друга по
строго определенным эквивалентным
соотношениям.
Так, если энергия химических связей в
продуктах реакции больше, чем в реагентах,
то освобожденная энергия выделяется
в виде тепла, света, либо за счет нее
произойдет работа (например, взрыв или
движение поршня).
Закон сохранения массы (М. В. Ломоносов,
1748 г.) – масса всех
веществ, вступивших в реакцию, равна
массе всех продуктов реакции.
С точки зрения атомно-молекулярного
учения закон сохранения массы объясняется
так: в результате химических реакций
атомы не исчезают и не возникают, а
происходит их перегруппировка.
Так как число атомов
до реакции и после остается
неизменным, то их общая масса также не
изменяется.
На основании этого закона проводятся
все расчеты по уравнениям химических
реакций.
Закон постоянства состава (Пруст,
1806 г.) – каждое
химическое соединение имеет вполне
определенный и постоянный состав.
Как следствие из этого закона вытекает,
что состав химического соединения не
зависит от способа его получения.
Вещества, состав которых подчиняется
этому закону, получили название
дальтониды. Вещества, состав которых
зависит от способа получения, называются
бертоллидами (например, оксиды
переходных металлов).
Закон кратных отношений (Дальтон) –
если два элемента образуют между
собой несколько соединений, то массовые
количества одного элемента, соединяющиеся
с одним и тем же массовым количеством
другого, относятся между собой как
небольшие целые числа.
Закон Авогадро (1811 г.) –
в равных объемах различных идеальных
газов при одинаковых условиях (температуре
и давлении) содержится одинаковое число
молекул.
Следствия из закона Авогадро
1. 1 моль
любого идеального газа при одинаковых
условиях (температуре и давлении)
занимает один и тот же объем.
При нормальных условиях (н. у.):
‑ t = 0C
(T = 273 K)
‑ p = 101325 Па = 101,325 кПа = 1 атм = 760 мм
рт. ст.
‑ молярный объем любого идеального
газа равен 22,4 л/моль
(22,4 10–2 м3).
2.
Плотности идеальных газов при одинаковых
условиях (температуре и давлении) прямо
пропорциональны их молярным массам:
=
=
= const M,
т. к. из закона
Авогадро следует, что при одинаковых
условиях ( p
и t) для любых идеальных газов
отношение / V = const.
Для газов вводят понятие относительной
плотности одного газа по другому.
DA(X) –
относительная плотность газа Х по газу
А:
DA(X) =
=
при рX = рA
и tX = tA.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
В уроке 12 «Элементный анализ» из курса «Химия для чайников» рассмотрим анализ химического состава вещества; научимся определять эмпирическую формулу соединения; кроме того разберем кучу примеров на нахождение весовых процентов и формулы вещества. Данный урок потребует от вас знания, что из себя представляет молекулярная формула соединения, а так же общих сведений, изложенных в первой главе «Атомы, молекулы и ионы». Обязательно прочитайте о законе сохранения массы и энергии, потому что все уроки из данного раздела посвящены именно ему.
Содержание
- Анализ химического состава вещества
- Эмпирическая формула вещества
- Определение формулы вещества
Анализ химического состава вещества
Анализ химического состава вещества или элементный анализ выполняют так: сначала разлагают исходное химическое соединение на отдельные элементы, а затем измеряют их относительные количества, выраженных в граммах на 100 грамм исходного вещества, либо в весовых (массовых) процентах. На практике это можно проделать, например, с углеводородом — соединением, содержащим лишь атомы углерода C и водорода H. Если известное количество углеводорода сжечь в кислороде, то образуется CO2 (диоксид углерода) и H2O, количество которых нужно затем измерить.
Пример 1: При сжигании неизвестного углеводорода массой 25 г образуется 68,58 г CO2 и 56,15 г H2O. Сколько граммов углерода и водорода содержится в исходном образце?
Решение:
Атомная масса C равна 12,011 г/моль, а молекулярная масса CO2 равна 12,011 + 2×15,999 = 44,010 г/моль. Сначала найдем относительное содержание C в CO2:
- (12,011/44,010)×100 = 27,29% углерода
Если 27,29% CO2 представляют собой углерод, то количество углерода, содержащееся в 68,58 г CO2, равно
- 27,29%×68,58 г = 18,72 г углерода
Аналогичный расчет содержания H в воде дает
- (2×1,008/18,015)×100 = 11,19% водорода
- 11,19%×56,15 г = 6,283 г водорода
Проверка: 18,72 г + 6,283 г = 25,00 г
Пример 2: Сколько граммов C содержится в 100 г образца углеводорода, рассмотренного в примере 1?
Решение:
- (100 г / 25,0 г)×18,72 г углерода = 74,88 г углерода на 100 г образца
Пример 3: Каков состав (в весовых процентах) углеводорода, рассматриваемого в примере 1?
Решение:
- (18,72 г углерода / 25,00 г образца)×100% = 74,88% углерода
- (6,28 г водорода / 25,00 г образца)×100% = 25,12% водорода
Если нам известен состав вещества в весовых процентах, можно воспользоваться атомными массами входящих в него элементов и вычислить относительное число атомов каждого элемента в соединении.
Пример 4: Вычислите относительное число атомов C и H в соединении, рассматриваемом в примере 3.
Решение:
Такие вычисления легче проводить, исходя из 100,0 г вещества: тогда весовые проценты, в которых выражен элементный состав соединения, можно просто заменить на такое же число граммов соответствующих элементов (ср. примеры 3 и 2). Теперь разделим массу C и массу H на их атомные массы:
- 74,88 г углерода / 12,011 г/моль = 6,234 моля углерода
- 25,12 г водорода / 1,008 г/моль = 24,92 моля водорода
Таковы относительные количества молей C и H в неизвестном углеводороде, и вот тут-то мы убедимся, насколько удобно пользоваться представлением о моле. Полученные выше численные значения должны также выражать относительные количества атомов углерода и водорода в соединении, то есть на каждые 6,234 атома углерода в неизвестном углеводороде приходится 24,92 атома водорода. Если мы попытаемся найти общее кратное этих двух чисел, то окажется, что они находятся в соотношении 1:4. Разделив оба числа на меньшее из них (16,234), мы найдем, на каждый атом углерода приходится 24,92/6,234=3,997, т.е 4 атома водорода.
Пример 5: Жидкость содержит 11,19 вес.% водорода и 88,81 вес.% кислорода. Каковы относительные количества атомов водорода и кислорода в этой жидкости?
Решение:
Рассмотрим снова 100 г вещества и вычислим количество молей каждого элемента, входящего в его состав:
- 11,19 г водорода / 1,008 г/моль = 11,10 моля водорода
- 88,81 г кислорода / 15,999 г/моля = 5,551 моля кислорода
Разделим оба числа на меньшее из них, чтобы найти общее кратное и тогда мы получим, что на каждый атом кислорода приходится по два атома водорода.
Пример 6 решаем самостоятельно: Обычный лабораторный растворитель, углеводород, содержит 92,26 вес.% углерода и 7,74 вес.% водорода. Каковы относительные количества атомов углерода и водорода в этом соединении?
Ответ: на 1 атом углерода приходится по 1 атому водорода
Эмпирическая формула вещества
Одним лишь элементным анализом невозможно определить правильную молекулярную формулу соединения. Например, с результатами вычислений в примере 4 согласуется формула метана -CH4, но те же аналитические результаты могли бы согласоваться с молекулярными формулами C2H8, C3H12 или C4H16, если бы подобные молекулы существовали. Вещество в примере 5 может быть водой H2O, но могло бы иметь формулу H4O2 или еще более сложную, но кратную H2O.
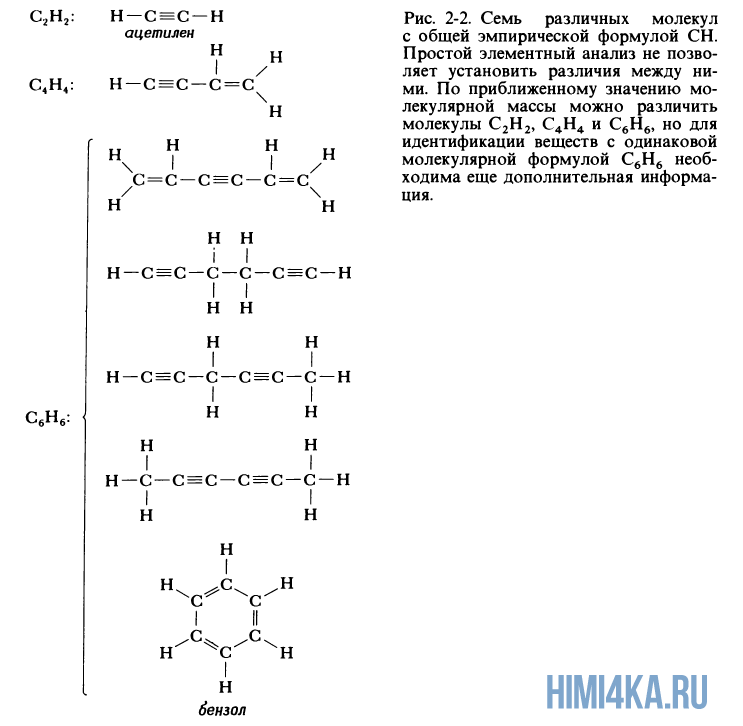
Химическая формула, указывающая относительные количества атомов каждого из элементов в соединении при помощи целых чисел, не имеющих общего кратного, называется эмпирической формулой соединения. Элементный анализ вещества приводит именно к эмпирической формуле соединения, а не к молекулярной формуле, которая может совпадать с эмпирической формулой, но может представлять собой ее целое кратное. Для метана и воды эмпирические формулы совпадают с молекулярными формулами CH4 и H2O. Например вещество из примера 6 имеет эмпирическую формулу CH, но молекулярная формула может представлять собой бензол С6H6, ацетилен C2H2 или любой из пяти других, менее распространенных углеводородов, молекулы которых изображены на рисунке 2-2.
Определение формулы вещества
Закрепим полученные знания заключительным примером:
Глюкоза содержит 40,00 вес.% углерода, 6,71 вес.% водорода и 53,29 вес.% кислорода. Каковы ее эмпирическая и молекулярная формулы, если из других экспериментов известно, что глюкоза имеет молекулярную массу, приблизительно равную 175 г/моль?
Решение:
Найдем сначала число молей каждого элемента, приходящихся на 100 г глюкозы:
- 40,00 г углерода / 12,011 г/моль = 3,330 моля углерода
- 6,71 г водорода / 1,008 г/моль = 6,66 моля водорода
- 53,29 г кислорода / 15,999 г/моль = 3,331 моля кислорода
Очевидно, что эмпирическая формула вещества должна иметь вид CH2O. Найденной эмпирической формуле глюкозы соответствует молекулярная масса
- 12,011 + (2×1,008) + 15,999 = 30,026 г/моль
Приближенная молекулярная масса из экспериментов почти в 6 раз превышает это значение, поэтому можно сделать вывод, что молекулярная формула глюкозы имеет вид C6H12O6.
Урока 12 «Элементный анализ» очень важный, поэтому если у вас возникли вопросы, пишите их в комментарии.