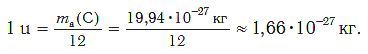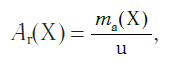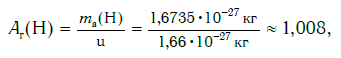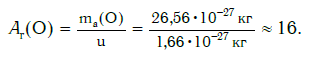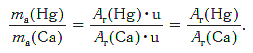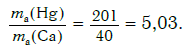найди число атомов каждого элемента в молекуле оксида углерода, если массовая доля углерода в нём равна (42,86) %, а массовая доля кислорода — (57,14) %.
1. Примем массу оксида равной (100) г. Масса углерода в такой порции равна (42,86) г, а масса кислорода — (57,14) г.
2. Находим относительные атомные массы элементов в Периодической таблице:
3. Обозначаем число атомов углерода как (x), а число атомов кислорода — (y), и записываем отношение масс:
.
4. Получаем выражение:
5. Находим отношение (x : y):
.
В молекуле оксида углерода на (1) атом углерода приходится (1) атом кислорода.
В уроке 2 «Относительная атомная масса химических элементов» из курса «Химия для чайников» рассмотрим разные способы выражения массы химических элементов. Напоминаю, что в прошлом уроке «Атомы и химические элементы» мы рассмотрели, кто и когда высказал идею о том, что все вокруг состоит из атомов; также выяснили, что из себя представляет химический элемент и каким образом обозначается.
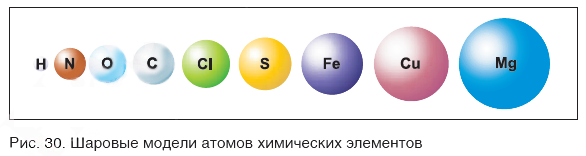
Чем различаются атомы разных элементов между собой? Вы уже знаете: массой, размерами и строением. На рисунке 30 показаны шаровые модели атомов некоторых химических элементов, конечно, не в реальных размерах, а многократно увеличенные. В действительности атомы настолько малы, что их невозможно рассмотреть даже в самые лучшие оптические микроскопы.
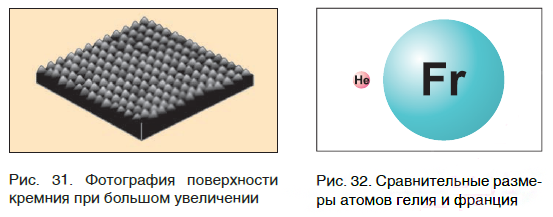
На заметку: В конце XX в. у ученых появились более совершенные микроскопы, позволяющие достигать увеличения в несколько десятков миллионов раз. Они называются туннельными микроскопами. На рисунке 31 показана фотография поверхности кремния. На ней отчетливо видны отдельные атомы, расположенные на поверхности этого вещества.
Размеры и масса атомов
Современная наука обладает методами, позволяющими определять размеры и массы атомов. Так, например, самый легкий атом — атом водорода. Его масса равна 0,0000000000000000000000000016735 кг. Самым маленьким является атом гелия He. Диаметр этого атома равен приблизительно 0,00000000098 м. Записывать и читать такие числа затруднительно, поэтому обычно их представляют в более удобном виде: 1,6735·10−27 кг и 9,8·10−10 м. Атомы большинства химических элементов по своим размерам значительно больше атома гелия. Самый большой из них — атом элемента франция Fr. Его диаметр в 7 раз больше диаметра атома гелия (рис. 32).
Еще больше различаются атомы разных элементов по массе. Масса атома обозначается символом ma и выражается в единицах массы СИ (кг). Так, например, масса атома углерода равна: ma(С) = 19,94·10−27 кг, а атома кислорода — ma(О) = 26,56·10−27 кг. Масса атома самого тяжелого из существующих на Земле элементов — урана U — почти в 237 раз больше массы атома водорода.
Атомная единица массы
Пользоваться такими маленькими величинами масс атомов при расчетах неудобно. К тому же, когда в XIX в. начало формироваться атомно- молекулярное учение, ученые еще не представляли реальных размеров и масс атомов. Поэтому на практике вместо истинных масс атомов стали применять их относительные значения. Они рассчитывались по массовым отношениям простых веществ в реакциях друг с другом. Химики предположили, что эти отношения пропорциональны массам соответствующих атомов. Именно так в начале XIX в. Дж. Дальтон ввел понятие относительной атомной массы, приняв за единицу сравнения массу самого легкого атома — водорода.
В настоящее время в качестве такой единицы сравнения используется 1/12 часть массы атома углерода (рис. 33). Она получила название атомной единицы массы (а. е. м.). Ее международное обозначение — u (от английского слова «unit» — единица):
Атомная единица массы — это 1/12 часть массы атома углерода, которая равна 1,66·10−27 кг.
Относительная атомная масса
Сравнивая средние массы атомов различных элементов с атомной единицей массы, получают значения относительных атомных масс химических элементов.
Относительная атомная масса элемента — это физическая величина, которая показывает, во сколько раз масса атома данного химического элемента больше 1/12 части массы атома углерода.
Относительная атомная масса обозначается символами Ar (А — первая буква английского слова «atomic» —атомный, r — первая буква английского слова «relative», что значит относительный), следовательно:
где Х — символ данного элемента.
Например, относительная атомная масса водорода:
а кислорода:
Как видите, относительная атомная масса показывает, во сколько раз масса атома данного элемента больше атомной единицы массы u.
В таблице Менделеева приведены относительные атомные массы всех элементов. В расчетах при решении задач мы будем пользоваться округленными до целых значениями этих величин (см. урок 1).
Внимание! Очень часто относительную атомную массу называют просто атомной массой. Однако следует отличать атомную массу — величину относительную (например, Ar(О) = 16) — от массы атома — величины, выражаемой в единицах массы — килограммах (ma(O) = 26,56·10−27 кг) или атомных единицах массы (ma(O) = 16·u).
Пример. Во сколько раз атом ртути тяжелее атома кальция?
Решение. Относительные атомные массы элементов равны: Ar(Hg) = 201 и Ar(Ca) = 40.
Масса атома ртути равна: ma(Hg) = Ar(Hg)·u (кг).
Масса атома кальция равна: ma(Са) = Ar(Са)·u (кг).
Другими словами, отношение масс атомов этих элементов равно отношению их относительных атомных масс. Следовательно, отношение масс атомов ртути и кальция равно:
Ответ: в 5,03 раза.
Краткие выводы урока:
- Атомная единица массы представляет собой 1/12 часть массы атома углерода.
- Относительная атомная масса химического элемента равна отношению массы его атома к 1/12 части массы атома углерода.
- Относительная атомная масса химического элемента является величиной безразмерной и показывает, во сколько раз масса атома данного элемента больше атомной единицы массы.
Надеюсь урок 2 «Относительная атомная масса химических элементов» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Оглавление
- Как решать задачи по химии?
- Метод соотношения масс веществ
- Метод сравнения масс веществ
- Метод с использованием величины «количество вещества» и ее единицы измерения «моль»
- Метод составления пропорции
- Метод использования коэффициента пропорциональности
- Метод приведения к единице
- Вывод алгебраической формулы и расчет по ней
1. Как решать задачи по химии?
Почти каждая химическая задача может быть решена несколькими способами. На начальном этапе обучения поиск разных вариантов решения одной и той же задачи способствует развитию аналитического мышления и в последующем облегчает выбор наиболее рационального способа для решения конкретной задачи. Знание разнообразных методов решения химических задач создает необходимую базу для выбора нужного способа при решении конкретной задачи. Совсем не обязательно отлично владеть ими всеми. Для успешного решения химических задач достаточно хорошо освоить 3-4 метода.
Можно выделить следующие основные способы решения химических задач:
1) соотношение масс веществ;
2) сравнение масс веществ;
3) использование величины «количество вещества» и ее единицы измерения «моль»;
4) составление пропорции;
5) использование коэффициента пропорциональности;
6) приведение к единице;
7) вывод алгебраической формулы и расчет по ней.
Из перечисленных методов решения расчетных задач по химии наиболее часто применяются использование величины «количество вещества» и ее единицы измерения «моль», составление пропорции, а также вывод алгебраической формулы и расчет по ней.
Рассмотрим различные способы решения задач, применив каждый из них к задачам, относящимся к разным группам: 1) задача, решаемая по формуле вещества; 2) задача, решаемая по уравнению реакции.
Задача 1. На завод была доставлена руда, содержащая 464 т магнитного железняка Fe3O4. Какая масса железа содержится в руде?
Задача 1 решается по формуле вещества. В данной задаче не говорится о химическом процессе, а требуется определить массу железа по массе магнитного железняка, для этого достаточно указать формулу магнитного железняка Fe3O4. По химической формуле Fe3O4 определяем, что в 1 моль Fe3O4 содержится 3 моль Fe. Если количество вещества Fe3O4 — 2, 5, 10 моль, то соответственно увеличится количество молей железа в 2, 5, 10 раз. Следовательно, между массой руды и массой железа существует прямая пропорциональная зависимость, используя которую можно рассчитать массу железа, применяя различные способы решений.
Задача 2. Вычислите массу сульфита натрия, необходимую для реакции с серной кислотой, чтобы получить 16 г оксида серы (IV).
Задача 2 решается по уравнению реакции. В условии указаны три вещества, участвующих в химическом процессе: сульфит натрия взаимодействует с серной кислотой, при этом получается оксид серы (IV). Записываем уравнение реакции, на основании которого делаем вывод, что при взаимодействии 1 моль Na2SO3 с кислотой выделяется 1 моль SO2. Для получения большего или меньшего количества вещества потребуется во столько же раз больше или меньше сульфита натрия, т.е. между массами или количествами веществ имеется прямая пропорциональная зависимость. Используя прямую пропорциональную зависимость между массой прореагировавшего сульфита натрия и получающейся массой оксида серы (IV) можно рассчитать массу оксида серы (IV), применяя различные способы решений.
2. Метод соотношения масс веществ
Согласно закону постоянства состава вещества состав сложного вещества один и тот же независимо от способа его получения. Установив по формуле или по уравнению реакции соотношение числа молей заданных веществ, вычисляют соответствующие этим количествам вещества массы данных веществ.
Задача 1
Дано:
m(Fe3O4)=464 т
m(Fe) — ?
Решение:
По химической формуле магнитного железняка Fe3O4 определяем, что в 1 моль Fe3O4 содержится 3 моль Fe. Вычислим соответствующие этим количествам вещества массы данных веществ по формуле:
m(Fe)=n(Fe)·M(Fe); M(Fe)=56 г/моль;
m(Fe)=3·56=168 (г);
m(Fe3O4)=n(Fe3O4)·M(Fe3O4); M(Fe3O4)=232 г/моль;
m(Fe3O4)=1·232=232 (г).
Найдем соотношение масс железа и магнитного железняка:
m(Fe):m(Fe3O4)=168:232≈1:1,38.
Следовательно, железа в магнитном железняке будет содержаться в 1,38 раз меньше. Вычислим, какая масса железа содержится в руде, содержащей 464 т магнитного железняка:
m(Fe)=1·m(Fe3O4)/1,38;
m(Fe)=1·464/1,38≈336 (т).
Ответ: В 464 т Fe3O4 содержится 336 т Fe.
Задача 2
Дано:
m(SO2)=16 г
m(Na2SO3) — ?
Решение:
Na2SO3+H2SO4=Na2SO4+SO2+H2O
По уравнению реакции определяем, что при взаимодействии 1 моль Na2SO3 с кислотой выделяется 1 моль SO2. Вычислим соответствующие этим количествам вещества массы данных веществ по формуле:
m(SO2)=n(SO2)·M(SO2); M(SO2)=64 г/моль;
m(SO2)=1·64=64 (г);
m(Na2SO3)=n(Na2SO3)·M(Na2SO3); M(Na2SO3)=126 г/моль;
m(Na2SO3)=1·126=126 (г).
Найдем соотношение масс оксида серы (IV) и сульфита натрия:
m(SO2):m(Na2SO3)=64:126≈1:1,97.
Следовательно, сульфита натрия потребуется в 1,97 раза больше, чем масса выделившегося оксида серы (IV). Вычислим, какая масса сульфита натрия потребуется для получения 16 г оксида серы (IV):
m(Na2SO3)=1,97·m(SO2);
m(Na2SO3)=1,97·16≈31,5 (г).
Ответ: Для получения 16 г SO2 нужно 31,5 г Na2SO3.
3. Метод сравнения масс веществ
Проводится сравнение массы вещества, данной в условии задачи, с массой этого же вещества, но вычисленной по формуле вещества или по уравнению реакции.
Задача 1
Дано:
m(Fe3O4)=464 т
m(Fe) — ?
Решение:
По химической формуле магнитного железняка Fe3O4 определяем, что в 1 моль Fe3O4 содержится 3 моль Fe. Вычислим соответствующие эти количествам вещества массы данных веществ по формуле:
m(Fe)=n(Fe)·M(Fe); M(Fe)=56 г/моль;
m(Fe)=3·56=168 (г);
m(Fe3O4)=n(Fe3O4)·M(Fe3O4); M(Fe3O4)=232 г/моль;
m(Fe3O4)=1·232=232 (г).
Сравним массу магнитного железняка, данную в условии задачи, с его массой, вычисленной по формуле:
464 т > 232 г в 2·106 раз.
Следовательно, и масса железа, содержащегося в Fe3O4, будет во столько же раз большей. Вычислим массу железа в руде, содержащей 464 т магнитного железняка:
m(Fe)=168·2·106=336·106 (г).
Ответ: В 464 т Fe3O4 содержится 336 т Fe.
Задача 2
Дано:
m(SO2)=16 г
m(Na2SO3) — ?
Решение:
Na2SO3+H2SO4=Na2SO4+SO2+H2O
По уравнению реакции определяем, что при взаимодействии 1 моль Na2SO3 с кислотой выделяется 1 моль SO2. Вычислим соответствующие этим количествам вещества массы данных веществ по формуле:
m(SO2)=n(SO2)·M(SO2); M(SO2)=64 г/моль;
m(SO2)=1·64=64 (г);
m(Na2SO3)=n(Na2SO3)·M(Na2SO3); M(Na2SO3)=126 г/моль;
m(Na2SO3)=1·126=126 (г).
Сравним массу оксида серы (IV), данную в условии задачи, с его массой, вычисленной по формуле: 16 г < 64 г в 4 раза.
Следовательно, и масса сульфита натрия, необходимого для получения 16 г оксида серы (IV), будет тоже меньше в 4 раза. Вычислим, какая масса сульфита натрия потребуется для получения 16 г оксида серы (IV):
m(Na2SO3)=126/4=31,5 (г).
Ответ: Для получения 16 г SO2 нужно 31,5 г Na2SO3.
4. Метод с использованием величины «количество вещества» и ее единицы измерения «моль»
Задача 1
Дано:
m(Fe3O4)=464 т=464·103 кг
m(Fe) — ?
Решение:
Согласно формуле магнитного железняка Fe3O4 в 1 моль Fe3O4 содержится 3 моль атомов Fe. Определим количество вещества магнитного железняка в 464 т руды по формуле:
n(Fe3O4)=m(Fe3O4)/M(Fe3O4); M(Fe3O4)=232·10-3 кг/моль;
n(Fe3O4)=464·103/(232·10-3)=2·106 (моль).
Тогда, в соответствии с формулой Fe3O4 2·106 моль Fe3O4 содержит 6·106 моль Fe.
Вычислим массу железа, соответствующую количеству вещества 6·106 моль по формуле:
m(Fe)=n(Fe)·M(Fe); M(Fe)=56·10-3 кг/моль;
m(Fe)=6·106·56·10-3=336·103 (кг)=336 (т).
Ответ: В 464 т Fe3O4 содержится 336 т Fe.
Задача 2
Дано:
m(SO2)=16 г
m(Na2SO3) — ?
Решение:
Na2SO3+H2SO4=Na2SO4+SO2+H2O
Согласно уравнению реакции при взаимодействии 1 моль Na2SO3 с кислотой выделяется 1 моль SO2. Определим количество вещества оксида серы (IV), соответствующее 16 г, по формуле:
n(SO2)=m(SO2)/M(SO2); M(SO2)=64 г/моль;
n(SO2)=16/64=0,25 (моль).
По уравнению реакции из 1 моля Na2SO3 образуется 1 моль SO2, тогда для получения 0,25 моль SO2 потребуется 0,25 моль Na2SO3. Вычислим массу сульфита натрия, соответствующую количеству вещества 0,25 моль по формуле:
m(Na2SO3)=n(Na2SO3)·M(Na2SO3); M(Na2SO3)=126 г/моль;
m(Na2SO3)=0,25·126=31,5 (г).
Ответ: Для получения 16 г SO2 нужно 31,5 г Na2SO3.
5. Метод составления пропорции
В основе решения химических задач этим способом лежат представления о том, что такое пропорция, знания свойств членов пропорции, а также знания о пропорциональных переменных. В ходе решения задач данным способом выполняются следующие последовательные действия: 1) установление пропорциональной зависимости между величинами; 2) составление пропорции; 3) решение полученной пропорции.
Задача 1
Дано:
m(Fe3O4)=464 т=464·103 кг
m(Fe) — ?
Решение:
По химической формуле магнитного железняка Fe3O4 определяем, что в 1 моль Fe3O4 содержится 3 моль Fe. Вычислим соответствующие эти количествам вещества массы данных веществ по формуле:
m(Fe)=n(Fe)·M(Fe); M(Fe)=56·10-3 кг/моль;
m(Fe)=3·56·10-3=168·10-3 (кг);
m(Fe3O4)=n(Fe3O4)·M(Fe3O4); M(Fe3O4)=232·10-3 кг/моль;
m(Fe3O4)=1·232·10-3=232·10-3 (кг).
Согласно формуле вещества устанавливаем пропорциональную зависимость:
в 232·10-3 кг Fe3O4 содержится 168·10-3 кг Fe
в 464 т Fe3O4 содержится x кг Fe
Составляем пропорцию, которую можно записать в разных вариантах, но с соблюдением прямой пропорциональной зависимости:
а) 232·10-3/(464·103)=168·10-3/х;
б) 232·10-3:(168·10-3)=464·103:x;
в) 464·103:(232·10-3)=х:(168·10-3).
Используя основное правило пропорции, рассчитаем неизвестное:
х=464·103·168·10-3/(232·10-3)=336·103;
m(Fe)=336·103 кг=336 т.
Ответ: В 464 т Fe3O4 содержится 336 т Fe.
Задача 2
Дано:
m(SO2)=16 г
m(Na2SO3) — ?
Решение:
Na2SO3+H2SO4=Na2SO4+SO2+H2O
По уравнению реакции определяем, что при взаимодействии 1 моль Na2SO3 с кислотой выделяется 1 моль SO2. Вычислим соответствующие этим количествам вещества массы данных веществ по формуле:
m(SO2)=n(SO2)·M(SO2); M(SO2)=64 г/моль;
m(SO2)=1·64=64 (г);
m(Na2SO3)=n(Na2SO3)·M(Na2SO3); M(Na2SO3)=126 г/моль;
m(Na2SO3)=1·126=126 (г).
Устанавливаем пропорциональную зависимость между массами, вычисленными по уравнению реакции (записываем под формулами веществ в уравнении реакции), и массами, данными в условии задачи (записываем над формулами веществ в уравнении реакции).
х г 16 г
Na2SO3+H2SO4=Na2SO4+SO2+H2O
126 г 64 г
Согласно уравнению реакции установленная пропорциональная зависимость выглядит следующим образом:
для получения 64 г SO2 необходимо 126 г Na2SO3
для получения 16 г SO2 потребуется х г Na2SO3
Составляем один из возможных вариантов пропорции:
х:126=16:64
Используя основное правило пропорции, рассчитаем неизвестное:
х=16·126/64=31,5;
m(Na2SO3)=31,5 г.
Ответ: Для получения 16 г SO2 нужно 31,5 г Na2SO3.
6. Метод с использованием коэффициента пропорциональности
Из курса алгебры известно, что отношение любых соответственных значений пропорциональных переменных x и y равны одному и тому же числу. Это число называют коэффициентом пропорциональности (k): k=y/x. При расчетах по химическим формулам веществ коэффициент пропорциональности (k) вычисляется как отношение массы вещества (mвещества), данной в условии задачи, к относительной молекулярной массе этого вещества (Mrвещества):
k=mвещества/Mrвещества
Тогда масса элемента (mэлемента) в веществе будет равна произведению коэффициента пропорциональности (k) на относительную атомную массу элемента (Arэлемента) и число атомов элемента в молекуле вещества (Nэлемента), определяемое по индексу в формуле:
mэлемента=k·Nэлемента·Arэлемента
Если необходимо решить обратную задачу, т.е. по массе элемента требуется рассчитать массу вещества, то
k=mэлемента/(Nэлемента·Arэлемента);
mвещества=k·Mrвещества
По уравнению реакции коэффициент пропорциональности вычисляется как отношение массы вещества, которая дана в условии задачи, к произведению количества вещества, указанного в уравнении реакции, на его молярную массу:
k=mвещества1/(nвещества1·Mвещества1)
Масса искомого вещества рассчитывается как произведение коэффициента пропорциональности на количество вещества и молярную массу определяемого вещества:
mвещества2=k·nвещества2·Mвещества2
Задача 1
Дано:
m(Fe3O4)=464 т
m(Fe) — ?
Решение:
Найдем коэффициент пропорциональности по формуле:
k=m(Fe3O4)/Mr(Fe3O4); Mr(Fe3O4)=232;
k=464/232=2 (т).
Вычислим массу железа, содержащуюся в 464 т магнитного железняка:
m(Fe)=k·N(Fe)·Ar(Fe); Ar(Fe)=56;
m(Fe)=2·3·56=336 (т).
Ответ: В 464 т Fe3O4 содержится 336 т Fe.
Задача 2
Дано:
m(SO2)=16 г
m(Na2SO3) — ?
Решение:
Na2SO3+H2SO4=Na2SO4+SO2+H2O
Найдем коэффициент пропорциональности по формуле:
k=m(SO2)/(n(SO2)·M(SO2); M(SO2)=64 г/моль;
k=16/(1·64)=0,25.
Вычислим массу сульфита натрия, соответствующую количеству вещества 0,25 моль по формуле:
m(Na2SO3)=k·n(Na2SO3)·M(Na2SO3); M(Na2SO3)=126 г/моль;
m(Na2SO3)=0,25·1·126=31,5 (г).
Ответ: Для получения 16 г SO2 нужно 31,5 г Na2SO3.
7. Метод приведения к единице
Задача 1
Дано:
m(Fe3O4)=464 т
m(Fe) — ?
Решение:
По химической формуле магнитного железняка Fe3O4 определяем, что в 1 моль Fe3O4 содержится 3 моль Fe. Вычислим соответствующие этим количествам вещества массы данных веществ по формуле:
m(Fe)=n(Fe)·M(Fe); M(Fe)=56 г/моль;
m(Fe)=3·56=168 (г);
m(Fe3O4)=n(Fe3O4)·M(Fe3O4); M(Fe3O4)=232 г/моль;
m(Fe3O4)=1·232=232 (г).
Согласно формуле магнитного железняка в 232 г Fe3O4 содержится 168 г Fe, тогда в 1 г Fe3O4 будет содержаться железа в 232 раза меньше, т.е. 168/232 г. В 464 т Fe3O4 железа будет больше, чем в 1 г, в 464·106 раз, т.е. (168/232)·464·106=336·106 (г) или 336 т.
Ответ: В 464 т Fe3O4 содержится 336 т Fe.
Задача 2
Дано:
m(SO2)=16 г
m(Na2SO3) — ?
Решение:
Na2SO3+H2SO4=Na2SO4+SO2+H2O
По уравнению реакции определяем, что при взаимодействии 1 моль Na2SO3 с кислотой выделяется 1 моль SO2. Вычислим соответствующие этим количествам вещества массы данных веществ по формуле:
m(SO2)=n(SO2)·M(SO2); M(SO2)=64 г/моль;
m(SO2)=1·64=64 (г);
m(Na2SO3)=n(Na2SO3)·M(Na2SO3); M(Na2SO3)=126 г/моль;
m(Na2SO3)=1·126=126 (г).
Согласно уравнению реакции для получения 64 г SO2 необходимо взять 126 г Na2SO3, тогда для выделения 1 г SO2 потребуется в 64 раза меньше Na2SO3, т.е. 126/64 г. Для образования 16 г SO2 нужно взять Na2SO3 в 16 раз больше, чем для выделения 1 г SO2.
Вычислим массу сульфита натрия, необходимую для образования 16 г SO2:
m(Na2SO3)=16·126/64=31,5 (г).
Ответ: Для получения 16 г SO2 нужно 31,5 г Na2SO3.
8. Вывод алгебраической формулы и расчет по ней
Данный способ решения химических задач предполагает использование алгебраических формул, отражающих законы, теоретические положения, взаимосвязь физических величин. Формула химического соединения позволяет провести расчет массовой доли элемента в веществе (ωэлемента), которая показывает, какую часть относительной молекулярной массы вещества (Mrвещества) составляет относительная атомная масса элемента (Arэлемента), умноженная на число атомов элемента в молекуле (Nэлемента):
ωэлемента=Nэлемента·Arэлемента/Mrвещества
Зная массу вещества и массовую долю элемента в веществе, можно определить массу этого элемента:
mэлемента=ωэлемента·mвещества
или
mэлемента=Nэлемента·Arэлемента·mвещества/Mrвещества
Таким образом, чтобы рассчитать массу элемента по известной массе вещества, нужно число атомов элемента в молекуле вещества, определяемое по индексу при знаке элемента в формуле, умножить на относительную атомную массу элемента и на массу вещества, а полученное произведение разделить на относительную молекулярную массу вещества.
При решении обратной задачи, когда известна масса элемента в веществе, а необходимо вычислить массу вещества, формула для расчета будет следующей:
mвещества=mэлемента/ωэлемента=mэлемента·Mrвещества/(Nэлемента·Arэлемента)
Чтобы определить массу вещества по известной массе элемента в нем, необходимо массу элемента умножить на относительную молекулярную массу вещества и разделить на произведение числа атомов элемента в молекуле вещества на относительную атомную массу элемента.
При химических реакциях массы реагирующих веществ и продуктов реакции связаны между собой стехиометрическими отношениями, которые можно выразить алгебраической формулой:
mвещества2=mвещества1·nвещества2·Mвещества2/(nвещества1·Mвещества1)
где mвещества1 — масса вещества, известная по условию задачи; Mвещества1 — молярная масса этого вещества; mвещества2 — масса вещества, которую нужно вычислить; Mвещества2 — молярная масса этого вещества; nвещества1 и nвещества2 — количества вещества, указанные в уравнении реакции (для соответствующих веществ).
Задача 1
Дано:
m(Fe3O4)=464 т
m(Fe) — ?
Решение:
Массу железа, содержащуюся в определенной массе магнитного железняка, можно определить, зная массовую долю железа в руде:
m(Fe)=m(Fe3O4)·ω(Fe)
Расчет массовой доли железа в руде произведем по формуле:
ω(Fe)=N(Fe)·Ar(Fe)/Mr(Fe3O4)
Получаем общую формулу, по которой рассчитываем массу железа:
m(Fe)=m(Fe3O4)·N(Fe)·Ar(Fe)/Mr(Fe3O4);
Ar(Fe)=56; Mr(Fe3O4)=232;
m(Fe)=464·3·56/232=336 (т)
Ответ: В 464 т Fe3O4 содержится 336 т Fe.
Задача 2
Дано:
m(SO2)=16 г
m(Na2SO3) — ?
Решение:
Na2SO3+H2SO4=Na2SO4+SO2+H2O
Массу сульфита натрия, необходимую для образования 16 г SO2 найдем по формуле:
m(Na2SO3)=m(SO2)·n(Na2SO3)·M(Na2SO3)/(n(SO2)·M(SO2));
M(SO2)=64 г/моль; M(Na2SO3)=126 г/моль;
m(Na2SO3)=16·1·126/(1·64)=31,5 (г).
Ответ: Для получения 16 г SO2 нужно 31,5 г Na2SO3.
ВИДЕО УРОК
Инертность, которой обладает каждое тело, – одно из важнейших его свойств,
потому что от неё зависит ускорение тела в результате его взаимодействия с
другими телами.
Всякое свойство тел выражается определённой величиной.
Свойство тел занимать часть пространства выражается его объёмом.
Свойство тел, которое названо инертностью, тоже выражается особой
величиной. Такой величиной является масса.
То из двух взаимодействующих
тел, которое получает меньшее ускорение, то есть более инертно, имеет большую
массу. Если обозначить массы взаимодействующих тел через m1 и m2, то можно предположить,
что
Отношение абсолютных значений ускорений двух взаимодействующих
тел равно обратному отношению их масс.
ПРИМЕР:
Отношение ускорения
алюминиевого цилиндра к ускорению стального равно трём. Это вызвано тем, что
масса алюминиевого цилиндра в три раза меньше массы стального цилиндра.
Чтобы найти отношение масс двух тел нужно измерить их ускорения при
взаимодействии.
Для определения массы отдельного тела надо поступить также как и при
измерении других величин. Для определения числа, выражающего длину тела надо
сравнить её с эталоном длины – метром.
Таким же способом определяют
численные значения масс; чтобы найти число, выражающее массу отдельного тела,
нужно сначала выбрать какое-нибудь тело, массу которого условно принимают за
единицу, – эталон массы. Затем провести опыт. В этом опыте тело, масса которого
определяется (измеряется), должно как-то взаимодействовать с эталоном массы. Схема
такого опыта показана на рисунке.
Тогда оба они, и тело, и эталон, получат
ускорения, которые можно измерить, и тогда можно написать равенство
или
где
– масса и ускорение тела, а
– масса и ускорение эталона.
Но масса эталона равна
единице, поэтому
Масса тела – это величина, выражающая его инертность. Она
определяет отношение ускорения эталона массы к ускорению тела при их
взаимодействии.
На Международном конгрессе в 1889 г. в качестве эталона массы была принята
масса специально изготовленного цилиндра из сплава платины и иридия. Масса
этого цилиндра и есть международная единица массы – килограмм
(сокращённо: кг). Эталон массы хранится в
Международном бюро мер и весов (Франция). В некоторых других странах имеются
копии этого эталона. С достаточной точностью можно считать, что массой в 1
кг обладает
1 л чистой воды
при 15°С.
Масса наряду с такими величинами, как длина и время, входит в число
основных величин систем единиц СИ и СГС. В системе СГС за единицу массы
принимается грамм (сокращённо: г):
1 г = 0,01 кг.
Одним из способов измерения массы – взвешивание,
которым обычно и пользуются.
Весы – прибор для
измерения массы тел. Действие рычажных весов
основано на сравнении гравитационного притяжения взвешиваемого тела и
гравитационного притяжения гирь к Земле.
Но в некоторых случаях определение массы по ускорениям при взаимодействии
является единственно возможным способом. Нельзя, например, взвешиванием
измерить массу планет, звёзд и других небесных тел. На весах нельзя также
измерять очень малые массы, например массы атомов и частиц, из которых они
состоят.
Масса тела выражает его собственное свойство (инертность), которое не
зависит ни от того, в каких взаимодействиях тело участвует, ни от того, как оно
движется. Что бы с телом ни происходило, где бы оно ни находилось, как бы оно
ни двигалось, масса его остаётся одной и той же.
Об одном интересном и важном свойстве массы можно узнать, если поставить
следующий опыт.
ОПЫТ:
Соединим вместе два одинаковых алюминиевых
цилиндра и поместим в центробежную машину.
Теперь стальной цилиндр
взаимодействует не с одним, а с двумя соединёнными вместе алюминиевыми
цилиндрами. Опыт показывает, что отношение ускорения соединённых вместе двух
алюминиевых цилиндров к ускорению стального цилиндра равно не 3,
а 3/2.
Это значит, что масса двух одинаковых цилиндров, соединённых вместе и ставших
как бы одним телом, вдвое больше массы одного из них.
Следовательно, когда два или несколько тел соединяются в
одно, их массы складываются.
Из-за этого свойства массы иногда говорят, что масса выражает собой и
количество вещества в теле. Ясно ведь, что в двух алюминиевых цилиндрах вдвое
больше алюминия, чем в одном.
Основные свойства массы.
– масса – скалярная величина, следовательно, инертные
свойства тел одинаковы во всех направлениях.
– масса не зависит от характера движения точки.
– масса не зависит от физических условий, в которых
находится тело (от температуры окружающей среды, от наличия электромагнитных
или гравитационных полей).
– масса – величина аддитивная, то есть масса составного
тела равна сумме масс его частей.
Закон сохранения массы.
Масса замкнутой системы остаётся неизменной при любых
механических процессах, происходящих в этой системе.
Масса Земли.
Массу Земли нельзя
измерить, положив её на весы. Но её можно вычислить, пользуясь формулой для
ускорения свободного падения:
Отсюда для величины массы Земли получаем:
Численные значения
были в своё время определены опытным путём:
и
Средний радиус Земли тоже хорошо известен:
R = 6370 км = 6,37 × 106
м.
Подставляя численные
значения
в формулу для
М, получаем:
Масса Земли равна почти шести миллионам миллиардов миллиардов килограмм !
Масса Луны.
В качестве примера того, как определяют массу тел по их ускорениям при
взаимодействии, найдём массу Луны по её взаимодействию с Землёй.
О том, что Земля влияет на движение Луны, известно всем. Именно под
влиянием Земли Луна движется вокруг Земли по окружности радиусом около 384 000 км.
Обычно считают, что Луна обращается вокруг Земли так, как будто центр Земли
есть неподвижный центр лунной орбиты. Но этого не может быть, потому что при
взаимодействии тел ускорения получают оба взаимодействующих тела. На самом деле
и Луна влияет на Землю, заставляя её двигаться по окружности и сообщая ей
центростремительное ускорение. Но вокруг какого центра ?
Астрономические
наблюдения показали, что Луна обращается не вокруг центра Земли, а вокруг
некоторой точки Р,
которая отстоит от центра Земли на 4700 км. (Эта точка находится внутри земного шара). Вокруг этой же точки Р движется по окружности
центр Земли.
Значит, радиусы, соединяющие центры Земли и Луны с точкой Р, движутся с одинаковой угловой скоростью вокруг
точки Р. Центр Земли движется по окружности радиусом
rз ≈ 4700
км,
а центр Луны – по окружности радиусом
rл ≈ 380 000 км.
Выходит, что Земля и
Луна ведут себя совершенно так же, как алюминиевый и стальной цилиндр в
центрифуге. Так как отношение центростремительных ускорений, сообщаемых
цилиндрами друг другу, равно отношению радиусов окружностей, по которым они
движутся. Точно так же отношение модулей ускорений Луны
и Земли
равно отношению радиусов rл и rз:
но отношение ускорений взаимодействующих тел
равно обратному отношению их масс, поэтому
Так как
rл ≈ 380 000 км, а
rз ≈ 4700 км, то
Следовательно, масс Луны в 81 раз
меньше массы Земли. Масса Земли была определена. Она равна 6 × 1024 кг. Тогда
Плотность вещества.
Для сравнения масс различных тел пользуются понятием плотности.
Каждое вещество занимает некоторый объём. И может оказаться, что объёмы
двух тел равны, а их массы различны. В этом случае говорят, что плотности этих
веществ различны.
Плотность вещества – это величина, измеряемая массой
вещества в единице объёма.
Если масса тела m, а объём
V, то плотность тела
где p – плотность
вещества,
m – масса тела,
V – объём тела.
Полагая в этой формуле V = 1, получим p = m.
Из этого следует, что плотность вещества численно равна массе вещества,
содержащейся в единице объёма.
Массу тела по его плотности и объёму можно вычислить по формуле:
m = p × V.
Объём тела по его массе
и плотности можно вычислить по формуле:
Чтобы лучше запомнить эти три формулы, их можно
объединить в мнемонический треугольник:
Для нахождения любой из величин нужно мысленно
закрыть буквенное обозначение этой величины, и получим формулу для её
определения:
За единицу плотности вещества в системе
СИ принимается
1 кг/м3,
а в системе СГС –
1
г/см3.
Плотность вещества в
г/см3, кг/дм3 и в т/м3
выражается одним и тем же числом, так
как увеличение числителя и знаменателя в
1000 раз не изменяет
отношения.
ПРИМЕР:
Рассмотрим кусок железа, масса
которого равна 1 кг, и кусок дерева, масса которого равна 1
кг. Объём дерева больше, чем объём куска железа. Плотность дерева меньше, чем
плотность железа (молекулы прилегают не так плотно друг к
другу).
Плотность железа равна 7900 кг/м3,
Это означает, что
масса 1 м3 железа равна
7900
кг.
Плотность воды равна 1000 кг/м3,
Это означает, что
масса 1 м3 воды равна
1000
кг.
Выражаясь по-другому,
плотность воды равна 1 г/см3, значит, масса
1 см3 воды равна
1 г.
В различных состояниях плотность вещества различна. Плотность веществ
зависит от их состояния и температуры. При переходе в газообразное
состояние плотность всех веществ уменьшается. При переходе из твёрдого
состояния в жидкое плотность большинства веществ также уменьшается. Исключение:
вода и лёд.
ПРИМЕР:
Плотность расплавленного железа
меньше плотности твёрдого железа.
Плотность вещества зависит от атмосферного
давления (строго говоря, от давления всех тел, включая
атмосферный воздух). При увеличении давления плотность всех веществ возрастает.
Плотность вещества зависит от температуры: при повышении температуры обычно
плотность снижается. Это связано с термическим расширением, когда при
неизменной массе увеличивается объём.
Плотности веществ могут быть различны. Самое плотное вещество не находится
на Земле.
ПРИМЕР:
В космосе плотность белого карлика Сириуса Б (звезда) так велика, что масса
спичечного коробка из этого вещества была бы равна 127 тоннам.
Средняя плотность вещества – физическая величина, равная отношению массы тела к его
объёму. Если тело однородное (состоит из одного вещества), то средняя плотность
тела равна плотности его вещества.
ЗАДАЧА:
10 вёдер вместимостью 1 л до краёв наполнили мёдом, масса всего
мёда равна 14 кг. Найдите плотность мёда.
РЕШЕНИЕ:
V = 10 л = 0,01 м3.
m = 14 кг.
ОТВЕТ: Плотность мёда равна
ЗАДАЧА:
Латунь состоит из 65% меди и 35% цинка. Определите
плотность сплава.
РЕШЕНИЕ:
Если масса латуни m, её объём V, то плотность латуни
Объём латуни V равен сумме объёма меди
и объёма цинка
то есть
Подставив значение
объёмов в формулу для плотности ρ, получим
ОТВЕТ: ρ = 8,2 г/см3
Как, зная только массу, рассчитать плотность ?
– если объём тела (вещества) неизвестен или не задан явно в условии задачи, то надо его измерить,
вычислить или узнать, используя косвенные (дополнительные) данные;
– если вещество сыпучее или жидкое, то оно, как правило,
находится в ёмкости, которая обычно имеет стандартный объём; так, например,
объём бочки обычно равен 200 л, объём ведра – 10 л, объём стакана – 200 мл (0,2 л), объём столовой ложки – 20 мл, объём чайной – 5 мл; об объёме трёхлитровых и литровых банок
нетрудно догадаться из их названия;
– если жидкость занимает не всю ёмкость или ёмкость
нестандартная, то перелейте её в другую тару, объём которой известен; если подходящеё
ёмкости нет, перелейте жидкость с помощью мерной кружки (банки, бутылки); в процессе вычерпывания жидкости просто посчитайте количество таких
кружек и умножьте на объём мерной тары;
– если тело имеет простую форму, то вычислите его объём,
используя, соответствующие геометрические формулы; так, например,
если тело имеет форму прямоугольного параллелепипеда, то его объём будет равен
произведению длин его рёбер;
– если тело имеет сложную геометрическую форму, то
попробуйте (условно) разбить его на несколько простых частей,
найдите объём каждой из них отдельно и затем сложите полученные результаты;
– если тело невозможно разделить на более простые фигуры (например,
статуэтку), то воспользуйтесь
методикой Архимеда; опустите тело в
воду и измерьте объём вытесненной жидкости; если тело не тонет, то утопите его с помощью тонкой палочки (проволоки);
– если объём вытесненной телом воды посчитать
проблематично, то взвесьте вылившуюся воду, или найдите разность между
начальной и оставшейся массой воды; при этом, количество килограммов воды будет
равняться количеству литров, количество граммов – количеству миллилитров, а
количество тонн – количеству кубометров.
Тема:
Вычисление относительной молекулярной массы веществ, отношения масс атомов
элементов в сложном веществе по его формуле.
Цели: Знать понятия формула вещества,
атомная единица массы, относительная атомная масса, относительная молекулярная
масса вещества, закон постоянства состава вещества.
Уметь вычислять относительную молекулярную
массу вещества, отношения масс атомов элементов в сложном веществе по его
формуле.
План
1. Повторение
основных понятий.
Что такое формула вещества?
Что такое атомная единица массы?
Что такое относительная атомная масса?
Вспомните формулировку закона постоянства
состава вещества.
v Формула вещества –
это условная запись состава вещества при помощи химических знаков и если
необходимо индексов.
Н2О –
формула воды, из неё видно, что молекула воды состоит из двух атомов водорода и
одного атома кислорода.
v Абсолютная масса
атома — масса атома, выраженная в граммах (или килограммах).
Масса атома
кислорода равна 0,000000000000000000000026667 г (после запятой 22 нуля)
v Абсолютная масса
молекулы — масса молекулы, выраженная в граммах (или килограммах).
Данные значения
ничтожно малы ими пользоваться не удобно, поэтому были введены относительные
величины, они показывают во сколько раз масса химического элемента больше 1/12
массы атома углерода с массовым числом 12 а.е.м. (это безразмерная величина, число)
v Атомная единица
массы (а.е.м.) — одна двенадцатая часть массы атома изотопа углерода 12С
(1 а.е.м. =1,66 *10-24……)
v Относительная
атомная масса — это отношение усредненной массы естественной смеси изотопов,
атомов химического элемента к атомной единице массы (одной двенадцатой части
массы атомов изотопа углерода 12С)
Значения
относительных атомных масс приведены в ПСХЭ Д.И. Менделеева под знаком химического
элемента, например: m(C =12)
Зная относительную
атомную массу элементов входящих в состав вещества можно вычислить
относительную молекулярную массу данного вещества.
v Относительная
молекулярная масса — сумма всех относительных атомных масс входящих в молекулу
атомов химических элементов.
Мr = Аr1 * i1+
Ar2* i2+ Аr3 * i3…
Где Мr –
относительная молекулярная масса вещества
Аr1 , Ar2, Аr3 … –
относительные атомные массы элементов входящих в состав этого вещества
i1, i2, i3… –
индексы при химических знаках химических элементов.
Например: Вычислим
относительную молекулярную массу гидроксида кальция Ca(OH)2
Мr ( Ca(OH)2 )=
Аr (Ca) *1+ Ar(O)*
2+ Аr(H) *2
Аr (Ca) =40
Ar(O)=16
Аr(H)=1 =>
Мr (Ca(OH)2)=
40*1 + 16*2 +1*2 = 74 или =>
Мr (Ca(OH)2 )=
40*1 + (16 +1)*2 = 74
Задание 1:
Вычислите, относительны молекулярные массы следующих веществ: AL(OH)3; Cu(OH)2
Fe(OH)2 ;
Rb2CO3; NaCl; HNO3
Французский ученый
Ж. Пруст (1754-1826), работая в прекрасно оборудованной лаборатории в
Мадридском
университете, исследовал количественный состав солей олова, меди, железа,
никеля, сурьмы, кобольта, серебра и золота (1799-1806) и пришел к выводу:
«Соединение есть привилегированный продукт, которому природа дала
постоянный состав. Природа, даже через
посредство людей,
не производит соединения иначе, как с весами в руках, — по мере и весу. От
одного полюса Земли к другому соединения имеют тождественный состав. Никакой
разницы мы не видим между окисью железа южного полушария и северного; японская
киноварь имеет тот же состав, как испанская киноварь; хлористое серебро
совершенно тождественно, происходит ли оно из Перу или из Сибири; во всем мире
имеется только один хлористый натрий, одна селитра,одна сернокальциевая соль,
одна сернобариевая соль. Анализ подтверждает эти факты на каждом
шагу».
Сейчас Закон
постоянства состава формулируется так:
v «Каждое
индивидуальное химическое вещество имеет постоянный качественный и количественный
состав и определенное химическое строение независимо от способа его
получения».
Этот Закон
утверждался Ж. Прустом в жесткой борьбе с соотечественником, признанным
авторитетом того времени в химии — К. Бертолле (1748-1822). Научная дискуссия
помогла химикам четко осознать различие между понятиями «соединение»
и «смесь».
Смеси веществ
действительно могут иметь переменный состав. Изучая соотношения между азотом и
кислородом в различных окислах азота, английский ученый (физик и химик) Джон
Дальтон (1766-1844) пришел к выводу, который и составил основное содержание
Закона кратных отношений:
v «Если два
химических элемента дают несколько соединений, то весовые доли одного и того же
элемента в этих соединениях, приходящиеся на одну и ту же весовую долю второго
элемента, относятся между собой как небольшие целые числа».
Пусть у нас
имеются данные о процентном содержании азота и кислорода в трех оксидах: N2O,
NO и NO2. Рассчитаем, сколько весовых частей кислорода приходится на
одну весовую часть азота в этих соединениях: в N2O это 16/28, в NO
-16/14 или 32/28 и в NO2 — 32/14 или 64/28. Между собой эти величины
относятся как 1:2:4. Можно было бы таким же образом рассчитать весовые части
азота, приходящиеся на одну весовую часть кислорода в этих окислах. Взяв их
отношения, мы получим 4:2:1. Используя данные о процентном содержании углерода
и кислорода в окислах CO и CO2, легко получить, что отношения
весовых частей кислорода, приходящиеся на одну весовую часть углерода в этих
оксидах, равно 1:2. Самое простое и естественное объяснение этим фактам дала
атомная теория. Так как важнейшие исходные данные — процентное содержание
химических элементов в рассматриваемых соединениях — были получены на основе
химического анализа, а выводы касались атомного строения химических соединений,
то все это учение получило название химической атомистики.
Основные
положения этой теории Д. Дальтон сформулировал так :
1) материя
состоит из мельчайших первичных частиц или атомов;
2) атомы
неделимы и не могут создаваться или разрушаться;
3) все
атомы данного элемента одинаковы и имеют один и тот же неизменный вес;
4) атомы
разных элементов обладают различным весом;
5) частица
или соединение сформированы из определенного числа атомов химических элементов составляющих
их;
6) вес
сложной частицы представляет собой сумму весов составляющих ее атомов».
Д. Дальтон
предложил первые химические формулы для некоторых простейших химических
соединений. Не имея экспериментальных данных о числе атомов в молекуле, Д. Дальтон
был вынужден
принять простейшие, как он считал, отношения, что в молекуле воды на один
атом водорода приходится один атом кислорода, в аммиаке на один атом азота
приходится один
атом водорода.
Д. Дальтон
рассчитал относительные атомные веса для некоторых элементов, приняв атомный
вес водорода за единицу.
Задание 2:
Определите массовые отношения атомов в молекулах веществ:
Серная кислота,
сульфид железа (II), оксид
кальция, сульфат меди(II), оксид серы (IV) , оксид серы (VI).
Выполни тест,
проверь усвоение материала, если тебя не удовлетворят результаты, ещё раз
прочитай лекцию.
Успехов.
Тест:
Выберите
правильный ответ .
Масса
вещества формула которого равна:
1. CaCO3 ;
1) 68 ;
2) 100;
3) 90;
4) 88
2. Mg(NO3)2;
1) 54
2) 148
3) 86
4) 564
3. CuSO4;
1) 160
2) 112
3) 128
4) 88
4. Na2CO3;
1) 51
2) 74
3) 106
4) 92
5. AlCl3;
1) 62
2) 48
3) 133,5
4) 205
2. Выберите
правильный овет: Массовые отношения химических элементов в формулах веществ
равны:
А)CuSO4;
1. 64 : 32:
64
2. 2: 1 : 2
3. 16: 8: 16
4. 4: 2: 4 1.
Б)CaCO3
1. 10: 3: 12
2. 40: 12: 48
3. 40: 12: 16
4. 10: 3: 4