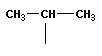
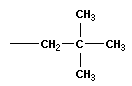
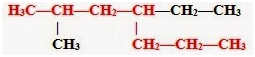
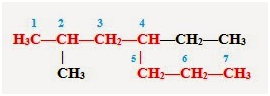
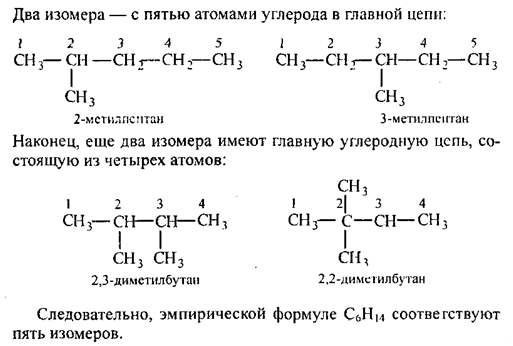
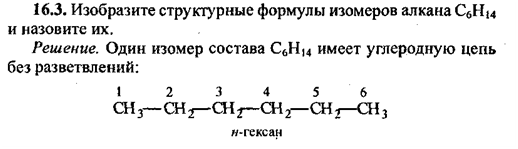
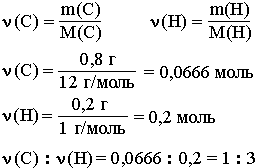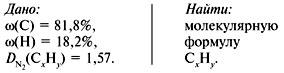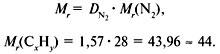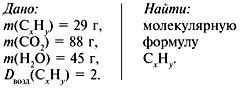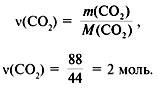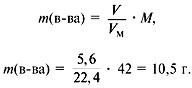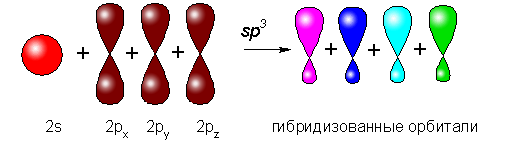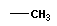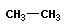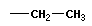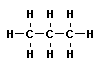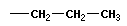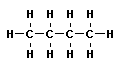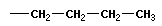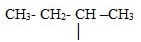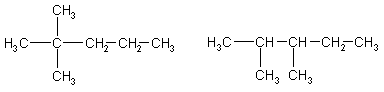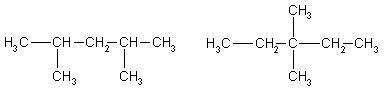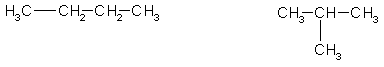Тема: «Решение задач на нахождение молекулярной формулы газообразного углеводорода по его плотности и массовой доле элементов»
1. Цели.
-
Образовательные:
-
закрепить знание понятий «органические вещества», «углеводороды», «массовая доля», «количество вещества», «относительная плотность»;
-
научить студентов решать задачи на нахождение молекулярной формулы органического вещества;
-
сформировать умения определять состав органических веществ исходя из знания массовых долей элементов, а также масс или объемов продуктов сгорания этих веществ;
-
Развивающие: развивать умения анализировать, сравнивать, применять теоретические знания на практике для решения задач;
-
Воспитательные: способствовать формированию научного мировоззрения.
2. Обеспечение занятия: таблица «Периодическая система», инструкции для студентов, тестовые задания для проверки знаний, карточки задания.
3. Порядок выполнения:
3.1. Разбор алгоритма решения задач.
3.2. Самостоятельное решение заданий.
3.3. Выполнение проверочной работы по вариантам.
4. Схема отчета:
4.1. Записать тему и цели практического занятия.
4.2. Привести решение задач.
4.3. Ответы к проверочной работе.
5. Анализ преподавателем выполнения работы.
6. Рекомендуемая литература:
-
Саенко О. Е. Химия. Учебник для колледжей. Ростов на Дону, 2008.
-
Габриелян О. С. Химия. Учебник для студентов среднего профессионального образования. –М.:Академия, 2008.
-
Кузьменко Н.Е., Еремин В.В., Попков В.А. Химия. Для школьников старших классов и поступающих в вузы. – М.: ОНИКС 21 век: Мир и образование, 2002. – С. 177–236.
Вывод формул соединений.
Этот вид расчетов чрезвычайно важен для химической практики, т.к. позволяет на основании экспериментальных данных определить формулу вещества (простейшую и молекулярную). На основании данных качественного и количественного анализов химик находит сначала соотношение атомов в молекуле (или другой структурной единице вещества), т.е. его простейшую формулу.
Например, анализ показал, что вещество является углеводородом CxHy, в котором массовые доли углерода и водорода соответственно равны 0,8 и 0,2 (80% и 20%). Чтобы определить соотношение атомов элементов, достаточно определить их количества вещества (число молей):
Таким образом, CH3 является простейшей формулой данного вещества. Соотношению атомов C и H, равному 1 : 3, соответствует бесчисленное количество формул: C2H6, C3H9, C4H12 и т.д., но из этого ряда только одна формула является молекулярной для данного вещества, т.е. отражающей истинное количество атомов в его молекуле. Чтобы вычислить молекулярную формулу, кроме количественного состава вещества, необходимо знать его молекулярную массу. Для определения этой величины часто используется значение относительной плотности газа D. Так, для вышеприведенного случая DH2 = 15.
Тогда M(CxHy) = 15 M(H2) = 15•2 г/моль = 30 г/моль.
Поскольку M(CH3) = 15, то для соответствия с истинной молекулярной массой необходимо удвоить индексы в формуле. Следовательно, молекулярная формула вещества: C2H6.
Алгоритм 1. Решение расчетных задач на вывод
молекулярной формулы вещества по массовым долям элементов
Задача 1. Найти молекулярную формулу вещества, содержащего 81,8% углерода и 18,2% водорода. Относительная плотность вещества по азоту равна 1,57.
Решение
1. Записать условие задачи.
2. Вычислить относительную молекулярную массу Mr(CхHy) по относительной плотности:
3. Найти индексы х и y по отношению :
4. Записать простейшую формулу: С3Н8.
Проверка: Мr(C3H8) = 44, следовательно, C3H8 – истинная формула.
Задача 2. Найти молекулярную формулу предельного углеводорода, массовая доля углерода в котором 83,3%.
Решение
1. Записать условие задачи.
2. Найти массовую долю водорода:
(Н) = 100% – 83,3% = 16,7%.
3. Найти индексы и простейшую формулу для углеводорода CхHy:
следовательно, простейшая формула – C2H5.
4. Найти истинную формулу. Поскольку общая формула алканов СnH2n+2, то истинная формула – С4Н10.
Алгоритм 2. Решение расчетных задач на вывод
молекулярной формулы вещества по массе (объему) продуктов сгорания
Задача 3. При сжигании 29г углеводорода образовалось 88г углекислого газа и 45 г воды, относительная плотность вещества по воздуху равна 2. Найти молекулярную формулу углеводорода.
Решение
1. Записать условие задачи.
2. Найти относительную молекулярную массу вещества:
Mr = Dвозд•Мr(возд.),
Mr(CхHy)= 2•29 = 58.
3. Найти количество вещества образовавшегося оксида углерода(IV):
4. Найти количество вещества углерода в сожженном веществе:
(C) =
(CO2) = 2 моль.
5. Найти количество вещества воды:
(H2O) = 45/18 = 2,5 моль.
6. Найти количество вещества водорода в сожженном веществе:
(H) = 2
(H2O),
(H) = 2,5•2 = 5 моль.
7. Найти простейшую формулу углеводорода:
(C) :
(Н) = 2 : 5,
следовательно, простейшая формула – С2Н5.
8. Найти истинную формулу углеводорода:
Мr(C2H5) = 29,
Mr (CхHy) = 58,
следовательно, истинная формула – C4H10.
Задача 4. При сжигании 5,6 л (н.у.) газообразного органического вещества было получено 16,8 л (н.у.) углекислого газа и 13,5 г воды. Масса 1 л исходного вещества при н.у. равна 1,875 г. Найти его молекулярную формулу.
Решение
1. Записать условие задачи.
2. Найти молекулярную массу вещества из пропорции:
1 л газа – 1,875 г,
22,4 л – m г.
Отсюда m = 42 г, M = 42 г/моль.
3. Найти количество вещества углекислого газа и углерода:
(CO2) = 16,8/22,4 = 0,75 моль,
(C) = 0,75 моль.
4. Найти количества веществ воды и водорода:
(H2O) = 13,5/18 = 0,75 моль,
(H) = 0,75•2 = 1,5 моль.
5. Найти сумму масс углерода и водорода:
m(C) + m(H) = 0,75•12 +1,5•1 = 10,5 г.
6. Найти массу сожженного вещества:
Следовательно, вещество содержит только углерод и водород.
7. Найти простейшую формулу углеводорода CхHy:
(C) :
(H) = 0,75 : 1,5 = 1 : 2,
следовательно, простейшая формула – СН2.
8. Найти истинную формулу углеводорода:
Mr(CH2) = 14,
Mr(в-ва) : Mr(CH2) = 42 : 14 = 3,
следовательно, истинная формула – С3Н6.
Задачи для самостоятельного решения:
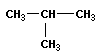
Задача 1. Установите молекулярную формулу монохлоралкана, содержащего 38,38% хлора. Приведите графические формулы и названия всех соединений, отвечающих данной формуле.
Решение:
-
Общая формула алканов CnH2n+2, общая формула монохлоралканов CnH2n+1Cl
-
Cоставим выражение для расчета массовой доли хлора:
М(Cl) 35,5
ω( Сl) =——————-=————-=0,3838 , откуда n=4
М(CnH2n+1Cl) 14n+36,5
Формула монохлоралкана С4Н9Сl
3. Графические формулы изомеров:
СН3 – СН2 – СН2 – СН2Сl 1-хлорбутан
СН3 – СН2 – СНCl– СН3 2- хлорбутан
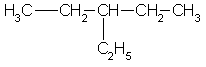
СН3 – СН – СН2Сl 2-метил-1-хлорпропан
|
СН3
СН3 – СCl – СН3 2-метил-2-хлорпропан
|
СН3
Задача 2. Установите молекулярную формулу алкена и продукта взаимодействия его с 1 моль бромоводорода, если это монобромпроизводное имеет относительную плотность по воздуху 4,24. Укажите название исходного алкена и одного его изомера.
Решение:
-
Общая формула монобромлканов CnH2n+1Br. Молярная масса монобромлкана М= 12n+2n+1+80=14n+81
-
Зная относительную плотность вещества по воздуху, находим молярную массу: М=29∙4,24=123г/моль
Из выражения 14n+81=123 n=3
-
Формула бромалкана С3Н7Br, исходного алкана С3Н6 – пропен. Изомер – циклопропан.
Задача 3. Установите молекулярную формулу алкена, если одно и то же количество его, взаимодействуя с различными галогеноводородами, образует, соответственно, 5,23 г хлорпроизводного или 8,2 г бромпроизводного.
Решение:
-
Уравнения реакций:
CnH2n + Н Сl = CnH2n+1Cl
CnH2n + Н Br = CnH2n+1Br
-
Так как количество вещества алкена одно и то же в обеих реакциях, то количества веществ галогеналканов равны:
n(CnH2n+1Cl) = n(CnH2n+1Br)
3. Из выражения 5,23/14n+36,5=8,2/14n+81 n=3
Формула алкена С3Н6
Задача 4. Установите молекулярную формулу алкена, если известно, что 1,012 л (н.у.) его при взаимодействии с хлором образует 5,09 г дихлорпроизводного.
Решение:
-
Находим количество вещества алкена:
n(CnH2n) = 1,012/22,4 = 0,045 моль
-
По уравнению реакции
CnH2n +Сl2 = CnH2nCl2
n(CnH2nCl2)= n(CnH2n) =0,045 моль
-
М(CnH2nCl2)=m/n=5,09/0,045=113г/моль
12n +2n+71=113 n=3
Формула алкена С3Н6
Задача 5. При полном сгорании 3,9 г углеводорода образовалось 13,2 г углекислого газа и 2,7 г воды. Плотность паров вещества 3,482г/л. Выведите молекулярную формулу.
Задача 6. При взаимодействии 1,74 г алкана с бромом образовалось 4,11 г монобромпроизводного. Определите молекулярную формулу алкана. Запишите структурные формулы названия возможных изомеров.
Задача 7. При полном сгорании неизвестной массы углеводорода образовалось 4,48 л углекислого газа и 3,6г воды. Относительная плотность вещества по водороду равна 14. Выведите молекулярную формулу углеводорода.
|
Задача 7. При полном сгорании неизвестной массы углеводорода образовалось 4,48 л углекислого газа и 3,6г воды. Относительная плотность вещества по водороду равна 14. Выведите молекулярную формулу углеводорода. |
Задача 6. При взаимодействии 1,74 г алкана с бромом образовалось 4,11 г монобромпроизводного. Определите молекулярную формулу алкана. Запишите структурные формулы названия возможных изомеров. |
|
Задача 5. При полном сгорании 3,9 г углеводорода образовалось 13,2 г углекислого газа и 2,7 г воды. Плотность паров вещества 3,482г/л. Выведите молекулярную формулу. |
Задача 1. Установите молекулярную формулу монохлоралкана, содержащего 38,38% хлора. Приведите графические формулы и названия всех соединений, отвечающих данной формуле. |
|
Задача 3. Установите молекулярную формулу алкена, если одно и то же количество его, взаимодействуя с различными галогеноводородами, образует, соответственно, 5,23 г хлорпроизводного или 8,2 г бромпроизводного. |
Задача 2. Установите молекулярную формулу алкена и продукта взаимодействия его с 1 моль бромоводорода, если это монобромпроизводное имеет относительную плотность по воздуху 4,24. Укажите название исходного алкена и одного его изомера. |
|
Задача 4. Установите молекулярную формулу алкена, если известно, что 1,012 л (н.у.) его при взаимодействии с хлором образует 5,09 г дихлорпроизводного. |
Задача 8. При сжигании 3.2г углеводорода образуется 8,8г СО2. Относительная плотность по водороду этого вещества равна 8. Найдите формулу углеводорода. |
|
Задача 9. При сжигании углеводорода массой 2,1 г получили 6,6г оксида углерода (IV). Относительная плотность органического соединения по водороду равна 42. Выведите молекулярную формулу углеводорода |
Задача 10. При сжигании 4,4г алкана выделилось 13,4г углекислого газа. Относительная плотность вещества по воздуху равна 1,52. Определите молекулярную формулу алкана. |
Задачи для самостоятельного решения:
Задача 1. Найти молекулярную формулу вещества, содержащего 81,8% углерода и 18,2% водорода. Относительная плотность вещества по азоту равна 1,57.
Задача 2. Найти молекулярную формулу предельного углеводорода, массовая доля углерода в котором 83,3%.
Задача 3. При сжигании 29г углеводорода образовалось 88г углекислого газа и 45 г воды, относительная плотность вещества по воздуху равна 2. Найти молекулярную формулу углеводорода.
Задача 4. При сжигании 5,6 л (н.у.) газообразного органического вещества было получено 16,8 л (н.у.) углекислого газа и 13,5 г воды. Масса 1 л исходного вещества ( при н.у.) равна 1,875 г. Найти его молекулярную формулу.
Задача 5. При сгорании 11,2 г Углеводорода получили оксид углерода массой 35,2 г и воду массой 14,4 г. Относительная плотность этого углеводорода по воздуху равна 1,93. Выведите молекулярную формулу.
Задача 6. При сжигании 2.2 г вещества получили 4,4 г оксида углерода и 1,8 г воды. Относительная плотность вещества по водороду равна 44. Определите молекулярную формулу вещества.
Задача 7. Выведите формулу вещества, содержащего 81,8% углерода и 18,2 % водорода, если относительная плотность по водороду равна 22.
Задача 8. Определите молекулярную формулу углеводорода, если массовая доля углерода равна 85,75, а водорода –14,3%. Относительная плотность этого вещества по азоту примерно равна 2.
Задача 9. Найти формулу вещества, содержащего 85,71% углерода и 14,29% водорода, если относительная плотность паров этого вещества по воздуху равна 1,448.
Задача10. При сгорании 4,3 г Углеводорода получили оксид углерода массой 13,2 г и воду массой 6,3 г. Относительная плотность этого углеводорода по воздуху равна 2,966. Выведите молекулярную формулу.
Задача 11. При сгорании 2,1 г вещества получили оксид углерода массой 6,6 г и воду массой 2,7 г. Относительная плотность этого углеводорода по воздуху равна 2,96. Выведите молекулярную формулу.
Задача 12. При сгорании 8,6 г Углеводорода получили оксид углерода массой 26,4 г и воду массой 12,6 г. Относительная плотность этого углеводорода по воздуху равна 2,966. Выведите молекулярную формулу.
Задача 13. При сжигании 3,9 г органического вещества плотность паров по водороду- 39, образовалось 13,2 г углекислого газа и 2,7 г воды. Определить формулу вещества .
Задача 14. При сжигании алкена массой 11,2 г получили 35,2 г оксида углерода (IV) и 14,4 г воды. Относительная плотность алкена по воздуху равна 1,93. Найти молекулярную формулу алкена.
Задача 15. Определить молекулярную формулу углеводорода, если при сжигании 2,2 г его было получено 3,36л углекислого газа и 3,6 г воды. Плотность вещества по воздуху равна 1,5172.
Задача 16. Определить молекулярную формулу углеводорода, если при сжигании 1,3 г его было получено 2,24л углекислого газа и 0,9 г воды. Плотность вещества по водороду равна 12,992.
Задача 17. При сжигании 5,25 г газообразного углеводорода с плотностью по водороду =21 получили 8,4 л углекислого газа и 6,75 г воды. Определить формулу вещества.
Задача 18. Найти молекулярную формулу углеводорода, имеющего плотность по водороду =22. если при сгорании 4,4 г его образуется 6,72л CO2 и 7,2 г Н2О.
Задача 19. Относительная плотность по водороду некоторого алкана 15. Определите его формулу.
Задача 20. Массовая доля углерода в алкане составляет 84%. Определите его формулу.
Задача 21. При сгорании 2,2 г органического вещества, имеющего плотность по воздуху 1,517, образовалось 3,36 л углекислого газа (н.у.) и 3,6 г воды. Определите формулу органического вещества.
Задача 22. Органическое вещество содержит углерод (массовая доля 84,21%) и водород (15,79%). Плотность паров вещества по воздуху составляет 3,93. Определите формулу органического вещества.
Задача 23. Массовая доля углерода в углеводороде составляет 83,33%. плотность паров по водороду =36. Определите формулу углеводорода. Сколько он имеет изомеров? Напишите структурные формулы этих изомеров и назовите их.
Задача 24. Определите формулу предельного одноатомного спирта, если при дегидратации образца его объемом 37 мл и плотностью 1,4 г/мл получили алкен 39,2 г.
Задача 25. Определите молекулярную формулу предельного трехатомного спирта, массовая доля углерода в котором равна массовой доле кислорода.
Определите молекулярную формулу алкана, если его молярная масса 86 г/моль.
Решение задачи
Напомню, алканы – предельные углеводороды, углеродная цепь которых незамкнута и не содержит кратных (двойных или тройных) связей.
Общая формула алканов имеет вид:
Исходя из условия задачи и зная, что молярная масса алканов вычисляется по формуле:
Найдем молекулярную формулу алкана:
14n + 2 = 86
14n = 84
n = 6
Получаем:
C6H14 – гексан.
Ответ:
гексан.
Определите относительную молекулярную массу алкана если относительная плотность по воздуху составляет 3.
93.
Если вам необходимо получить ответ на вопрос Определите относительную молекулярную массу алкана если относительная плотность по воздуху составляет 3?, относящийся
к уровню подготовки учащихся 5 — 9 классов, вы открыли нужную страницу.
В категории Химия вы также найдете ответы на похожие вопросы по
интересующей теме, с помощью автоматического «умного» поиска. Если после
ознакомления со всеми вариантами ответа у вас остались сомнения, или
полученная информация не полностью освещает тематику, создайте свой вопрос с
помощью кнопки, которая находится вверху страницы, или обсудите вопрос с
посетителями этой страницы.
Массовая доля углерода в алкане составляет 84%. Определите молекулярную формулу алкана.
1. Общая молекулярная формула алканов — CnH2n+2 Относительная молекулярная масса алканов вычисляется следующим образом:
Mr(CnH2n+2)= Ar(C)⋅n+Ar(H)⋅(2n+2)
Mr(CnH2n+2)=12n + 1(2n+2)=14n+2
2. Массовая доля углерода рассчитывается по формуле: ω(С)=Ar(C)⋅n/Mr(CnH2n+2);
Или 0,84=12n/14n+2, отсюда n=7
3. Таким образом, молекулярная формула алкана C7H16
Ответ: C7H16
9.3.
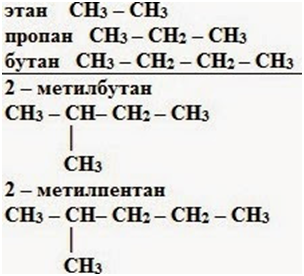
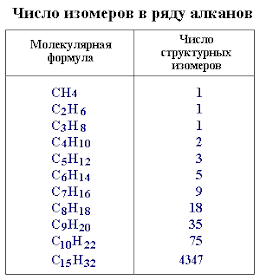
Предельные углеводороды (алканы)
Алканы – это
алифатические (ациклические), насыщенные углеводороды, в которых все
валентности атомов углерода, не затраченные на образование простых С – С
связей, насыщены атомами водорода.
Общая формула алканов – СnH2n+2
В таблице
представлены некоторые представители ряда алканов и их радикалы.
|
Формула |
Название |
Название радикала |
|
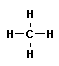
CH4 |
метан |
— CH3 метил |
|
C2H6 |
этан |
— C2H5 этил |
|
C3H8 |
пропан |
— C3H7 пропил |
|
C4H10 |
бутан |
— C4H9 бутил |
|
C4H10 |
изобутан |
изобутил |
|
C5H12 |
пентан |
пентил |
|
C5H12 |
изопентан |
изопентил |
|
C5H12 |
неопентан |
неопентил |
|
C6H14 |
гексан |
гексил |
|
C7H16 |
гептан |
гептил |
|
C10H22 |
декан |
децил |
Из таблицы
видно, что эти углеводороды отличаются друг от друга количеством групп — СН2 -.Такой
ряд сходных по строению, обладающих близкими химическими свойствами и
отличающихся друг от друга числом данных групп называется гомологическим рядом.
А вещества, составляющие его называются гомологами.
Гомологи – вещества
сходные по строению и свойствам, но отличающиеся по составу на одну или
несколько гомологических разностей (- СН2 -).
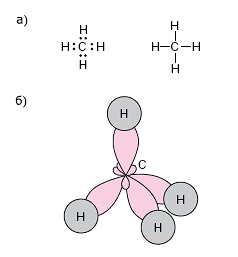
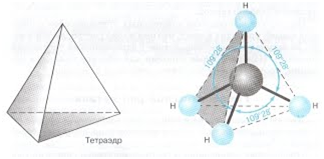
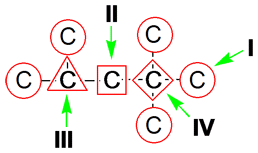
Строение:
Основные
характеристики:
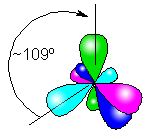
пространственное
строение – тетраэдрическое
sp3 – гибридизация,
‹ HCH = 109
° 28
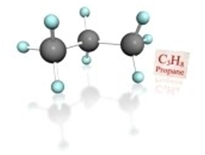
Углеродная
цепь — зигзаг (если n ≥ 3)
σ – связи
(свободное вращение вокруг связей)
длина
(-С-С-) 0,154 нм
энергия
связи (-С-С-) 348 кДж/моль
Все атомы
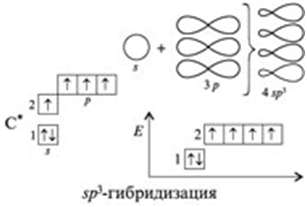
углерода в молекулах алканов находятся в состоянии sр3-гибридизации
угол между связями С-C составляет 109°28′, поэтому
молекулы нормальных алканов с большим числом атомов углерода имеют
зигзагообразное строение (зигзаг). Длина связи С-С в предельных углеводородах
равна 0,154 нм (1нм=1*10-9м).
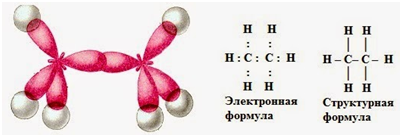
а) электронная и структурная формулы;
б) пространственное строение
Строение молекулы этана С2Н6
Строение молекулы пропана С3Н8 –
цепь зигзагообразная
Электронное строение атома
углерода в алканах
В составе алканов (а также циклоалканов) все атомы
углерода имеет sp3-гибридизацию, связи образованы
четырьмя равноценными гибридизованными орбиталями, полученными в результате
гибридизации неравноценных одной 2s- и трех 2р-орбиталей:
Для обеспечения минимальных
стерических затруднений и взаимного отталкивания эти четыре равноценные
молекулярные орбитали расположены в пространстве на равных друг от друга расстояниях,
направлены к вершинам тетраэдра (ядро атома углерода располагается в центре
тетраэдра), а пространственные углы между орбиталями составляют около 109°28’:
В таком состоянии четыре s- связи в
результате перекрывания с орбиталями других атомов могут быть образованы
беспрепятственно.
Вокруг s-связи возможно вращение
фрагментов молекулы, поэтому длинные цепи углеводородов могут свободно
изгибаться в пространстве. Стоит иметь в виду, что атомы углерода в составе
длинных цепей никогда не расположены на прямой линии, даже если цепь не
изгибается. Геометрия связей в алканах такова, что реальная молекула в самом
«распрямленном» состоянии может выглядеть, например, таким образом:
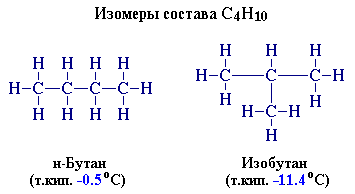
Изомерия – характерна СТРУКТУРНАЯ изомерия
цепи с С4
Один из этих изомеров (н-бутан)
содержит неразветвленную углеродную цепь, а другой — изобутан — разветвленную
(изостроение).
Атомы углерода в разветвленной цепи
различаются типом соединения с другими углеродными атомами. Так, атом углерода,
связанный только с одном другим углеродным атомом, называется первичным,
с двумя другими атомами углерода – вторичным, с тремя – третичным,
с четырьмя – четвертичным.
С
увеличением числа атомов углерода в составе молекул увеличиваются возможности
для разветвления цепи, т.е. количество изомеров растет с ростом числа
углеродных атомов.
Сравнительная
характеристика гомологов и изомеров
1. Свою
номенклатуру имеют радикалы (углеводородные радикалы)
|
Алкан — ан СnH2n+2 |
Радикал (R) — ил СnH2n+1 |
||
|
ФОРМУЛА |
НАЗВАНИЕ |
ФОРМУЛА |
НАЗВАНИЕ |
|
метан |
метил |
||
|
этан |
этил |
||
|
пропан |
пропил |
||
|
изопропил (втор-пропил) |
|||
|
бутан |
н — бутил |
||
|
втор-бутил |
|||
|
изобутан (2 – |
изобутил (перв-изобутил) |
||
|
трет-бутил |
|||
|
неопентан (2,2-диметилпропан) |
нео-пентил |
2. Число
одинаковых заместителей указывают при помощи множительных приставок:
два – «ди»
три – «три»
четыре –
«тетра»
пять –
«пента»
шесть –
«гекса»
семь –
«гепта»
восемь –
«окта»
девять –
«нано»
Для названия предельных углеводородов применяют в
основном систематическую(международная
номенклатура IUPAC) и рациональную номенклатуры.
I. По рациональной
номенклатуре алканы рассматривают как производные простейшего
углеводорода — метана, в молекуле которого один или несколько водородных атомов
замещены на радикалы. Эти заместители (радикалы) называют по старшинству (от
менее сложных к более сложным). Если эти заместители одинаковые, то указывают
их количество. В основу названия включают слово «метан»:
II. Систематическая номенклатура
Правила систематической номенклатуры:
1. В формуле
молекулы алкана выбираем главную цепь — самую длинную.
2. Затем эту
цепь нумеруем с того конца, к которому ближе расположен заместитель (радикал).
(Если заместителей несколько, то поступают так, чтобы цифры, указывающие их
положение, были наименьшими) Заместители перечисляем по алфавиту.
3. Называем
углеводород: вначале указываем (цифрой) место расположения заместителя, затем
называем этот заместитель (радикал), а в конце добавляем название главной
(самой длинной) цепи.
Таким образом, углеводород может быть назван: 2
— метил — 4 — этилгептан (но не 6-метил-4-этилгептан).
Физические свойства
В обычных условиях
С1— С4 –
газы
С5— С15 –
жидкие
С16 – твёрдые
Температуры
плавления и кипения алканов, их плотности увеличиваются в гомологическом ряду с
ростом молекулярной массы. Все алканы легче воды, в ней не растворимы, однако
растворимы в неполярных растворителях (например, в бензоле) и сами являются
хорошими растворителями. Физические свойства некоторых алканов представлены в
таблице.
Таблица
2. Физические свойства некоторых алканов
|
Название |
Формула |
tпл °С |
tкип °С |
|
Метан |
СН4 |
-182,5 |
-161,5 |
|
Этан |
С2Н6 |
-182,8 |
-88,6 |
|
Пропан |
С3Н8 |
-187,7 |
-42 |
|
Бутан |
С4Н10 |
-138,3 |
-0,5 |
|
Пентан |
C5H12 |
-129,7 |
+36,1 |
|
Гексан |
С6Н14 |
-95,3 |
68,7 |
|
Гептан |
С7H16 |
-90,6 |
98,4 |
|
Октан |
C8H18 |
-56,8 |
124,7 |
|
Нонан |
С9Н20 |
-53,7 |
150,8 |
|
Декан |
C10H22 |
-29,6 |
174,0 |
|
Пентадекан |
C15H32 |
+10 |
270,6 |
|
Эйкозан |
С20Н42 |
36,8 |
342,7 |
|
Пентакозан |
C25H52 |
53,7 |
400 |
Химические свойства
алканов
1. Реакции замещения.
а) Галогенирование
при действии света — hν или
нагревании (стадийно – замещение атомов водорода на галоген носит
последовательный цепной характер. Большой вклад в разработку цепных
реакций внёс физик, академик, лауреат Нобелевской премии Н. Н. Семёнов )
В реакции образуются вещества
галогеналканы RГ или Сn H2n+1Г
(Г — это галогены
F, Cl, Br, I)
CH4 + Cl2 hν → CH3Cl + HCl (1
стадия) ;
метан
хлорметан
CH3Cl + Cl2 hν → CH2Cl2 + HCl (2
стадия);
дихлорметан
СH2Cl2 + Cl2 hν → CHCl3 + HCl (3
стадия);
трихлорметан
CHCl3 + Cl2 hν → CCl4 + HCl (4
стадия).
тетрахлорметан
Скорость реакции замещения водорода на
атом галогена у галогеналканов выше, чем у соответствующего алкана, это связано
с взаимным влиянием атомов в молекуле:
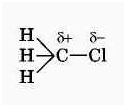
Электронная
плотность связи С – Cl смещена
к более электроотрицательному хлору, в результате на нём скапливается частичный
отрицательный заряд, а на атоме углерода – частичный положительный заряд.
На атом
углерода в метильной группе ( — СН3) создаётся дефицит электронной
плотности, поэтому он компенсирует свой заряд за счёт соседних атомов
водорода, в результате связь С – Н становится менее прочной и атомы
водорода легче замещаются на атомы хлора. При увеличении углеводородного
радикала наиболее подвижными остаются атомы водорода у атома углерода
ближайщего к заместителю:
CH3 – CH2 – Cl + Cl2 hν → CH3 – CHCl2 +
HCl
хлорэтан 1,1
-дихлорэтан
Со фтором
реакция идёт со взрывом.
С хлором и
бромом требуется инициатор.
Иодирование
происходит обратимо, поэтому требуется окислитель для удаления HI из
рекции.
Внимание!
В
реакциях замещения алканов легче всего замещаются атомы водорода у третичных
атомов углерода, затем у вторичных и, в последнюю очередь, у
первичных. Для хлорирования эта закономерность не соблюдается
при T>400˚C.
б) Нитрование
(реакция М.И. Коновалова, он провёл
её впервые в 1888 г)
CH4 + HNO3(раствор) t˚С → CH3NO2 + H2O
нитрометан
RNO2 или Сn H2n+1 NO2 (нитроалкан)
2. Реакции отщепления
(дегидрирование)
а) CnH2n+2 t˚С, Ni или Pd → CnH2n + H2
б) При нагревании до 1500 С
происходит образование ацетилена и водорода:
2CH4 1500°С →
C2H2 + 3H2
3. Реакции перегруппировки
(изомеризация)
н-алкан AlCl3, t°С → изоалкан
4. Реакции
горения (горят светлым не коптящим пламенем)
CnH2n+2 + O2 t°С → nCO2 + (n+1)H2O
Помните! Смесь
метана с воздухом и кислородом взрывоопасна
V(CH4) : V(O2) = 1: 2
V(CH4) : V(воздуха) =
1 : 10
5. Реакции разложения
а) Крекинг при
температуре 700-1000°С разрываются (-С-С-) связи:
C10H22 t°С → C5H12 + C5H10
алкан алкен
б) Пиролиз при
температуре 1000°С разрываются все связи,
продукты – С и Н2:
СH4 1000°С → C + 2H2
в) Конверсия метана
с образованием синтез – газа (СО + Н2)
CH4 + H2O 800˚C, Ni → СО + 3Н2
Получение и применение
алканов
|
В лаборатории |
||||||
|
1. Гидролиз Al4C3 + |
||||||
|
2. Реакция R-Г + 2Na + Г-R1 → R—R1 + 2NaГ (R— это радикал; Г- это галоген) a) CH3-Cl + 2Na или 2CH3Cl б) CH3-I + 2Na + I-C2H5 → или CH3I |
||||||
|
3. Термическое R-COONa + NaOH —t a) CH3-COONa + (ацетат б) C2H5-COONa + NaOH —t этилат |
||||||
|
4. Каталитическое a) CnH2n + алкен C2H4 + b) CnH2n-2 + алкин C2H2 + |
||||||
|
5. Электролиз растворов солей карбоновых кислот — реакция КОЛЬБЕ Пример. H2O,
Итог: 2H2O + 2CH3COONa эл.ток= H2 + 2CO2 + 2H2O + 2CH3COONa эл.ток= H2 + |
|
В промышленности |
|
1. Из природного и попутного нефтяного Важнейшим источником алканов в природе является Метан называют ещё и болотным; рудничным газом. Попутные нефтяные газы состоят в основном из бензины — т. кип. от 40 до 180 С, (содержит углеводороды С5-С10), керосин 180-230 C, (С11-С12); легкий газойль (дизельное топливо) тяжелый газойль и легкий дистиллят смазочного масла 305-405 С (С18-С25); смазочные масла 405-515 С (С26-С38). Остаток |
|
2. Синтезом n CO + (2n + 1) H2 — t,kat→ CnH2n+2 + n H2O CO + 3H2 — t,kat→ CH4 + |
|
3. Синтезом n C + (n C + 2 H2 — 500°C,Ni → CH4 |
Применение
1. Предельные
углеводороды находят широкое применение в самых разнообразных сферах жизни и
деятельности человека.
2. Использование
в качестве топлива – в котельных установках, бензин, дизельное топливо,
авиационное топливо, баллоны с пропан-бутановой смесью для бытовых плит
3. Вазелин
используется в медицине, парфюмерии, косметике, высшие алканы входят в состав
смазочных масел, соединения алканов применяются в качестве хладагентов в
домашних холодильниках
4. Смесь
изомерных пентанов и гексанов называется петролейным эфиром и применяется в
качестве растворителя. Циклогексан также широко применяется в качестве
растворителя и для синтеза полимеров.
5. Метан
используется для производства шин и краски
6. Значение
алканов в современном мире огромно. В нефтехимической промышленности
предельные улеводороды являются базой для получения разнообразных
органических соединений, важным сырьем в процессах получения полупродуктов
для производства пластмасс, каучуков, синтетических волокон, моющих средств и
многих других веществ. Велико значение в медицине, парфюмерии и
косметике.
УПРАЖНЕНИЯ
1. Напишите структурные формулы всех алканов с пятью
атомами углерода в главной цепи, плотность паров которых по водороду равна
50. Назовите их по систематической номенклатуре.
Решение:
Молярная масса алканов равна: M(CnH2n+2)
= 2*50 = 100 г/моль, откуда n = 7. Из 7 атомов углерода 5 составляют главную
цепь, а два входят в состав заместителей: двух групп -СН3 или одной группы -С2Н5.
Две группы -СН3 могут
находиться в следующих положениях при главной цепи: 2,2-: 2,3-: 2,4-; 3.3-.
2.2-диметилпентан 2.3-диметилпентан
2.4-диметилпентан
3.3-диметилпентан
Одна группа -С2Н5 может находиться только в положении
3. В противных случаях она войдет в состав главной цепи, и длина последней
будет превышать пять атомов углерода:
3-этилпентан
Ответ. 5 изомеров состава С7Н16.
________________________________________________________________
2. Углеводород имеет элементный состав: 82,76%
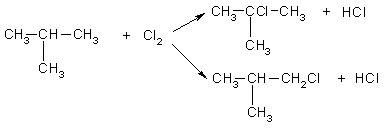
углерода и 17,24% водорода (по массе). При хлорировании
(радикальном) углеводород образует два изомерных монохлорида —
первичный и третичный. Определите строение исходного углеводорода.
Решение:
Пусть формула углеводорода — СхНу (М = 12x+y). Массовая доля водорода
в одном моле этого вещества равна:
w(H)
= y/(12x+y) = O,1724
откуда, y = 2,5x. Это означает, что простейшая
формула углеводорода С2Н6. Ей соответствует истинная
формула С4Н10. Существует два углеводорода состава С4Н10:
Бутан
2-мстилпропан
Третичные атомы углерода есть только в одном из этих
двух изомеров, в 2-метилпропане, поэтому только 2-метилпропан при
хлорировании может образовать третичный алкилхлорид:
Ответ. 2-метилпропан.
________________________________________________________________
3. Газ,
образующийся при полном сгорании 0,1 моль предельного углеводорода,
пропустили через избыток известковой воды, при этом выпало 60 г осадка.
Определите молекулярную формулу и строение предельного углеводорода, если
известно, что он содержит один четвертичный атом углерода.
Решение:
При сгорании одного моля углеводорода, содержащего
и атомов углерода, образуется n моль СО2:
СnН2n+2 + (Зn+1)/2O2 →
СO2 + (n+1)Н2О.
При пропускании СО2 через известковую воду образуется
карбонат кальция:
Са(ОН)2 +
СО2 = СаСО3↓
+ Н2О.
v(СаСО3) = 60/100 = 0,6 моль = v(CO2). При сгорании 0,1
моль СnН2n+2 выделилось
0,6 моль СО2, следовательно n = 6. Молекулярная формула
углеводорода — С6Н14.
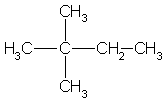
Из пяти углеводородов состава С6Н14 четвертичный атом углерода есть
только в 2,2-диметилбутане:
Ответ. С6Н14— 2,2-диметилбутан.
________________________________________________________________
4. При прокаливании смеси массой 49г, состоящей из
ацетата калия и избытка гидроксида калия, выделился газ, прореагировавший при
освещении с парами брома. В результате последней реакции образовалось 25,3 г
трибромметана. Выход трибромметана составил 50% от теоретического. Найдите
массовые доли веществ в исходной смеси.
Решение:
При прокаливании исходной смеси происходит реакция:
СН3СООK + KОН = K2СО3 + СН4 .
Выделяющийся метан реагирует при освещении с парами
брома: СН4 + 3Вr2 = СНВr3 + 3НВr.
M/(СНВr3) = 253 г/моль, М(СН3СООK)
= 98 г/моль. Трибромметана образовалось 25,3/253 = 0,1 моль. С учетом
50%-ного выхода в реакцию бромирования вступило 0,1/0,5 = 0,2 моль метана.
Следовательно, в первую реакцию вступило 0,2 моль СН3СООК (КОН — в
избытке) массой 0,2•98 = 19,6 г. Массовая доля ацетата калия в исходной смеси
равна: ω(СН3СООК) = 19,6/49 = 0,4, или 40%. Тогда массовая доля
КОН равна 0,6 или 60%.
Ответ. 40% СН3СООK, 60% KОН.
________________________________________________________________
5. При пропускании
11,2 л смеси метана, оксида углерода (IV) и оксида углерода (II) через
раствор гидроксида натрия, взятый в избытке, объем исходной смеси уменьшился
на 4,48 л (н.у.). Для полного сгорания оставшейся смеси потребовалось 6,72 л
(н.у.) кислорода. Определите состав исходной смеси (в % по объему).
Решение:
При пропускании смеси через раствор щелочи
поглощается только оксид углерода (IV):
СО2 +
2NaOH = Na2CO3 + Н2О
0бъем поглощенного СО2
составляет 4,48 л. Следовательно, v(CO2) = 4,48/22,4 = 0,2 моль. После
поглощения СО2 объем
смеси составил 11,2-4,48 = 6,72 л, что соответствует 0,3 моль. Оставшиеся
газы сгорают по уравнениям:
СН4 +
2О2 = СО2 + 2Н2О, 2СО + О2 = 2СО2 .
Пусть в смеси было x моль СН4 и у моль СО, тогда на сгорание СН4 израсходовано 2x моль О2,
а на сгорание СО —у/2 моль O2; всего израсходовано 6,72/22,4 = 0,3
моль О2. Имеем систему:
x + у
= 0,32
2x +
у/2 = 0,3
Отсюда x = 0,1, у = 0,2. Значит, в исходной смеси
было 0,1 моль СН4 (2,24
л, или 20%), 0,2 моль СО (4,48 л. или 40%) и 0,2 моль СO2(4,48 л
или 40%).
Ответ. 20% СН4, 40% СО, 40% СО2.
________________________________________________________________
6. Этиловый спирт
содержит 52,18% углерода:13,04% водорода: 34,78% кислорода. Плотность паров
спирта по водороду 23. Определите формулу этилового спирта.
Решение:
1.
Определим молекулярную массу искомого вещества:
Mr(CxHyOz) = D(H2) · Mr(H2)=23·
2 =46
2.По
формуле n = (Wэлемента * Mr(вещества)) / Ar элемента *
100%
вычислим
число атомов C, H, O
n(C)=(52,18%
· 46) / 12· 100% = 2
n(H)=( 13,04%
· 46) /1· 100% =6
n(O)=( 34,78%
· 46) / 16· 100% =1
следовательно, вещество C2H6O
Проверка, Mr(C2H6O)= 46
________________________________________________________________
7. Углеводород
содержит 81,82% углерода. Масса 1 л этого углеводорода (н.у.) составляет
1,964 г. Найдите молекулярную формулу этого углеводорода.
Решение:
1.
Определим молярную массу искомого вещества:
ρ = m/V,
следовательно М(СхНу) = ρ· Vm = 1,964 г/л · 22,4 л/моль =
44
2. По
формуле
n =
(Wэлемента * Mr(вещества)) / Ar элемента * 100%
вычислим
число атомов C, H.
Здесь Мr=M.
n(C)=(81,82%
· 44) / (12 · 100%) = 3
n(H)=(18,18%
· 44) / (1· 100%) = 8
8, следовательно, вещество C3H8.
Проверка, Mr(C3H8)= 44
________________________________________________________________
__
________________________________________________________________
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО
РЕШЕНИЯ
1. Какой продукт получится в результате
электролиза водного раствора соединения (СН3)2СН-СOONa?
Что получится при прокаливании этого же соединения в присутствии NaOH? Назовите
соединения по рациональной и ИЮПАК номенклатурам.
2. Что получится при обработке
металлическим натрием бромистого этила? Назовите полученное соединение.
3. Что получится при обработке
металлическим натрием смеси из бромистого этила и хлористого изопропила?
Назовите полученные соединения.
4. Что получится при обработке
2-иодпентана йодистым водородом (HJ). Назовите соединение по номенклатуре
ИЮПАК.
5. Сколько различных моногалогензамещенных
может теоретически получиться при реакции 2-метилбутана с газообразным хлором
на свету? Напишите все возможные структуры и назовите соединения по
номенклатуре ИЮПАК.
6. Какое соединение получится
преимущественно при бромировании бутана-
1-бромбутан или 2-бромбутан? Почему так происходит?
7. Сколько изомеров моногалогенирования может иметь
циклогексан?
8. В углеводороде массовая доля углерода равна 84%.
Относительная плотность паров углеводорода по воздуху равна 3,45. Определите
формулу углеводорода.
9. Массовая доля углерода в углеводороде составляет
83,33%. Плотность паров углеводорода по водороду равна 36. Определите формулу.
10. Массовая доля углерода в углеводороде составляет
85,7%. Плотность паров углеводорода по воздуху равна 1,931. Определите
формулу.
ВИДЕО ОПЫТ
|
1. Укажите тип гибридизации атомов углерода в |
|
|
а) sp |
б) sp2 |
|
в) sp3 |
г) sp3d2 |
|
2. Укажите величину валентных углов НСС у насыщенных |
|
|
а) 1090 |
б) 1200 |
|
в) 1400 |
г)1800 |
|
3. Найдите число изомеров алкана общей формулы С5Н12: |
|
|
а) 2 |
б) 1 |
|
в) 4 |
г) 3 |
|
4. Назовите по систематической номенклатуре СН3 – СНСl – CH2 – CHBr – CH3: |
|
|
а) 2-хлор-4-бромбутан |
б) 2-бром-4-хлорбутан |
|
в) 2-хлор-4-бромпентан |
г) 2-бром-4-хлорпентан |
|
5. Укажите тип гибридизации атомов углерода в |
|
|
а) sp |
б) sp2 |
|
в) sp3 |
г) sp3d2 |
|
6. Укажите соединение, при хлорировании на свету |
|
|
а) |
б) 2-метилбутан |
|
в) 2-метилпентан |
г) 2,2-диметилбутан |
|
7. Укажите статистически возможный процент |
|
|
а) 25 |
б) 35 |
|
в) 50 |
г) 75 |
|
8. Относительная молекулярная масса алкана равна 142. |
|
|
а) 8 |
б) 6 |
|
в) 10 |
г) 12 |
|
9. Число изомеров для алкана с относительной |
|
|
а) 5 |
б) 4 |
|
в) 2 |
г) 3 |
|
10. Число изомерных соединений состава С4Н9Сl равно: |
|
|
а) 4 |
б) 2 |
|
в) 1 |
г) 3 |
Ответы:
|
1 |
в |
|
2 |
а |
|
3 |
г |
|
4 |
г |
|
5 |
в |
|
6 |
б |
|
7 |
а |
|
8 |
в |
|
9 |
а |
|
10 |
а |