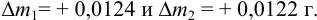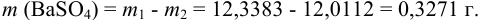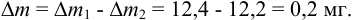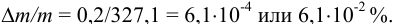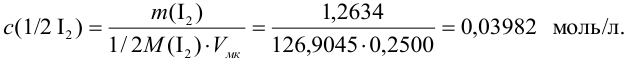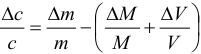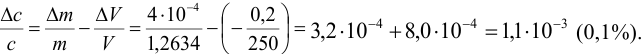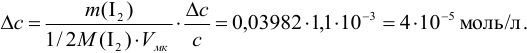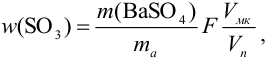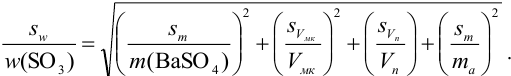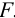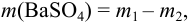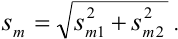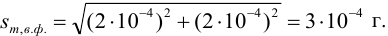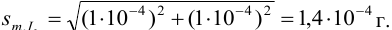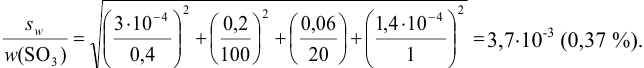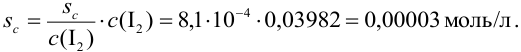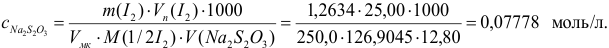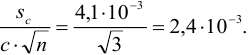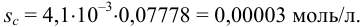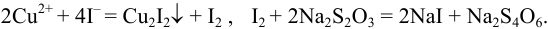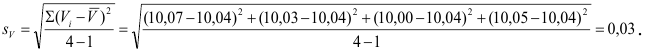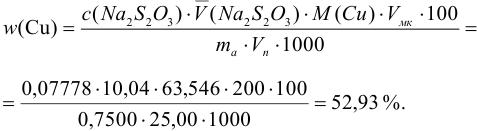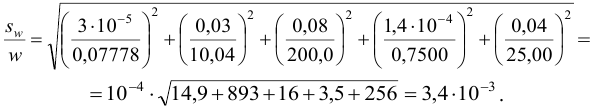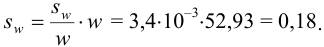Обработка результатов измерений
Любая
лабораторная работа по физической химии
сводится к определению численных
значений конкретных физико-химических
величин. Последние находятся путем
расчётов по уравнениям с использованием
результатов измерений, которые всегда
содержат некоторую погрешность
(ошибку).
Погрешность имеют и табличные данные.
Погрешности,
в зависимости от источников их
происхождения, подразделяются на грубые,
систематические
и случайные.
Грубые
ошибки (промахи)
связаны обычно с невнимательностью
экспериментатора, и их довольно легко
обнаружить при повторных измерениях.
В дальнейшем предполагается, что грубые
промахи студентом не допускаются.
Систематические
погрешности обусловлены дефектами
измерительной аппаратуры, её
неправильной установкой, применением
недостаточно чистых реактивов,
использованием приближённых уравнений
и недостаточно точных констант,
отсутствием контроля постоянства
условий проведения эксперимента,
например температуры. При повторных
измерениях систематические ошибки
обычно остаются постоянными. Если же в
процессе проведения эксперимента
условия, определяющие состояние системы,
изменяются, возможно существенное
изменение систематической ошибки.
Исключить
систематические ошибки можно проверкой
оборудования по эталонным образцам,
его калибровкой, использованием других,
более точных методов и уравнений,
введением соответствующих поправок.
Часто
при повторных измерениях одной и той
же величины получаются несколько
отличающиеся друг от друга результаты,
что связано с невозможностью поддержания
строгого постоянства условий эксперимента.
Последние испытывают случайные колебания
и являются причиной появления случайных
погрешностей
измерений. Случайные
погрешности независимы друг от друга.
Они
обусловлены факторами, которые практически
невозможно контролировать и учесть и
которые при повторных измерениях могут
действовать на результаты измерений
по-разному. Исключить эти ошибки нельзя,
но их можно учесть, проведя серию
повторных измерений и статистическую
обработку результатов последних.
Разделение
ошибок на систематические и случайные
весьма условно. Например, если для
приготовления серии растворов использовать
несколько колб, то погрешность их объёмов
выступает как случайная ошибка. Но если
эта серия растворов приготовлена с
использованием лишь одной колбы, то
погрешность её объёма является
систематической, поскольку во всех
случаях постоянна и её значение
присутствует во всех результатах.
При
определении величины погрешности
физико-химического параметра, измеряемого
в ходе конкретного эксперимента, характер
погрешности, как правило, безразличен,
важна величина общей погрешности, равная
сумме систематической и случайной
ошибок.
Результаты
измерений и вычислений характеризуются
правильностью
и воспроизводимостью.
Под воспроизводимостью
понимают разброс результатов параллельных
измерений относительно среднего
значения. Чем этот разброс меньше, тем
воспроизводимость выше. При отсутствии
систематических ошибок воспроизводимость
определяется случайными ошибками. Если
чувствительность прибора недостаточна,
случайные погрешности могут не проявиться
и тогда бессмысленно говорить об учёте
случайных ошибок. Из теории ошибок
следует, что если они подчиняются
распределению Гаусса (в дальнейшем это
подразумевается), среднее арифметическое
результатов достаточно большого числа
отдельных измерений наиболее близко к
истинному значению измеряемой величины.
Правильность
результата характеризуется отклонением
среднего арифметического от истинного
значения и определяется наличием
систематических ошибок. Хорошая
воспроизводимость результатов не
означает их правильности, поскольку
результат может содержать очень большую
постоянную систематическую погрешность.
Погрешность
конкретного результата измерения
величины хi
(если
произведено n
измерений) можно выразить через абсолютную
ошибку xi,
являющуюся разностью между хi
и истинным значением х
(средним арифметическим
=хi/n,
если ошибки случайные). Относительная
погрешность i=xi/
более наглядно характеризует точность
измерения. Для серии из n
измерений величины х
средняя абсолютная ошибка х=хi/
.
Абсолютная погрешность имеет размерность
измеряемой величины, относительная
погрешность безразмерная.
В
физико-химическом эксперименте значение
определяемой величины обычно рассчитывают
из некоторого уравнения, в которое
входят параметры, имеющие определённую
погрешность. Для нахождения относительной
погрешности
величины у,
являющейся функцией независимых
переменных ,,
и т.д., выражаемой уравнением у=f(,,,…)
при условии, что
,
необходимо прологарифмировать это
уравнение и продифференцировать
полученный натуральный логарифм, т.е.
Так
как знаки отдельных погрешностей
неизвестны, предполагается наихудший
вариант, когда они одинаковы и вклады
всех ошибок складываются. Поэтому, если
после описанных выше математических
операций получается полином, отдельные
слагаемые в котором отрицательные, то
знак минус перед ними заменяется плюсом.
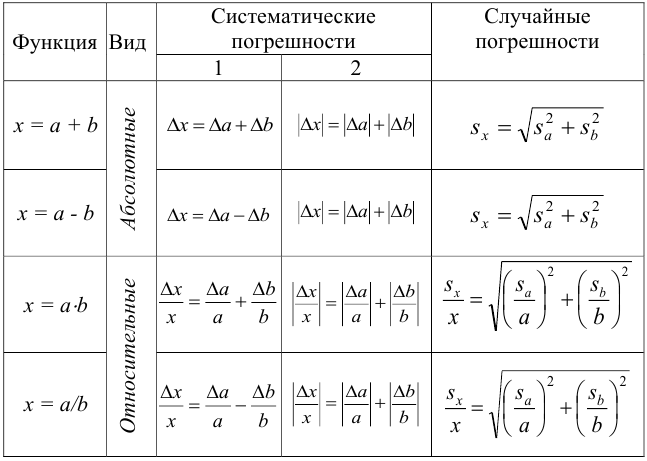
Относительные
погрешности некоторых простых функций
приведены в таблице 1, в которой а
– точная константа. В случае более
сложного уравнения (например, выражение
для энтальпии реакции Н
через ЭДС и её температурный коэффициент),
его необходимо представить как комбинацию
более простых соотношений.
Таблица 1
Погрешности
некоторых функций
|
№ |
Функция |
Относительная |
№ |
Функция |
Относительная |
|
1 2 3 |
y = ах y = x + z y = x — z |
у
|
4 5 6 7 |
y = xz
y
y |
|
Если
определяемая величина является
логарифмической функцией (в том числе
рН, рК), то обычно находят её абсолютную
погрешность, а не относительную. Как
следует из формулы (7), абсолютная
погрешность натурального логарифма
равна относительной погрешности
логарифмируемого выражения.
Если логарифм десятичный, то сначала
необходимо перейти к натуральному,
после чего воспользоваться формулой
(7).
Погрешность
исходных данных определяется погрешностью
используемых приборов (указывается в
паспорте прибора). Если она неизвестна,
то обычно принимается равной половине
наименьшего деления шкалы. Погрешность
приборов соответствует паспортному
значению лишь при правильном их
использовании.
Погрешность
весов зависит от их конструкции.
Погрешность мерной посуды, в соответствии
с ГОСТом, не должна превышать значений,
указанных в таблице 2. Погрешность
бюреток объёмом 50 и 25 мл равна соответственно
0,12 и 0,10 мл.
Погрешность
табличных величин учитывается так же,
как и погрешность результатов измерений.
При этом, если она не оговаривается, то
принимается равной половине единицы
последнего десятичного разряда. Например,
подвижность иона Н3О+
равна 349,8, следовательно, её абсолютная
погрешность 0,05.
Часто
некоторые величины приходится определять
графически, например, путем экстраполяции,
интерполяции, через тангенс угла наклона
линейного участка графика или касательной
к кривой. В подобных случаях при построении
графика необходимо выбрать такой
масштаб, чтобы график не был источником
значительной погрешности, т.е. для
построения необходим достаточно большой
лист бумаги1.
Таблица 2
Допустимая
абсолютная погрешность объема мерной
посуды
|
Колбы |
Пипетки с одной меткой |
Пипетки с подразделениями |
|||
|
Ёмкость, мл |
V, мл |
Ёмкость, мл |
V, мл |
Ёмкость, мл |
V, мл |
|
1000 500 250 200 100 50 |
0,60 0,30 0,20 0,20 0,20 0,10 |
50; 40 25 20; 15 10 5 2; 1 |
0,12 0,10 0,06 0,04 0,03 0,015 |
10 5 2 1 |
0,06 0,04 0,02 0,02 |
Если
точки графика укладываются
на прямую, т.е. выполняется уравнение
y
= а + bx,
то
для определения величин а
и b
выбирают на графике две точки с
координатами х1,у1
и
х2,у2
, расположенные,
по возможности, дальше друг от друга, и
константы а
и
b находят из
выражений
Погрешности
величин а и
b
можно найти, используя формулы (3) – (5)
таблицы 1, зная погрешности величин х
и у
и учитывая, что х
= хх.
Поскольку при определении х1
, у1
,х2 ,
и у2
производится отсчёт их значений на
координатных осях, результат отсчёта
содержит соответствующую погрешность,
равную половине наименьшего деления,
и которую необходимо прибавить к
погрешности величины, изображаемой на
оси.
Численные
значения величин, имеющих погрешность,
выражаются приближёнными
числами. Используя приближённые числа,
следует соблюдать определённые правила.
При записи приближённого числа
предпоследняя цифра должна быть точной,
а последняя – сомнительной (т. е. содержать
погрешность). Большее число цифр,
записанных с отступлением от этого
правила, не увеличивает точности.
Точность величины выражается числом
значащих цифр в её численном выражении.
Значащими2
цифрами являются все цифры приближённого
числа, записанного правильно, кроме
первых нулей. Нули в конце числа значащие,
если они стоят на своем месте, а не
записаны вместо отсутствующих цифр.
Так, числа 628, 6,28, 0,00628, 6,2810–5,
6,28104
содержат три значащие цифры. Если вместо
последнего из приведенных чисел записать
62800, в этом числе останется три значащие
цифры.
Произведение
и частное приближенных чисел должно
содержать столько значащих цифр, а сумма
и разность – столько знаков после
запятой, сколько их имеется в наименее
точном исходном числе. Например, 42,6
73,503 = 3,13103,
а не 3131,2278, и 36,823 – 22,4 = 14,4, а не 14,423. У
логарифма значащие только цифры мантиссы,
т.е. его дробной части1,
и последняя должна иметь столько цифр,
сколько их в логарифмируемом числе.
Поскольку при выполнении арифметических
действий погрешность накапливается,
необходимо стремиться сокращать, если
это возможно число таких действий. При
проведении цепочки вычислений оставляют
лишнюю цифру в промежуточных результатах,
конечный же результат округляется в
соответствии с изложенными выше
правилами. Применяя для вычислений
калькулятор, следует использовать его
память для исключения необоснованных
округлений промежуточных результатов.
В
качестве примера рассмотрим расчёт
относительной погрешности молярной
концентрации приготовленного раствора.
На технических весах взята навеска
хлорида натрия массой 3,28 г, которая была
растворена в воде в мерной колбе объёмом
250 мл. Молярная концентрация с
рассчитывается по уравнению
,
где
g
– масса навески, г, М
– молярная масса растворённого вещества,
V
– объём колбы, мл.
Как
следует из уравнений (4) и (5) таблицы 1,
относительная погрешность концентрации
равна сумме относительных погрешностей
всех величин, входящих в правую часть
формулы для концентрации. Однако 1000 –
число миллилитров в одном литре – по
определению величина точная, следовательно,
её погрешность равна нулю.
Относительная
погрешность массы навески g
равна отношению абсолютной погрешности
взвешивания g
к массе навески. Последняя же находится
как разность между массой навески вместе
с сосудом, в котором производилось
взвешивание (бюкс, стаканчик), и массой
пустого сосуда. Поэтому погрешность
массы навески рассчитывается по уравнению
(3) таблицы 1, в котором абсолютные
погрешности обоих взвешиваний одинаковы
(так как использовались одни и те же
весы) и равны 0,02 г для технических весов.
Следовательно, абсолютная погрешность
массы навески g
равна 20,02
= 0,04 г. Поэтому относительная погрешность
массы навески составляет 0,04: 3,28 = 0,012.
Молярная
масса вещества – постоянная величина,
поэтому часто студенты ошибочно считают
её точной. Однако атомные массы элементов
определены с большей или меньшей
погрешностью, которая для разных
элементов различна, что следует из
разного числа значащих цифр в их
величинах. Если молярная масса вещества
рассчитана по атомным массам элементов,
входящих в его состав, то для нахождения
относительной погрешности следует
воспользоваться формулой (2), причём
абсолютные погрешности атомных масс
элементов необходимо умножать на число
этих атомов в молекуле. Поэтому удобнее
брать величину молярной массы из
справочника. Тогда её абсолютная
погрешность равна пяти в первом
отсутствующем разряде. Молярная масса
хлорида натрия равна 58,44, следовательно,
её абсолютная погрешность составляет
0,005, а относительная погрешность –
0,005/58,44 = 0,000086.
В
соответствии с таблицей 2 абсолютная
погрешность объёма мерной колбы на
250 мл равна 0,20 мл, поэтому относительная
погрешность объёма составит 0,20:250 =
0,0008.
Суммируя
найденные погрешности, для относительной
погрешности концентрации приготовленного
раствора получим: 0,012 + 0,000086 + 0,0008 = 0,012886
0,013 = 1,3 %. Оценивая вклад погрешностей
исходных величин, можно заметить, что,
во-первых, погрешность концентрации
определяется, в основном, погрешностью
взвешивания. Если найденная погрешность
концентрации оказывается слишком
большой, то для её уменьшения необходимо
навеску брать с использованием
аналитических весов, погрешность
которых1
составляет 0,0002 г. Тогда относительная
погрешность массы навески составит
0,00012 и определяющей станет погрешность
объёма колбы. Если и теперь точность
определения концентрации окажется
недостаточной, необходимо калибровать
используемую мерную колбу, т.е. более
точно определить её объём. Методика
калибровки мерной посуды описана в
пособиях по аналитической химии.
Во-вторых,
все величины, используемые в расчётных
формулах, следует определять с максимально
возможной точностью, поскольку даже
одна величина, имеющая большую погрешность,
обесценивает труд по определению
остальных величин с высокой точностью.
В-третьих,
погрешность молярной массы в рассмотренном
примере практически не влияет на
погрешность концентрации. Это является
следствием большого числа значащих
цифр в величине М
по сравнению с другими величинами.
Отсюда следует, что если некоторые
величины, используемые в расчётной
формуле, содержат значащих цифр больше,
чем другие, т.е. являются более точными,
то их погрешность можно не учитывать,
считая их точными числами. Конечно, при
расчётах необходимо и использовать эти
величины с большим числом значащих
цифр, не округляя.
При
построении графиков необходимо правильно
выбрать размеры листа бумаги. Обе
координатные оси не должны сильно
различаться в размерах. Вместе с тем
всё поле графика должно быть использовано,
т.е. если первое значение координаты
точки сильно отличается от нуля, разметку
соответствующей оси необходимо начинать
с ближайшего меньшего целого значения.
При этом точка пересечения координатных
осей не будет соответствовать нулям на
осях координат.
Координаты
изображаемых точек не записываются на
осях координат, где необходимо указать
лишь целые значения изображаемой
величины, т.е. построить шкалу этих
значений. На осях должны быть указаны
обозначения величин и их размерность.
Точки
на графике должны быть выделены отчётливо.
Если изображается несколько зависимостей,
то точки каждой из них необходимо
изображать разными символами. Кривую
проводить плавно так, чтобы число точек,
не попадающих на кривую, по разные её
стороны было одинаково. Используя для
построения графиков компьютер, следует
не соединять точки между собой, а
аппроксимировать зависимость плавной
кривой, подобрав соответствующую
функциональную зависимость.
Одной
из наиболее удобных и распространённых
программ для построения графиков функций
и их обработке является компьютерная
программа Origin.
В настоящее время доступна седьмая
версия этой программы, которая имеет
незначительные отличия от предыдущей
шестой версии. Изменения коснулись в
основном стиля работы программы, он
стал более приближен к стилю, принятому
в программах Microsoft
Excel
и Microsoft
Word.
Несмотря на то, что работа в программе
Origin
рассматривается в курсах «Информатика»
и «Новые информационные технологии»
есть смысл кратко напомнить основные
моменты работы с данной программой, её
возможности, ограничившись при этом
лишь самыми необходимыми функциями.
Программа
Origin
позволяет строить различные двухмерные
графики в декартовой или полярной
системе координат, кроме того, имеется
возможность построения треугольных
диаграмм (используются для описания
поведения трехкомпонентных систем) и
трехмерных (3D)
поверхностей.
При
запуске Origin сначала открывается новое
окно в виде рабочего листа в рабочем
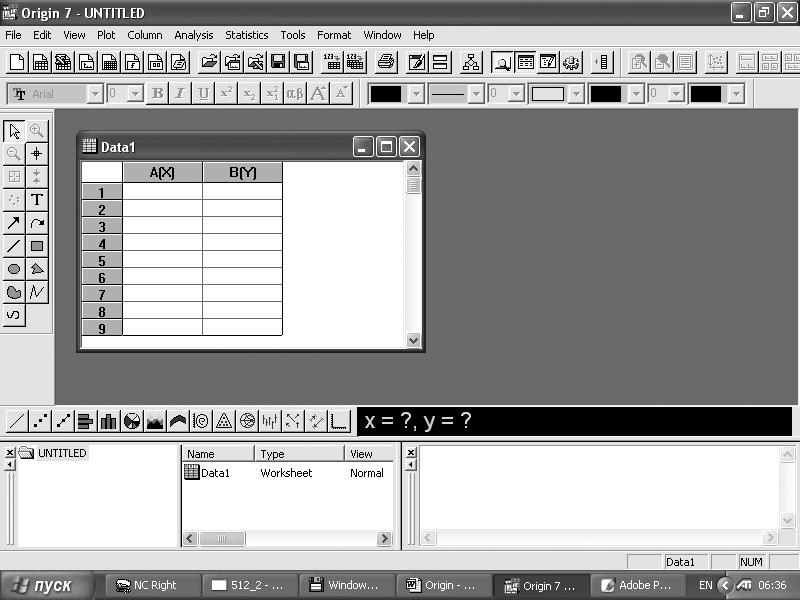
пространстве Origin. Рабочий лист (рис. 1)
является одним из типов окон, доступных
в этой программе. В самом верху окна в
строке заголовка указывается версия
Origin
7 и имя проекта (в
начальный момент Untitled
– без имени), в правом верхнем углу
расположены стандартные для WINDOWS
элементы управления, позволяющие
свернуть окно в кнопку на панели задач,
свернуть в окно и закрыть приложение.
Ниже
расположена стандартная для WINDOWS
строка меню: File,
Edit,
View,
Plot,
Column,
Analysis,
Statistics,
Tools,
Format,
Window,
Help,
элементы которого раскрываются после
щелчка по ним мышью. Перечень меню
меняется в зависимости от того, какое
окно активно. Под строкой меню расположены
кнопки быстрого доступа к определенным
функциям программы, например, сохранить
проект (кнопка с изображением дискеты),
распечатать (кнопка с изображением
принтера) и т.д. Узнать назначение той
или иной кнопки можно, поместив на неё
указатель мыши; при этом рядом с кнопкой
появляется соответствующее пояснение.
Количество выводимых кнопок может
меняться, в зависимости от настройки
конкретной программы, а доступ к
соответствующим функциям может быть
осуществлен через общее меню программы.
Ещё ниже находится
панель форматирования, позволяющая
выбрать шрифт надписей, его начертание
и размер, толщину линий.
Рис.1. Вид окна
программы Origin
В
основном поле окна находится Окно
рабочий лист
– пустая таблица со столбцами A[X]
и B[Y],
в каждую строку которых попарно вносятся
результаты измерений. При
необходимости количество столбцов
может быть добавлено, для чего необходимо
открыть меню Column
и щелкнуть мышью по пункту Add
New
Columns…
или, не заходя, в меню нажать комбинацию
клавиш Ctrl
+ D
(плюс в
данном случае означает одновременное
нажатие указанных клавиш). В поле
открывшегося окна Add
New
Columns
указать необходимое количество
добавляемых колонок.
При
наборе данных с клавиатуры или их
копировании из других приложений
(например, Excel)
необходимо помнить, что разделителем
целой и дробной части числа в программе
Origin
является точка, а не запятая, как во
многих русифицированных программах.
Набор запятой в числе в качестве
разделителя приводит к тому, что введенные
данные воспринимаются программой как
текстовые, а не числовые, без какой либо
диагностики. Ввод каждого числа в ячейку
заканчивается нажатием клавиши “Enter”,
при этом происходит переход к следующей
ячейке.
После
ввода всех исходных данных необходимо
построить график, для чего следует войти
в меню Plot
и выбрать в открывшемся перечне вариант
построения графика: только линии (Line),
только точки – маркеры (Skatter)
или маркеры, соединенные линиями (Line
+ Symbol).
Если планируется аппроксимировать
экспериментальные данные методом
наименьших квадратов, то целесообразно
строить только маркеры. Если под таблицей
в нижней части рабочего окна Origin
открыта панель кнопок 2D Graphs,
то для построения графика достаточно
щелкнуть указателем мыши по соответствующей
кнопке.
Открывается
окно Select
Columns
for
Plotting,
в котором необходимо выбрать, какая
колонка будет аргументом (ось X),
какая функцией (ось Y).
Для этого, щёлкнув в окне по названию
колонки значений аргумента (например,
A[X]),
щёлкнуть по кнопке <–>X
, находящейся рядом справа. Затем выбрать
щелчками колонку функции (например,
B[Y]) и кнопку <–>Y
.После нажатия на кнопку “OK”
мышью появляется окно Graph,
в котором будет построен график. Один
из вариантов построения представлен
на рис.2.
В
рабочем окне Origin
одновременно может быть отображено
несколько окон, но активным может быть
только одно. Для того, чтобы сменить
активное окно, необходимо щелкнуть
мышью по нужному окну. Любое окно может
быть свернуто кнопкой и тогда оно не
заслоняет другие окна, либо развернуто
во всю площадь окна Origin
(соответствующие элементы управления
находятся в правом верхнем углу). В тех
случаях, когда на одном графике
представлено несколько зависимостей,
для редактирования, аппроксимации,
сглаживания и других типов обработки,
необходимо выделить активный набор
данных, для чего нужно зайти в меню
“Data”,
если активно окно Graph
и выбрать из представленных там наборов
данных.
Для
аппроксимации экспериментальных данных
методом наименьших квадратов необходимо
выделить активный набор данных (если
их несколько) и зайти в меню “Analysis”,
где из списка выбрать подходящую функцию
из набора, либо задать пользовательскую
функцию. После выполнения расчётов
выдается отчёт, в котором указывается
вид функции и значения всех её
коэффициентов. Сама аппроксимирующая
кривая обычно строится красным цветом,
который может быть изменен пользователем.

Рис.2
График
функции, построенный в Origin,
не имеет подписей под координатными
осями (точнее, там указано, что это
соответственно ось X
и ось Y).
Для изменения подписей необходимо
щелкнуть по ним указателем мыши, при
этом становится активной панель
форматирования. После чего можно набирать
на клавиатуре название осей. Необходимо
помнить, что в программе Origin
для перехода на русский язык недостаточно
переключить клавиатуру, надо выбрать
шрифт, поддерживающий кириллицу (типа
“Courier
New
Cyr“
или другой, но обязательно Cyr).
Origin позволяет в произвольном месте
графика выполнить любую надпись, для
этого необходимо щелкнуть по кнопке с
буквой T на панели Tools
и набрать текст, который можно перетащить
мышью в любое место.
При
сохранении информации вся работа в
данной секции сохраняется, как проект
Origin.
Он включает в себя все окна на экране
(включая также свернутые окна) а также
все файлы, связанные с информацией в
окнах. Кроме сохранения проектов, можно
также сохранить окно или шаблон как
отдельный файл.
How to Calculate Experimental Error in Chemistry
Updated on September 08, 2019
Error is a measure of accuracy of the values in your experiment. It is important to be able to calculate experimental error, but there is more than one way to calculate and express it. Here are the most common ways to calculate experimental error:
Error Formula
In general, error is the difference between an accepted or theoretical value and an experimental value.
Error = Experimental Value — Known Value
Relative Error Formula
Relative Error = Error / Known Value
Percent Error Formula
% Error = Relative Error x 100%
Example Error Calculations
Let’s say a researcher measures the mass of a sample to be 5.51 grams. The actual mass of the sample is known to be 5.80 grams. Calculate the error of the measurement.
Experimental Value = 5.51 grams
Known Value = 5.80 grams
Error = Experimental Value — Known Value
Error = 5.51 g — 5.80 grams
Error = — 0.29 grams
Relative Error = Error / Known Value
Relative Error = — 0.29 g / 5.80 grams
Relative Error = — 0.050
% Error = Relative Error x 100%
% Error = — 0.050 x 100%
% Error = — 5.0%
Суммирование погрешностей
В химических методах количественного химического анализа -гравиметрии и тириметрии в расчетах используют в основном суммы, разности, произведения и частные измеренных величин, определение каждой из которых содержит свою погрешность. Возникает задача вычисления суммарной погрешности, решение которой зависит от вида погрешностей и выполняемых арифметических действий с полученными значениями. В данном пособии рассмотрим суммирование погрешностей только для перечисленных арифметических действий. Правила суммирования представлены в табл. 9.1.
Таблица 9.1
Правила суммирования погрешностей
Примечание: суммарную систематическую погрешность рассчитывают по формулам столбца 1, если известны и величина, и знаки отдельных составляющих; если знаки неизвестны, расчет проводят по формулам столбца 2. Определив абсолютную погрешность, можно рассчитать относительную и наоборот.
Пример 9.8.
Вычислите абсолютную и относительную систематические погрешности взвешивания гравиметрической формы 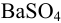
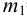
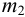
Решение:
Массу гравиметрической формы вычисляем по разности взвешиваний:
Используя правило сложения систематических погрешностей для разности при известном знаке составляющих (колонка 1 табл. 9.1), получаем:
Следует обратить внимание на то, что при использовании одних и тех же гирь при взвешивании тигля с осадком и без него систематическая погрешность уменьшается.
Найдем относительную погрешность определения массы гравиметрической формы:
Пример 9.9.
Рассчитайте систематическую погрешность (абсолютную и относительную) концентрации 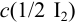
Решение:
Концентрацию раствора рассчитываем по формуле:
В соответствии с законом распространения систематических погрешностей относительная погрешность частного при известных знаках определяется равна разности относительных погрешностей делимого и делителя, а произведения — сумме (табл. 9.1, колонка 1):
Поскольку погрешность определения молярной массы мала по сравнению с другими погрешностями, ее вкладом пренебрегаем. Найдем относительную погрешность величины концентрации:
Абсолютная погрешность концентрации составляет:
Пример 9.10.
Рассчитайте максимально допустимое относительное стандартное отклонение при определении массовой доли серы в пересчете на 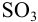
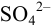
Решение:
При осаждении 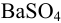
где 
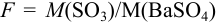
С учетом правила суммирования случайных погрешностей для произведения и частного (табл. 9.1) относительное стандартное отклонение результата можно выразить формулой:
При этом пренебрегаем погрешностью гравиметрического фактора
Масса гравиметрической формы 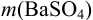
где 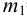
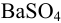
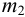
Аналогично берут навеску пробы. Погрешность взвешивания примерно одинакова в обоих случаях: 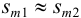
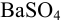
При взвешивании тигля до постоянной массы погрешность взвешивания составляет 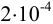
Абсолютная погрешность взятия навески иода на аналитических весах:
Из табл. 11 приложения берем соответствующие допуски мерной посуды и подставляя в формулу (9,6) вычисляем максимально возможное относительное стандартное отклонение результата:
Пример 9.11.
Рассчитайте максимальную допустимую погрешность (абсолютную и относительную) концентрации 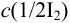
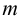
Решение:
Вычисление проводим с учетом примера 9.9, где найдена концентрация 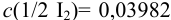
Очевидно, что измерение объема вносит больший вклад в погрешность. Вычислим максимально допустимую абсолютную погрешность:
Пример 9.12.
Определите относительную и абсолютную погрешность концентрации раствора тиосульфата, если она устанавливалась по раствору иода, приготовленному как в примере 9.11, по результатам одного титрования аликвоты иода тиосульфатом (расход тиосульфата 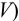
Решение:
Концентрацию тиосульфата вычисляем по формуле (гл. 8):
Расчет относительной погрешности проводим с учетом вклада всех измеряемых составляющих, упуская малую погрешность молярной массы:
Из расчета следует, что наибольший вклад в погрешность вносит объем титранта, и с его увеличением погрешность уменьшается. Если титрование повторять 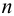
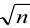
Абсолютная случайная погрешность определения концентрации 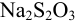
Пример 9.13.
Проведите расчет погрешности результата анализа образца на содержание 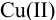
Навеску образца 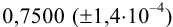
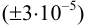
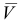
Решение:
Рассчитаем стандартное отклонение объема тиосульфата:
Массовую долю меди вычислим по формуле:
С учетом погрешностей входящих в формулу величин рассчитаем относительную погрешность содержания меди:
Абсолютная погрешность:
Тогда можно представить результат определения массовой доли меди как 53,27±0,18 (%).
Эти примеры взяты со страницы примеров решения задач по аналитической химии:
Решение задач по аналитической химии
Возможны вам будут полезны эти страницы:
Как рассчитать экспериментальную ошибку в химии
На чтение 1 мин. Просмотров 375 Опубликовано 05.06.2021
Ошибка – это мера точности значений в вашем эксперименте. Важно уметь вычислить экспериментальную ошибку, но есть несколько способов ее вычислить и выразить. Вот наиболее распространенные способы вычисления экспериментальной ошибки:
Содержание
- Формула ошибки
- Формула относительной ошибки
- Формула процента ошибки
- Пример расчета ошибки
Формула ошибки
В общем, ошибка – это разница между принятым или теоретическое значение и экспериментальное значение.
Ошибка = экспериментальное значение – известное значение
Формула относительной ошибки
Относительная ошибка = ошибка/известное значение
Формула процента ошибки
% Error = относительная ошибка x 100%
Пример расчета ошибки
Допустим, исследователь измеряет массу образца, который должен быть 5,51 грамм. Известно, что фактическая масса образца составляет 5,80 грамма. Рассчитайте погрешность измерения.
Экспериментальное значение = 5,51 грамма
Известное значение = 5,80 грамма
Ошибка = экспериментальное значение – известное значение
Ошибка = 5,51 г – 5,80 грамма
Ошибка = – 0,29 грамма
Относительная ошибка = ошибка/известное значение
Относительная ошибка = – 0,29 г/5,80 г
Относительная ошибка = – 0,050
% Error = относительная ошибка x 100%
% Error = – 0,050 x 100%
% Error = – 5,0%