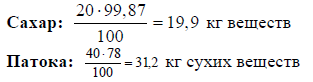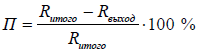Относительный выход
Cтраница 1
Относительный выход растворимого и нерастворимого полимеров регулируется исходным сырьем. Неорганические продукты отделяются от смол фильтрованием. При повторной обработке твердого остатка разбавленной кислотой с последующим отмыванием неорганической смолы на фильтре остаются белые крупинки нерастворимого полимера. Растворимый полимер находится в фильтрате, выделяется из него отгонкой растворителя при возможно низкой температуре. Обычно применяют перегонку в вакууме. Последние следы высококипящего масла удаляют, пропуская перегретый пар прямо в горячую расплавленную смолу. До известного предела твердость смолы регулируется прибавлением перегретого пара.
[1]
Малый относительный выход этих пар свидетельствует, по-видимому, о том, что реакция протекает с значительной энергией активации.
[2]
Относительный выход изомеров зависит от потенциала электрода, температуры, рН и состава раствора.
[4]
Относительный выход изомеров не зависит от длины волны излучения.
[5]
Относительный выход радикалов представлен в виде [ G ( C6H10) G ( C12H22) — 0 96 ] / [ G ( C6H10) e G ( C12H22) e — 0 96 ], где е означает выход при воздействии быстрых электронов.
[6]
Относительный выход W является мерой правильности проведения процесса.
[7]
Относительный выход радикалов представлен в виде [ 0 ( С Н10) G ( C12H22) — 0 96 ] / [ G ( CeH10) c G ( C12H22) e — 0 96 ], где е означает выход при воздействии быстрых электронов.
[9]
Относительный выход ионов C1J повышается, если происходит отрыв двух атомов С1 от разных атомов углерода, вследствие стабилизации нейтрального фрагмента путем образования дополнительной связи между атомами углерода.
[10]
Относительный выход элементов с различными массовыми числами при делении урана под действием медленных нейтронов сейчас исследован более детально [ см. УФН 33, вып. Минимальный выход приходится на массовое число 117 ( примерно 10 — 20 / о всех делений), наибольший выход — на массовые числа от 90 до 100 и соответственно от 134 до 144 ( примерно, 5 — 7 % всех делений на каждое из массовых чисел в этих промежутках) и резко падает вне этих интервалов.
[11]
Относительный выход W является мерой правильности проведения процесса.
[12]
Относительный выход продуктов гидролиза существенно зависит от концентрации кислоты.
[14]
Страницы:
1
2
3
4
5
Расчетные задачи типа «Определение выхода продукта реакции в процентах от теоретического»
Признак
В условии задачи встречается слово «выход». Теоретический выход продукта всегда выше практического.
Понятия «теоретическая масса или объём, практическая масса или объём» могут быть использованы только для веществ-продуктов.
Доля выхода продукта обозначается буквой
(эта), измеряется в процентах или долях.
Также для расчётов может использоваться количественный выход:
I. Первый тип задач
Известны масса (объём) исходного вещества и масса (объём) продукта реакции. Необходимо определить выход продукта реакции в %.
Задача 1. При взаимодействии магния массой 1,2 г с раствором серной кислоты получили соль массой 5, 5 г. Определите выход продукта реакции (%).
| 1. Записываем краткое условие задачи |
Дано: m (Mg) = 1,2 г m практическая(MgSO4) = 5,5 г _____________________ Найти: |
|
2. Запишем УХР. Расставим коэффициенты. Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции. |
|
| 3. Находим по ПСХЭ молярные массы подчёркнутых веществ |
M(Mg) = 24 г/моль M(MgSO4) = 24 + 32 + 4 · 16 = 120 г/моль |
|
4. Находим количество вещества реагента по формулам |
ν(Mg) = 1,2 г / 24(г/моль) = 0,05 моль |
| 5. По УХР вычисляем теоретическое количество вещества (νтеор) и теоретическую массу (mтеор) продукта реакции |
m = ν · M mтеор (MgSO4) = M(MgSO4) · νтеор (MgSO4) = = 120 г/моль · 0,05 моль = 6 г |
|
6. Находим массовую (объёмную) долю выхода продукта по формуле |
Ответ: Выход сульфата магния составляет 91,7% по сравнению с теоретическим |
II. Второй тип задач
Известны масса (объём) исходного вещества (реагента) и выход (в %) продукта реакции. Необходимо найти практическую массу (объём) продукта реакции.
Задача 2. Вычислите массу карбида кальция, образовавшегося при действии угля на оксид кальция массой 16,8 г, если выход составляет 80%.
|
1. Записываем краткое условие задачи |
Дано: m(CaO) = 16,8 г
___________________ Найти: m практ (CaC2) = ? |
|
2. Запишем УХР. Расставим коэффициенты. Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции. |
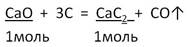 |
|
3. Находим по ПСХЭ молярные массы подчёркнутых веществ |
M(CaO) = 40 + 16 = 56 г/моль M(CaC2) = 40 + 2 · 12 = 64г/моль |
|
4. Находим количество вещества реагента по формулам |
ν(CaO)=16,8 (г) / 56 (г/моль) = 0,3 моль |
|
5. По УХР вычисляем теоретическое количество вещества (νтеор) и теоретическую массу (mтеор) продукта реакции |
|
|
6. Находим массовую (объёмную) долю выхода продукта по формуле |
m практич (CaC2) = 0,8 · 19,2 г = 15,36 г Ответ: m практич (CaC2) = 15,36 г |
III. Третий тип задач
Известны масса (объём) практически полученного вещества и выход этого продукта реакции. Необходимо вычислить массу (объём) исходного вещества.
Задача 3. Карбонат натрия взаимодействует с соляной кислотой. Вычислите, какую массу карбоната натрия нужно взять для получения оксида углерода (IV) объёмом 28,56 л (н. у.). Практический выход продукта 85%.
| 1. Записываем краткое условие задачи |
Дано: н. у. Vm = 22,4 л/моль Vпрактич(CO2) = 28,56 л = 85% или 0,85 ____________________ Найти: m(Na2CO3) =? |
| 2. Находим по ПСХЭ молярные массы веществ, если это необходимо | M (Na2CO3) =2·23 + 12 + 3·16 = 106 г/моль |
|
3. Вычисляем теоретически полученный объём (массу) и количество вещества продукта реакции, используя формулы: |
Vтеоретич(CO2) = = 28,56 л / 0,85 = 33,6 л ν(CO2) = 33,6 (л) / 22,4 (л/моль) = 1,5 моль |
|
4. Запишем УХР. Расставим коэффициенты. Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции. |
|
| 5. Находим количество вещества реагента по УХР |
По УХР:
ν(Na2CO3) = ν(CO2) = 1,5 моль |
|
6. Определяем массу (объём) реагента по формуле: m = ν · M V = ν · Vm |
m = ν · M m(Na2CO3) = 106 г/моль · 1,5 моль = 159 г |
IV. Решите задачи
Задача №1. При взаимодействии натрия количеством вещества 0, 5 моль с водой получили водород объёмом 4,2 л (н. у.). Вычислите практический выход газа (%).
Задача №2. Металлический хром получают восстановлением его оксида Cr2O3 металлическим алюминием. Вычислите массу хрома, который можно получить при восстановлении его оксида массой 228 г, если практический выход хрома составляет 95 %.
Задача №3. Определите, какая масса меди вступит в реакцию с концентрированной серной кислотой для получения оксида серы (IV) объёмом 3 л (н.у.), если выход оксида серы (IV) составляет 90%.
Задача №4. К раствору, содержащему хлорид кальция массой 4,1 г, прилили раствор, содержащий фосфат натрия массой 4,1 г. Определите массу полученного осадка, если выход продукта реакции составляет 88 %.
Проведение практических работ
в форме количественного
химического эксперимента
Мы постоянно говорим, утверждаем и доказываем,
что химия – наука экспериментальная, точная
(количественная). Программой обучения химии
предусмотрено решение задач определенного
содержания, проведение лабораторных и
практических работ, демонстрационных
экспериментов (все это в идеале!).
Одна из разновидностей количественных задач
школьного уровня – расчет выхода продукта
реакции (исходные данные могут быть разными).
Обычно эти задачи являются комбинированными, т.е.
включают расчетные действия, предусмотренные в
более простых ситуациях [1, 2].
Есть прекрасная возможность оптимизировать
преподавание химии, соединив в единый процесс
количественное получение органического
вещества и осуществление необходимых расчетных
действий. При этом достигаются различные учебные
ц е л и: формирование у учащихся
представлений о лабораторном химическом
синтезе, умений и навыков в проведении
химического эксперимента; формирование
потребности в химических знаниях, ориентация на
химические профессии; и – реализация
программных требований – проведение конкретной
практической работы.
Проиллюстрируем сказанное на примере практической
работы «Получение сложного эфира».
Учащиеся заранее получают задание
подготовиться к практической работе (по учебнику
Л.А.Цветкова [3], учебникам Г.Е.Рудзитиса и
Ф.Г.Фельдмана или Н.Н.Буринской и Л.П.Величко) и
решить задачу.
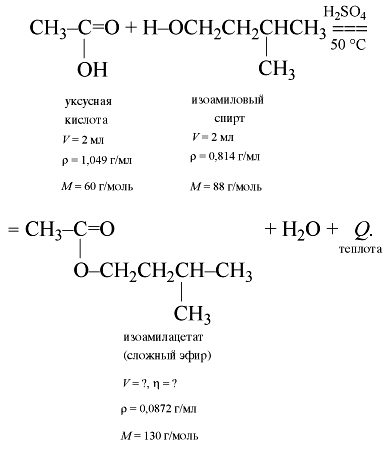
Задача. Смешали 30 г этанола с 30 г
уксусной кислоты. Рассчитать массу
образовавшегося сложного эфира, если выход
продукта составил 85%.
Решение
Уравнение реакции:
Допустив, что кислота полностью вступила в
реакцию, рассчитываем по уравнению химической
реакции массу спирта:
Анализ показывает, что спирт взят в избытке.
По массе кислоты рассчитываем теоретический
выход продукта (эфира):
Подставив в формулу относительного выхода
продукта имеющиеся физические величины, находим
массу эфира, которая составляет практический
выход продукта:
откуда
При проверке тетрадей по химии [4] учитель
смотрит, как решена эта задача, сверяя ход
решения и результат со своими записями в
конспекте к уроку.
Практическая работа
В устойчивый штатив помещены (заблаговременно,
трудами лаборанта) три пробирки. Первая пробирка
– реактор с 2 мл ледяной уксусной кислоты –
закрыта пробкой с газоотводной
трубкой. Во вторую пробирку налито 2 мл
изоамилового спирта (использование этого спирта
объясняется тем, что он был доступен: в городе
функционировал молокозавод; кроме того,
упрощалась технология, и не менее важно –
получался продукт с очень приятным запахом).
Третья пробирка с 1 мл концентрированной серной
кислоты закрыта пробкой или плотным комком
технической ваты.
Изоамиловый спирт переливают в
пробирку-реактор, смесь перемешивают легкими
ударами большого или указательного пальца одной
руки, при этом другая рука держит у горла
пробирку тремя пальцами (учитель все показывает,
и только после этого учащиеся повторяют за ним
описанные действия – независимо от того, что у
учащихся имеется личный опыт, сформированы
умения и навыки при обращении с химическим
оборудованием).
Аккуратно, по стенке, в смесь приливают серную
кислоту, после чего к реактору присоединяют
газоотводную трубку (рис. 1). Она выполняет роль
воздушного холодильника и служит физическим
препятствием при маловероятном, но все же
возможном выбросе агрессивной реакционной
массы. Теперь уже смесь трех веществ, с еще
большей осторожностью, перемешивают, а
выделяющуюся теплоту отводят рукой,
охватывающей реактор в зоне протекания
химической реакции.
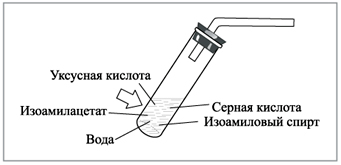 |
Рис. 1. Пробирка-реактор для получения
|
Далее реактор несколько секунд
нагревают в горячей зоне пламени, помешивают при
помощи руки и контролируют температуру (около 50
°С). Это прикидка, проверенная многолетней
практикой. Если горячо, плотным кольцевым
поглаживанием тепло отводится. Если рука
чувствует только тепло, нагревание продолжается.
Перемешивание – нагревание – охлаждение с
непостоянной периодичностью длится 5 мин. Весь
этот период пробку с газоотводной трубкой
придерживают указательным пальцем руки (если
этого не делать, она может отделиться).
В химический стакан вместимостью 100–150 мл на
1/3 объема наливают водопроводную (еще лучше
колодезную) воду. Осторожно выливают туда
реакционную массу. Для уменьшения потерь
продукта реакции в освобожденный реактор
наливают воду (не больше половины по высоте
пробирки), после чего содержимое пробирки также
выливают в химический стакан. (В пробирку из-под
серной кислоты наливают небольшое количество
дистиллированной воды и затем сливают в
специальную емкость – далее полученный раствор
находит применение для самых разных целей.)
Содержимое химического стакана перемешивают
стеклянной палочкой, после чего системе дают
возможность отстояться (рис. 2). Уже на этом этапе
ощущается специфический запах (груши) продукта
реакции.
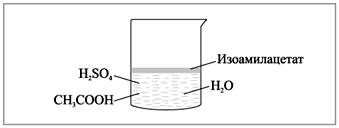 |
Рис. 2. Химический стакан
|
Для отделения эфирного слоя от
остальной части смеси используют делительную
воронку. Это очень ответственный этап
практической работы, т.к. можно потерять часть
продукта реакции этерификации.
Полученный эфир сливают в «мерник» (рис. 3).
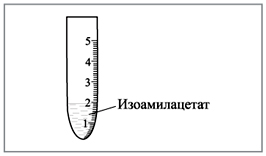 |
Рис. 3. Пробирка-мерник для
|
Учащиеся работают в па’рах, они
подходят к учителю и показывают, какой объем
эфира получен; учитель фиксирует их результат в
своем конспекте.
На демонстрационном столе стоит склянка с
чистым изоамилацетатом. Учитель обращает
внимание на цвет продукта синтеза
(слабокоричневый) и образца (бесцветный).
Различие в окрашивании объясняется осмолением;
для получения чистого продукта необходима
перегонка.
Результаты опытов учащиеся заносят в
информационную таблицу, которая нарисована на
доске (табл. 1).
Таблица 1
Данные по процессу получения
изоамилацетата
| Вещество | Плотность, г/мл |
Объем, мл |
Молярная масса, г/моль |
Выход продукта, % |
| 1. Изоамиловый спирт | 0,814 | 2 | 88 | – |
| 2. Уксусная кислота | 1,049 | 2 | 60 | – |
| 3. Изоамилацетат | 0,872 | ? опыт |
130 | ? расчет |
Для осуществления расчетных действий
учащиеся записывают уравнение реакции:
Учащимся разрешается пользоваться
округленными значениями плотностей. Они должны
определить массу исходных веществ и перевести
эти массы в количество вещества:
m(кислоты) = •V = 1,049•2 = 2,098 г,
(кислоты)
= 2,098/60 = 0,035 моль;
m(спирта) = 0,814•2 = 1,628 г,
(спирта)
= 1,628/88 = 0,0185 0,02 моль.
Из анализа полученных данных и уравнения
реакции вытекает, что кислота дана в избытке.
Расчеты выхода продукта реакции ведем по спирту.
По уравнению химический реакции теоретически
должно получиться 0,02 моль
эфира.
mтеор(эфира) = 0,02•130 2,6 г,
V(эфира) = 2,6/0,872 3 мл.
А сколько получилось на самом деле эфира?
За каждым столом – свой результат,
который во многом зависит от
экспериментальных навыков юных химиков.
Практически учащиеся получают приблизительно
от 1 мл до 2 мл эфира и более.
По формуле выхода продукта рассчитывают
относительный выход продукта в процентах:
Чтобы облегчить себе работу при проверке
правильности расчетов, удобно пользоваться
таблицей (табл. 2).
Таблица 2
Определение относительного выхода
изоамилацетата по его объему
| Объем, мл | Выход, % | Объем, мл | Выход, % | Объем, мл | Выход, % |
| 0,1 | ~ 4 | 1,1 | ~ 44 | 2,1 | ~ 84 |
| 0,2 | ~ 8 | 1,2 | ~ 48 | 2,2 | ~ 88 |
| 0,3 | ~ 12 | 1,3 | ~ 52 | 2,3 | ~ 92 |
| 0,4 | ~ 16 | 1,4 | ~ 56 | 2,4 | ~ 96 |
| 0,5 | ~ 20 | 1,5 | ~ 60 | 2,5 | 100 |
| 0,6 | ~ 24 | 1,6 | ~ 64 | – | |
| 0,7 | ~ 28 | 1,7 | ~ 68 | – | |
| 0,8 | ~ 32 | 1,8 | ~ 72 | – | |
| 0,9 | ~ 36 | 1,9 | ~ 76 | – | |
| 1,0 | ~ 40 | 2,0 | ~ 80 | – |
За данную практическую работу учащиеся
получают две оценки: одна – за экспериментальную
часть, вторая – за знание теории. Во время
проведения практической работы соблюдаются все
правила поведения на уроке, и поскольку этот урок
обучающий, учащиеся не ограничены в
использовании информационного материала, в
общении с соседом, они могут полностью проявить
свою творческую самостоятельность. При проверке
тетрадей учитель (в силу своей педагогической
зоркости) учитывает все нюансы – все, что
позволяет сделать правильное умозаключение,
справедливое и объективное.
* * *
Автор знаком практически со всеми публикациями
в методической литературе, предназначенной
учителю химии, за последние 40 лет, но не
встречался с аналогом данного материала. Это
дает моральное право претендовать на новизну
идеи, которая десятилетиями «прокручивалась» в
личном опыте и начиналась с практической работы
по получению нитробензола и бромэтана.
Считаю своим долгом публично поделиться
опытом. Не исключаю, что этот опыт – не
единственное явление в реальном обучении химии.
Л и т е р а т у р а
1. Шмуклер Е.Г. Решение многоходовых
количественных задач. Химия (ИД «Первое
сентября»), 2004, № 42, с. 10–13.
2. Шмуклер Е.Г. Развитие у учащихся умений и
навыков в решении типовых задач в IХ и X классах.
Химия в школе, 1989, № 2, с. 64–74.
3. Цветков Л.А. Органическая химия. Учебник
для 10 класса средней школы. М.: Просвещение, 1988, с.
137–139, 231.
4. Шмуклер Е.Г. К вопросу об ученических
тетрадях по химии. Химия (ИД «Первое сентября»),
2006, № 5, с. 26–29.
Е.Г.ШМУКЛЕР,
заслуженный учитель Украины
(г. Славута, Украина)
На рис. 1Х-10, а приведены значения р, соответствующие 5%-ному отклонению выхода относительно предельного случая Р = 0 на рис. 1Х-10,б — относительно с р = оо. Рис. 1Х-11 демонстрирует значения р, для которых оптимальная высота является наибольшей эти значения следует использовать при отсутствии сведений о величине Е , что дает прп расчете некоторый запас. [c.410]
Превращение Выход, % Относительная [c.179]
Для дальнейшего рассуждения удобно заменить все [Р,] на выходы , относительно исходного вещества Aj, вместо концентрации Ai ввести долю непрореагировавшего Aj, а отношение констант заменить на относительные константы И , т. е. ввести безразмерные величины [c.262]
По этому методу получались большие выходы относительно чистых лигносульфоновых кислот с нормальным содержанием метоксилов, чем по ранее применявшимся методам. Содержание метоксилов и серы, спектры ультрафиолетового поглощения эфирных и спиртовых экстрактов соответствовали данным для лигносульфоновых кислот. [c.126]
Из сепаратора 14 выходят два трубопровода 13 и 15. По трубопроводу 15 выходят относительно крупные частицы, а по трубопроводу 13 — более мелкие частицы. Размер этих частиц обычно не превышает 50 мкм, в то время как в первой фазе размер частиц достигает 250 мкм. Было установлено, что вторая фаза имеет относительно большую концентрацию оксида кальция и меньшее содержание золы, чем первая фаза обычно во второй фазе присутствует 40—75 % от общего количества оксида кальция. [c.249]
Выход относительно высок 1,0—1,4 кг из ЮО кг крапивы, но содержание чистого хлорофилла не выше 70—80% и цвет продукта с желтоватым оттенком. Его смешивают с жиром и ставят на желаемую степень окраски (об этом см. ниже, п. 2). [c.311]
Решая систему (VI, 1) получим выхода (относительные и абсолютные) конечных продуктов из аппаратов главной линии и продуктов, представляющих собой сопряженный рециркулят и направляемых на переработку в отдельные блоки этой комбинированной системы. [c.183]
Основными параметрами сушильного агента являются его расход и температура на входе и выходе относительная влажность. [c.167]
Условия крекинга Выход Относительное [c.26]
Во время испытаний следует соблюдать погрешности измерения определяемых величин в допустимых пределах. Точки измерения выбирают таким образом, чтобы показания соответствовали фактическим в процессе эксплуатации. Если по техническим причинам приемочные испытания нельзя проводить на опытном образце насоса, то договариваются об испытаниях модели. Причем масштаб модели выбирают таким, чтобы обеспечивались соответствующие точность изготовления и качество обработки поверхности, а также имелась возможность пересчета полученных значений, Модель должна быть идентична опытному образцу от входа (включая линию всасывания) до выхода относительно всех деталей проточной части. Это требование относится также ко всем зазорам. Масштаб модели не должен быть меньше 1 4, [c.159]
Идея об основной роли процессов рекомбинации электронов и положительных дырок в явлениях люминесценции чистых окрашенных щелочно-галоидных кристаллов была впервые высказана автором в 1947 году [72]. В этих кристаллах процессы рекомбинации электронов и положительных дырок сопровождаются люминесценцией с небольшим выходом относительно F -центров. Впоследствии эта точка зрения развивалась в ряде работ, посвященных исследованию люминесценции чистых кристаллов щелочно-галоидных соединений [134, 142, 205, 221, 228, 231, 232]. Аналогичный механизм предложен в последнее время также для объяснения свечения типичных фосфоров [234, 233]. [c.247]
К аналогичным результатам приводит наличие у многих изотопов метастабильных состояний. Так, например, при облучении элементоорганических соединений германия медленными нейтронами выход сравнительно короткоживущего изотопа Ое ( 91%) значительно превышает выход относительно долгоживущего изотопа Ое ( 60%). Это явление объясняется наличием у Ое » короткоживущего метастабильного состояния. [c.257]
Продукты деления Независимый выход, % Относительный выход (доля от выхода всей цепочки с данным А) [c.553]
Получить гипс путем обработки паром под давлением можно в различных аппаратах. В запарочном аппарате последовательно протекают процессы обработки материала паром под давлением и удаления выделившейся воды путем сушки. В аппарат подают дробленый гипсовый камень с размером кусков 0,015—0,04 м, обрабатывают его насыщенным паром под давлением 0,23 МПа и при температуре 397 К в течение 5—8 ч. После этой обработки материал в аппарате немедленно продувают (сушат) горячими топочными газами с температурой 393—433 К в течение 3—5 ч до тех пор, пока из выхлопной трубы не будет выходить относительно сухой воздух. Полученный материал подвергают помолу. [c.32]
В отчете следует указать также все известные методы синтеза с соответствующими литературными ссылками. Отчет должен содержать краткое обоснование выбранного метода синтеза и подробное описание его практического выполнения со всеми наблюдениями, отраженными в лабораторном журнале. Для каждой стадии рассчитывают выход веществ кроме того, после описания последней стадии приводят и суммарный выход — относительно количеств веществ, взятых для первой стадии. В заключение отчета следует обсудить проведенный опыт и сравнить полученные результаты с указанными в литературе. [c.193]
Наряду с водородом, циклогексеном и дициклогексилом при облучении жидкого циклогексана образуются некоторые другие продукты. Однако их выходы относительно малы. Образование этих продуктов требует разрыва одной и более связей С—С, тогда как основные продукты образуются в результате разрыва связи С—Н. Наиболее полный анализ продуктов проведен Хо и Фрименом [69]. Их результаты приведены в табл. 4.5. Среди продуктов радиолиза [c.175]
Угол выхода относительной скорости ги [c.257]
Р1 Угол выхода относительной скорости Wg с учетом конечного числа лопаток [c.257]
В результате электролиза водных растворов азидов с использованием различных металлических анодов образуется главным образом азот наряду с некоторым количеством аммиака и гидразина. Выходы относительно малы [36]. [c.21]
Если речь идет о крупном современном производстве, то задача построения даже статической модели ХТС оказывается весьма громоздкой. Поэтому при текущем планировании, а в ряде случаев даже при оперативном управлении по большей части пренебрегают динамическими свойствами отдельных установок, проявляющимися в инерционности процессов, запаздывании выхода относительно входа ИТ. п. это требуется уже хотя бы для того, чтобы вместо динамической модели ХТС получить статическую модель (IV. ). Элементарная динамическая модель может быть записана в виде [c.73]
А общий квантовый выход относительно вещества С находим путем деления (Х.15) на скорость поглощения света (/а) [c.266]
Очевидно, что общий квантовый выход относительно С выразится [c.266]
Окисление в присутствии бромистого водорода [18] не только характеризуется реакциями, не приводящими к разрыву углеродной цепи, но в некоторых случаях ведет к образованию продуктов, не получающихся в достаточном количестве при обычных окислительвых реакциях. Кроме того, высокие выходы относительно простых смесей получаются в этом случае нри температурах, намного ниже применяемых обычно для окисления углеводородов. [c.274]
В зависимости от числа подсоеднннтельньгх патрубков для прохода среды всю арматуру можно разделить на двухходовую и многоходовую. Двухходовая арматура по направлению движения среды на выходе относительно направления движения на входе делится на проходную и угловую. [c.89]
К достоинствам фотоэлектрическнх приемников излучения следует отнести большой диапазон линейности сигнала на выходе относительно количества падающего излучения чувствительность в широком диапазоне длин волн оперативность получения информации возможность регистрировать очень малые количества квантов излучения вплоть до регистрации отдельных фотонов. [c.26]
На Рисунке 7 даны отношения выхода к октану для периода каждой технологии в добавление к рисунку 6. Эти кривые показывают увеличетше КПД реакции. Из-за реакций крекинга отношение выхода к октану периода 50-ых г.г. по эффективности было гораздо ниже чем эта теоретическая основа. Потеря выхода юдорода также происходит в результате потребления юдорода в реакциях крекинга. Например, на установке 50-ых гх. при октане 90 потеря выхода относительно теоретического составляет более [c.36]
Ферритометр обеспечивает непрерывное измерение содержания ферритной фазы, что позволяет значительно увеличить производительность контроля. Диапазон измерений прибора от 0,5 до 60%, габаритные размеры 300x250x 120 мм он предназначен для измерения в лабораторных и цеховых условиях как на образцах, так и непосредственно на изделиях. Прибор снабжен световым сигнализатором превышения контролируемого параметра (б-фазы) с регулируемым порогом срабатывания и имеет релейный выход относительная погрешность измерения не более 10%. Масса прибора 3 кг. [c.146]
Если в смеси имеется только 1% хлорбензола, то количество бензола, превращаемого по уравиению (1), в 842 раза больше, чем колвчество хлорбензола, реагирующего далее по уравиению (2). Еслн же хлорбензола 74,10/о, эти количества становятся приблизительно равными, следовательно с возрастанием концевтрации образующегося хлорбензола в смесн при продолжающемся хлорировании его выходы относительно падают. [c.104]
Выходы. Относительные выходы зависят от исходного сырья основные факторы, влияющие на выходэто происхождение нефти и глубина предварительной очистки масла. Выходы при доочистке различного сырья приведены в табл. 55. [c.169]
Отгоны в воде от О. splendida на ПМФС (газ-носитель гелий) не дали результатов, а пробы, растворенные в бензоле и ацетоне, дали сдвиг во времени выхода относительно чистого растворителя. Подобный сдвиг пика, по-видимому, можно объяс- [c.95]
Степень уменьщения щелочности системы при автотрофной денитрификацин является важным фактором для контроля процесса. Щелочность уменьшается в результате образования серной кислоты при микробиологическом окислении серы. Уравнение (24.16) может быть использовано для расчета коэффициента наблюдаемого выхода относительно щелочности [c.311]
Карбонильное соединение вначале превращают в тозилгидразон. а затем обрабатывают катехолбораном указан выход относительно тозилгидразона. [c.318]
Основываясь на результатах этих, а также большого количества других опубликованных данных, можно предполагать, что перекисно-спиртовые радикалы обладают окислительными свойствами и могут в определенных условиях вовлекаться в процессы цепного окисления. Подтверждение этому можно найти в работе Прибуша и др. [44], где было обнаружено протекание цепного процесса окисления метилового спирта. Тщательным исследованием было установлено, что процесс окисления замедляется, и выход его снижается ири искусственном увеличении в исходном растворе концентрации кислорода, акцептиг рующего радикалы — продолжатели цепи. В то же время введение добавок участвующей в развитии цепи перекиси водорода существенно увеличивает выход ценного окисления и устраняет индукционный период процесса, нл котором выходы относительно низкие. Аналогичным образом влияет изменение pH исследуемого раствора. [c.38]
Для определения гафния в многокомпонентных образцах, как правило, необходимо выделение гафния. Для этого после облучения образцы переводят в раствор и добавляют к нему известное количество носителя для того, чтобы после выделения и радиохимической очистки гафния можно было определить химический выход — относительную величину, показывающую, какая часть первоначально взятого изотопного носителя используется при измерении скорости счета выделенного радиохимически чистого препарата. Аналогично готовят и эталонные образцы. Массу гафния в образце (/Побр) вычисляют по формуле [c.444]
Во всех рассмотренных случаях математическая постановка задачи идентична. Она может быть пояснена с домощью рис. 11, на котором изображен объект (динамический канал) с известной весовой функцией K t), разделяющий искомую и измеряемую величины. В дальнейшем ограничимся рассмотрением линейных объектов. Местом приложения величины x t) обозначено сечение объекта (вход или выход), относительно которого следует знать измеряемую величину x t). В действительности x t) измеряется в другом сечении объекта, отделенном от места приложения x t) указанным динамическим каналом. [c.113]
На основании изучения закономерностей реакции были проведены опыты в условиях, близких к оптимальным. В этих опытах удалось получить достаточно большую концентрацию 3-иентеновой кислоты в реакционной массе, при этом ее выход относительно загруженного бутадиена и скорость реакции были более высокими, чем ранее достигнутые [3]. [c.228]
Руководство по лабораторной ректификации 1960 (1960) — [
c.254
]
Фотолюминесценция жидких и твердых веществ (1951) — [
c.64
]
Рецептуры кондитерских изделий
Рецептуры кондитерских изделий – количественный расход отдельных видов сырья и полуфабрикатов, необходимых для приготовления 1 тонны незавернутых готовых изделий.
Рецептура служит трем основным целям:
1) изготовление определенного сорта изделий с соблюдением установленных для них соотношений отдельных видов сырья, ароматических и вкусовых веществ; которые создают и придают изделию характерные только для него вкусовые и ароматические характеристики;
2) определение стоимости расхода сырья на 1 т готовой продукции при калькуляции;
3) для расчета потребности различного вида сырья на определенный период времени в соответствии с производственным заданием;
4) для проектирования и расчета аппаратуры, необходимой для выработки определенного количества готовых изделий.
Рецептуры делятся на:
• сложные (многофазные);
• простые (однофазные).
В 1939 году были систематизированы все рецептуры по кондитерскому производству. Унифицированные рецептуры обязательны к исполнению на всей территории России. Унифицированная рецептура состоит из текстовой части, в которой записывается форма изде-лия, состав корпуса, количество штук в 1 кг; и из таблиц, в которых записывается содержание сухих веществ в сырье и в готовой продукции, количественное соотношение отдельных видов сырья и полуфабрикатов. Соотношение отдельных видов сырья и полуфабрикатов записывается в натуральном выражении и по сухому веществу.
2. Методы составления технологических рецептур
Для того чтобы рассчитать рецептуру необходимы следующие исходные данные:
1) технологические фазы при изготовлении изделий и их последовательность;
2) расход сырья и полуфабрикатов в кг на фактическую загрузку по фазам;
3) содержание сухих веществ в отдельных видах сырья и полуфабрикатах;
4) содержание сухих веществ в готовой продукции (строго регламентируется в указателях рецептурных сборников);
5) нормативы потерь сухих веществ сырья и полуфабрикатов по фазам;
6) нормативы потерь сухих веществ сырья и полуфабрикатов на одну тонну готовой продукции;
7) для смесей: процентное соотношение отдельных сортов, входящих в смесь.
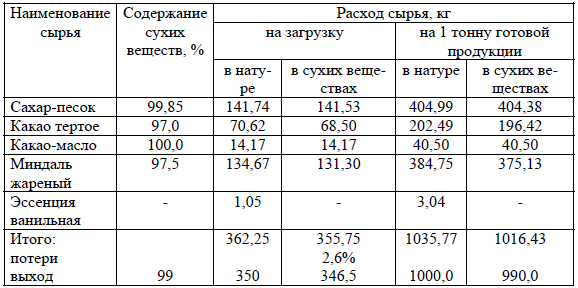
Расчет рецептуры начинается с последней технологической фазы: глазированные конфеты – глазирование; пастила – обсыпка готовой пастилы сахарной пудрой. Классическая форма унифицированной рецептуры приведена в таблице 9.
Для того чтобы найти выход готовой продукции по сухим веществам (графа 4) надо выход готовой продукции в натуральном выражении (графа 3) умножить на содержание сухих веществ в готовой продукции (графа 2) и разделить на 100.
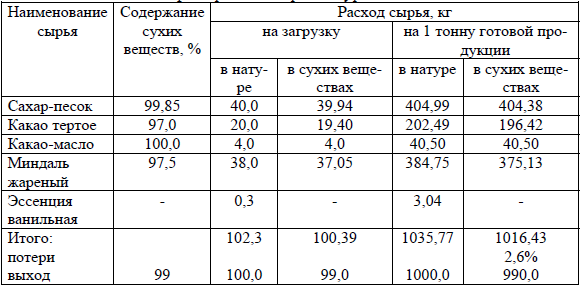
Таблица 9 – Унифицированная рецептура
Для того чтобы определить количество отдельного вида сырья по сухим веществам можно либо составить пропорцию, либо применить коэффициент пересчета – отношение количества сухих веществ, пошедших на производство 990 кг к количеству сухих веществ, пошедших на производство 99 кг готовой продукции:
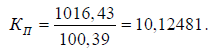
Для определения содержания сахара-песка по сухим веществам, необходимого для выработки одной тонны готовой продукции графу 4 нужно умножить на коэффициент пересчета.
Для расчета расхода сырья на 1 тонну готовой продукции:
1) определяют затраты сырья в сухих веществах на одну тонну с учетом потерь по нормам (графа 6);
2) определяют затраты каждого вида сырья по сухим веществам (графа 6);
3) определяют затраты каждого вида сырья в натуре (графа 5);
4) определяют расход сырья в натуре и в сухих веществах на одну тонну готовых изделий (итого графа 5, итого графа 6).
Для того чтобы определить, какое количество готовой продукции будет получено при загрузке:
1) определить количество сырья, для этого необходимо перевести это сырье в сухие вещества;
2) найти сумму сухих веществ сырья, которое пошло на производство продукции;
3) определить количество потерь, которое допускается для данного вида продукции;
4) сумма сырья по сухим веществам принимается за 100 %, находим количество сухих веществ, получаемое при нормируемых потерях:
П=2,6 %
Составляют пропорцию: было загружено 1016,43 кг сырья по сухим веществам – 100 %,
находят 2,6 %:
1016,43 кг – 100 % Х кг – 2,6 %
Найденное количество (26,43 кг) – это количество сырья по сухим веществам, которое теряется при производстве изделия. Это количество вычисляется из загрузки сырья по сухим веществам (1016,43 кг) и находится количество готовой продукции, которое будет получено по сухим веществам.
Для определения продукции в натуральном выражении надо умножить на 100 % и разделить на содержание сухих веществ . Для того чтобы определить количество сырого ореха для получения 384,75 кг жареного, надо открыть рецептурный сборник и найти указатели: какое количество ореха теряется при обжарке.
При расчете сложных рецептур рассчитывается рецептура на каждую фазу с учетом потерь на каждой фазе. Расчет начинается с последней технологической стадии.
3. Составление рабочей рецептуры по унифицированной рецептуре
Используя таблицу 9 унифицированной рецептуры, можно произвести расчет сырья на определенную загрузку (в кг), связанную с емкостью аппарата или наличием сырья. В этом случае пересчет сырья производится с итога затрат (графа 5) сырья в натуральном выражении.
Например: требуется рассчитать сырье на приготовление кондитерских изделий на загрузку сырья 362,25 кг. Количества сырья для приготовления 1000 кг готовой продукции берут из таблицы 9. Для простоты расчета находят коэффициент пересчета, т. е. соотношение количества сырья, необходимого на 1 т готовой продукции в натуральном выражении (графа 5) к количеству сырья, необходимого на загрузку аппарата.
На полученный коэффициент умножают количество каждого вида сырья (графа 5) и находят количество, необходимое для разовой загрузки.
Если необходимо определить количество сырья по сухому веществу Мс, то количество сырья в натуральном выражении (графа 5) умножают на содержание сухих веществ в данном виде сырья или гото-вой продукции (графа 2) и делят на 100 %.
Располагая всеми расчетами расхода сырья в натуральном выражении и по сухому веществу, заполняют таблицу, форма которой с 1939 г не претерпела изменений.
4. Взаимозаменяемость сырья в кондитерском производстве
Все сырье в кондитерской промышленности делится на определенные группы:
I. Сахаристые вещества
• сахар
• сахарная пудра
• мед
• патока
• глюкоза
• ксилит
• сорбит
II. Фруктовое сырье
• пюре
• подварки
• припасы
• пульпа
• соки
• цукаты
• заспиртованные фрукты
• сухофрукты (изюм, курага)
• фруктовые порошки
III. Какао-продукты
• какао-порошок
• какао тертое
• какао-масло
• какао-жмых
• какао-велла
• шоколадная глазурь
• жировая глазурь
IV. Молокопродукты
• молоко сгущенное
• молоко сухое цельное
• молоко сухое обезжиренное
• молоко цельное
• сливки
В практике кондитерского производства один вид сырья иногда заменяется другим видом сырья, причем в основу этой замены положено количество исходного продукта, содержащегося как в заменяемом сырье, так и в идущем на замену.
Во взаимозаменяемости сырья допускается внутригрупповая замена: если необходимо заменить 500 кг пюре, идущего на производство 1 т карамельной начинки, на подварку.
В указателях к рецептурам находят, какое количество сахара и пюре надо для производства 1 т подварки: в 1 т подварки находится 780 кг пюре и 612 кг сахара:
Значит, 633 кг подварки заменят 500 кг пюре.
Следовательно, в 633 кг подварки содержится 500 кг пюре и 387,4 кг сахара.
Найденное количество подварки (633 кг) вносят в рецептуру на 1 т начинки вместо пюре, а содержащийся в ней сахар-песок – 387,4 исключают из расхода сахара-песка на 1 т начинки.
Расход сырья в рецептурах дан по всем сортам на 1 т незавернутой продукции.
Для выявления потребности сырья на 1 т готовых весовых завернутых изделий расход сырья следует уменьшить на количество оберточного материалов (входящих в нетто) пропорционально по всем видам сырья.
Искомое количество определенного виды сырья может быть выражено в общем виде так:
А=аК,
где а – расход данного вида сырья в кг на 1 т незавернутых изде-лий из рецептуры;
К – коэффициент пересчета ( , где Б – количество оберточного материала)
Пересчет сырья в случае отклонения содержания сухих веществ против принятых в рецептуре
По рецептуре идет 100 кг яблочного пюре с содержанием сухих веществ 10 %.
Вместо 10 % сухих веществ по рецептуре содержится 8% сухих веществ.
Необходимо сделать пересчет:
где Х – количество фактически израсходованного сырья, кг; а – количество израсходованного сырья по рецептуре в натуральном выражении, кг; б – содержание сухих веществ в данном сырье по рецептуре, %; в – фактическое содержание сухих веществ, %.
Следовательно, 125 кг пюре с содержанием сухих веществ 8 % заменят 100 кг пюре с содержанием сухих веществ 10 %.
5. Форма отчетности 35-К
Форма отчетности 35-К – это отчет ежесменный, ежемесячный, ежеквартальный и ежегодный о расходе сырья на сданную в склад продукцию и товарные полуфабрикаты.
Все сырье подразделяется на группы: сахаристые, фруктовые добавки и так далее, внутри каждой группы сырье может заменять друг друга, но с учетом пересчета на сухое вещество, а также с учетом компонентов, входящих в то или иное сырье.
Форма отчетности включает:
I. Наименование вида сырья и полуфабрикатов по группам.
II. Итоговый расход сырья и полуфабрикатов за отчетный период.
III. Плановое содержание сухих веществ.
IV. Фактическое содержание сухих веществ.
Плановый расход сырья – расход сырья, пошедшего на производство продукции по рецептуре.
Фактический расход сырья – расход сырья по факту.
Рассчитывается он следующим образом:
1. Каково количество сырья на начало отчетного периода.
2. Прибавляют количество сырья, полученное в смену со склада. 3. Отнимают количество сырья на конец отчетного периода, получают фактический расход сырья.
Потери – фактический расход больше планового.
Экономия – плановый расход больше фактического.
Внутригрупповые потери и экономия могут перекрывать друг друга.
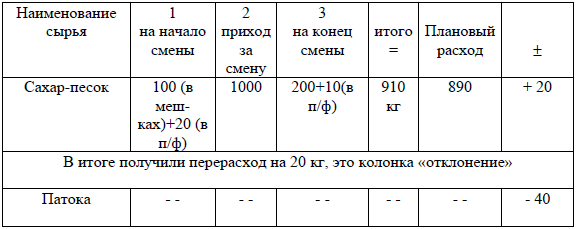
6. Определение абсолютных и относительных потерь
Также в рецептуре предусматривается определенное значение предельно допустимых потерь сухих веществ при производстве всего изделия или полуфабриката. Потери по сухим веществам строго регламентируются контролирующими органами или руководителем предприятия.
Потери сухого вещества – это отношение разности затраченного количества сырья по сухому веществу (итого – графа 6) и затрачен-ного количества сырья по сухому веществу (выход – графа 6).
Абсолютный выход – это затраченное количество сырья по сухому веществу (итого – графа 6)
Относительный выход готовой продукции – это отношение количества сырья по сухому веществу на выход к затраченному их количеству (выход – графа 6) к затраченному количеству сырья по сухому веществу (итого – графа 6).
Значит, 633 кг подварки заменят 500 кг пюре.