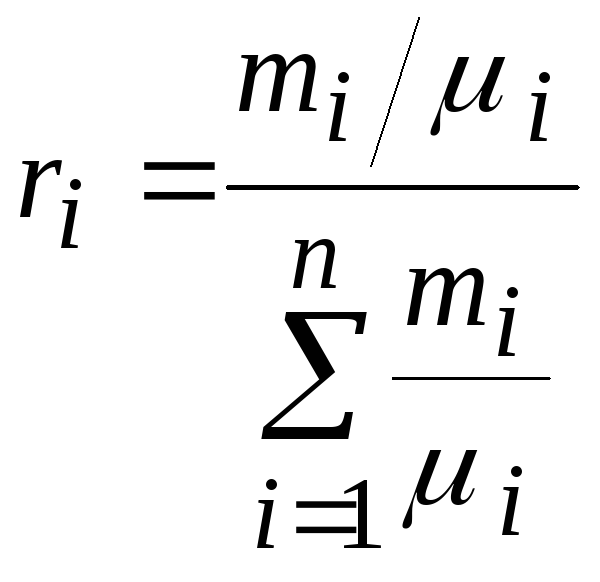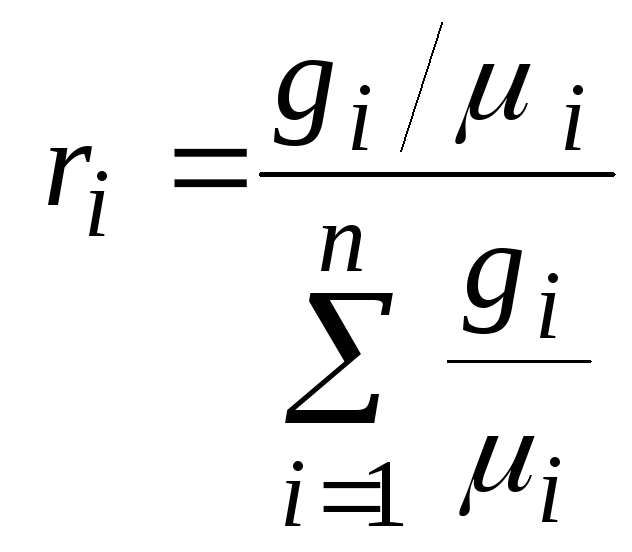Смесям идеальных газов характерно свойство аддитивности двух показателей: парциального давления и объёма. Другими словами, любому включённому в смесь инертному газу характерно такое поведение, какое было бы, если б он в единственном числе заполнял предлагаемый объём. Для лучшего понимания разумно разобраться, что выражают указанные величины.
Определения
Давление – действующая на единицу поверхности сила, прямопропорциональная числу и скоростью сталкивающихся с этой поверхностью молекул, зависящей от температуры.
Парциальное давление – давление, оказываемое компонентом газовой смеси, при условии удаления других компонентов из занимаемого объёма, сохраняя этот объём и текущую температуру.
Объём – ограниченное чертой трёхмерное пространство, вмещающее вещество и отображающее его форму.
Парциальный объём – объём, занимаемый компонентом газовой смеси, при условии удаления других компонентов из занимаемого объёма, сохраняя первоначальное давление и температуру.
Идеальный газ – научная модель для познания газов, не учитывающая силу молекулярного взаимодействия.
Смесь идеальных газов – это совокупность газов, каждый из которого, находясь в смеси, при сохранении заданных условий, не вступает в химическую реакцию с остальными компонентами.
Говоря об идеальных газах и их смеси, следует понимать, что изменение условий, например температуры или давления, всё же может спровоцировать химическую реакцию. Важным параметром такой смеси является молярная (весовая) концентрация газового компонента. Данная величина измеряется в мг/м3 и показывает количество конкретного компонента в единице объёма газовой смеси.
Парциальное давление
Описывая характеристику состояния компонентов идеальной смеси газообразных веществ, парциальное давление, создаваемое i-ым газом в случае удаления других компонентов из сохраняемых условий, является показателем pi.
Формула
Формула парционального давления:
[p i=frac{m_{i}}{mu_{i}} frac{R T}{V}=mu_{i} frac{R T}{V}]
Где V– объём смеси, R = 8,31
Дж/моль*K– универсальная газовая постоянная, а T –
температура.
Следует отметить, что равность средней кинетической энергии находящихся в смеси молекул определяет равенство температур всех компонентов термодинамически уравновешенной газовой смеси. Найти общее давление смеси идеальных газов представляется возможным через закон Дальтона, отражаемый аддитивность парциальных давлений, а именно [p=sum p_{i}].
Пользуясь данным законом, найдём давление смеси идеальных газов через следующую формулировку: [p=sum_{i}^{N}=1 rightarrow p_{i}=frac{R T}{V} sum_{i}^{N}=1^{v_{i}}], где N – количество вошедших в смесь газов, vi– количественный показатель молей i-го газа. Отсюда парциальное давление можно выразить формулой [p_{i}=x_{i} p], где xi – молярная концентрация i-го газа.
Понятие парциального объёма
Описывая характеристику состояния компонентов идеальной смеси газообразных веществ, парциальный объём, занимаемый i-ым газом в случае удаления других компонентов из сохраняемых условий, является показателем Vi. Аддитивность парциального объёма определяет закон Амага, выраженный формулой [V=sum_{i}^{N}=1 V_{i}].
Формула
Пользуясь данным законом, можно вывести формулу нахождения парциального объёма через следующую формулировку:
[v_{i}=frac{p^{V_{i}}}{R T}]; [p=frac{R T}{V} frac{p}{R T} sum_{i}^{N}=mathbf{1}^{V}_{i}] , отсюда
следует, что — [boldsymbol{V=sum_{i}^{N}=1^{V_{i}}}, text{ а } boldsymbol{V_{i}=x_{i} V}].
Зная, что характеризующие состояние смеси инертных газов показатели подчиняются уравнению Менделеева-Клапейрона, выведем формулу:
[p V=frac{m}{mu_{s m}} R T] данное уравнение свои параметры относит ко всей газовой смеси.
[pV=mR_{s m} T] такой вариант уравнения содержит показатель Rsm, обозначающий удельную газовую составляющую смеси.
Уравнение Менделеева-Клапейрона показывает возможность изменения трёх характеризующих состояние идеального газа параметров.
Нет времени решать самому?
Наши эксперты помогут!
Примеры вычисления парциального давления и объёма
Задача №1
Условие: в сосуде объёмом 2 м3, при постоянной температуре 290 К находится 0,20*10-3 кг гелия и 1*10-3 кг водорода. Необходимо вычислить давление смеси и парциальное давление гелия.
Решение.
Сначала вычислим количество молей каждого компонента, используя следующую формулу:
[mathrm{v}{mathrm{i}}=frac{mathrm{m}{mathrm{i}}}{mu_{mathrm{i}}}]
Для расчёта количество молей водорода в смеси нам понадобится его молярная масса, которую возьмём из таблицы Менделеева:
[mu_{mathrm{H}_{2}}=2 * 10^{-3} frac{mathrm{кг}}{text { моль }}]
Теперь можно найти количество молей водорода в смеси:
[mathrm{v}_{mathrm{H}_{2}}=frac{mathrm{m}_{mathrm{H}_{2}}}{mu_{mathrm{H}_{2}}}=frac{1 * 10^{-3}}{2 * 10^{-3}}=0,5 text { (моль) }]
Зная молярную массу гелия из таблицы Менделеева, рассчитаем количество молей гелия в смеси:
[mathrm{v}_{mathrm{He}}=frac{mathrm{m}_{mathrm{He}}}{mu_{mathrm{He}}}=frac{4 * 10^{-3}}{20 * 10^{-3}}=0,2 text { (моль) }]
Теперь можно найти парциальное давление каждого из компонентов с помощью уравнения Менделеева-Клапейрона:
[mathrm{p}_{mathrm{i}} mathrm{V}=mathrm{v}_{mathrm{i}} mathrm{RT}]
Сначала нужно рассчитать давление водорода:
[mathrm{p}_{mathrm{H}_{2}} mathrm{~V}=mathrm{v}_{mathrm{H}_{2}} mathrm{RT} rightarrow mathrm{p}_{mathrm{H}_{2}}=frac{mathrm{v}_{mathrm{H}_{2}} mathrm{RT}}{mathrm{V}}=frac{0,5 * 8,31 * 290}{1}=1205 text { (Па) }]
Рассчитаем парциальное давление гелия:
[mathrm{p}_{mathrm{He}}=frac{mathrm{v}_{mathrm{He}} mathrm{RT}}{mathrm{V}}=frac{0,2 * 8,31 * 290}{1}=482 text { (Па) }]
Теперь найдём полное давление газовой смеси, сложив значения компонентов:
[mathrm{p}=mathrm{p}_{mathrm{H}_{2+}} mathrm{p}_{mathrm{H}}=1205+482=1687 text { Па }]
Ответ: парциальное давление гелия равно 482 Па, а общее давление 1205 Па.
Задача №2
Условие: идеальная газовая смесь состоит из 0,5 кг углекислого газа и 0,25 кг кислорода, какой объём они займут, если давление равно 1 атм, а температура смеси равна 300 К?
Решение.
Найдём суммарную массу газовой смеси:
[mathrm{m}=mathrm{m}_{mathrm{O}_{2}}+mathrm{m}_{mathrm{CO}_{2}}=0,5+0,25=0,75 text { (кг) }]
Вычислим массовые компоненты смеси:
[g_{mathrm{O}_{2}}=frac{0,25}{0,75}=0,33] [mathrm{g}_{mathrm{CO}_{2}}=frac{0,5}{0,75}=0,67]
Тогда газовая постоянная смеси равняется:
[mathrm{R}_{mathrm{sm}}=mathrm{R} sum_{mathrm{i}=1}^{mathrm{N}} frac{mathrm{g}_{mathrm{i}}}{mu_{mathrm{i}}}=8,31left(frac{0,33}{32 * 10^{-3}}+frac{0,67}{46 * 10^{-3}}right)=200left(frac{text { Дж }}{text { кгК }}right)]
Пользуясь уравнением Менделеева-Клапейрона, и, зная, что 1 атм равна 105 Па,вычислим объём смеси:
[mathrm{V}_{mathrm{sm}}=frac{mathrm{m}_{mathrm{sm}} mathrm{R}_{mathrm{sm}} mathrm{T}_{mathrm{sm}}}{mathrm{P}_{mathrm{sm}}}=frac{0,75 * 200 * 300}{10^{5}}=0,45left(mathrm{м}^{3}right)]
Ответ: при заданных условиях смесь займёт 0,45 м3.
Навык определения парциальных давлений и объёма актуален в машиностроении, энергетике и других промышленностях, связанных с использованием тепловых двигателей, приводимых в действие парами высокой температуры.
Андрей Геннадьевич Блохин
Эксперт по предмету «Физика»
Задать вопрос автору статьи
Так как парциальное давление и парциальный объем — понятия, относящиеся к смесям газов, определим сначала, что такое смесь идеальных газов. Итак, смесью газов, называется совокупность нескольких разных газов, невступающих в химическую реакцию при заданных условиях. При других условиях (например, повышении давления) те же газы могут химически реагировать. Смеси характеризуются такой физической величиной, как весовая концентрация $g_i$ i — го газа, являющегося компонентом смеси, при этом:
где N — общее количество разных газов в смеси,
и молярной концентрацией $x_i i-го$ газа в смеси, при этом:
где ${nu }_i$- количество молей $i-го$ газа в смеси.
Что такое парциальное давление
Характеристикой состояния компоненты смеси идеальных газов является парциальное давление.
Определение
Парциальное давление $(p_{i })$ $i-го$ газа в смеси называется давление, которое создавал бы этот газ, если кроме него все остальные газы отсутствовали, но объем и температура остались неизменными.
[p_{i }=frac{m_i}{{mu }_i}frac{RT}{V}=н_ifrac{RT}{V} left(3right),]
где $V- $объем смеси, $T$- температура смеси. Здесь необходимо отметить, что вследствие равенства средних кинетических энергий молекул смесей можно говорить о равенстве температур всех компонент смесей в состоянии термодинамического равновесия.
Давление смеси идеальных газов p определяется по закону Дальтона:
[p=sumlimits^N_{i=1}{p_i}=frac{RT}{V}sumlimits^N_{i=1}{{nu }_i} left(4right).]
Следовательно, парциальное давление, можно выразить как:
[p_i=x_ip left(5right).]
Что такое парциальный объем
Другим важным параметром состояния смеси газов является парциальный объем.
Определение
Парциальным объемом $V_i$ $i-го$ газа в смеси называют тот объем, который имел бы газ, если бы из смеси убрали все остальные газы, при неизменной температуре и объеме:
[V_i=н_ifrac{RT}{p}left(6right).]
«Парциальное давление и объём» 👇
Для смеси идеальных газов выполняется закон Амага:
[V=sumlimits^N_{i=1}{V_i}left(7right).]
Действительно, если из (6) выразить ${nu }_i$ и подставить в (4), получим:
[{nu }_i=frac{pV_i}{RT};; p=frac{RT}{V}frac{p}{RT}sumlimits^N_{i=1}{V_i}to V=sumlimits^N_{i=1}{V_i}]
Парциальный объем можно рассчитать по формуле:
[V_i=x_iV left(8right).]
Параметры состояния смеси идеальных газов подчиняются уравнению Менделеева — Клайперона в следующем виде:
[pV=frac{m}{{mu }_{sm}}RT left(9right),]
где все параметры в уравнении (9) относятся к смеси в целом.
Или уравнение (9) иногда удобнее записывать в таком виде:
[pV=mR_{sm}T left(10right),]
где $R_{sm}=frac{R}{{mu }_{sm}}=Rsumlimits^N_{i=1}{frac{g_i}{{mu }_i}}$ — удельная газовая постоянная смеси.
Пример 1
Задание: При 290 K в сосуде объемом 1$м^3$ содержится 0,5${cdot 10}^{-3}$ кг водорода и 0,10${cdot 10}^{-3}$ кг гелия. Найдите парциальное давление гелия и давление смеси.
Решение:
Найдем количество молей для каждой компоненты смеси, используя формулу:
[{nu }_i=frac{m_i}{{mu }_i} left(1.1right),]
тогда количество молей водорода в смеси, если с помощью таблицы Менделеева находим, что молярная масс водорода ${mu }_{H_2}=2cdot {10}^{-3}frac{кг}{моль}$:
[{nu }_{H_2}=frac{m_{H_2}}{{mu }_{H_2}}]
Проведем расчет:
[{nu }_{H_2}=frac{0,5{cdot 10}^{-3}}{2cdot {10}^{-3}}=0,25 (моль)]
Аналогично рассчитаем ${nu }_{He} ({mu }_{He}=4cdot {10}^{-3}frac{кг}{моль}):$
[{nu }_{He}=frac{0,10{cdot 10}^{-3}}{4cdot {10}^{-3}}=0,025 left(мольright).]
Используем уравнение Менделеева — Клайперона найдем парциальные давления каждой компоненты смеси:
[p_iV={nu }_iRT left(1.2right).]
Тогда давление водорода:
[p_{H_2}V={nu }_{H_2}RTto p_{H_2}=frac{{nu }_{H_2}RT}{V}left(1.3right)]
Рассчитаем парциальное давление водорода:
[p_{H_2}=frac{0,25cdot 8,31cdot 290}{1}=602,5 (Па)]
Аналогично найдем парциальное давление гелия:
[p_{He}=frac{0,025cdot 8,31cdot 290}{1}=60,25 (Па)]
Давление смеси найдем как сумму давлений составляющих ее компонент:
[p=p_{H_2}+p_{He} left(1.4right).]
Следовательно, давление смеси равно:
$p=602,5+60,25=662,75$ (Па)
Ответ: Парциальное давление гелия равно $60,25$ Па, давление смеси $662,75$ Па.
Пример 2
Задание: В состав смеси газов входят 0,5 кг $O_2$ и 1 кг $CO_2$. Определить объем, который займет смесь газов при давлении в одну атмосферу, если газы считать идеальными. Температуру смеси принять равной 300 К.
Решение:
Найдем массу смеси газов:
[m=m_{O_2}+m_{CO_2}left(2.1right).]
Следовательно,
[m=1+0,5=1,5 left(кгright).]
Найдем массовые компоненты смеси $g_i$:
[g_{O_2}=frac{0,5}{1,5}=0,33]
[g_{CO_2}=frac{1}{1,5}=0,67]
Рассчитаем газовую постоянную смеси:
[R_{sm}=Rsumlimits^N_{i=1}{frac{g_i}{{mu }_i}} (2.2)]
[R_{sm}=8,31left(frac{0,33}{32cdot {10}^{-3}}+frac{0,67}{46cdot {10}^{-3}}right)=200 left(frac{Дж}{кгК}right)]
Выражение для объема смеси, полученное из уравнение Менделеева — Клайперона:
[V_{sm}=frac{m_{sm}R_{sm}T_{sm} }{p_{sm}}left(2.3right)]
Проведем вычисления объема, учитывая, что p=1атм.=$ {10}^5Па$:
[V_{sm}=frac{1,5cdot 200cdot 300}{{10}^5}=0,9 м^3]
Ответ: Смесь занимает объем 0,9 $м^3.$
Находи статьи и создавай свой список литературы по ГОСТу
Поиск по теме
Для сравнения
количества газов в смеси по объему,
необходимо их объемы при температуре
смеси привести к
одинаковому
давлению.
Если этим
одинаковым давлением
является давление смеси
,
то приведенные
к этому
давлению объемы
компонентов называются парциальными.
Парциальный
(приведенный) объем
— это объем, который занимал бы i-тый
компонент, если бы он один находился
при температуре
и давлении смеси .
Для понимания
физического смысла парциального объема
рассмотрим смесь двух идеальных газов.
Как отмечалось ранее, молекулы обоих
газов равномерно распределены по всему
объему ,
занимаемому смесью при давлении
и температуре .
Представим себе,
что каким-то
образом удалось разделить
молекулы этих двух газов так, что в общем
объеме
первый газ занимает объем ,
а второй —
при одинаковой температуре .
Для того, чтобы эта гипотетическая
система находилась в
равновесии
и газы не
смешивались
за счет разности давлений, давление в
объемах
и
должно быть одинаковым
и равным общему давлению смеси ,
т. е.
Или в общем случае
Типичной
студенческой ошибкой
является подстановка в это уравнение
вместо
давления смеси
величины парциального давления .
1.4.4. Задание состава смеси идеальных газов объемными долями.
Во многих практических
задачах состав смеси газов задается
объемными долями:
,
где:
— парциальный объем i-го
газа в составе смеси газов, занимающей
объем .
Установим связь
между объемными и мольными долями газов
смеси.
Т. к. универсальная
газовая постоянная
Дж / (кмоль · К)
связана с удельными
газовыми постоянными ,
Дж / (кг · К), соотношением
,
то из определения
парциального объема идеального газа в
составе смеси получим:
или
,
где: -число
киломолей i-го
газа.
Просуммировав
значения
для всех газов, входящих в смесь, получим
,
где:
и
Разделив выражения
для
на выражение для
получим
Т. о. для смеси
идеальных
газов мольная
и объемная доли i-го
газа
равны между
собой по величине
.
и
.
1.4.5. Формулы пересчета для различных способов задания состава газовых смесей
Получим формулу
пересчета мольных долей на массовые и
наоборот.
Т. к. и
,
то
.
Разделив числитель
и знаменатель полученного выражения
на массу смеси
получим

или окончательно:
Т. к. и
,
то 
Разделив числитель
и знаменатель этого выражения на
получим 
или окончательно
1.4.6. Кажущаяся молекулярная масса смеси газов
Для упрощения
расчетов смесь идеальных газов условно
полагают однородным
газом с той
же суммарной массой
и с тем же
суммарным числом молекул,
равным
,
где
— число молекул в единице объема смеси
газов;
— число Авогадро
(число молекул в одном киломоле вещества):
, 1 / кмоль
Молекулярная масса
такого однородного газа обозначается
и называется кажущейся молекулярной
массой смеси:

Разделив числитель
и знаменатель этого выражения на ,
получим 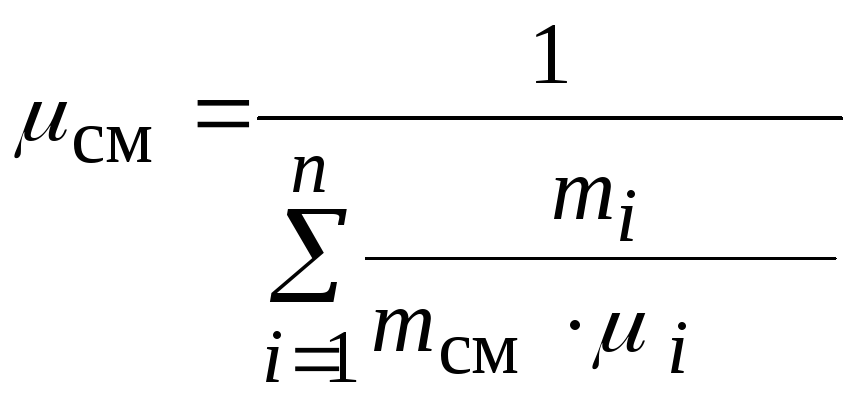
или окончательно
Через мольные доли
величина
выражается проще:

или окончательно
Подборка по базе: Расчет газовой смеси.docx, СТ 60 специальные газовые средства.ppt, Давление твердых тел.doc, Масса смеси.docx, Расчет основных рабочих параметров корчевателя-собирателя.docx, Практическая работа на тему _Анализ содержания УМК _Английский в, Статья_ Требования к созданию рабочих программ, в соответствии с, курс тел.docx, Улучшение условий труда рабочих или компенсационные выплаты (про, Улучшение условий труда рабочих или компенсационные выплаты (про
Задание: В тетрадях написать конспект, разобрать примеры решения задач.
Газовые смеси. Смеси рабочих тел.
1. Газовые смеси.
1) Газовые смеси — обычно имеются в виду соединения горючих составных частей топлива и воздуха при горении.
Как известно, горение представляет собой химический процесс соединения горючих составных частей топлива с кислородом воздуха. В результате этого процесса получается газовая смесь, состоящая из кислорода, азота, углекислого, газа, водяного пара и некоторых других газов.
Состав этих смесей, или, как их называют, продуктов сгорания топлива, может быть самым разнообразным и зависит как от состава топлива, так и от условий, при которых происходит сгорание (в частности, от количества подводимого воздуха).
2) Иногда топливо заставляют сгорать при недостаточном количестве воздуха (в газогенераторе). В этом случаев состав продуктов сгорания топлива входят в значительном количестве водород, окись углерода и другие продукты неполно го сгорания. Такие газовые смеси способны к дальнейшему соединению с кислородом (сгоранию) и при этом выделяют тепло, а поэтому они применяются как горючие газы, часто их употребляют в качестве топлива в двигателях внутреннего сгорания.
Газовая смесь может также быть получена в газогенераторе, где происходит сгорание при недостатке кислорода. газогенератор

3) Кроме того к газовым смесям относятся продукты сгорания топлива, а также горючие газы:
Горючий газ, добываемый из недр земли (естественный газ), также представляет собой газовую смесь; она состоит главным образом из метана (СН4), различных углеводоро¬дов, углекислого газа, азота и др.
В свою очередь, к смесям не относятся однородные газы, например, пар (рабочее тело в паросиловых установках). Кроме пара все остальные рабочие тела являются смесями и рассматриваются как смеси идеальных газов.
2. Уравнение состояния идеального газа для компонентов смесей.
С однородным газом приходится иметь дело главным образом в паросиловых установках, где рабочим телом служит по преимуществу водяной пар. В остальных случаях в качестве рабочего тела используется газовая смесь. Поэтому необходимо уметь вычислять для такой смеси все те величины, о которых шла речь в предыдущих параграфах. Газовые смеси, встречающиеся в теплотехнических расчетах, рассматриваются как идеальные газы; они подчиняются законам Бойля — Мариотта и Гей-Люссака.
Уравнение аналогично уравнению идеального газа для однородного газа
Когда мы имеем дело со смесями газов, важно знать, что они имеют такие характеристики, как парциальный объем и парциальное давление. Для начала определим, что такое смесь идеальных газов.
Смесь идеальных газов – это смесь нескольких газообразных веществ, которые при заданных условиях не будут вступать в определенные химические реакции.
При смене условий (например, повышении температуры, понижении давления) газовая смесь все же может вступать во взаимодействие.
3. Понятие парциального давления для смеси
Парциальное давление – это особая характеристика, описывающая состояние компонентов смеси идеальных газов. Сформулируем основное определение:
Парциальным называется давление pi, которое могло бы создаваться i-ым газом в смеси при условии отсутствия остальных газов и сохранения исходного объема и температуры.
Формула парциального давления будет выглядеть так:
Объем смеси здесь обозначен буквой V, ее температура – T.
Для нахождения давления смеси идеальных газов нужно воспользоваться законом Дальтона: р = р1 + р2 +..+рn, тогда


4. Понятие парциального объема для смеси
У газовой смеси также есть такая характеристика, как парциальный объем.
Парциальный объем Vi газа в газовой смеси – это такой объем, который мог бы иметь газ при условии отсутствия всех остальных газов и сохранении исходной температуры и объема.
Если речь идет о смеси идеальных газов, то к ней применим закон Амага:
Нам известно, что параметры, определяющие состояние смеси идеальных газов, будут подчиняться уравнению Менделеева-Клайперона.
Формула будет выглядеть так:
Все параметры данного уравнения будут относиться ко всей смеси. Это же уравнение удобнее записать так:
pV = mRsmTpV
Здесь параметры 
удельную газовую постоянную смеси.
5. Параметры смеси1) Массовая доли смеси 
Масса газовой смеси равна сумме масс всех входящих в нее:
2) Объёмная доля каждого компонета газа.
где ri – объёмная доля i-го газа; Vi – парциальный объём i-го газа; V – объём смеси газов.
3) Существует
взаимосвязь массовых и объемных долей смеси.
Ее несложно получить, выразив массы газов через произведение их объемов на плотности, а отношение плотностей при одинаковых параметрах, в соответствии с законом Авогадро, заменив отношением молярных масс:
4) К
ажущаяся молярная масса смеси μсм – это величина, которая определяется путём деления массы смеси mсм, кг, на число молей смеси νсм, моль
Кажущаяся молярная масса смеси:
Эта величина имеет условный характер (ее иногда называют кажущейся молекулярной массой) из следующих соображений. По отношению к отдельному газу молекулярная масса — отвлеченное число, характеризующее массу действительно существующей молекулы. Так как газовая смесь — совокупность разнородных молекул, по отношению к такой смеси понятие о молекулярной массе может быть применено в том смысле, что эта смесь как бы заменяется газом, состоящим из однородных фиктивных («средних») молекул, совокупность которых образует газ, соответствующий действительной смеси. Эта величина вводится для удобства при расчетах.
В теплотехнических расчетах в громадном большинстве случаев пользуются объемными долями, так как прибор, которым пользуются для определения состава продуктов сгорания — газоанализатор, дает результаты анализа в объемных долях.
5) К
ажущуюся молярную массу смеси по её химическому составу
μсм= r1 μ1+ r2 μ2+…+ rn, где r – объемные доли компонентов
6) Г
азовая постоянная смеси
Rсм = g1·R1+ g2·R2+……+ gn·Rn,
где 
7) Вычисление
относительного объемного состава газовой смеси по относительному массовому составу
На практике часто необходим взаимный пересчёт из массовых и объёмных долей. Рекомендуется использовать следующие выражения:

Решение задач
Задача 1. Какой объем V занимает смесь газов — азота массой m1=1 кг и гелия массой m2=1 кг — при нормальных условиях?
Дано: Решение:
m1=1 кг V = V1 + V2
m2=1 кг Уравнение Менделеева-Клайперона:
V-? Откуда: 

Задача 2. Дана смесь газов, состоящая из 1 кг углекислого газа и 0,5 кг O2. Если считать их идеальными, какой объем они будут занимать при давлении в 1 атм? Температура смеси равна 300К.
Дано:
M = 1 кг (CO2)
m = 0,5 кг (O2)
р =1 атм = 10·105Па
Т = 300К
Vс-?
Решение
1) Вычислим общую массу газовой смеси.
m = mO2 + mCO2
Значит, m = 1 + 0,5=1,5
2) Вычислим массовые компоненты смеси:
gO2=0,5/1,5=0,33; gСO2=1/1,5=0,67
3) Найдем газовую постоянную смеси:
Rсм = g1·R1+ g2·R2, где
Rсм=8,31(0,33/32⋅10−3+0,67/46⋅10−3)= 200 ДжкгК.
4) Объем смеси вычисляем с помощью уравнения Менделеева-Клайперона:
Vsm=1,5⋅200⋅300/105=0,9 м3V
Ответ: 0,9 м3.
Задача 3. В баллоне объемом 25 литров находится 20 г азота и 2 г гелия при 301К. Найдите давление в баллоне.
Дано:
V= 25л = 0,025м3
m1 = 20·10-3кг
m2 = 2·10-3кг
р-?
Решение:
1) Уравнение Менделеева-Клайперона:
Для двух газов: 
2) Запишем закон Дальтина
Ответ: p = 105 Па.
Задача 4 Газовая смесь, состоящая из кислорода и азота, находится в баллоне под давлением p=1 МПа. Определить парциальные давления p1 кислорода и p2 азота, если массовая доля g1кислорода в смеси равна 0,2
Дано:
P =1 МПа
g 1 = 0,2
р1,р2-?
Решение:
Закон Дальтона: р = р1 + р2


Выразим 
р1 = р — р2 =0,18МПа
Задача 5. Сухой воздух состоит в основном из кислорода и азота. Если пренебречь остальными составными частями воздуха, то можно считать, что массовые доли кислорода и азота соответственно g1=0,232, g2=0,768. Определить относительную молекулярную массу Mr воздуха.
Дано:
g1=0,232,
g2=0,768
μ-?
Решение:
Если известен массовый состав смеси, то по нему можно найти её мольный состав. Массы отдельных газов mi и полную массу смеси т можно выразить через число моль следующим образом: m1=μ1 ν1; m2=μ2 ν2;
νсм = ν1 + ν2

Тогда
Задача 6.. Найти молярную массу смеси кислорода массой m1 =25г и и азота массой m2=75 г
Дано:
m1 = 25·10-3кг
m2 = 75·10-3кг
μсм-?
Решение:
Молярная масса смеси:
Масса смеси m = m1 + m2

Задача для самостоятельного решения:
Имеется сосуд объемом 1 м3, в котором находится 0,10⋅10−3 кгг гелия и 0,5⋅10−3 кг водорода. Постоянная температура равна 290 К. Вычислите давление смеси и парциальное давление гелия в нем.
Контрольные вопросы:
1. Что называется смесью газов
2. Назовите параметры смеси газов: массовые доли, объемные доли
3. Как найти парциальное давление смеси газов
4. Как найти кажущуюся молярную массу смеси газов
5. Как вычислить относительный объемный состав газовой смеси по относительному массовому составу
6. Как определить газовую постоянную смеси?
Парциальный объем
Cтраница 1
Парциальный объем представляет собой величину, дополнительную к парциальному давлению.
[1]
Парциальный объем — объем, который занимал бы газ, входящий в состав газовой смеси, если бы он находился при тех же давлении и температуре, что и вся смесь.
[2]
Парциальные объемы выражены как функция полного объема моля раствора и производной объема по составу.
[3]
Парциальный объем — объем, который занимал бы данный компонент смеси газов, если бы из нее были удалены остальные компоненты при условии сохранения первоначального давления и температуры.
[4]
Парциальный объем каждого компонента газовой смеси равен общему, умноженному на молярную ( объемную) концентрацию его в смеси.
[5]
Парциальный объем метана в системе метан — н-бутан — декан.
[6]
Парциальные объемы метана в бесконечно разбавленном растворе при низких давлениях различаются между собой незначительно для рассмотренных смесей.
[7]
Парциальный объем данного газа в смеси газов определяется, как такой объем, который занимал бы этот газ, если бы он один находился при тех же температуре и давлении, что и смесь газов. Если выполняются законы идеальных газов, то должен быть также справедлив и закон Амага — сумма парциальных объемов равна общему объему.
[8]
Парциальным объемам отдельных газов соответствует одно и то же давление и температура смеси, а при этих условиях, как было показано ранее, объемы молей любых газов и смеси одинаковы.
[9]
Парциальным объемом называется объем, который имел бы газ, входящий в газовую смесь, если бы из нее были удалены все остальные газы при условии сохранения первоначальных давления и температуры.
[10]
Парциальным объемом называется объем, который имел бы газ, входящий в газовую смесь, если бы он находился при давлении и температуре смеси.
[11]
Парциальным объемом называется объем, который занимает компонент смеси, если его давление равно общему давлению.
[12]
Парциальным объемом / — го компонента смеси Vj называется объем, который имел бы этот компонент, если бы его давление равнялось давлению смеси.
[14]
Парциальным объемом газа называют объем, который занимал бы этот газ, если бы его температура и давление равнялись температуре и давлению смеси газов.
[15]
Страницы:
1
2
3
4