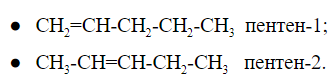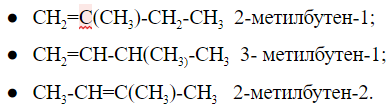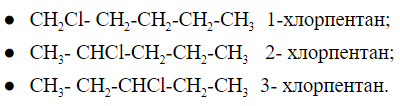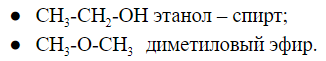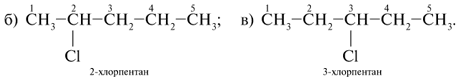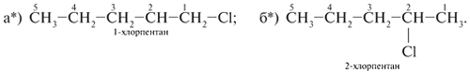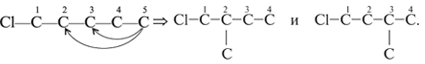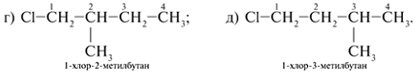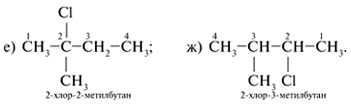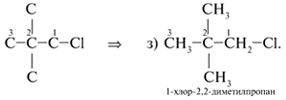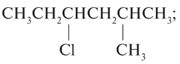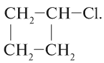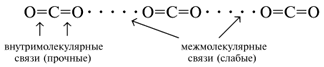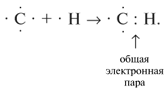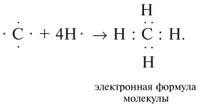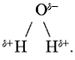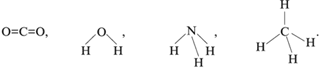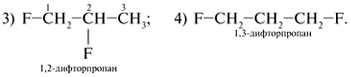Изомеры – это вещества, имеющие одинаковый состав (число атомов каждого типа), но разное взаимное расположение атомов – разное строение.
Изомерия – это явление существования веществ с одинаковым составом, но различным строением.
Например, формуле C4H10 соответствуют два изомерных соединения н-бутан с линейным углеродным скелетом и изобутан (2-метилбутан) с разветвленным скелетом:
При этом температура кипения н-бутана –0,5оС, а изобутана –11,4оС.
Виды изомерии
Различают два основных вида изомерии: структурную и пространственную (стереоизомерию).
Структурные изомеры отличаются друг от друга взаимным расположением атомов в молекуле; стереоизомеры — расположением атомов в пространстве.
Структурная изомерия
Структурные изомеры – соединения с одинаковым составом, но различным порядком связывания атомов, т.е. с различным химическим строением. Молекулярная формула у структурных изомеров одинаковая, а структурная различается.
1. Изомерия углеродного скелета: вещества различаются строением углеродной цепи, которая может быть линейная или разветвленная.
Например, молекулярной формуле С5Н12 соответствуют три изомера:
2. Изомерия положения обусловлена различным положением кратной связи, функциональной группы или заместителя при одинаковом углеродном скелете молекул.
2.1. Изомерия положения функциональной группы. Например, существует два изомерных предельных спирта с общей формулой С3Н8О: пропанол-1 (н-пропиловый спирт) пропанол-2 (изопропиловый спирт):
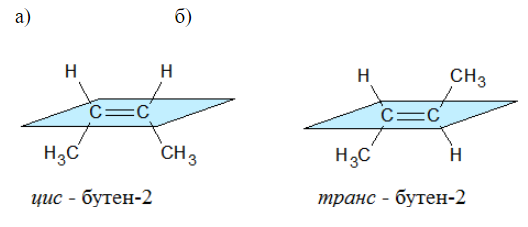
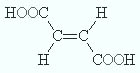
2.2. Изомерия положения кратной связи может быть вызвана различным положением кратной (двойной или тройной) связи в непредельных соединениях. Например, в бутене-1 и бутене-2:
2.3. Межклассовая изомерия – ещё один вид структурной изомерии, когда вещества из разных классов веществ имеют одинаковую общую формулу.
Например, формуле С2Н6О соответствуют: спирт (этанол) и простой эфир (диметиловый эфир):
Пространственная изомерия
Пространственные изомеры – это вещества с одинаковым составом и химическим строением, но с разным пространственным расположением атомов в молекуле. Виды пространственной изомерии – геометрическая (цис—транс) и оптическая изомерия.
1. Геометрическая изомерия (или цис-транс-изомерия).
Геометрическая изомерия характерна для соединений, в которых различается положение заместителей относительно плоскости двойной связи или цикла. Например, для алкенов и циклоалканов.
Двойная связь не имеет свободного вращения вокруг своей оси.
Поэтому заместители у атомов углерода при двойной связи могут быть расположены либо по одну сторону от плоскости двойной связи (цис-изомер), либо по разные стороны от плоскости двойной связи (транс-изомер). При этом никаким вращением нельзя получить из цис-изомера транс-изомер, и наоборот.
Например, бутен-2 существует в виде цис— и транс-изомеров
1,2-Диметилпропан также образует цис-транс-изомеры:
Геометрические изомеры различаются по физическим свойствам (температура кипения и плавления, растворимость, дипольный момент и др.). Например, температура кипения цис-бутена-2 составляет 3,73 оС, а транс-бутена-2 0,88оС.
При этом цис—транс-изомерия характерна для соединений, в которых каждый атом углерода при двойной связи С=С (или в цикле) имеет два различных заместителя.
Например, в молекуле бутена-1 CH2=CH-CH2-CH3 заместители у первого атома углерода при двойной связи (два атома водорода) одинаковые, и цис—транс-изомеры бутен-1 не образует. А вот в молекуле бутена-2 CH3—CH=CH-CH3 заместители у каждого атома углерода при двойной связи разные (атом водорода и метильная группа CH3), поэтому бутен-2 образует цис— и транс-изомеры.
Таким образом, для соединений вида СH2=СHR и СR2=СHR’ цис—транс-изомерия не характерна.
2. Оптическая изомерия
Оптические изомеры – это пространственные изомеры, молекулы которых соотносятся между собой как предмет и несовместимое с ним зеркальное изображение.
Оптическая изомерия свойственна молекулам веществ, имеющих асимметрический атом углерода.
Асимметрический атом углерода — это атом углерода, связанный с четырьмя различными заместителями.
Такие молекулы обладают оптической активностью — способностью к вращению плоскости поляризации света при прохождении поляризованного луча через раствор вещества.
Например, оптические изомеры образует 3-метилгексан:
Содержание
- 1 Определение
- 2 Структурная изомерия
- 2.1 Изомерия углеродного скелета
- 2.2 Изомерия положения кратной связи
- 2.3 Изомерия положения функциональной группы
- 2.4 Валентная изомерия
- 2.5 Межклассовая изомерия
- 3 Изомерия статическая и динамическая
- 4 Стереоизомерия
- 4.1 Цис-транс — изомерия (геометрическая)
- 4.2 Оптическая изомерия
- 5 Правила построения формул Фишера
- 6 Заключение
Органические соединения с одинаковым качественным и количественным составом – изомеры — могут отличаться по свойствам. Причиной является различное строение, которое определяет отношение веществ к классу соединений.
Чтобы определить класс недостаточно оперировать молекулярной формулой вещества – необходимо знать графическую формулу, которая показывает структурное и пространственное расположение атомов в молекуле.
Определение
Изомеры — это химические соединения с идентичным атомным составом, но различные по строению или пространственному расположению атомов. Изомеры имеют разные химические свойства.
Основные виды изомерии:
- структурные;
- пространственные.
Структурная изомерия
Структурные изомеры – химические вещества, при одинаковом качественном и количественном составе различающиеся порядком расположения атомов – строением вещества.
Выделяют шесть видов структурной изомерии:
Изомерия углеродного скелета
Пентан имеет три структурные формулы изомеров:
Изомерия положения кратной связи
При общей формуле пентен имеет два изомера, различающихся расположением двойной связи:
У изомеров положения кратной связи параллельно может быть изомерия углеродного скелета. Для пентена это:
Общее число структурных изомеров пентена равно пяти, из которого два изомера положения двойной связи и три изомера углеродного скелета.
Изомерия положения функциональной группы
К функциональным группам относятся фрагменты органических соединений, определяющие их свойства.
Для примера: -ОН гидроксильная, -СООН карбоксильная, -NH2 аминогруппа, -CN цианогруппа и другие.
Как выглядит изомерия положения можно рассмотреть на примере пентана и -Cl в качестве функциональной группы:
Хлорпентан имеет 3 положения функциональной группы, которые различаются между собой местом расположения заместителя на углеродной цепи.
Валентная изомерия
Изомеры, которые можно перевести из одного в другой путем перераспределения внутренних связей называют валентными. Внутримолекулярная перегруппировка является не катализируемым и не зависящим от растворителя процессом.
На внутримолекулярные изменения, влияет температура, в случае с бензолом Хюккеля УФ-облучение.
Пример:
бензол – у этого простейшего ароматического углеводорода, известны три валентных изомера:
Бензол Дьюара трансформируется в обычный бензол при t 20°С за 48 часов, при t 90°С для изомеризации достаточно 30 минут.
Преобразование бензола в бензвален (бензол Хюккеля) происходит при его облучении УФ-светом с определенной длиной волны.
Призман – самый нестабильный из изомеров бензола.
Межклассовая изомерия
Соединения, имеющие общую формулу, могут содержать функциональные группы, относящиеся к разным классам соединений.
Общую формулу имеют два вещества:
Изомерия статическая и динамическая
Различают типы изомерии:
- статическая – изомеры образуются в результате химического процесса изомеризации;
- динамическая – несколько изомеров существуют одномоментно и легко переходят друг в друга.
К статической относятся изомерия углеродного скелета, положения кратной связи, функциональной группы, межклассовая и валентная.
Пример динамической изомерии – прототропная таутомерия, при которой обратимая изомеризация происходит за счет перехода протона водорода внутри молекулы.
Это интересно:
Изомеры гексана
Изомеры пентена
Гомологический ряд алкенов
Стереоизомерия
В пространственных изомерах с одинаковой структурной формулой, атомы молекулы ориентированы в пространстве по-разному.
Чем же отличается структурная изомерия от пространственной: первая рассматривает порядок атомов в молекуле на плоскости, а вторая – в объеме.
Стереоизомерия делится на геометрическую (цис-транс) и оптическую.
Цис-транс — изомерия (геометрическая)
Геометрические изомеры присутствуют в веществах, имеющих двойные связи или циклы.
Подразделяют геометрические изомеры относительно плоскости, в которой расположена π-связь или закольцованный цикл.
Изомеры, у которых одинаковые заместители расположены по одну сторону от плоскости называют цис- изомерами.
Соединения, у которых заместители расположены по разные стороны от плоскости π-связь или кольца называют транс- изомерами.
Наглядной иллюстрацией могут служить простейшие геометрические изомеры — бутен-:
Оптическая изомерия
При исследовании веществ с одинаковой структурной формулой на поляриметре было выявлено явление вращения плоскости поляризованного света. Такие вещества получили название оптически активных веществ.
Исследования показали, что молекулы этих веществ хиральны, то есть несовместимы со своим отражением в зеркале. Хиральные вещества присутствуют в виде двух оптических антиподов (энантиомеров), один из которых правовращающий (+), а другой – левовращающий (-).
Определить знак оптического изомера можно с помощью поляриметра.
Причина хиральности состоит в присутствии ассиметрического атома углерода – связанного с четырьмя различными заместителями.
Хиральные молекулы невозможно совместить, так как они зеркально симметричны.
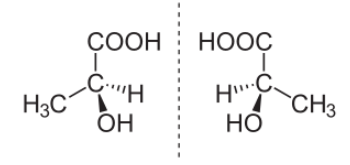
Пример пары стереоизомеров, представляющих зеркальные отражения:
(S)-(+)- Молочная кислота (слева) и (R)-(-)-Молочная кислота (справа).
Для изображения оптических изомеров используют проекционные формулы Э.Фишера.
Правила построения формул Фишера
Изображают стереоизомеры с ассиметрическим атомом углерода на плоскости в виде проекционных форм, предложенных в конце XIX века Э.Фишером.
Правила изображения проекции Фишера:
- Углеродный скелет располагается в пространстве вертикально, нумерация атомов углерода идет сверху вниз.
- Горизонтальные связи в проекции направлены к наблюдателю, а вертикальные – от него.
Правила пользования проекциями Фишера имеют ограничения:
- проекция корректна только в плоскости чертежа;
- нельзя разворачивать чертеж на 90° и 270°, так как вертикальные и горизонтальные линии меняются местами;
- допускается разворот на 180°.
Номенклатура стереоизомеров основана на правиле последовательности заместителей при асимметрическом атоме углерода по старшинству (определяется как порядковый номер в Периодической таблице). Учитывается направление уменьшения старшинства: падение по часовой стрелке обозначается как R, против – как S.
Заключение
Все виды изомерии органических соединений делят на две части – структурная изомерия и пространственная.
Изомеры, относящиеся к первой группе, различаются порядком соединения атомов, а ко второй – только их пространственным расположением. Классификация изомеров опирается на различия между ними. Изучение множества структурных и пространственных форм веществ стали возможны благодаря работам А.М.Бутлерова и Я.Г.Вант-Гоффа.
Изомерия (от греческих слов
«изос» – «равный» и «мерос» – «часть», «доля») — явление существования химических соединений — изомеров, — одинаковых по
составу и молекулярной массе, но различающихся по строению или расположению
атомов в пространстве и по свойствам.
Термин «изомерия» вёл в химию Й. Берцелиус
в 1830 году, а подлинное объяснение этот термин получил во второй половине 19
века на основе теории химического строения А. М. Бутлерова и стереохимического
учения Я. Вант-Гоффа.
Например, вам известно, что молекулярная формула бутана – С4Н10.
Бутан, в молекуле которого атомы расположены в виде линейной цепочки, называют
нормальным бутаном, а бутан, цепь атомов углерода которого разветвлена,
называют изобутаном. Эти два вещества имеют одинаковую молекулярную формулу, но
различаются по строению, а значит, и по свойствам.
Например, молекулярной формуле C2H6O соответствуют два
вещества с разными структурными формулами – этиловый спирт и
диметиловый эфир. Они также имеют одинаковый состав, по разное строение и
свойства. Этиловый спирт – жидкость, которая реагирует с металлическим
натрием с выделением водорода, кипит при +78,5 0С. При тех же
условиях диметиловый эфир – газ, не реагирующий с натрием, кипит при -23 0С.
Существуют два основных типа изомерии. Это структурная и пространственная.
Структурные изомеры – это изомеры, имеющие различный порядок
соединения атомов в молекуле.
Пространственные изомеры – это изомеры, которые имеют одинаковые
заместители у каждого атома углерода, но отличаются их взаимным расположением в
пространстве.
Различают три вида структурной изомерии. Это изомерия углеродного
скелета, обусловленная различным порядком связи атомов углерода, изомерию
положения, обусловленную различным положением функциональных групп или
кратных связей при одинаковой углеродной цепи.
Изомерия углеродного скелета характерна для любых классов
органических соединений. Например, для вещества С4Н10 изомерами
будут бутан и 2-метилпропан, для С5Н8 – это пентин и
3-метилбутин-1, для С5Н10О2 – это пентановая
кислота и 2-метилбутановая кислота, 3-метилбутановая кислота, для С5Н12О
– это пентанол-1 и 2-метилбутанол-1, для С4Н8О2
– это пропилметаноат и изопропилметаноат.
Если рассмотреть изомерию положения кратной связи или функциональной
группы, то существуют структурные изомеры с одинаковым углеродным скелетом,
которые отличаются положением кратных связей (двойных и тройных) или
функциональных групп.
Например, изомерия положения кратных связей характерна для алкенов,
алкинов и диенов. Так, изомерами по отношению друг к другу будут бутен-1 и
бутен-2, бутин-1 и бутин-2, бутадиен-1,2 и бутадиен-1,3. Изомерия положения
функциональных групп характерна для спиртов и аминов. Так пропанол-1 и
пропанол-2 будут по отношению к друг другу изомерами, как и
бутанамин-1 и бутанамин-2, α-аминопропановая кислота и
β-аминопропановая кислота.
В межклассовой изомерии вещества относятся к различным классам
органических соединений, как этанол и диметиловый эфир имеют общую формулу – С2Н6О
или бутин-1 и бутадиен-1,3, относящиеся к классам алкинов и диенов, а также
этановая кислота и метилметаноат (то есть насыщенные одноосновные карбоновые
кислоты и сложные эфиры).
Различают два вида пространственной изомерии: геометрическую и
оптическую. Геометрическая изомерия характерна для соединений с двойной
углерод-углеродной связью. Так для молекулы бутена-2 характерно 2 изомера:
цис-изомер и транс-изомер. У цис-изомера одинаковые
группы атомов находятся по одну сторону от плоскости, а у транс-изомера
– по разные стороны.
Другим примером пространственных изомеров являются циклические α- и
β-формы глюкозы, различающиеся положением гидроксильных групп у первого
атома углерода.
Оптической изомерией обладают только те вещества, у которых есть асимметрический,
или хиральный атом (от греческого хирос – «рука», «образец
несимметричной фигуры»), то есть это атом, который связан с четырьмя различными
заместителями. Оптические изомеры являются зеркальным изображением друг друга,
подобно двум ладоням и несовместимы. Так, молочная кислота, или
2-оксипропановая кислота, существует в виде двух оптических изомеров, потому
что она содержит 1 асимметрический атом углерода.
Оптическая изомерия называется также энантиомерией (от
греческого enantios – «противоположный» и meros –
«часть»), а оптические изомеры – энантиомерами. У
хиральных молекул возникают изомерные пары, в которых молекулы изомеров
различаются пространственной организацией, точно также, как предмет и его
зеркальное отражение. Пара таких изомеров имеют, как правило, одинаковые
химические и физические свойства, но разную оптическую активность: если один
изомер вращает плоскость поляризованного света по часовой стрелке, то другой –
обязательно против. Тогда один изомер называют правовращающим, а второй –
левовращающим.
Изомерия органических соединений
Изомерия –
явление существования изомеров,
веществ, имеющих одинаковую молекулярную
формулу, но разное химическое строение
(разные структурные формулы), и по этой
причине различающихся по физическим
или химическим свойствам.
Различают два
основных типа изомерии – структурную
и
пространственную.
Структурная
изомерия:
1. Изомерия
углеродного скелета,
обусловленная различным порядком связи
атомов углерода.
Например, циклобутан
и метилциклопропан:
|
|
|
|
Циклобутан |
Метилциклопропан |
2. Изомерия
положения,
обусловленная различным положением
функциональных групп или кратных связей
при одинаковом углеродном скелета:
|
|
|
|
|
|
бутанол-1 |
бутанол-2 |
бутен-1 |
бутен-2 |
Разновидность
этого вида изомерии – существование
соединений с различным взаимным
расположением функциональных групп
или кратных связей (т.н. изомерия взаимного
расположения), например
|
|
|
|
ά-аминопропионовая кислота |
β-аминопропионовая кислота |
Важную роль играет
изомерия положения у соединений
ароматического ряда, так как положение
заместителей в бензольном ядре определят
и их реакционную способность. Например,
1,2-динитробензол и 1,4-динитробензолы
легко реагируют с аммиаком, тогда как
1,3-динитробензол в реакцию с NH3 не
вступает.

3. Межклассовая.
Во всех приведенных выше примерах
изомеры имеют одинаковую химическую
природу, однако структурные изомеры
могут принадлежать к разным классам
органических соединений, например
дивинилацетилен и бензол (С6H6)
|
|
|
|
Дивинилацетилен |
Бензол |
4. Особым видом
структурной изомерии является таутомерия
(равновесная
динамическая изомерия) – существование
вещества в двух или более изомерных
формах, легко переходящих друг в друга:

Пространственная
изомерия:
1. Геометрическая
изомерия –
наблюдается в соединениях, содержащих
жесткий фрагмент, т.е. двойную связь или
цикл. Атомы или группы атомов могут
располагаться по-разному относительно
этого жесткого фрагмента. Полученное
их расположение называется – конфигурация.
Для соединений с
двойной связью возможность геометрической
изомерии возникает при наличии двух
неодинаковых заместителей у каждого
из атомов, связанных двойной связью.
|
|
|
|
цис-изомеры |
транс-изомеры |
|
|
|
|
малеиновая
(цис-1,2-этилендикарбоновая |
фумаровая кислота
(транс-1,2-этилендикарбоновая |
Как двойная связь,
так и цикл являются жесткими и препятствуют
вращению атомов или групп атомов вокруг
линии связи. Два заместителя могут
располагаться по разные стороны кольца
или по одну сторону. В первом случае это
— транс-изомеры, во втором — цис-изомеры.
|
|
|
|
цис-1,2-диметилциклопентан |
транс-1,2-диметилциклопентан |
Цис-изомеры –
более полярные, более растворимы в
полярных растворителях, более
высококипящие, но низкоплавкие, менее
устойчивые.
Транс-изомеры –
менее полярные, менее растворимые в
полярных растворителях, более низкокипящие,
но более высокоплавкие, более устойчивые.
Химические
свойства геометрических изомеров схожие
(вступают в одни и те же типы реакций),
но не идентичные (различные по активности,
реакционной способности). Для перевода
одного изомера в другой необходимо
разорвать двойную связь или цикл. Это
происходит или при УФ-облучении или при
нагревании.
Геометрические
изомеры превращаются друг в друга
вращением вокруг связи после разрыва
двойной связи.
Для названия
геометрических изомеров используется
также E,Z
номенклатура.
E,Z-номенклатура носит более универсальный
характер.
|
|
|
|
Z-бутен-2 |
E-бутен-2 |
|
Z (zusammen-вместе) |
E (entgegen-напротив) |
Рассмотрим
правила построения названия:
-
Определяют
относительное старшинство заместителей
у каждого атома, несущего двойную связь.
Старшинство атомов определяется их
положением в периодической системе.
Атом с большим порядковым номером или
массой считается старшим. Если в первом
уровне стоят одинаковые атомы, то
рассматривают второй уровень и так
далее до первого отличия. -
Если старшие
заместители располагаются по одну
сторону от линии двойной связи,
конфигурация двойной связи обозначается
буквой Z (от немецкого “zusammen” – вместе),
если по разные – E (“entgegen” – напротив). -
Буквы Z,E располагают
перед названием с указанием номера
двойной связи.
Примеры:


Аналогом
цис-транс-изомерии относительно связи
С=С является син-анти-изомерия
относительно связей C=N или N=N (анти
соответствует транс, син – цис).
Например, азобензол
обычно существует в анти-конфигурации,
а при УФ-облучении появляется менее
стабильный син-изомер:
|
|
|
|
анти-азобензол |
син-азобензол |
2. Оптическая
изомерия
Оптическая изомерия
была открыта еще задолго до теории
химического строения, т.е. в начале 19
столетия. Было найдено, что при пропускании
поляризованного света через некоторые
вещества, они вращают (отклоняют)
плоскость поляризации плоскополяризованного
света на некоторый угол. Причем находятся
всегда два изомера, которые отклоняют
на одну и ту же величину угла, но в разные
стороны. Такая способность получила
название оптической активности, а
вещества, обладающие такими свойствами,
стали называть оптически активными.
Начнем с того, что
дело имеют с плоскополяризованным
светом. В поляризованном свете поперечное
колебание совершается только в одной
плоскости, перпендикулярной направлению
распространения светового луча. Плоскость
поляризации – плоскость перпендикулярная
к плоскости поперечных колебаний.
Явление оптической
изомерии обнаруживают с помощью прибора
поляриметра (рис.1, 2).
|
|
|
Рисунок 1 – Схематическое изображение |
Соединения, которые
изменяют (вращают) плоскость поляризации,
называют оптически
активными,
и они существуют в виде двух оптических
изомеров. Один из них вращает плоскость
поляризации вправо, а другой — на тот же
угол, но влево (рис.). Для обозначения
этих вращений используют знаки (+) и (-),
которые ставят перед формулой оптического
изомера. Изомеры, которые вращают
плоскость поляризации в разные стороны,
но на один и тот же угол, называют
антиподами
(или энантиомерами
(от греч. enantio — противоположный). Смесь,
состоящая из равных количеств левого
и правого изомеров (антиподов), известна
как рацемическая
смесь, или
рацемат,
и обозначается или буквой r. Рацематы
образуются при синтезе вещества в том
случае, когда вероятность образования
каждого из оптических антиподов
одинакова. Поэтому рацемическое вещество
оптически неактивно в результате
взаимной компенсации активностей
входящих в него оптических изомеров.
|
|
|
Рисунок 2 – Изменение плоскости |
Почему некоторые
органические соединения являются
оптически активными? Ответ на этот
вопрос был дан на основании тетраэдрической
теории Я. Вант-Гоффа и А. Ле-Беля (1874).
Независимо друг от друга эти ученые
отметили, что все оптически активные
вещества содержат в своих молекулах
хотя бы один асимметрический атом
углерода (в формулах этот атом
обозначается звездочкой), т.е. углерод,
который связан с четырьмя различными
атомами или группами атомов (рис. 3).
Такая система лишена практически всех
элементов симметрии. При взаимодействии
с асимметрическим углеродным атомом,
у которого все четыре заместителя
отличаются по своему геометрическому
и электронному строению, электромагнитная
волна света «деформируется», что
и приводит к повороту плоскости
поляризации.
|
|
|
|
Рисунок 3 – |
Любое органическое
соединение, содержащее асимметрический
углеродный атом, можно представить в
виде двух пространственных форм
(моделей), которые при наложении в
пространстве не могут быть совмещены
друг с другом (рис. 4). Эти две формы
(модели) отличаются друг от друга как
предмет от своего зеркального изображения.
Поэтому такая изомерия получила название
«зеркальной». Молекулы (или их
модели), которые нельзя совместить в
пространстве (при наложении) и которые
относятся друг к другу как предмет к
своему зеркальному изображению, называют
хиральными
(от греч. хейрос — рука, рукоподобие).
Примером могут служить руки — правая и
левая, которые при наложении не
совмещаются. Таким образом, оптическая
изомерия
– это явление, обусловленное хиральностью.
Если молекула идентична своему зеркальному
изображению, она ахиральна.
|
|
|
Рисунок 4 – |
Существование
хиральности в органических соединениях
не обязательно связано с наличием атома
углерода, имеющего четыре различных
заместителя. Во-первых, помимо соединений
углерода хиральностью обладают другие
органические соединения, имеющие
четырехсвязные атомы, например кремния,
азота и фосфора. Во-вторых, хиральностью
обладают молекулы, формально не содержащие
стереогенного центра. Наличие оптической
изомерии может быть обусловлено также
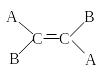
наличием стереогенной оси (рис.5,
соединения а
и б)
или плоскости (рис.5, соединения в
и г).

Рисунок 5 – Примеры
молекул, содержащих стереогенную ось
(а и б) и плоскость (в и г)
Если молекула
содержит более одного стереогенного
центра, то число оптических изомеров
определяют по формуле 2n,
где n – число стереогенных центров.
Стереоизомеры, не
являющиеся энантиомерами, называются
диастереомерами.
Например, молекула 2,3-дигидроксибутаналя
имеет два стереогенных центра (рис.6,
отмечены звездочками) и следовательно
22=4 оптических изомера. Изомеры а
и б,
как и в
и г
представляют
пары энантиомеров. Изомеры а
и в
или г
являются диастереомерами. Их называют
диастереоизомерами или диастререомерами.
Они различаются не только по отношению
к плоскополяризованному свету, но и по
физическим и химическим свойствам, т.к.
расстояния между функциональными
группами разные.

Рисунок 5 –
Оптические изомеры молекулы
2,3-дигидроксибутаналя
Для изображения
оптических изомеров на плоскости чаще
всего используют проекционные
формулы Фишера.
Например, формула 2-бромбутана в проекции
Фишера изображается следующим образом:

Атомы или группы,
лежащие на горизонтальной линии, должны
рассматриваться как направленные к
наблюдателю, а атомы или группы,
находящиеся на вертикальной линии и
составляющие, как правило, главную цепь
рассматриваются как идущие за плоскость
листа бумаги. Существуют правила
обращения с проекционными формулами
Фишера,
основные из которых:
а) фишеровские
проекции нельзя выводить из плоскости;
б) фишеровские
проекции можно поворачивать в плоскости
только на 180 градусов:
в) в фишеровских
проекциях любое четное число перестановок
заместителей у центрального атома не
изменяет стереохимического смысла
формулы, а нечетное число перестановок
заместителей приводит к формуле
оптического изомера.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
РАБОЧИЕ ТЕТРАДИ
Продолжение. Начало см. в № 15/2004
Явление существования разных по строению и
свойствам веществ, у которых одинаковый
качественный и количественный состав, носит
название и……. .
Вещества, у которых одинаковая м……….. формула,
но разные с………. формулы – это и……
(табл. 2).
Таблица 2
Примеры изомерных углеводородов
| Молекулярная формула | Структурные формулы |
|---|---|
| С4Н10 | СН3СН2СН2СН3,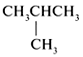 |
| С5Н12 | СН3СН2СН2СН2СН3,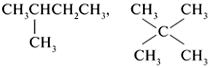 |
| С6Н14 | СН3(СН2)4СН3,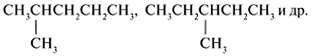 |
 |
Найди девять отличий |
Правила составления изомеров на
примере соединения С5Н11Сl.
1. Записывают линейную углеродную цепь С5:
С–С–С–С–С.
2. Определяют, к какому классу углеводородов
принадлежит данное соединение. Определение
производят с помощью общих формул для
углеводородов разных классов (CnH2n+2,
CnH2n и т. п.). Вещество С5Н11Сl
– хлоралкан, т.е. является производным алкана
вида CnH2n+2 (n = 5), в котором
один атом Н замещен на Cl. Значит, все связи в
молекуле одинарные и нет циклов.
3. Нумеруют атомы С углеродной цепи (углеродного
скелета) и при С-1 помещают гетероатом Cl:
4. Записывают необходимое число атомов водорода
при каждом углероде цепи, учитывая, что
валентность С – IV. В результате получают изомер
а):
5. Перемещают атом хлора по главной цепи С5,
последовательно соединяя его с атомами С-2 и С-3.
Так получают изомеры б) и в):
Дальнейшее смещение хлора вправо по цепи новых
изомеров не дает. Так, изомер а*) тождественен
изомеру а), изомер б*) идентичен изомеру б). Просто
в изомерах а*) и б*) меняется направление
нумерации атомов С, счет ведется справа налево
(без звездочек было слева направо):
6. Исходя из углеродного скелета (см. пункт 3),
крайний (пятый) атом С отрывают и помещают
заместителем к внутреннему углероду цепи
(сначала к С-2, потом к С-3). Получают главные цепи С4
с углеродным заместителем при С-2 и С-3:
Записывают структурные формулы новых изомеров:
7. Помещая хлор при внутренних атомах С главной
углеродной цепи С4, получают два
дополнительных изомера:
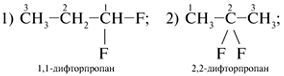
8. Вещество формулы С5Н11Сl может
иметь трехуглеродную главную цепь С3:
Таким образом, для вещества с молекулярной
формулой С5Н11Сl можно составить
восемь структурных формул изомеров а)–з),
различающихся строением.
Упражнения.
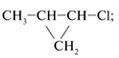
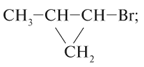
1. Для каждого из веществ: С2Н4Br2,
С3Н7Сl, С4Н8 – составьте
структурные формулы двух изомеров. На примере
одной пары изомеров укажите, в чем сходство и
различие этих соединений.
2. Составьте все структурные формулы
изомеров вещества состава С3Н6F2,
назовите эти соединения.
3. Какие из приведенных ниже веществ
являются изомерами?
а) Cl(CH2)6Cl;
б) Cl(CH2)6CН3;
в) Cl2СН(CH2)4CН3;
г)
д)
е)
ж)
4. Назовите все соединения из задания
3.
5. Составьте молекулярные формулы
углеводородов гомологического ряда метана, в
составе которых: а) 14 атомов углерода; б) 14 атомов
водорода; в) всего 14 атомов (С и Н).
6. При хлорировании пропана получают
смесь изомерных дихлорпропанов. Напишите
структурные формулы этих изомеров.
7. Напишите структурную формулу
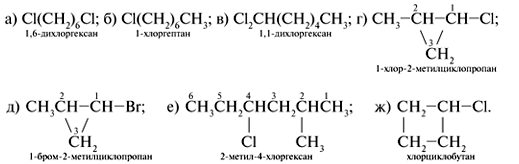
изомера дибромтетрафторэтана, в молекуле
которого атомы галогенов расположены
симметрично относительно атомов углерода.
Вычислите содержание углерода (в процентах) в
этом соединении.
Урок 4. Ковалентные связи
органических соединений
Органические соединения обладают молекулярным
строением. Напомним, молекулы – устойчивые
группы атомов (двух или более). Связи между
атомами внутри молекул значительно сильнее, чем
между атомами разных молекул. Например,
внутримолекулярные и межмолекулярные связи в
углекислом газе:
Для молекулярных соединений углерода
характерна ковалентная связь.
Ковалентная связь – химическая связь,
возникающая между двумя атомами при спаривании
(обобществлении) электронов, причем каждый из
этих атомов отдает по одному электрону в общее
пользование. Связывающие электронные пары
принадлежат как одному, так и другому атому.
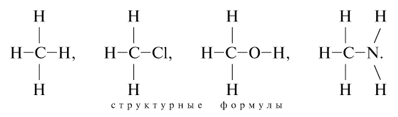
Например:
Здесь точками при атомах обозначены валентные
электроны, т.е. электроны внешнего
энергетического уровня элемента.
Ковалентная связь обычно возникает между
атомами неметаллов, имеющими близкие значения
электроотрицательности (ЭО). Так, ЭО(С) = 2,5, ЭО(Н) =
2,1, ЭО(О) = 3,5, ЭО(Сl) = 3,0, ЭО(Br) = 2,8, ЭО(N) = 3,0.
Образование молекулы метана СН4 из атомов С
и Н можно показать так:
Запись химического состава молекулы, где
каждый атом со своими валентными электронами
указан отдельно, а общие электронные пары
помещены между связываемыми атомами, называют электронной
формулой молекулы.
Если общие электронные пары изображать в виде
черточек, то получают графические или
структурные формулы:
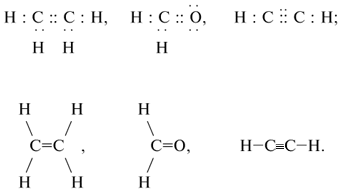
Помимо простых (одинарных) связей, в создании
которых участвует пара электронов, в
органических молекулах встречаются двойные и
тройные связи. Такие связи образуют две или три
пары электронов соответственно. Например:
При образовании химических соединений атомы (С,
N, О, F и др.) стремятся дополнить свои валентные
оболочки до устойчивой восьмиэлектронной
конфигурации, характерной для атомов
благородных газов (Nе, Ar, Кr). Такая особенность
атомов называется правило октета.
(Отметим, что при образовании ковалентной связи
атом водорода приобретает устойчивую
двухэлектронную конфигурацию, как в атоме
благородного газа гелия Не.)
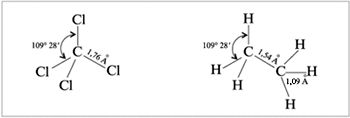
Каждая химическая связь имеет точную численную
характеристику. В нее входят геометрические
параметры – длина связи и валентный угол,
энергия связи (Eсв), а также электронные
параметры – полярность и поляризуемость.
Длина связи – это расстояние между
центрами связанных атомов. Длины связей лежат в
пределах 1–2 (1
(ангстрем) = 10–10
м).
Валентный угол – угол между
направлениями двух химических связей при одном
атоме.
Пространственное строение молекул СCl4 и С2Н6
изображено ниже.
|
|
Длины связей и валентные углы
|
Энергия связи – это энергия,
которую необходимо затратить на расщепление 1
моль молекул с этой связью (например, Н3С–СН3).
Полярность связи указывает на характер
распределения электронной плотности между
связанными атомами А–В. Более
электроотрицательный элемент (В) оттягивает на
себя электронную плотность связывающей
электронной пары и приобретает частичный
отрицательный заряд. Такой же по величине, но
противоположный по знаку положительный заряд
приобретает элемент А. Подобные частичные заряды
обозначают знаками – и
+.
Например, для молекулы воды:
Полярность связи определяет реакционные
возможности связанных атомов. Полярность
дипольных систем А–В выражают в виде дипольного
момента (в дебаях,
D) – произведение величины заряда на расстояние
между полюсами.
Поляризуемость – способность
химической связи изменять (увеличивать) свою
полярность под действием приближающейся в ходе
реакции молекулы.
Таблица 3
Физико-химические характеристики
ковалентных связей
| Тип связи |
Длина, |
Eсв, кДж/моль |
Дипольный момент, D |
Поляри- зуемость |
|---|---|---|---|---|
| С–С | 1,54 | 83 | 0 | 1,3 |
| С=С | 1,33 | 148 | 0 | 4,2 |
| С |
1,20 | 194 | 0 | 6,2 |
| Н–С | 1,09 | 99 | 0,4 | 1,7 |
| Н–О | 0,96 | 111 | 1,5 | 1,7 |
| С–О | 1,43 | 82 | 0,7 | 1,5 |
| С=О | 1,21 | 169 | 2,4 | 3,3 |
| С–Cl | 1,76 | 79 | 1,5 | 6,5 |
Упражнения.
1. Обозначьте ковалентные связи
шифром КС, а ионные связи – ИС между следующими
элементами:
2. Подчеркните формулы веществ
молекулярного строения:
Са, СаО, СО2, СН4, MgCl2,
ССl4, С2Н4, СН2О.
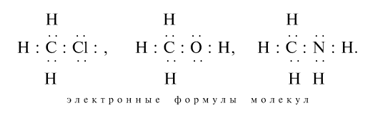
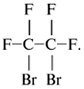
3. Напишите электронные формулы
следующих соединений (покажите также свободные
электронные пары, не участвующие в образовании
химических связей):
СН3ОН, СН3Сl, NH3, (СН3)2O,
СН3NН2.
4. В каких из приведенных пар
соединений химическая связь более полярная:
а) Н2О и H2S; б) НСl и НI; в)
СН4 и NН3? Поясните свой ответ.
5. Сколько валентных электронов в
атомах элементов: Na, С, Са, О, N, Сl?
6. Молекулы СО2, Н2О, NН3,
СН4 имеют следующее строение:
Какие из этих молекул полярные и являются
электрическими диполями?
7. Сколько связывающих электронных пар
в следующих соединениях:
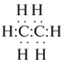
СО2, СН2О, С2Н6, С2Н2?
8. Укажите расстояния между центрами
крайних атомов в предположении, что все атомы
лежат на одной прямой:
Ответы на упражнения к теме 1
Урок 3
1.
| Молекулярная формула |
Структурные формулы изомеров |
|---|---|
| С2Н4Вr2 | 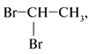 Вr–СН2–СН2–Br |
| С3Н7Cl | Cl–CН2–CН2–СН3, |
| С4H8 | CН2=CН–CН2–СН3 (a), |
Для изомеров общей формулы С4Н8
сходство: 1) одинаковая молекулярная формула;
2) в каждом из них имеются группы атомов СН3,
СН и две группы СН2; различия: 1) а –
алкен, б – циклоалкан, т.е. принадлежат к разным
классам углеводородов; 2) а – линейный изомер и
содержит двойную связь С=С, б – циклический
изомер и все связи С–С одинарные.
2. Изомеры состава С3Н6F2:
3. Изомеры имеют одинаковые
молекулярные формулы, это: а и в, б и е, г и ж.
4.
5. Воспользуемся общей формулой
углеводородов ряда метана (алканов) – СnH2n+2:
а) n = 14, С14Н30;
б) 2n + 2 = 14, n = 6, С6H14;
в) n + 2n + 2 = 14, n = 4, C4H10.
6. Изомеры дихлорпропана: Сl2СНСН2СН3,
СН3ССl2CH3, ClСН2СН2СН2Сl,
ClСН2СНСlСН3.
7. Симметричный дибромтетрафторэтан:
Молекулярная масса М(С2Вr2F4)
= 2•12 + 2•80 + 4•19 = 260 г/моль. Массовая доля углерода
(в %) в С2Br2F4: %(C) = (2Ar(C)/Mr(C2Br2F4))•100%
= (2•12/260)•100 = 9,23%.
Урок 4
1.
2. Подчеркнуты формулы веществ
молекулярного строения:
Са, СаО, СО2, СН4, МgCl2,
ССl4, С2H4, CH2O.
3. Электронные формулы молекул:
4. Сравнение полярности химической
связи в соединениях:
а) H2O > H2S; б) HCl > HI; в) CH4 < NH3.
Значения электроотрицательности (ЭО)
элементов:
Чем больше разность ЭО связанных элементов, тем
выше полярность химической связи.
5. Валентные электроны элементов:
6. В молекулах СО2, Н2О, NН3
связи полярные с частичным отрицательным
зарядом – на
атомах О и N. Из-за близкого значения
электроотрицательности атомов углерода (2,5) и
водорода (2,1) связи С–Н практически неполярные.
По причине симметричного строения молекул О=С=О
(линейная) и СН4 (тетраэдрическая) они в
целом неполярные и не являются электрическими
диполями. Молекулы Н2О и NH3
представляют собой диполи типа c
+
на атомах водорода и – на кислороде и азоте.
7.
| Формулы молекул с обозначением связывающих электронов |
 |
|||
| Число общих электронных пар |
4 | 4 | 7 | 5 |
8.