Загрузить PDF
Загрузить PDF
В быту под pH подразумевают обычно шкалу, используемую для описания нейтральности или, наоборот, недостатка нейтральности того или иного вещества. В научном значении величина pH соответствует количеству ионов в химическом растворе. Если вы изучаете химию или связанные с ней предметы, вам может понадобиться рассчитать уровень pH, основываясь на концентрации веществ в растворе. Значение pH находится по следующей формуле: pH = -lg[H3O+].
-
1
Ознакомьтесь с понятием pH. Величина pH соответствует концентрации ионов водорода в растворе. Раствор с повышенной концентрацией ионов водорода называется кислотным, а раствор с пониженной концентрацией этих ионов – щелочным.[1]
Ионы водорода кратко обозначают как H+. Их можно представлять и в составе соединения, тогда они называются гидроксонием и записываются как H30+.- Ознакомьтесь со шкалой pH. Значения на шкале pH изменяются от 1 до 14. Чем меньше число, тем более кислотным является данный раствор. И наоборот, чем выше значение, тем более щелочным является раствор.[2]
Например, pH апельсинового сока составляет 2, поскольку этот сок представляет собой довольно кислотную жидкость. У хлорного отбеливателя pH равно 12, так как в нем много щелочи.[3]
В середине шкалы располагаются относительно нейтральные растворы, такие как вода, pH которой составляет 7. - Разница между двумя растворами на 1 пункт по шкале pH означает, что они различаются по кислотности в 10 раз. Например, если взять два раствора со значениями pH 6 и 7, кислотность первого раствора с pH 6 будет выше кислотности второго раствора с pH 7 в 10 раз. А, например, кислотность раствора с pH 6 выше кислотности раствора с pH 8 в 100 раз.[4]
- Ознакомьтесь со шкалой pH. Значения на шкале pH изменяются от 1 до 14. Чем меньше число, тем более кислотным является данный раствор. И наоборот, чем выше значение, тем более щелочным является раствор.[2]
-
2
Запомните уравнение для определения pH. Шкала pH вычисляется с помощью отрицательного десятичного логарифма. Отрицательный десятичный логарифм соответствует числу нулей, стоящих перед единицей, включая и ноль целых: например, отрицательный десятичный логарифм числа 0,1 равен 1, числа 0,01 — 2, и так далее.[5]
Формула для нахождения pH выглядит следующим образом: pH = -lg[H3O+].- Иногда формулу записывают в виде pH = -lg[H+]. Неважно, стоит ли в уравнении H3O+ или H+, обе формы записи равноценны.
- Для нахождения pH необязательно уметь рассчитывать десятичный логарифм, так как практически в каждом научном или инженерном калькуляторе есть опция его вычисления.
-
3
Ознакомьтесь с понятием концентрации. Концентрация какого-либо вещества соответствует числу частиц этого вещества, присутствующих в растворе.[6]
Как правило, концентрация выражается в количестве молей на единицу объема и обозначается как m/V, или M. В химических лабораториях концентрации растворов пишут на бутылках с ними. Если вы решаете химическую задачу, концентрация может быть дана в условии, либо ее требуется найти.Реклама
-
1
Вспомните формулу для нахождения pH. Вот эта формула: pH = -lg[H3O+].[7]
Убедитесь в том, что вы знакомы со всеми элементами, входящими в данную формулу. Посмотрите, какая величина соответствует концентрации.- В химии квадратные скобки означают концентрацию чего-либо. Так что формула для расчета pH читается как «pH равно отрицательному логарифму концентрации гидроксоний-ионов».
-
2
Определите действительную концентрацию. Внимательно прочитайте условие задачи. Найдите в исходных данных концентрацию кислоты или щелочи. Запишите полную формулу на листке бумаги, подставив в нее известные величины.[8]
Чтобы не возникло путаницы, рядом с числами всегда указывайте единицы измерения.- Например, если концентрация составляет 1,05 x 105 M, запишите формулу для расчета pH в следующем виде: pH = -lg[1,05 x 105 M]
-
3
Вычислите pH. Для этого удобно использовать научный калькулятор. Сначала введите знак минуса, нажав кнопку «+/-». Затем нажмите кнопку «log», соответствующую десятичному логарифму (в английском языке десятичный логарифм обозначается как log). На экране отобразится «-log».[9]
Затем нажмите левую скобку и введите концентрацию. При необходимости не забудьте указать значение степени.[10]
После этого закройте скобки.[11]
В результате на экране калькулятора вы увидите «-log(1,05×105). Нажмите «=». У вас должно получиться значение pH, приблизительно равное 4,98.Реклама
-
1
Определите, что дано и что требуется найти. Запишите формулу для вычисления pH. После этого выясните известные величины, выписав их значения под формулой. Например, если известно, что pH равно 10,1, запишите это число под pH в формуле.
-
2
Преобразуйте формулу. При этом вам понадобятся знания из школьного курса алгебры. Для вычисления концентрации по известному значению pH необходимо преобразовать формулу так, чтобы концентрация обособленно стояла с какой-либо из двух сторон уравнения. То есть необходимо, чтобы по одну сторону знака равенства было выражение, содержащее величину pH, а по другую — концентрация гидроксония. Сначала умножьте обе части уравнения на -1. Затем возведите 10 в степени, стоящие по обе стороны получившегося равенства.
- Преобразовывая равенство pH = -log[H3O+], получаем формулу +[H3O+] = 10-pH, то есть концентрация ионов равна десяти в степени -pH. Теперь вместо pH подставляем известное значение, в нашем случае 10,1.
-
3
Решите уравнение. Для возведения десяти в степень в калькуляторе предусмотрена определенная процедура. Сначала наберите 10. Затем нажмите клавишу возведения в степень «EXP». Введите знак минуса и значение степени. Нажмите «=».
- В нашем примере pH равно 10,1. Наберите «10» и нажмите клавишу «EXP». После этого нажмите «-/+», меняя знак. И наконец, введите значение pH «10,1» и нажмите клавишу «=». В результате у вас должно получиться 1e-100. Это означает, что концентрация составляет 1,00 x 10-100 M.
-
4
Обдумайте полученный ответ. Имеет ли он физический смысл? Если pH равно 10,1, это значит, что концентрация гидроксония чрезвычайно мала, и у вас щелочной раствор.[12]
Таким образом, найденная очень низкая концентрация соответствуетРеклама
Советы
- Если вычисление уровня pH поначалу кажется вам трудным, не забывайте, что существует множество источников, позволяющих больше узнать об этом вопросе. Воспользуйтесь учебником химии или попросите преподавателя помочь вам.
Реклама
Об этой статье
Эту страницу просматривали 130 471 раз.
Была ли эта статья полезной?
Download Article
Download Article
You can calculate the pH of a chemical solution, or how acidic or basic it is, using the pH formula: pH = -log10[H3O+]. Anything less than 7 is acidic, and anything greater than 7 is basic. Check out the steps below to learn how to find the pH of any chemical solution using the pH formula.
-
1
Know what pH actually is. The pH is a measure of the concentration of hydrogen ions in a solution.[1]
A solution with a high concentration of hydrogen ions is acidic. A solution with a low amount of hydrogen ions is basic, or also known as alkaline. Hydrogen ions, also known as hydronium, are written shorthand as H+ or H3O+.[2]
- Know the pH scale. The pH scale is usually presented from 0 to 14. The lower the number, the more acidic the solution. The higher the number, the more basic the solution. For example, orange juice would have a pH of 2 because it is quite acidic. In contrast, bleach has a pH of 12 as it is quite basic. Numbers in the middle of the scale are neutral, such as water, with a pH of 7.
- One level of pH is a 10x difference. For example, when comparing pH 7 to pH 6, pH 6 is ten times more acidic than pH 7. Furthermore, pH 6 would be 100 times more acidic than pH 8.
-
2
Define pH in an equation. The pH scale is calculated by a negative logarithm. A negative logarithm of base b is simply how many times a number must be divided by b to reach 1.[3]
The pH equation can be seen as follows: pH = -log10[H3O+].[4]
- The equation can sometimes be seen as pH = -log10[H+]. Know that whether the equation has H3O+ or H+, they are the same.
- It is not vital to have a firm understanding of what a negative log is to calculate pH. Most calculators used at high school and post secondary level will have a log button.
Advertisement
-
3
Understand concentration. Concentration is the number of particles of a compound in a solution relative to the volume of the same solution.[5]
For pH, you have to use molar concentration for the formula to work out. Molar concentration, which is also called molarity, denotes the number of moles of dissolved compound per liter of solution. Its units are moles per liter (mol/L), also called molar (M). If you’re using a solution in a lab, the concentration will be written on the bottle. When working on your chemistry homework, the concentration will usually be given to you.[6]
Advertisement
-
1
Remember the pH equation. The pH equation is as follows: pH = -log10[H3O+].[7]
Ensure you know what all terms in the equation represent. Look at which term is used for concentration.- In chemistry, square brackets usually indicate «concentration of». So the equation of pH would be read as «pH equals the negative logarithm of the concentration of hydronium ions».
-
2
Identify the actual concentration. Read over your chemistry question. Identify the concentration of the acid or base. Write down the entire equation on paper with the known values represented in the equation.[8]
Always include units to avoid confusion.- For example, if the concentration is 1.05 x 10-5 M, write the pH equation as: pH = -log10(1.05 x 10-5 M)
-
3
Solve the equation. When solving the pH equation, you must use a scientific calculator. First, hit the “negative” button. It is usually written as “+/-”. Now key in the “log” button. Your screen should display “-log”.[9]
Now hit an open bracket and enter in your concentration. Don’t forget to add exponents when necessary.[10]
Follow with a closed bracket.[11]
At this point, you should see “-log(1.05×10^-5). Hit solve. Your pH should be approximately 4.98.
Advertisement
-
1
Identify the known unknowns. First write out the pH equation. Next, identify the values you have by writing them directly below your equation. For example, if you know the pH is a value of 10.1, write it on the paper below the pH equation.
-
2
Rearrange the equation. Rearranging the equation will require a strong understanding of algebra. To calculate concentration from pH, you must understand that the inverse of log10 is «10 to the power of …» Start by shifting the minus sign over from the log side to the pH side. Then raise 10 to the power of (each side). «10 to the power of» and log10 are inverses of each other and cancels out.[12]
- For example, pH = -log10[H3O+] will mold into [H3O+] = 10-pH. pH can then be filled in as 10.1
-
3
Solve the equation. When working with inverse log, the calculator process is unique. Remember that log is a type of multiplication by 10. To enter your equation, key in 10. Next, hit the “EXP” exponent button. Key in the negative sign followed by the value. Hit solve.
- For example, take a pH value of 10.1. Key in “10” followed by “EXP.” Now key in “-/+” to have our value be negative. Finally, key in the pH of “10.1”. Hit solve. You should get about 7.943ᴇ-11, or 7.943*10-11. This means our concentration is 7.943*10-11 M.
-
4
Think about your answer. A neutral pH of 7 equates to a hydronium ion concentration of 10-7 M. A solution with a pH of 10.1 is basic, so it will have less hydronium ions than that. If we look at our answer, 7.943*10-11, we do indeed see that this number is way smaller than 10-7, so our answer does make sense.[13]
Advertisement
Add New Question
-
Question
What are some natural indicators?
Dr. Chris Hasegawa was a Science Professor and the Dean at California State University Monterey Bay. Dr. Hasegawa specializes in teaching complex scientific concepts to students. He holds a BS in Biochemistry, a Master’s in Education, and his teaching credential from The University of California, Davis. He earned his PhD in Curriculum and Instruction from The University of Oregon. Before becoming a professor, Dr. Hasegawa conducted biochemical research in Neuropharmacology at the National Institute of Health. He also taught physical and life sciences and served as a teacher and administrator at public schools in California, Oregon, and Arizona.
Retired Science Professor & Dean
Expert Answer
Cabbage juice, celeries, and different kinds of flowers are all excellent, natural base indicators.
-
Question
What is the purpose of a titration lab?
Dr. Chris Hasegawa was a Science Professor and the Dean at California State University Monterey Bay. Dr. Hasegawa specializes in teaching complex scientific concepts to students. He holds a BS in Biochemistry, a Master’s in Education, and his teaching credential from The University of California, Davis. He earned his PhD in Curriculum and Instruction from The University of Oregon. Before becoming a professor, Dr. Hasegawa conducted biochemical research in Neuropharmacology at the National Institute of Health. He also taught physical and life sciences and served as a teacher and administrator at public schools in California, Oregon, and Arizona.
Retired Science Professor & Dean
Expert Answer
Titration labs let you titrate an unknown acid solution with a basic solution that you already know the pH and molarity of.
-
Question
What is the most accurate method of reading pH?
Dr. Chris Hasegawa was a Science Professor and the Dean at California State University Monterey Bay. Dr. Hasegawa specializes in teaching complex scientific concepts to students. He holds a BS in Biochemistry, a Master’s in Education, and his teaching credential from The University of California, Davis. He earned his PhD in Curriculum and Instruction from The University of Oregon. Before becoming a professor, Dr. Hasegawa conducted biochemical research in Neuropharmacology at the National Institute of Health. He also taught physical and life sciences and served as a teacher and administrator at public schools in California, Oregon, and Arizona.
Retired Science Professor & Dean
Expert Answer
A pH meter is the most accurate options, but most people don’t have those lying around at home. pH papers and other indicators can work, too.
See more answers
Ask a Question
200 characters left
Include your email address to get a message when this question is answered.
Submit
Advertisement
-
If calculating pH seems difficult to you, there are many sources available. Use your textbook and reach out to your teacher for further help.
Advertisement
References
About This Article
Article SummaryX
To calculate pH, remember that the pH scale goes from 0 to 14 with numbers below 7 being acidic and numbers above 7 being basic. If you are doing chemistry in a lab, you will need to determine the concentration by finding the moles per unit of volume (m/v or M). If you are doing a chemistry problem, look at the equation to identify the concentration. Then, use the formula pH = -log10[H3O+], where H equals Hydrogen ions, to find the pH. To learn how to use pH to calculate a concentration, keep reading!
Did this summary help you?
Thanks to all authors for creating a page that has been read 348,753 times.
Reader Success Stories
-
Roman Barasa
May 15, 2018
«I had been taught 3 times in class about pH calculations, but failed to grasp. However, I have now grasped this in…» more
Did this article help you?
Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований
В практике аналитической химии широко используются кислотно-основные реакции для разделения, растворения, определения ионов, создания условий для взаимодействия частиц в растворе и др. Поэтому необходимо научиться рассчитывать равновесные концентрации ионов ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-581.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-582.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-583.png)
Константа автопротолиза растворителя ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-585.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-586.png)
для воды ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-587.png)
для метанола
Учитывая, что активность чистого растворителя (стандартное состояние вещества) равна 1, справедливы выражения:
(в чистой воде ионная сила I мала, близки к 1);
При расчетах, связанных с кислотно-основным равновесием и кислотно-основными взаимодействиями в растворах слабых протолитов, считают табличные термодинамические значения констант ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-592.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-593.png)
В качестве характеристик кислотности используются отрицательные десятичные логарифмы активности (при приближенных расчетах без учета ионной силы — логарифмы концентрации) ионов лиония и лиата (для воды ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-594.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-595.png)
Для воды:
Соответственно: ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-598.png)
В чистой воде, нейтральном водном растворе:
Для метанола (см. также пример 3.7):
и нейтральному раствору в метаноле соответствует pH = 8,35.
Эти соотношения используют для вычисления равновесной концентрации одного из ионов растворителя, если концентрация другого известна.
При описании поведения сильных и слабых кислот и оснований следует помнить о том, что сильные протолиты в водных растворах диссоциируют практически полностью, степень диссоциации (ионизации) ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-602.png)
или (в упрощенном виде):
Из реакций следует, что для одноосновных протолитов в воде справедливо:
Если НА и В — кислотно-основная сопряженная пара и В соответствует ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-608.png)
а для растворителя
При растворении в воде солей, в состав которых входит анион слабой кислоты (![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-611.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-612.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-613.png)
Реакция гидролиза характеризуется константой равновесия, соответствующей протолитыческому поведению гидролизующейся частицы ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-614.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-615.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-616.png)
Например, для соли ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-617.png)
Для соли с катионом слабого основания, например ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-620.png)
(поскольку для сопряженных протолитов в воде ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-622.png)
Для соли, в которой и катион, и анион — ионы слабых протолитов, например
(протекает гидролиз “по катиону» и “по аниону”, среда зависит от ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-625.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-626.png)
Для кислой соли с катионом сильного основания, например ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-628.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-629.png)
(упрощенно: 2) ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-631.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-632.png)
Для реакции 1)
для реакции 2)
От соотношения ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-635.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-636.png)
Заменяя концентрации компонентов в правой части уравнения через соответствующие константы, ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-638.png)
Решая последнее уравнение относительно ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-640.png)
Формула (3.7) упрощается при пренебрежении малыми величинами и при допущении
Например, если ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-643.png)
Для приближенных расчетов разных случаев кислотно-основного равновесия можно воспользоваться формулами таблицы 3.1. Значения ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-645.png)
В случаях, когда нельзя считать равновесную концентрацию ионизирующегося вещества равной его аналитической концентрации (не соблюдается условие ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-646.png)
Пример 3.1.
Рассчитайте ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-647.png)
0,10 М раствора ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-648.png)
Решение:
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-648.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-649.png)
Проверка условия ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-651.png)
Таблица 3.1
Формулы для приближенного расчета ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-653.png)
Пример 3.2.
Рассчитайте ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-655.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-656.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-657.png)
Решение:
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-657.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-658.png)
Поскольку ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-660.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-661.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-661.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-661.png)
откуда:
Решаем квадратное уравнение относительно ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-661.png)
Пример 3.3.
Рассчитайте pH 0,010 М раствора муравьиной кислоты в присутствии 0,010 М ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-665.png)
Решение:
Отношение ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-666.png)
С учетом соотношения (2.11) термодинамической и реальной констант:
Пример 3.4.
Рассчитайте ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-822.png)
Решение:
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-824.png)
Запишем уравнение электронейтральности:
Тогда:
откуда: ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-836.png)
Без учета автопротолиза воды:
pH = 7, расчет менее точен.
Подобный подход необходим и при расчете pH очень разбавленных ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-840.png)
Пример 3.5.
Рассчитайте ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-842.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-843.png)
Решение:
Определяем тип гидролизующейся соли (тип протолита).
Гидролиз протекает по аниону, т. е. ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-845.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-846.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-847.png)
Поскольку ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-851.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-853.png)
отсюда:
Решаем квадратное уравнение:
Находим степень гидролиза ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-858.png)
Пример 3.6.
К 50 мл 0,10 М раствора ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-860.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-861.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-863.png)
Решение:
После смешивания двух растворов получаем:
В результате взаимодействия протолитов в растворе образуется кислая соль (амфолит) согласно уравнению реакции:
Для угольной кислоты ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-866.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-868.png)
Пример 3.7.*
К 20 мл 0,20 М раствора соли аммония в безводном метаноле добавили 10 мл 0,20 М раствора метилата натрия в безводном метаноле. Определите: а) pH исходного раствора соли; в) pH полученного раствора, если для метанола ![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-871.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-873.png)
Решение:
а) в метанольном растворе протекает протолитическая реакция:
Откуда
б) протолитическая реакция взаимодействия при сливании двух растворов:
Значение константы равновесия реакции:
указывает на ее практическую необратимость и возможность приближенных расчетов. Используя эту константу или формулу для расчета pH в растворе, содержащем кислотно-основную сопряженную пару (3.11), можно вычислить pH полученного раствора:
откуда
Эти примеры взяты со страницы примеров решения задач по аналитической химии:
Решение задач по аналитической химии
Возможны вам будут полезны эти страницы:
Теоретические основы
Вода является средой, в которой растворяются органические и неорганические химические вещества, и обладает способностью распадаться на ионы. Одна молекула отдает свой протон другой, поэтому в воде постоянно находится некоторое количество положительно заряженных ионов водорода H и отрицательно заряженных гидроксид-ионов OH. Этот процесс называется электролитической диссоциацией.
Говоря об ионе водорода, делается упрощение, так как на самом деле положительно заряженный ион в воде — это ион гидроксония H3O. Он образуется из целой молекулы воды и протона, оторванного от другой молекулы. Чем больше таких ионов в воде, тем больше и ее кислотность.
Ионы очень подвижны и постоянно переходят от одной молекулы к другой. Таким образом, процесс распада и процесс соединения в новую молекулу идут постоянно и уравновешивают друг друга, т. е. диссоциация воды находится в равновесии.
Количество ионов H+ и мера их активности в большинстве растворов очень малы, их записывают в виде числа с отрицательной степенью, что очень неудобно. Поэтому датским биохимиком Сёреном Сёренсеном в 1909 году было предложено выражать это число в виде показателя кислотности (водородного показателя) pH, который вычисляется как десятичный логарифм от меры активности ионов H+ с обратным знаком: pH = — lg [H+].
С. Сёренсен руководил химико-физиологической лабораторией при пивоваренном заводе Carlsberg, где разработал шкалу для измерения показателя pH. На ее основе были созданы специальные приборы: pH-метры, которые применяются для измерения кислотности растворов и жидкостей в промышленности, и ацидогастрометры для диагностики желудочно-кишечных заболеваний в медицине.
Показатель основности раствора, выражающийся десятичным логарифмом с отрицательным знаком от концентрации в растворе гидроксид-ионов: pOH = — lg [OH-], применяется гораздо реже. Величины pH и pOH могут быть как положительными, так и отрицательными.
Важно не путать pH с понятиями кислотности и щелочности. Главное различие заключается в том, что pH — это показатель не количества, а активности.
Он отражает степень кислотности или щелочности среды, а не количественное содержание в воде химических веществ. В разбавленных растворах мера активности эквивалентна концентрации, поэтому при определенном допущении один термин заменяют другим.
Влияние pH на свойства среды
С помощью несложных математических вычислений можно доказать, что сумма показателей pH и pOH для воды — величина постоянная и равна 14. Например, если рН = 5, то рОН = 9; для рН = -2 pOH = 16. У чистой воды без примесей (дистиллированной) и у водных растворов, образуемых неэлектролитами, pH = 7, а значит и рОН = 7, т. е. кислотный и основной (щелочной) показатели уравновешивают друг друга, и получается нейтральная среда.
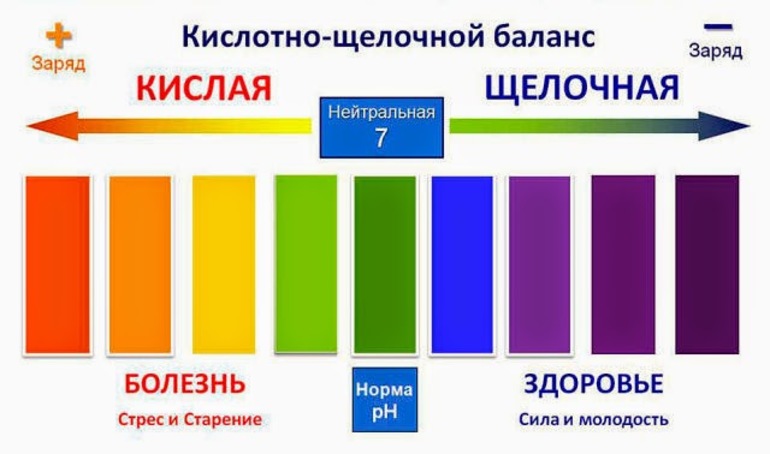
При попадании в воду многих химических соединений происходит их гидролиз. Растворяемое вещество распадается на катионы и анионы, которые могут соединяться с ионами, получившимися в результате диссоциации воды. При этом получается смещение равновесия диссоциации воды. Показатель pH определяет, в какую сторону оно произошло. Если pH < 7, то получилась кислотная среда, когда pH > 7 — щелочная.
Показатель pH влияет на протекание химических реакций как на производстве, так и в природе и является универсальным показателем состояния среды. С помощью его контроля производят все виды горючего, краски, удобрения, средства личной гигиены и косметику. В пищевой промышленности проверяется качество изготовления напитков, молокопродуктов, изделий из злаков. Все живые обитатели природных почв и вод могут жить только при определенных значениях водородного показателя, от него же зависит и урожайность многих растений, поэтому ведется наблюдение за pH в почвоведении и земледелии, особенно в гидропонике.
При этом обычно необходимо поддерживать постоянное значение pH в течение длительного времени. Для этого используют так называемые буферные растворы. Они представляют собой смеси слабого основания и его соли или слабой кислоты и ее соли, в которых мера активности ионов водорода постоянна и устойчива.
Измерение водородного показателя
Формулы для расчета pH зависят от того, к какому классу относится химическое вещество, входящее в исследуемый раствор, и приведены в специальных справочниках. Более точное значение получают другими методами. Цели и условия проведения исследований определяют, как будет измеряться водородный показатель.
Индикаторные способы
Приблизительно оценить меру активности ионов водорода можно с помощью кислотно-основных индикаторов. Такие вещества обычно относятся к органическим соединениям и имеют свойство изменять свой цвет в разных средах:
- Лакмус меняет цвет от красного в кислой среде через фиолетовый в нейтральной до синего в щелочной.
- Фенолфталеин становится синим в щелочной среде, оставаясь бесцветным в остальных.
- Метилоранж розового цвета соответствует повышенной кислотности, оранжевого — показывает нейтральность среды, в щелочах становится синим.
Изменение происходит для каждого индикатора в своём диапазоне кислотности, обычно составляющем 1—2 единицы. При этом методе результат можно получить быстрый и наглядный при небольших затратах, но недостаточно точный, с большой погрешностью при исследовании очень слабых растворов, окрашенных или мутных вод. Используется, когда нужно найти предварительное определение pH.
Более широкий диапазон и выше точность у универсального индикатора. Он соединяет в себе несколько индикаторов и градуируется в соответствии со значениями pH от единицы до десяти. Соответствие значения водородного показателя и цвета:
- 1 — красный;
- 2 — розовато-оранжевый;
- 3 — оранжевый;
- 4 — темно-желтый;
- 5 — желтый;
- 6 — желтовато-зеленый;
- 7 — светло-зеленый;
- 8 — насыщенный зеленый;
- 9 — сине-зеленый;
- 10 — сине-серый.
Аналитический объемный метод
Кислотно-основное титрирование — метод определения водородного показателя среды с помощью так называемых титрантов. В основном для этого используются сильные кислоты (серная, соляная) и сильные щелочи (едкий калий, каустическая сода).
Раствор-титрант добавляют в исследуемую жидкость по каплям. При этом они вступают в химическую реакцию. Когда она завершается, наступает точка эквивалентности, т. е. момент отчетливого изменения окраски исследуемого раствора. По установленному в результате опыта объему титранта, необходимому для получения точки эквивалентности, и известному значению его концентрации можно рассчитать pH с высокой точностью.
Измерительный прибор pH-метр
Ионометрический метод, при котором кислотный показатель можно измерить с помощью специализированного прибора — pH-метра, является наиболее точным (до сотых от единицы pH), удобным и имеет широкий диапазон измерения. PH-метр представляет собой милливольтметр, способный измерять разность потенциалов со стеклянных электродов. У него также есть система пересчета напряжения в pH.
В исследуемый раствор погружают индикаторный электрод и электрод сравнения, замыкая таким образом гальваническую цепь. Величина электродвижущей силы в ней зависит от активности ионов H+ в растворе, т. е. является функцией только его pH. Индикаторный электрод состоит из стеклянной трубки, заполненной специальной суспензией в растворе соляной кислоты, и погруженной в нее серебряной проволоки.
Полезный сигнал возникает на границе соприкосновения раствора и индикаторного электрода и передается через металлический проводник на вход pH-метра. Таким способом можно измерять pH любых жидкостей, в том числе непрозрачных и цветных.
Специализированный прибор, применяемый в медицине для исследований pH жидкостей желудочно-кишечного тракта, называется ацидогастрометром. Включает в себя регистрирующий блок и один или несколько зондов. Для измерения уровня pH таких биологических жидкостей, как слюна и моча, применяются электронные pH-метры.
Кислотно-щелочной баланс человека
Организмом человека вырабатываются разные жидкости, каждая из которых должна иметь определенное значение pH. Отклонение в ту или иную сторону может привести к развитию множества серьезных заболеваний. Вовремя обнаруженные изменения можно исправить, если повысить или понизить кислотность потребляемых продуктов и питьевой воды. Механизм регулирования пропорционального соотношения кислот и щелочей в клеточных и межклеточных жидкостях называют кислотно-щелочным балансом (равновесием). По значению pH можно определить, в каком состоянии находятся многие органы человека.
На pH почек и печени оказывают влияние не только метаболические процессы в самом организме, но также пища и вода. Излишнюю кислотность потребленных продуктов организм выводит через мочу. Низкий уровень pH мочи говорит о том, что почки работают на пределе. Когда излишняя кислота не может быть выведена из организма естественным путем, она скапливается в подкожной жировой прослойке, имеющей кислотный pH. Это приводит к излишнему весу. В борьбе с этим явлением помогает щелочная вода, снижая нагрузку на почки.
В желудке среда резко кислая, в момент пищеварения pH равен 1,8−3. Вопреки распространненому мнению, причиной таких неприятных симптомов, как изжога и дискомфорт в желудке, является пониженная, а не повышенная кислотность желудочного сока. Нормальный уровень pH создает благоприятные условия для развития правильных бактерий и запускает механизм переваривания пищи, а болезнетворные микроорганизмы и гельминты расщепляются пищеварительными ферментами.
pH крови организм поддерживает в постоянном состоянии на уровне 7,4—7,45. Малейшее отклонение его от нормы может привести к тяжелым последствиям для человека. При понижении pH ниже 7,35 возникает ацидоз. При превышении нормы — алкалоз. Это не самостоятельные заболевания, они свидетельствуют о нарушениях в работе легких, почек, печении. Такие состояния сопровождаются очень опасными для здоровья симптомами, приводящими иногда даже к коме. По мнению врачей, ацидоз переносится легче алкалоза.
Кровеносные сосуды питают слюнные железы, поэтому за уровнем pH крови можно следить по pH слюны. Поддержание кислотно-щелочного баланса в кровеносной системе — это важнейшая функция организма человека. Внешние факторы не оказывают влияния на pH крови, он регулируется только внутренними механизмами тела человека:
- Буферные системы крови поддерживают устойчивость среды.
- Легочная (респираторная) система удаляет излишки углекислого газа из крови.
- Выделительная система (почки). Самый медленный, но и самый мощный механизм, может полностью восстанавливать pH организма путем выведения ионов водорода через мочу.
Таким образом, хотя кислотный показатель крови совершенно не подвержен внешнему влиянию, механизмы его поддержания на нужном уровне имеют зависимость от того, чем человек питается и какую воду пьет. Мясо и молоко повышают общую кислотность организма, а зелень и зеленые овощи лучше всего нейтрализуют ее. Кислотность и щелочность различных пищевых продуктов можно узнать из специальных таблиц. Оптимальное значение pH для воды находится в пределах от 6 до 9.
Придерживаясь принципов правильного питания для поддержания кислотно-щелочного равновесия в своем организме, человек надолго сохранит молодость, красоту и здоровье.
Расчет рН растворов сильных и слабых электролитов
Сильные
кислоты и основания
(табл.2.1) в растворах диссоциируют пол-
ностью,
поэтому концентрация ионов водорода и
ионов гидроксила равна
общей
концентрации сильного электролита.
Для
сильных оснований:
[OH—]
= См;
для
сильных
кислот:
[H+]
=
См.
Таблица
2.1
Сильные электролиты
-
Класс
Формулы
электролитовКислота
HNO3,
H2SO4,
HCl, HBr, HI, HMnO4,
HClO4Основание
LiOH ,
KOH, RbOH, CsOH, NaOH, Ba(OH)2,
Ca(OH)2,
Sr(OH)2Соль
Растворимые
соли
Слабым
электролитом
принято считать химические соединения,
молекулы которых даже в сильно разбавленных
растворах не полностью диссоциируют
на ионы. Степень диссоциации слабых
электролитов для децимолярных растворов
(0,1М) меньше 3%. Примеры слабых электролитов:
все органические кислоты, некоторые
неорганические кислоты (например, H2S,
HCN), большинство гидроксидов (например,
Zn(OH)2,
Cu(OH)2).
Для
растворов слабых
кислот
концентрация ионов водорода [H+]
в растворе рассчитывается по формуле:
где:
Кк –
константа диссоциации слабой кислоты;
Ск –
концентрация кислоты, моль/дм3.
Для
растворов слабых
оснований
концентрация гидроксильных ионов
рассчитывается по формуле:
где:
Ко –
константа диссоциации слабого основания;
Сосн. –
концентрация основания, моль/дм3.
Таблица
2.2
Константы диссоциации слабых кислот и оснований при 25 оС
|
Формула |
Константа |
|
СH3COOH |
1,86 |
|
HCN |
7,2 |
|
HOCl |
5,0 |
|
HBO2 |
7,5 |
|
HOBr |
2,5 |
|
HF |
6,2 |
|
HNO2 |
5,1 |
|
HIO |
2,3 |
|
HOCN |
2,7 |
|
NH4OH |
1,79 |
|
AgOH |
5,0 |
2.2.
Примеры решения индивидуального задания
Пример
№1.
Условие
задания: Определить
концентрацию
водородных и гидроксильных ионов в
растворе, если
рН =5,5.
Решение
Концентрация
ионов водорода рассчитывается по
формуле:
[Н+]
= 10-рН
[Н+]
= 10-5,5
=
3,16 •10-6
моль/дм3
Концентрация
гидроксильных ионов рассчитывается по
формуле:
[OН—]
= 10-рOН
рОН
= 14 – рН = 14 – 5,5 = 8,5
[OН—]
= 10 -8,5
=
3 • 10-9
моль/дм3
Пример
№ 2.
Условие
задания: Вычислить
рН 0,001 М раствора HС1.
Решение
Кислота
HС1 является сильным электролитом
(табл.2.1) и в разбавленных растворах
практически полностью диссоциирует на
ионы:
HС1⇄
Н+
+
С1—
Поэтому
концентрация ионов [Н+]
равна общей концентрации кислоты:
[Н+]
= См = 0,001 М.
[Н+]
= 0,001= 1·10-3
моль/дм3
Тогда:
рН
= – lg[H+]
= – lg 1 • 10-3
= 3
Пример
№ 3.
Условие
задания:
Вычислить
рН 0,002 М раствора NaOH.
Решение
Основание
NaOH является сильным электролитом
(табл.2.1) и в разбавленных растворах
практически полностью диссоциирует на
ионы:
NaOH
⇄Na++OH—
Поэтому
концентрация гидроксильных ионов равна
общей концентрации основания: [ОH—]=
См
= 0,002
М.
Тогда:
рОН
= – lg[ОН—]
= – lgСм = – lg 2 •10-3
= 2,7
Исходя
из формулы: рН + рОН = 14, находим рН
раствора:
рН
= 14 – 2,7 = 11,3
Пример
№4.
Условие
задания: Вычислить
рН 0,04 М раствора NH4OH,
если
константа диссоциации Кд(NH4OH)
= 1,79·10-5
(табл.2.2).
Решение
Основание
NH4OH
является слабым электролитом и в
разбавленных растворах очень незначительно
диссоциирует на ионы.
Концентрация
гидроксильных ионов [ОH—]
в растворе слабого основания рассчитывается
по формуле:
моль/дм3
рОН
= – lg[ОH—]
= – lg 8,5·10-2
= 1,1
Исходя
из формулы: рН + рОН = 14, находим рН
раствора:
рН
= 14 – рOН = 14 – 1,1 = 12,9
Пример
№5.
Условие
задания: Вычислить
рН
0,17
М раствора
уксусной
кислоты (CH3COOH),
если константа диссоциации Кд(CH3COOH)
= 1,86 • 10-5
(табл.2.2).
Решение
Кислота
CH3COOH
является слабым электролитом и в
разбавленных растворах очень незначительно
диссоциирует на ионы.
Концентрация
ионов водорода [H+]
в растворе слабой кислоты рассчитывается
по формуле:
Тогда:
моль/дм3
Вычисляем
pH
раствора по формуле: рН = – lg [H+]
pH
= – lg 1,78 • 10-3
=
2,75
2.3.
Индивидуальные задания
Условия
заданий
(табл.
2.3):
Задание
№ 1.
Вычислить концентрацию водородных и
гидроксильных ионов в растворе при
определенном значении рН (см. пример №
1);
Задание
№ 2.
Вычислить рН раствора сильного электролита
(кислоты, основания) при заданной
концентрации (см. пример № 2, 3);
Задание
№ 3.
Вычислить рН раствора слабого электролита
(кислоты, основания) при заданной
концентрации (см. пример № 4, 5).
Таблица
2.3
Состав
исследуемой воды
|
№ задания |
Условия |
||||
|
Задание № 1 |
Задание |
Задание |
|||
|
рН |
Сильный |
Концентрация, |
Слабый электролит |
Концентрация, |
|
|
1 |
6,05 |
НСl |
0,033 |
NH4OH |
0,01 |
|
2 |
8,5 |
HNO3 |
0,091 |
HCN |
0,09 |
|
3 |
5,5 |
HI |
0,032 |
HOCl |
0,05 |
|
4 |
7,7 |
NaOH |
0,054 |
HBO2 |
0,36 |
|
5 |
6,3 |
HBr |
0,076 |
HOBr |
0,22 |
|
6 |
6,5 |
KOH |
0,045 |
HF |
0,63 |
|
7 |
8,9 |
HClO4 |
0,027 |
HNO2 |
0,55 |
|
8 |
8,5 |
HMnO4 |
0,005 |
HOI |
0,03 |
|
9 |
6,5 |
CsOH |
0,008 |
HOCN |
0,19 |
|
10 |
6,1 |
HNO3 |
0,004 |
NH4OH |
0,082 |
|
11 |
6,5 |
HI |
0,001 |
AgOH |
0,04 |
|
12 |
6,9 |
LiOH |
0,009 |
СH3COOH |
0,26 |
|
13 |
8,8 |
HBr |
0,005 |
HCN |
0,075 |
|
14 |
6,9 |
RbOH |
0,036 |
HOCl |
0,07 |
|
15 |
7,3 |
HClO4 |
0,0022 |
HBO2 |
0,15 |
|
16 |
6,3 |
HMnO4 |
0,063 |
HOBr |
0,23 |
|
17 |
7,4 |
KOH |
0,055 |
HF |
0,34 |
|
18 |
6,7 |
HNO3 |
0,003 |
HNO2 |
0,18 |
|
19 |
8,2 |
HI |
0,019 |
HOI |
0,39 |
|
20 |
8,3 |
HNO3 |
0,082 |
HOCN |
0,15 |
|
21 |
6,1 |
CsOH |
0,004 |
NH4OH |
0,33 |
|
22 |
6,9 |
HCl |
0,026 |
AgOH |
0,091 |
|
23 |
8,2 |
HClO4 |
0,075 |
HBO2 |
0,32 |
|
24 |
8,6 |
HMnO4 |
0,007 |
HOBr |
0,054 |
|
25 |
8,5 |
LiOH |
0,015 |
HF |
0,076 |
|
26 |
8,2 |
HNO3 |
0,0023 |
HNO2 |
0,045 |
|
27 |
8,0 |
HI |
0,034 |
HOI |
0,27 |
Продолжение
табл. 2.3
|
28 |
7,9 |
NaOH |
0,018 |
HOCN |
0,35 |
|
29 |
7,9 |
HBr |
0,039 |
NH4OH |
0,08 |
|
30 |
8,1 |
HCl |
0,015 |
AgOH |
0,4 |
|
31 |
6,1 |
HNO3 |
0,003 |
NH4OH |
0,032 |
|
32 |
6,5 |
HI |
0,002 |
AgOH |
0,02 |
|
33 |
6,9 |
LiOH |
0,008 |
СH3COOH |
0,24 |
|
34 |
8,8 |
HBr |
0,003 |
HCN |
0,073 |
|
35 |
6,9 |
RbOH |
0,033 |
HOCl |
0,072 |
|
36 |
7,3 |
HClO4 |
0,0012 |
HBO2 |
0,16 |
|
37 |
6,3 |
HMnO4 |
0,033 |
HOBr |
0,24 |
|
38 |
7,4 |
KOH |
0,045 |
HF |
0,35 |
|
39 |
6,7 |
HNO3 |
0,004 |
HNO2 |
0,28 |
|
40 |
8,2 |
HI |
0,029 |
HOI |
0,29 |
|
41 |
8,3 |
HNO3 |
0,081 |
HOCN |
0,05 |
|
42 |
6,1 |
CsOH |
0,006 |
NH4OH |
0,033 |
|
43 |
6,9 |
HCl |
0,023 |
AgOH |
0,29 |
|
44 |
8,2 |
HClO4 |
0,078 |
HBO2 |
0,62 |
|
45 |
8,6 |
HMnO4 |
0,006 |
HOBr |
0,024 |
|
46 |
8,5 |
LiOH |
0,012 |
HF |
0,036 |
|
47 |
8,2 |
HNO3 |
0,0021 |
HNO2 |
0,025 |
|
48 |
8,0 |
HI |
0,037 |
HOI |
0,027 |
|
49 |
7,9 |
NaOH |
0,013 |
HOCN |
0,015 |
|
50 |
7,9 |
HBr |
0,034 |
NH4OH |
0,08 |
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
10.02.20161.72 Mб14referat_turbaza.docx
- #
- #
- #
- #
- #
- #























![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-584.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-588.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-589.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-590.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-591.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-596.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-597.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-599.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-600.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-601.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-603.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-604.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-605.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-606.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-607.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-609.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-610.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-618.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-619.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-621.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-623.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-624.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-627.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-630.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-633.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-634.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-637.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-639.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-641.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-642.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-644.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-650.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-652.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-654.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-659.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-662.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-663.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-664.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-667.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-668.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-821.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-825.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-833.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-835.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-838.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-839.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-844.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-848.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-850.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-855.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-856.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-857.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-859.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-864.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-865.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-870.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-875.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-877.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-878.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-879.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-881.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-882.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-884.png)
![Расчет [H+], [OH-], pH, pOH в растворах сильных и слабых кислот и оснований с примерами решения](https://lfirmal.com/wp-content/uploads/2020/03/%D0%B8%D0%B7%D0%BE%D0%B1%D1%80%D0%B0%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5-885.png)