Раковая опухоль возникает в случаях, когда клетки начинают бесконтрольно расти. Такую особенность могут приобрести клетки практически любого органа. Кроме того, по мере роста опухоли они с током крови или лимфы могут переноситься в другие области тела, оседать там и давать начало росту новых очагов. Такие очаги называют вторичным раком, или метастазами, а начальную опухоль, соответственно, первичным раком.
Метастазы в любых органах классифицируют в зависимости от того, из какого органа изначально происходит опухоль. Например, вторичный очаг рака легких в печени все равно будет называться раком легких, только получит приставку «вторичный». Иногда не получается определить, в каком именно органе сначала возникла опухоль. Однако при исследовании выявляются ее метастазы в других частях тела. Если их первичный очаг определить не удается, то врачи говорят про первичный рак неизвестного происхождения, или скрытый первичный рак.
Пример выявления
Скрытый первичный рак встречается нечасто. Более того, в ходе дальнейших обследований первичный очаг может обнаружиться. Если так происходит, то опухоль более не считается первичным раком неизвестного происхождения. Ей присваивают название в соответствии с органом происхождения и, опираясь на новые данные, модифицируют схему лечения онкологического заболевания.
На практике это происходит следующим образом:
- У человека обнаруживают, например, увеличенный лимфатический узел на шее.
- При его биопсии выясняется, что в лимфоузле находится злокачественная опухоль.
- Однако при цитогистологическом исследовании оказывается, что клетки этой опухоли не похожи на клетки рака лимфатической системы.
- Пациенту предварительно устанавливают диагноз первичного рака неизвестного происхождения.
- Найденные опухолевые клетки похожи на клетки рака ротовой полости, мягких тканей горла или гортани.
- Пациенту назначают ряд углубленных обследований.
- В ходе этих обследований обнаруживают небольшой бессимптомный опухолевый очаг в гортани.
- Диагноз пациента изменяют на рак гортани и назначают соответствующее этому типу онкопатологии лечение.
Однако в ряде случаев даже самое тщательное обследование не позволяет обнаружить первичный очаг. Более того, его не всегда получается найти даже при патологоанатомическом исследовании.
Типы раковых опухолей
Обычно опухоли классифицируют по их первичной локализации. Однако их также можно сгруппировать по типам клеток, по тому, как раковые клетки выглядят под микроскопом. Знание типа клетки может дать врачам ключ к пониманию того, из каких тканей или органов происходит данная опухоль.
Карциномы
Карцинома — это рак, который происходит из клеток, выстилающих внутреннюю или внешнюю поверхности различных органов нашего тела. Такие клетки называются эпителиальными. Наиболее распространенные типы карцином:
1) Плоскоклеточный рак
Самым ярким примером плоских клеток являются клетки, встречающиеся на поверхности кожи. Кроме того, они составляют часть слизистых оболочек многих полых органов. Плоскоклеточный рак может возникать в ротовой полости, в горле, пищеводе, легких, прямой кишке, на шейке матки, во влагалище и некоторых других органах.
2) Аденокарциномы
Эти злокачественные новообразования развиваются из железистых клеток, то есть из тех, которые способны производить какие-либо вещества. Железистые клетки входят в состав очень многих органов нашего тела, в том числе и тех, которые формально не считаются железами. Например, большинство видов раковых опухолей желудка, кишечника и толстой кишки представляют собой именно аденокарциномы и примерно 4 из 10 случаев рака легких также являются аденокарциномами.
Другие виды злокачественных опухолей
Из других типов клеток раковые новообразования возникают реже. К таким опухолям относятся:
- лимфомы — развиваются из клеток иммунной системы, находящихся в лимфатических узлах и некоторых других органах;
- меланомы — развиваются из клеток кожи, которые накапливают пигмент меланин и отвечают за окраску кожных покровов;
- саркомы — развиваются из клеток соединительной ткани, которые обычно присутствуют в сухожилиях, связках, мышцах, жире, костях и хрящах;
- опухоли из половых клеток, которые могут развиваться в семенниках (яичках) у мужчин и яичниках у женщин.
Итак, при первичном раке неизвестного происхождения не всегда получается установить орган, где изначально возникла опухоль. Однако, исследуя под микроскопом клетки вторичного очага, чаще всего удается отнести их к одной из пяти категорий:
- аденокарцинома (примерно 60% от всех опухолей неизвестного происхождения);
- плохо дифференцированная карцинома;
- плоскоклеточный рак;
- плохо дифференцированное злокачественное новообразование;
- нейроэндокринная карцинома.
В дальнейшем эта информация поможет более точно идентифицировать опухоль и в конечном итоге обнаружить ее первичный очаг.
Зачем нужно искать первичный очаг?
Основная причина для поисков начальной опухоли — выбор правильной тактики лечения. Вторичные метастатические очаги состоят из тех же клеток, что и начальная опухоль, даже если развиваются в совершенно других органах. Значит, для их лечения будут эффективны те же препараты, что и для терапии первичного рака, а не те, которые используются при лечении онкопатологий органа, где развился метастаз.
Это имеет особенно важное значение при некоторых формах рака, которые хорошо поддаются лечению определенными химиотерапевтическими или гормональными препаратами. Например, такими особенностями характеризуются многие опухоли молочной железы. Их можно эффективно лечить гормональными средствами. А значит, такие же препараты подойдут и для терапии их метастазов в костях, головном мозге, печени.
К сожалению, предугадать развитие злокачественного заболевания пока практически невозможно. А потому наиболее эффективным способом борьбы с опухолями является выявление рака на 1 стадии развития. В этом случае успешному лечению поддаются более 90% всех злокачественных новообразований. Обнаружить опухоль на начальных этапах возникновения можно только при помощи периодических скринигов. Такие скрининговые программы действуют и в медицинском центре «Анадолу». На первичной консультации специалист-онколог оценит риск развития у вас онкологического заболевания и составит индивидуальный план прохождения профилактических обследований для ранней диагностики рака.
Материал подготовлен по согласованию с врачом «Анадолу», терапевтом и медицинским онкологом Шерефом Комурджу.
Когда пациенты приходят на прием к врачу-онкологу, в первую очередь специалисту необходимо правильно диагностировать болезнь: подтвердить или опровергнуть онкологическое заболевание, корректно поставить диагноз, правильно определить стадию злокачественного процесса (в случае его подтверждения) для того, чтобы подобрать правильную тактику лечения.
О том, как строится лечебный процесс от первичного приема у врача-онколога до терапии выявленного онкозаболевания и какие методы диагностики применяются рассказывает Ани Погосовна Оганесян, к.м.н., врач-онколог НМИЦ онкологии им. Н.Н. Петрова.
Оценка симптомов при подозрении на злокачественный процесс
Свою работу с пациентом врач начинает с оценки симптомов, с которыми может столкнуться больной в случае подозрения на злокачественный процесс. Симптомы принято подразделять на общие и частные.
Общие симптомы:
- прогрессирующая потеря веса;
- слабость;
- лихорадка;
- повышенное потоотделение.
В целом прогрессивное ухудшение общего состояния, появление слабости, апатии, сонливости может быть связано с большим количеством причин, но стоит насторожиться, если такие симптомы возникли, особенно в совокупности с повышением температуры тела. Общее состояние – первый главный прогностический признак при опухолях любых локализаций.
К частным симптомам могут относиться:
- длительный сухой кашель (может быть характерно для опухоли в средостении, опухоли, расположенной в главных или долевых бронхах, а также при вторичном увеличении лимфатических узлов);
- длительная одышка при малой физической нагрузке или в покое (возможно развитие опухолевого плеврита);
- болевой синдром в зоне наличия первичного очага опухоли или отдаленных метастазов, которые могут сдавливать сосудисто-нервные пучки, вызывая боль у пациента;
- дисфагия – нарушение прохождения пищи – достаточно частое проявление клинической картины опухолей пищевода или гастроэзофагиальной зоны.
Клинические проявления возможного злокачественного процесса
Диагностические методы, применяемые в онкологии
Первичная диагностика в онкологии, как правило, состоит из двух аспектов:
- Визуальный осмотр кожных покров, доступных слизистых оболочек;
- Пальпация.
В первую очередь, необходима визуальная диагностика. Врач проводит визуальный осмотр кожных покровов и доступных слизистых оболочек. Это важная часть диагностического процесса, поскольку целый ряд опухолей локализуется в таких областях, которые можно оценить визуально. Например, меланома кожи и другие варианты рака кожи. Также с помощью пальпации врач может обнаружить увеличенные лимфатические узлы и некоторые опухоли мягких тканей.
Для правильной постановки диагноза и стадирования опухолевого процесса нередко необходим комплекс исследований. Диагностические методы в онкологии подразделяются на лучевые, эндоскопические и морфологические.
Лучевые методы
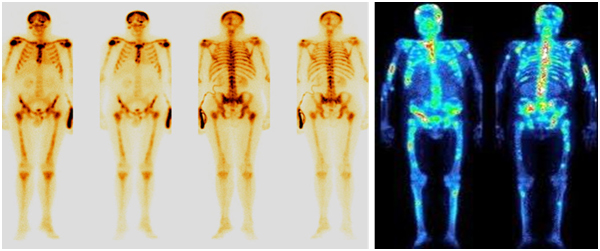
К лучевым методам относятся рентгенологические исследования (рентгенография, маммография), КТ, МРТ, УЗИ, радиоизотопные исследования (ПЭТ-КТ, остеосцинтиграфия).
Задачи лучевых методов диагностики:
- выявление первичной опухоли;
- оценка местной распространенности процесса (определение того, как опухоль относится к окружающим тканям, есть ли прорастание в какие-либо магистральные сосуды, есть ли периневральная инвазия – прикрепление опухолевых клеток к рядом лежащим нервным стволам);
- выявление регионарных и отдаленных метастазов;
- биопсия под контролем лучевых методов;
- оценка результатов лечения.
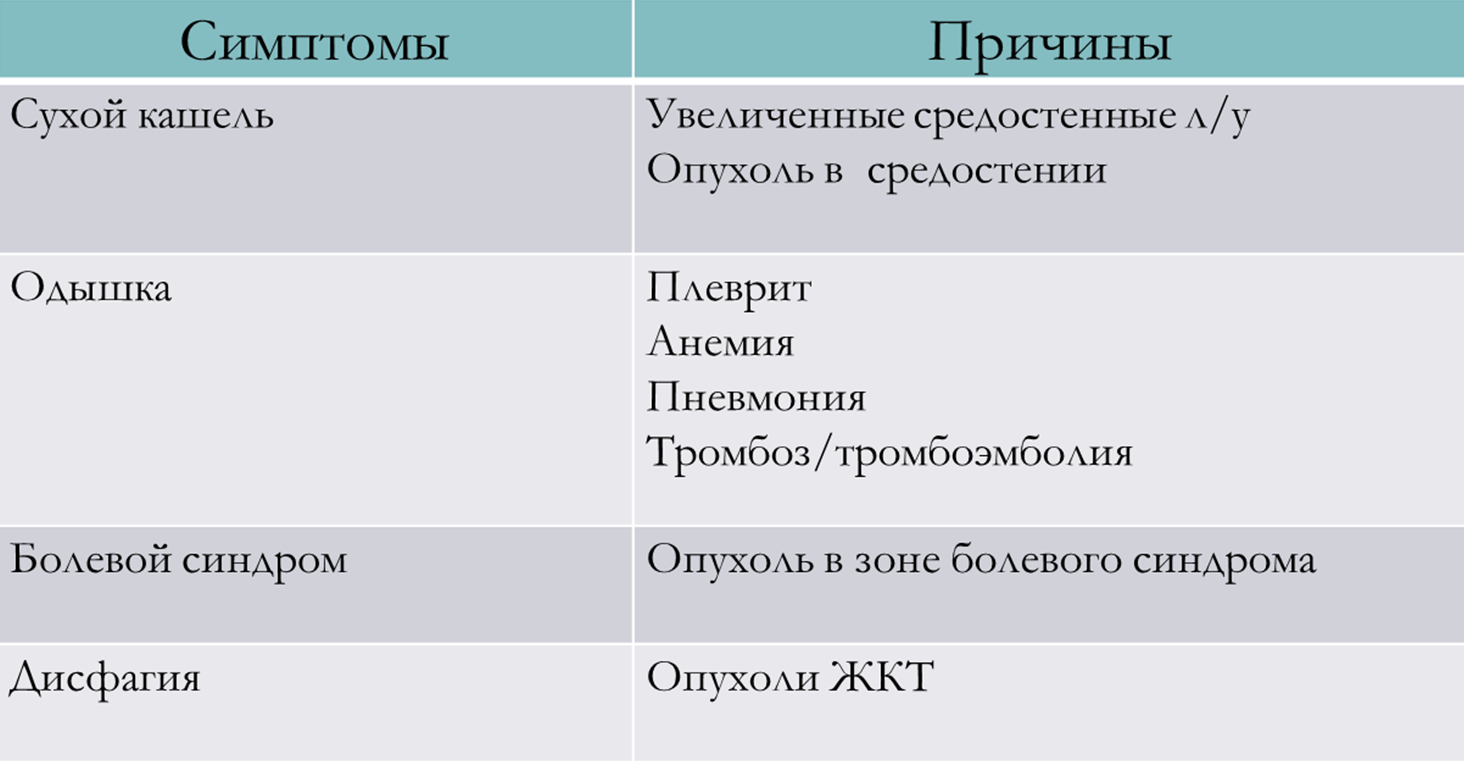
Компьютерная томография
Компьютерная томография нередко используется для визуализации не полых, т.е. паренхиматозных органов. На картинке ниже (снимках компьютерной томографии) вы можете увидеть крупное первичное образование лёгкого, вторичное метастатическое поражение печени.
Магнитно-резонансная томография
Магнитно-резонансная томография чаще всего применяется для обнаружения каких-либо изменений при исследовании головного мозга и малого таза. Кроме того, врачи оценивают не только сам онкологический процесс, но и все возможные сопутствующие патологии, если они визуализируются.
Позитронно-эмиссионная томография
Особенность исследования позитронно-эмиссионной томографии (совмещённая с компьютерной томографией) в том, что в этом случае используются радиофармпрепараты, например, радиоактивная глюкоза, которая вводится в организм перед исследованием.
Помимо размера опухоли, с помощью ПЭТ-КТ специалисты могут оценить метаболическую активность (т.е. степень накопления радиофармпрепарата в опухоли) как первичных, так и вторичных образований.
Остеосцинтиграфия
Остеосцинтиграфия – это метод радионуклидной лучевой диагностики, который оценивает специфическое поражение костей, развивающееся на фоне злокачественного процесса.
Таким образом, лучевые методы исследования необходимы как до начала лечения в целях диагностики и оценки распространённости опухолевого процесса, так и в процессе лечения, чтобы отслеживать изменения опухолевой массы.
Эндоскопические методы
Эндоскопические методы являются ведущими для ранней диагностики злокачественных опухолей, поражающих слизистую оболочку полых органов. Они обладают относительной простотой, безопасностью и высокой информативностью.
Данные методы диагностики позволяют не только обнаружить злокачественное образование, но и выявить предраковые фоновые заболевания полых органов, которые, в свою очередь, способны привести к злокачественной трансформации. Во время выполнения эндоскопических методов диагностики часто выполняется забор биоматериала, т. е. производится биопсия подозрительных участков и тканей для последующих морфологических исследований.
К эндоскопическим методам относятся гастроскопия, колоноскопия, цистоскопия, бронхоскопия.
Задачи эндоскопических методов:
- диагностика начальных форм онкологических заболеваний;
- поиск и выявление предраковых изменений слизистой полых органов;
- дифференциальная диагностика доброкачественных и злокачественных изменений;
- определение формы роста злокачественной опухоли и уточнение местной распространенности опухолевого процесса;
- оценка эффективности хирургического, лучевого или лекарственного лечения.
Морфологические методы
В онкологии диагноз ставится только на основании морфологической верификации обнаруженного новообразования. Для того, чтобы полноценно поставить диагноз, опираясь на комплексный подход, необходимо получить материал, т.е. клетки ткани пораженного органа. Получение образца ткани для дальнейшего исследования выполняется с помощью биопсии.
Биопсия может быть:
- тонкоигольная биопсия;
- трепан-биопсия;
- эксцизионная биопсия;
- инцизионная биопсия.
Цель любой из этих вариаций биопсии – получение материала, чтобы в последующем можно было выполнить морфологические методы исследования.
С помощью морфологических методов определяют тканевую принадлежность опухоли для понимания ее гистотипа (гистологической структура опухолевой ткани и ее особенностей). При диагностике учитывают особенности атипичных клеток, также производят оценку полей некроза, кровоизлияний, определяют форму и количество питающих сосудов.
Необходимость морфологической дифференцировки и диагностики –основополагающее в онкологии. Морфологические методы можно подразделить на гистологические и ииммуногистохимические исследования.
В ряде случаев для того, чтобы подобрать эффективное лечение или детально разобраться в диагнозе необходимо выполнить комплекс иммуногистохимических исследований, поскольку наличие определенных маркеров позволяет определить максимально эффективную тактику лекарственного лечения для пациента.
Наиболее часто определяемые иммуногистохимические маркеры:
- ER (рецептор к эстрогену);
- PR (рецептор к прогестерону);
- Her2/neu (рецептор эпидермального фактора роста);
- Ki67 (индекс пролиферативной активности, может определяться при всех типах опухолей. Определяет скорость роста опухоли, риск метастазирования и ответ на терапию);
- PD-L1 (трансмембранный белок, лиганд к рецептору PD-1, связывается с PD-1 на цитотоксических лимфоцитах и блокирует их цитотоксическую активность).
Кому и зачем проводят молекулярно-генетические исследования:
- пациентам с установленными онкологическими диагнозами для подбора наиболее оптимальной и эффективной терапии (например, определяется такой параметр, как микросателлитная нестабильность – характеризует генетическую изменчивость многих опухолей. Определяется для назначения иммуноонкологических препаратов);
- здоровым людям с наследственным анамнезом для определения наличия онкологической предрасположенности (например, мутацию BRCA рекомендуется определять и у молодых здоровых девушек, чьи кровные родственники – мать, бабушка – имели злокачественные образования молочной железы).
Биология опухоли может быть различной даже при одном и том же типе рака. Таргетная терапия подбирается индивидуально, в зависимости от молекулярно-генетических характеристик выявленной опухоли. Здесь молекулярно-генетические маркеры необходимы для того, чтобы детально дифференцировать опухоль и найти точку приложения для таргетной терапии. Вот только небольшое количество мутаций, которые могут встречаться при различных злокачественных образованиях: BRAF, EGFR, с-kit, KRAS, NRAS, ALK, ROS1, MET. При наличии каждой из них применяются определенные таргетные препараты, которые позволяют эффективно лечить конкретное заболевание.
Правильная диагностика – это залог эффективного лечения онкологического заболевания. Если врач говорит пациенту о том, что нужно дополнительно сделать какое-либо исследование или необходима определенная иммуногистохимическая панель, необходимо придерживаться рекомендаций специалиста. Так врач-онколог сможет более детально подойти к вопросу лечения.
Весь диагностический поиск, оценка распространенности процесса, конкретизация по гистологическим и иммуногистохимическим параметрам необходимы для индивидуализации лечения.
В настоящее время существуют широкие опции возможного лечения – хирургия, лучевая терапия, различные варианты лекарственной терапии. Чем больше врач знает о течении и особенностях вашего заболевания, тем больше возможностей и шансов для борьбы с раком.
Вебинар: Онкологический маршрут: от постановки диагноза до лечения
- Диагностика рака на ранней стадии
- Первые признаки онкологических заболеваний органов
- Какие анализы укажут на онкологическое заболевание?
- Анализ мочи
- Анализ кала
- Может ли общий анализ крови показать рак?
- Онкомаркеры
- Другие методы диагностики рака
Все больше людей интересует, как выявить рак у себя на ранних стадиях. Это связано с увеличением онкологической настороженности в обществе, повышением медицинской образованности населения, а также ростом числа доброкачественных и злокачественных опухолей. Мировая статистика говорит о том, что в 2018 году в мире зафиксировано более 17 млн новых случаев рака, при этом от онкологических заболеваний умерло 9,6 млн человек.
По данным отечественного Минздрава, в России в 2017 году на первое место вышел рак кожи — 617,2 тыс. случаев, на втором месте находится рак груди — 70,6 тыс. случаев, на третьем расположился рак трахеи, рак бронхов и рак легких — 62,2 тыс. случаев.
Кому стоит провериться на онкологию:
- Активные курильщики — особенно часто у них возникает рак гортани, легких и рак губы.
- Лица, злоупотребляющие алкоголем — рак поджелудочной железы или печени, рак желудка.
- Пациенты с гепатитами В или С, а также другими канцерогенными инфекционными заболеваниями — может возникать рак печени.
- Часто загорающие или активно посещающие солярии — рак кожи, меланома.
- Люди в возрасте 50 лет и старше — повышены риски рака простаты у мужчин, рака молочной железы у женщин.
- При наличии раковых заболеваний у ближайших родственников. Наследственность – важный фактор, способный повысить вероятность онкозаболевания.
- Малая физическая активность, избыточный вес негативно сказываются на состоянии иммунной защиты, которая является важнейшим фактором защиты организма от раковых клеток.
- Носительство вируса папилломы человека повышает риск рак шейки матки у женщин, рака гортани у обоих полов.
- Жители крупных городов и мегаполисов — возникающие при стирании автомобильных шин частицы вместе с выхлопами транспорта повышают риск злокачественной онкологии дыхательной системы и кожи.
- Работники «грязных» производств — обилие в воздухе сажи, свинца, асбеста и других мелких частиц повышает вероятность рака легких и не только.
Диагностика рака на ранней стадии
Ранняя диагностика рака критически важна для каждого человека, поскольку в этом случае значительно повышается шанс на удачное лечение. Например, пятилетняя выживаемость на ранних стадиях сквамозно-клеточной карциномы составляет более 90% при условии своевременной диагностики и адекватной терапии. Исходы у пациентов с поздними стадиями этого рака значительно хуже — при наличии метастазов в лимфоузлы пятилетняя выживаемость составляет всего 25–45%. При Т-клеточной лимфоме разница в исходах еще более значительная: на ранних этапах десятилетняя выживаемость достигает 97–98%, тогда как на поздних этапах — всего 20%.
Специалисты Американского онкологического общества провели многолетние наблюдения за исходами терапии пациентов с меланомой — одного из самых злокачественных раков кожи. Было установлено, что прогноз успешного лечения значительно возрастает при выявлении меланомы на ранних стадиях:
- Локализованная опухоль, которая не выходит за пределы кожи — 98%
- Региональное распространение с прорастанием в близлежащие лимфоузлы — 64%
- Отдаленные метастазы в легких, печени и других органах — 23%
Подобные цифры можно найти для любых типов злокачественных опухолей. Например, пятилетняя выживаемость пациентов с раком желудка при ранней диагностике значительно увеличивается:
- Локализованная опухоль, которая не выходит за пределы слизистой желудка — 68%
- Региональное распространение с прорастанием в близлежащие лимфоузлы — 31%
- Отдаленные метастазы в печени и других органах — 5%
Все это говорит о невероятной важности своевременной диагностики рака, поскольку только в этом случае можно гарантировать высокую вероятность успешного лечения и благоприятного исхода. Каждому человеку следует не только регулярно проходить общее обследование организма на рак, но и самостоятельно обращать внимание на первые признаки онкологических заболеваний. Ведь зачастую организм сигнализирует о проблемах — надо лишь внимательно к нему прислушаться.
Первые признаки онкологических заболеваний органов
Вся дальнейшая информация о том, как определить рак, не должна восприниматься в качестве обязательного критерия наличия онкологии. Любой из указанных симптомов сам по себе не говорит о присутствии в организме доброкачественной или злокачественной опухоли. Однако эти признаки должны вызывать настороженность с последующим визитом к врачу — только квалифицированный медицинский специалист, после внимательного осмотра и проведения ряда анализов, может говорить о наличии или отсутствии рака.
Проблемы с мочеиспусканием — с возрастом они появляются у многих мужчин и женщин. К таким проблемам относятся:
- Частое мочеиспускание, особенно по ночам
- Внезапные позывы в туалет
- Слабое мочеиспускание, длящееся дольше, чем обычно
- Чувство жжения во время мочеиспускания
- Подтекание мочи при кашле, чихании, во время смеха, напряжения мышц живота и др.
Эти симптомы могут вызывать гиперплазия или рак предстательной железы у мужчин, слабость мышечного сфинктера мочеиспускательного канала у женщин, инфекции, передаваемые половым путем у обоих полов, и др. В любом случае, стоит незамедлительно обратиться к врачу.
Кровь в моче или стуле — является одним из признаков рака мочевого пузыря, почек или толстого кишечника. Однако кровь может также возникать при урогенитальной инфекции или геморрое. В любом случае, это состояние не является нормальным, поэтому следует записаться на прием к медицинскому специалисту: урологу, хирургу или терапевту.
Изменения кожи — особое внимание следует обратить на родинки и любые другие пятна. Изменение цвета, размера или формы родинки является поводом для обращения к врачу. Также следует обращать внимание на беспричинное потемнение или осветление какой-либо области кожи. Врач может назначить биопсию — взятие небольшого кусочка из подозрительного участка для анализа на рак под микроскопом.
Увеличение и/или болезненность лимфоузлов — может являться реакцией на простуду или на воспалительный процесс в лимфатических узлах, так называемый лимфаденит. Однако в ряде случаев увеличение лимфоузлов говорит о раке, поэтому нужно без промедления посетить лечащего врача.
Нарушение голоса и/или глотания — может быть признаком рака гортани, которому особенно подвержены активные курильщики. Для диагностики врач может назначить рентгеноскопию с барием, компьютерную или магнитно-резонансную томографию и другие процедуры.
Изжога — неспецифический признак, который сам по себе не говорит о наличии злокачественной опухоли. Однако прогрессирующая изжога может возникать при раке пищевода, желудка или ротоглотки.
Изменения на слизистой рта — особенно тщательно ротовую полость следует осматривать активным курильщикам. Наличие белых, красноватых или сероватых бляшек на слизистой может быть признаком рака и является поводом для визита к врачу.
Резкая потеря веса — злокачественные клетки раковой опухоли требуют много энергии для деления, которую они берут из поступающей в организм пищи. Поэтому значительный объем питательных веществ не доходит до нужных органов и тканей, и человек начинает быстро терять вес. Если фиксируется беспричинное снижение массы тела, это может говорить о раке внутренних органов. Поэтому нужно как можно скорее записаться на прием к врачу.
Жар — в большинстве случаев повышение температуры тела и жар свидетельствуют о том, что организм борется с инфекцией. Но постоянный или возникающий регулярно без явной причины жар может свидетельствовать о раке крови.
Изменения груди — если грудь женщины изменила свою структуру или форму, либо в молочных железах начали прощупываться узловатые или иные образования, это является поводом для обращения к медицинскому специалисту. Врач может назначить маммографию — рентгеновское обследование, помогающее выявить рак молочной железы. Сегодня женщин во всем мире учат регулярному самообследованию груди, что является важным методом ранней диагностики злокачественных опухолей. Однако в 2017 году в Европе было зафиксировано 2470 случаев рака молочной железы у мужчин, поэтому им также следует быть внимательными и регулярно обследовать свою грудь на предмет любых изменений.
Боль — при увеличении размеров раковой опухоли она начинает давить на окружающие структуры: мышцы, сосудистые пучки, нервные волокна, соединительнотканную капсулу органов и др. Это может вызывать болевые ощущения, которые сами по себе не говорят о наличии рака, но являются поводом для посещения врача.
Какие анализы укажут на онкологическое заболевание?
При подозрении на онкологическое заболевание или при уже диагностированном раке пациенту могут быть назначены некоторые лабораторные исследования. Чаще всего требуется сдать анализы:
- общеклинический анализ крови; анализ крови на онкомаркеры;
- биохимическое исследование крови; анализ на белки плазмы;
- оценка свертываемости крови – коагулограмма.
Эти анализы не применяют для первичной диагностики злокачественных опухолей. Но они помогают оценить важные показатели в организме, дают дополнительную информацию о характере течения заболевания.
Общий анализ крови — распространенный и даже «рутинный» метод, который заключается в подсчете различных типов кровяных клеток. С его помощью можно заподозрить рак крови, если выявлено слишком много или слишком мало клеток определенных типов или присутствуют аномальные кровяные тельца. Для подтверждения диагноза рака может быть назначена биопсия костного мозга.
Биохимический анализ крови — дает общую информацию о метаболизме и работе внутренних органов: поджелудочной железы, печени, почек, желчного пузыря и др. Определенные изменения в биохимии крови могут говорить о наличии того или иного рака, например, предстательной железы.
Белки плазмы — этот анализ помогает выявлять особые белки в плазме крови, которые называются иммуноглобулинами. Их число может быть повышено у пациентов с множественной миеломой и другими типами рака крови.
Анализ крови на онкомаркеры относят к уточняющим тестам и не могут служить в качестве основного метода выявления рака. Их проводят в динамике, когда онкозаболевание уже диагностировано. По снижению или росту уровней онкомаркеров можно судить, насколько хорошо помогает лечение, не прогрессирует ли рак.
Коагулограмма помогает оценить состояние свертывающей системы крови. В ней нередко возникают нарушения при онкологических заболеваниях, в частности, при лейкозах.
Анализ мочи
В анализе мочи можно найти отклонения, указывающие на возможное наличие злокачественной опухоли, только в определенных случаях:
Рак органов мочевыделительной системы может привести к тому, что в моче появляется кровь. В большом объеме она хорошо заметна визуально, а в малых количествах может быть обнаружена лабораторно. Это неспецифический признак, он встречается не только при онкологических, но и при многих других заболеваниях, например, камнях в почках и мочевом пузыре, гломерулонефрите, инфекционном процессе.
При распаде опухолевой ткани в моче могут появиться кетоновые тела. Их наличие – также неспецифический признак, чаще всего он свидетельствует не об опухолевом процессе, а о сахарном диабете.
Белок Бенс-Джонса представляет собой легкие цепи иммуноглобулинов. Их появление в моче может свидетельствовать о миеломной болезни (злокачественном поражении костного мозга) или макроглобулинемии Вальденстрема.
В остальных случаях анализ мочи при онкологических заболеваниях неинформативен. Он может лишь выявить некоторые нарушения в организме, но ничего не говорит непосредственно об опухолевом процессе.
Анализ кала
Кровь в кале может свидетельствовать о злокачественной опухоли в кишечнике. Но это неспецифический симптом. Он часто встречается при геморрое, кишечных полипах и других заболеваниях кишки. В то же время, при раке кровь не всегда видна визуально, и ее можно обнаружить только с помощью специальных анализов. Иногда для скрининга колоректального рака вместо колоноскопии применяют такие лабораторные исследования, как анализ кала на скрытую кровь и анализ фекальной ДНК.
Может ли общий анализ крови показать рак?
С помощью общего анализа крови невозможно диагностировать рак, но он в целом может помочь в ранней диагностике, так как показывает, что с организмом пациента не всё в порядке, и требуется дальнейшее обследование. Возможны такие неспецифические отклонения, как повышение или снижение уровня лейкоцитов, снижение уровня эритроцитов и гемоглобина (анемия), снижение числа тромбоцитов, ускорение СОЭ, появление в крови незрелых клеток. Подобные отклонения в анализах могут быть вызваны как самим раком, так и противоопухолевой терапией.
Онкомаркеры
Анализы на онкомаркеры основаны на выявлении в крови химических веществ, вырабатываемых опухолевыми клетками. Универсального теста, который может безошибочно указать на наличие того или иного рака, нет. Это связано с тем, что уровни данных химических веществ могут повышаться в том числе и при некоторых нераковых состояниях. Ниже представлены наиболее популярные онкомаркеры — какие из них сдавать для профилактики и что они могут показать:
- простат-специфический антиген (ПСА) — рак предстательной железы;
- углеводный антиген 125 (CA-125) — рак яичников;
- кальцитонин — медуллярный рак щитовидной железы;
- альфа-фетопротеин (АФП) — рак печени;
- хорионический гонадотропин человека (ХГЧ) — рак яичка и рак яичников.
Анализ крови на раковые клетки CancerSEEK — направлен на выявление циркулирующих в крови клеток злокачественной опухоли. Его также называют жидкой биопсией.
Указанные выше анализы помогают врачу заподозрить наличие злокачественной опухоли в организме. Однако для подтверждения рака обязательно выполняют диагностическую биопсию — взятие кусочка ткани из подозрительного участка на гистологическое исследование. Только под микроскопом можно достоверно установить, является ли конкретное образование злокачественной опухолью, а также определить вид.
Биопсия может быть взята с поверхности кожи, со слизистых, из внутренних органов, мышц, костей и др. В ряде случаев выполняется диагностическая малоинвазивная операция с использованием эндоскопа.
Другие методы диагностики рака
Диагностическая визуализация — рентгеновские исследования, маммография, компьютерная и магнитно-резонансная томография, позитронно-эмиссионная томография, совмещенная с томографией, двухфотонная рентгеновская абсорциометрия, УЗИ органов брюшной полости, печени и др.
Эндоскопические исследования:
- эзофагогастродуоденоскопия — исследование желудка и 12-перстной кишки;
- колоноскопия — исследование толстого кишечника;
- кольпоскопия — исследование влагалища и шейки матки;
- цистоскопия — исследование мочевого пузыря и уретры;
- эндоскопическая ретроградная холангиопанкреатография — изучение желчных протоков, желчного пузыря и печени с помощью эндоскопа и рентгеновских методов;
- сигмоидоскопия — обследование сигмовидной кишки.
Генетический скрининг — картирование генетического профиля человека для выявления наследственной предрасположенности к той или иной злокачественной опухоли.
Скрининговые исследования, которые доступны на данный момент, достаточно просты и не отнимают много времени. Но иногда они помогают спасти жизнь. Хотите узнать, какие виды скрининга нужно проходить вам? Узнайте у онколога в клиниках «Евроонко».
Рак из невыявленного первичного очага
Так как заболевание уже на первых этапах проявляется метастазами, можно говорить о первично генерализованном процессе, который к моменту обращения пациента за медицинской помощью, как правило, выходит за пределы одного органа.
В зависимости от локализации и распространенности метастатического поражения больных делят на следующие группы:
- Пациенты с изолированным поражением лимфоузлов (единичным или множественным в пределах одного коллектора) — шейных, подмышечных, паховых, медиастинальных, забрюшинных.
- Пациенты с изолированным поражением органов и тканей (единичным или множественным) – костей, легких, печени, мягких тканей, головного и спинного мозга и др.
- Пациенты с поражением нескольких коллекторов лимфоузлов, сочетанное поражение лимфоузлов и/или органов.
Клинические проявления заболевания неспецифичны и зависят от локализации очагов метастатического поражения и распространенности опухолевого процесса. Первым симптомом чаще всего является увеличение размеров периферических лимфоузлов. Общие проявления: слабость, потливость, похудание, гипертермия более характерны при поражении органов — легких, печени. При обращении за медицинской помощью часто встречаются следующие изменения: наличие того или иного опухолевого образования, боль, увеличение печени, боли в костях, патологические переломы, респираторные нарушения, потеря веса, неврологические расстройства.
В ходе обследования после анализа данных рентгенографии органов грудной клетки, ультразвуковой томографии органов брюшной полости, забрюшинного пространства и малого таза, радиоизотопного исследования скелета и лимфоузлов, компьютерной томографии головного мозга оценивается распространенность метастатического поражения. Далее проводится морфологическое исследование материала, взятого при пункции или биопсии опухоли. Морфологическое исследование является наиболее значимым и должно выполняться как можно раньше. Полученные данные позволяют подтвердить злокачественность процесса, определить гистогенез опухоли, степень дифференцировки клеток, а иногда и предположительную локализацию первичной опухоли, что значительно облегчает поиск первичного очага и сокращает количество диагностических манипуляций.
Существенную помощь в определении характеристик опухоли может оказать выполнение иммуногистохимического исследования, которое позволит в каждом конкретном случае выработать индивидуальную лечебную тактику.
На заключительном этапе исследований осуществляется поиск первичной опухоли (если ее не смогли обнаружить ранее) в соответствии с гистологической структурой метастазов и распространенностью поражения. Эти два фактора существенно влияют на индивидуальную программу обследования конкретного пациента.
Стандартные методы лечения рака из НПО — это лучевая терапия, возможно в комплексе с химиотерапией, лимфаденэктомия (хирургическая операция, заключающаяся в иссечении лимфатических узлов, пораженных злокачественным процессом).
В медицинском центре ООО «Эдис Мед Ко» научились бороться с разными гистологическими формами злокачественных заболеваний, в том числе и рак из НПО, применяя авторский метод лечения фотодинамической терапией (ФДТ) в сочетании с омелотерапией. Применяемый на протяжении многих лет, этот метод доказал свою эффективность в борьбе с заболеваниями, которые считались неизлечимыми.
Курсы лечения ФДТ в медицинском центре помогут пациенту выйти на ремиссию болезни, восстановить иммунитет и защитные силы своего организма, чтобы патологический процесс не смог появиться вновь.
Сайт издательства «Медиа Сфера»
содержит материалы, предназначенные исключительно для работников здравоохранения. Закрывая это сообщение, Вы подтверждаете, что являетесь дипломированным медицинским работником или студентом медицинского образовательного учреждения.
ФГАОУ ВО «Первый Московский государственный медицинский университет им. И.М. Сеченова Минздрава РФ, ул. Б. Пироговская, 2, стр.4, Москва, 119991, Российская Федерация
Морфологическая диагностика карциномы с невыявленной первичной локализацией
Как цитировать:
Журавлев А.С. Морфологическая диагностика карциномы с невыявленной первичной локализацией. Архив патологии.
2019;81(2):51‑58.
Zhuravlev AS. Carcinoma with unknown primary site: Morphological diagnosis. Arkhiv Patologii. 2019;81(2):51‑58. (In Russ.)
https://doi.org/10.17116/patol20198102151

Читать метаданные
Карцинома с невыявленной первичной локализацией (КНПЛ) — это группа злокачественных опухолей, первым проявлением которых является метастатическая диссеминация. Клиническое обследование пациентов с КНПЛ обычно не позволяет обнаружить первичную опухоль, и значительную роль в диагностике источника метастаза играет патолого-анатомическое исследование. Приведены данные литературы по патолого-анатомической диагностике КНПЛ, рассмотрены морфологические характеристики метастазов, возможности иммуногистохимической диагностики и молекулярно-генетического метода в поиске первичного очага.
Авторы:
Журавлев А.С.
ФГАОУ ВО «Первый Московский государственный медицинский университет им. И.М. Сеченова Минздрава РФ, ул. Б. Пироговская, 2, стр.4, Москва, 119991, Российская Федерация
Карцинома с невыявленной первичной локализацией (КНПЛ) — это гистологически подтвержденная метастатическая злокачественная опухоль, для которой первичный источник не был обнаружен при детальном клиническом и лабораторном обследовании [1—3]. Поиск первичного очага затруднен тем, что биология этих опухолей предполагает возможность метастатической диссеминации без роста первичной опухоли, а в случае, когда первичный очаг удалось обнаружить, его размер редко превышает 2 см [1]. Термин «карцинома с невыявленной первичной локализацией» используется с середины прошлого века по сегодняшний день для всех злокачественных опухолей без выявленного первичного очага, несмотря на то что около 5% этих опухолей представлено метастазами меланомы, саркомы или лимфомой [1—4]. Известный первичный опухолевый очаг позволяет применить специфические таргетные схемы лечения, и часто именно патолого-анатомические методы позволяют установить природу клеток-родителей метастаза (например, опухоль с экспрессией иммуногистохимических (ИГХ) маркеров cytokeratin (CK) 20 и CDX2, а также отсутствием экспрессии CK7 практически всегда соответствует метастазу колоректального рака). Отсутствие известного источника метастаза ведет к дополнительным диагностическим исследованиям, задержке химиотерапии, применению неэффективных и/или комбинированных схем лечения (и повышению токсического эффекта терапии), эмоциональному напряжению пациента вследствие отсутствия определенного диагноза, снижению качества жизни и ухудшению прогноза заболевания [1, 3, 5]. В данной статье рассмотрены общие практические подходы к патолого-анатомической диагностике метастатических опухолей без выявленного первичного очага.
Анализ клинической информации
Анализ клинической информации при КНПЛ всегда следует проводить тщательным образом, запрашивая у клинициста результаты всех выполненных обследований, внешнего осмотра пациента, анамнеза болезни, так как любые клинические данные позволяют патологу сузить дифференциальный диагноз источников метастаза, уточнить или уменьшить ИГХ-панель, сократить сроки выдачи заключения, а также материальные затраты лаборатории на диагностику. В совместном клинико-патолого-анатомическом подходе разработана прогностическая классификация КНПЛ, объединяющая две группы: благоприятную и неблагоприятную. Морфологические особенности опухолей в благоприятной группе (она составляет около 20% пациентов с КНПЛ) предполагают возможность постановки определенного диагноза даже при отсутствии анатомически выявленного первичного очага, а ведение таких пациентов соответствует методам, применяемым при опухолях с известной локализацией, что позволяет выбрать определенную тактику лечения и продлить выживаемость этих пациентов до 12 мес и более (табл. 1).
При метастазах в лимфатическом узле необходимо исключить опухоль в органах, для которых пораженный лимфатический узел является регионарным (например, метастазы в подмышечных лимфатических узлах у женщин в 72% представлены карциномой молочной железы, метастазы в шейных лимфатических узлах выше надключичных в 75% представлены плоскоклеточным раком органов головы и шеи) [8—11]. При метастазах в лимфатических узлах шеи всегда следует уточнять результаты клинического осмотра органов носо- и ротоглотки. Описанный при КНПЛ нетипичный характер метастазирования, например метастазы аденокарциномы легкого в костях или карциномы предстательной железы в лимфатических узлах шеи, можно объяснить более быстрым ростом обнаруженных метастатических очагов по сравнению с метастазами в регионарных лимфатических узлах [10, 12].
Помимо сбора анамнеза и стандартных лабораторно-инструментальных исследований, в расширенный набор клинического обследования пациентов с КНПЛ должны быть включены такие методы, как анализ кала на скрытую кровь, маммография для женщин, определение концентрации некоторых сывороточных маркеров (простатического специфического антигена для мужчин, альфа-фетопротеина, бета-человеческого хорионического гонадотропина, белков СА125, СА19−9) [3].
Морфологическая диагностика КНПЛ
Применение только световой микроскопии при известных данных клинического обследования позволяет патологу предположить один верный источник метастаза КНПЛ примерно в половине случаев, а в некоторых случаях чувствительность морфологического метода стремится к 90% (например, у колоректальной и простатической ацинарной аденокарциномы относительно специфический фенотип с наличием в опухоли «грязных» некрозов или мелких мономорфных желез с крупными ядрышками в округлых ядрах соответственно) [9, 13]. К группе «узнаваемых» также можно отнести метастазы фолликулярной и папиллярной карциномы щитовидной железы с секрецией коллоида и плоскоклеточного рака с наличием «жемчужин» из кератиновых масс. Однако зачастую возможности базовой окраски гематоксилином и эозином недостаточно для проведения дифференциальной диагностики, и целью световой микроскопии становится определение набора ИГХ-маркеров для типирования метастаза.
Существует несколько морфологических классификаций КНПЛ. Классификация Европейского общества медицинской онкологии выделяет следующие группы: высоко- и умеренно дифференцированная аденокарцинома, плоскоклеточная карцинома, нейроэндокринная карцинома, низко-/недифференцированная карцинома, низкодифференцированная опухоль [1]. Для дальнейшего клинического ведения пациента рекомендуется определять метастаз в одну из этих групп, однако, если аденокарцинома, плоскоклеточный рак и нейроэндокринный рак зачастую демонстрируют характерные морфологические признаки в виде железистого паттерна роста, очагов ороговения, типичного хроматина «соль—перец» соответственно, то в группах недифференцированных карцином/опухолей отсутствует специфический фенотип. Это не позволяет однозначно высказаться о возможном источнике опухоли и требует широкой ИГХ-панели для исключения неэпителиальных опухолей.
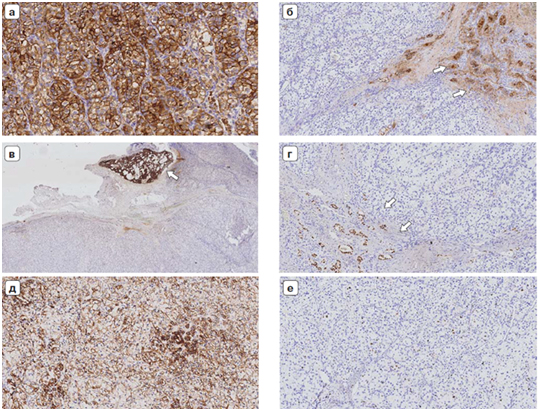
Классификация, предложенная F. Lin и соавт. [9, 14, 15], разделяет метастазы КНПЛ на: 1) метастазы с наличием признаков, позволяющих предположить тип опухоли (например, очаги ороговения/плоскоклеточной метаплазии, микрососочковая или сосочковая архитектура, продукция пигмента, слизи, коллоида или остеоида, светлоклеточная или перстневидно-клеточная морфология, бифазная морфология, «грязные» некрозы и т. д.); 2) метастазы опухолей с наличием железистой дифференцировки (высоко- и умеренно дифференцированные аденокарциномы); 3) метастазы с неопределенной линией дифференцировки (веретеноклеточные, мелкокруглоклеточные, эпителиоидно-клеточные, плеоморфные или недифференцированные опухоли) (рис. 1).
Практический алгоритм диагностики источника метастаза КНПЛ, основанный только на гистологической архитектуре и цитологических особенностях клеток метастаза, в настоящее время отсутствует, но разделение на указанные выше морфологические типы опухоли позволяют сузить ИГХ-панель для дальнейшей диагностики первоисточника [9, 10, 16].
Иммуногистохимическая диагностика КНПЛ
ИГХ-исследование остается золотым стандартом в диагностике КНПЛ, так как позволяет работать с фиксированным в формалине и залитым в парафин материалом, является относительно легко интерпретируемым анализом, обладает низкой себестоимостью и обеспечивает быстрый результат [17—19]. В среднем патологу требуется 8—10 маркеров для диагностики одного случая метастаза КНПЛ [6, 7]. В некоторых исследованиях показано, что эффективность ИГХ для метастазов КНПЛ невысока и не превышает 30%, но следует учитывать, что результаты многих исследований не совсем соответствуют современной действительности, так как большинство из них проведено в начале 2000-х годов с применением слабоспецифичных ИГХ-маркеров [20]. В настоящее время в диагностике КНПЛ отдают предпочтение антителам к ядерным транскрипционным факторам, а также некоторым антителам к промежуточным филаментам клеток [15, 18, 21—23]. В рамках данной статьи будут описаны только базовые моменты ИГХ-диагностики, так как данная тема широко изложена на страницах многих руководств [21, 22].
Диагностический ИГХ-алгоритм для КНПЛ основан на приведенной выше морфологической классификации с разделением на метастазы злокачественных опухолей без формирования желез и метастазы аденокарциномы с формированием желез [13, 15, 22, 24]. Для злокачественных опухолей без формирования желез необходимо всегда уточнять линию дифференцировки опухоли и не стремиться назначить широкую панель сразу, а выполнять поэтапное ИГХ-исследование. В тех случаях, когда материала в биоптате крайне мало и есть риск срезать из блока всю опухоль при его тримминге, лучше сразу изготовить несколько запасных срезов, но окрашивать их поэтапно.
На первом этапе диагностики низко- и недифференцированных опухолей большинство авторов предлагают использовать следующие маркеры: антитело широкого спектра действия к нескольким цитокератинам (например, маркеры CAM5.2, OSCAR, AE1/3, MNF116) и маркеры S100, Vimentin и Leukocyte Common Antigen (LCA) (табл. 2)
Для метастазов карциномы с наличием железистой дифференцировки начальный этап ИГХ-диагностики в настоящее время не отличается от предложенного еще в конце прошлого века алгоритма с применением антител к низкомолекулярным кератинам — СК7 и СК20 (табл. 3)
Иммунопрофиль CK7/20 дополняется ИГХ-диагностикой с применением антител к ядерным транскрипционным факторам, которые обладают высокой чувствительностью и специфичностью для карцином разной степени дифференцировки. В табл. 4 приведены основные маркеры этой группы, а также опухоли, в которых их экспрессия встречается чаще всего [2, 15, 18, 21, 22, 33]. Некоторые ИГХ-алгоритмы, в которых основную роль играют антитела к факторам транскрипции, а профиль СК7/20 оценивается только на конечных этапах, демонстрируют чувствительность до 65% в метастазах высоко- и умеренно дифференцированных аденокарцином [33]. Следует учитывать, что некоторые карциномы имеют неспецифический или схожий иммунофенотип, например дуктальная аденокарцинома поджелудочной железы и аденокарцинома из билиарного эпителия, в таких случаях можно ограничиться формулировкой «метастаз аденокарциномы панкреатобилиарного типа». Также необходимо обращать внимание на специфические типы экспрессии, например, в метастазах аденокарцином слюнных желез наблюдается экспрессия р63 и других миоэпителиальных маркеров по периферии фокусов аденокарциномы (рис. 3).
Для идентификации метастазов нейроэндокринных неоплазий (НЭН) наиболее специфичными маркерами являются synapthophysin и chromogranin A, менее специфичен маркер CD56, так как экспрессируется в ряде карцином, однако он обладает высокой чувствительностью к НЭН [22]. Для подтверждения НЭН лучше использовать как минимум два маркера из указанных выше, а также следует обращать внимание на тип экспрессии цитокератинов, который довольно специфичен и проявляется в виде точечного парануклеарного окрашивания в мелкоклеточном нейроэндокринном раке и карциноме из клеток Меркеля. В редких случаях можно определить первичную локализацию нейроэндокринной опухоли, например экспрессия маркера РАХ8 встречается в карциноиде поджелудочной железы, а SATB2 — в карциноиде толстой кишки [35, 37]. Мелкоклеточный нейроэндокринный рак не требует определения первичного очага, так как хорошо реагирует на химиотерапию [34—37]. ИГХ-определение первичной локализации для метастазов плоскоклеточного рака невозможно для большинства локализаций, однако в плоскоклеточном раке орофарингеальной зоны (область небных миндалин и корня языка) наблюдается экспрессия маркера p16, а в тимической плоскоклеточной карциноме часто присутствует экспрессия CD5 и CD117 — эти маркеры могут быть использованы для уточнения источника метастаза [38, 39].
Генетическое исследование — альтернатива ИГХ?
Одна из первых работ, где было показано, что профиль экспрессии генов (ПЭГ) в метастазах может быть использован для обнаружения локализации первичной опухоли, была опубликована еще в 2001 г., а в настоящее время в продаже уже доступно несколько тестов для определения ПЭГ в метастазах КНПЛ и низкодифференцированных карциномах — CancerTYPE ID (от компании bioTheranostics), Cancer Origin Test (Rosetta Genomics), EPICUP (Ferrer, IDIBELL) [6, 7, 40—42]. При валидации тестов на материале опухолей с известной первичной локализацией точность определения клеток-родоначальников опухоли достигает 99%, а при тестировании метастазов КНПЛ (с подтвержденным впоследствии первичным источником) — 87% [6, 21, 43]. Предложенный В. Centero [43] в 2010 г. диагностический алгоритм для КНПЛ с применением комбинации генетических тестов и ИГХ продемонстрировал точность исследования 90%. В случаях, когда установить единственный источник метастаза при ИГХ-диагностике невозможно, последующее применение результатов исследования ПЭГ позволяет лечащему врачу скорректировать схему терапии для 50% КНПЛ-пациентов и изменить диагностическую тактику для 65% [44]. Недостатками методов диагностики с исследованием ПЭГ являются высокая стоимость (около 3000 долл. США), сомнительные результаты теста при малом количестве материала, перекрестные результаты, ограниченный набор последовательностей нуклеотидов в ДНК-микрочипе теста, что не позволяет включить все возможные опухоли в дифференциальный диагноз [6, 24, 44, 45].
Применение генетических методов исследования позволило открыть новые перспективы в изучении природы и лечения КНПЛ. Используя комплексное геномное профилирование, J. Ross и K. Wang [46] в 2015 г. доказали, что в 85% КНПЛ генетические альтерации являются таргетными для химиотерапии (например, в генах ALK, BRAF, EGFR, KRAS и др.), что в целом ставит под сомнение необходимость определения локализации первичной опухоли.
Заключение
Современная патолого-анатомическая диагностика КНПЛ базируется на комплексном анализе клинических, морфологических, иммуногистохимических исследований, но даже всесторонний анализ не всегда приводит врача к одной локализации, в таких случаях следует указать в заключении несколько возможных источников метастаза, чтобы сузить клинический поиск. Для успешной диагностики КНПЛ патолог должен быть знаком как с морфологией различных опухолей, так и с особенностями экспрессии доступных в лаборатории антител, а также учитывать возможные аберрантные типы экспрессии в низкодифференцированных карциномах.
Автор заявляет об отсутствии конфликта интересов.
Сведения об авторах
Журавлев Александр Сергеевич — e-mail: zhuravlev@lab.unim.su; https://orcid.org/0000-0002-2821-7434