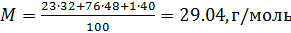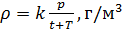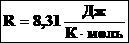Найти массу, плотность или объем онлайн
На данной странице калькулятор поможет найти плотность, массу или объем вещества онлайн. Для расчета введите значения в калькулятор.
Объем, масса и плотность
Найти
Масса:
Объем:
Плотность:
Ответы:
Формула для нахождения массы тела через плотность и объем:
m — масса; V — объем; p — плотность.
Формула для нахождения объема тела через плотность и массу:
m — масса; V — объем; p — плотность.
Формула для нахождения плотности тела через объем и массу:
m — масса; V — объем; p — плотность.
Калькулятор
Уравнение состояния идеального газа
теория по физике 🧲 молекулярная физика, МКТ, газовые законы
Уравнение состояния идеального газа было открыто экспериментально. Оно носит название уравнения Клапейрона — Менделеева. Это уравнение устанавливает математическую зависимость между параметрами идеального газа, находящегося в одном состоянии. Математически его можно записать следующими способами:
Уравнение состояния идеального газа
Внимание! При решении задач важно все единицы измерения переводить в СИ.
Пример №1. Кислород находится в сосуде вместимостью 0,4 м 3 под давлением 8,3∙10 5 Па и при температуре 320 К. Чему равна масса кислорода? Молярная масса кислорода равна 0,032 кг/моль.
Из основного уравнения состояния идеального газа выразим массу:
Уравнение состояния идеального газа следует использовать, если газ переходит из одного состояния в другое и при этом изменяется его масса (количество вещества, число молекул) или молярная масса. В этом случае необходимо составить уравнение Клапейрона — Менделеева отдельно для каждого состояния. Решая систему уравнений, легко найти недостающий параметр.
Подсказки к задачам
Важна только та масса, что осталась в сосуде. Поэтому:
| Давление возросло на 15% | p2 = 1,15p1 |
| Объем увеличился на 2% | V2 = 1,02V1 |
| Масса увеличилась в 3 раза | m2 = 3m1 |
| Газ нагрелся до 25 о С | T2 = 25 + 273 = 298 (К) |
| Температура уменьшилась на 15 К (15 о С) | T2 = T1 – 15 |
| Температура уменьшилась в 2 раза |  |
| Масса уменьшилась на 20% | m2 = 0,8m1 |
| Выпущено 0,7 начальной массы | |
| Какую массу следует удалить из баллона? | Нужно найти разность начальной и конечной массы: |
| Газ потерял половину молекул |  |
| Молекулы двухатомного газа (например, водорода), диссоциируют на атомы |  |
| Озон (трехатомный кислород) при нагревании превращается в кислород (двухатомный газ) | M (O3) = 3Ar (O)∙10 –3 кг/моль M (O2) = 2Ar (O)∙10 –3 кг/моль |
| Открытый сосуд | Объем V и атмосферное давление pатм остаются постоянными |
| Закрытый сосуд | Масса m, молярная масса M, количество вещества ν, объем V, число N и концентрация n частиц, плотность ρ— постоянные величины |
| Нормальные условия | Температура T0 = 273 К Давление p0 = 10 5 Па |
| Единицы измерения давления | 1 атм = 10 5 Па |
Пример №2. В баллоне содержится газ под давлением 2,8 МПа при температуре 280 К. Удалив половину молекул, баллон перенесли в помещение с другой температурой. Определите конечную температуру газа, если давление уменьшилось до 1,5 МПа.
2,8 МПа = 2,8∙10 6 Па
1,5 МПа = 1,5∙10 6 Па
Так как половина молекул была выпущена, m2 = 0,5m1. Объем остается постоянным, как и молярная масса. Учитывая это, запишем уравнение состояния идеального газа для начального и конечного случая:
Преобразим уравнения и получим:
Приравняем правые части и выразим искомую величину:

Алгоритм решения
Решение
График построен в координатах (V;Ek). Процесс 1–2 представляет собой прямую линию, исходящую из начала координат. Это значит, что при увеличении объема растет средняя кинетическая энергия молекул. Но из основного уравнения МКТ идеального газа следует, что мерой кинетической энергии молекул является температура:
Следовательно, когда кинетическая энергия молекул растет, температура тоже растет.
Запишем уравнение Менделеева — Клапейрона:
Так как количество вещества одинаковое для обоих состояния 1 и 2, запишем:
ν R = p 1 V 1 T 1 . . = p 2 V 2 T 2 . .
Мы уже выяснили, что объем и температура увеличиваются пропорционально. Следовательно, давление в состояниях 1 и 2 равны. Поэтому процесс 1–2 является изобарным, давление во время него не меняется.
Процесс 2–3 имеет график в виде прямой линии, перпендикулярной кинетической энергии. Так как температуры прямо пропорциональна кинетической энергии, она остается постоянной вместе с этой энергией. Следовательно, процесс 2–3 является изотермическим, температура во время него не меняется. Мы видим, что объем при этом процессе уменьшается. Но так как объем и давление — обратно пропорциональные величины, то давление на участке 2–3 увеличивается.
pазбирался: Алиса Никитина | обсудить разбор | оценить
На высоте 200 км давление воздуха составляет примерно 10 –9 от нормального атмосферного давления, а температура воздуха Т – примерно 1200 К. Оцените плотность воздуха на этой высоте.
Как найти плотность зная температуру и давление
Комбинированный газовый закон — это формула, которая связывает основные параметры идеального газа и позволяет вычислять неизвестные в случаях, если заданы пять остальных величин.
Идеальный газ
Идеальный газ — это математическая модель с определенными допущениями, которая позволяет исследовать свойства газообразных веществ с достаточной точностью. К допущениям, которые используются в модели идеального газа, относятся:
- пренебрежение размерами молекул;
- силы молекулярного взаимодействия не учитываются;
- соударение атомов и молекул абсолютно упруго;
- газ находится в термодинамическом равновесии.
Благодаря этим допущениям ученые изучили основные свойства газообразных веществ и вывели основные законы, которым подчиняются любые газы. Комбинированный закон объединяет все перечисленные ниже зависимости.
Газовые законы
Любое газообразное вещество характеризуется тремя простыми параметрами: объемом, давлением и температурой. Газ тем и хорош, что он заполняет весь предоставленный объем или может сжиматься до минимальных объемов, иногда переходя в состояние жидкости. Сжимать газ можно двумя способами:
- при постоянном давлении уменьшить температуру;
- при постоянной температуре увеличить давление.
Эти две простые формулировки отражают в себе два известных газовых закона: изобару и изотерму. В изобарном процессе изменение температуры приводит к прямо пропорциональному изменению объема. Вспомните жидкий азот: он занимает минимум места, при этом его температура составляет 63,29 К, что соответствует –209 градусам Цельсия. Если температуру азота поднять до 20 градусов Цельсия, то 1 литр жидкого азота превратится в 700 литров газа. Увеличивается температура, увеличивается объем и наоборот. Эти изменения обусловлены тем, что соотношение объема к температуре газа остается статичным.
В изотермическом процессе температура не изменяется и для сжатия газа придется увеличить давление. Это процесс проще для понимания, так как сдавливая газ мы уменьшаем его объем подобно тому, как утрамбовывание грунта или снега позволяет уложить их более плотно и с меньшим объемом. В этом изотермическом процессе изменение давления приводит к обратно пропорциональному изменению объема. Больше давление, меньше объем и наоборот. Такая динамика обусловлена тем, что произведение давления на объем — это всегда постоянная величина.
Если же объем газа не изменяется, то процесс называется изохорным и в этом процессе отображается взаимосвязь давления и температуры. Согласно закону, изменение одного параметра вызывает прямо пропорциональное изменение другого. Это означает, что увеличение давления в сосуде вызывает рост температуры находящегося там газа. Верно и обратное утверждение.
Комбинированный закон
Все перечисленные законы подчиняются общей формулировке: при постоянстве одного параметра, отношение двух других также постоянно. Обобщая эти законы в динамике получаем комбинированный газовый закон, который описывается формулой:
где P1, V1 и T1 — соответственно начальные давление, объем и температура, а P2, V2 и T2 — конечные.
Используя данную формулу легко определить динамику параметров во время нагрева газа или его сжатия.
Наша программа позволяет рассчитать соотношение параметров идеального газа при их изменении. Для использования калькулятора требуется задать пять известных величин, после чего программа определит последнее неизвестное. Рассмотрим небольшой пример.
Пример использования калькулятора
Представим баллон газа объемом 15 л под давлением 120 кПа и при температуре –20 градусов Цельсия. Определим температуру газа, если баллон будет заменен на емкость объемом 10 л и давлением 150 кПа. На первый взгляд у нас есть все параметры, однако в газовых законах температура обязательно указывается в кельвинах, а не градусах. Для перевода температуры в систему Си достаточно прибавить к значению величину 273. Получаем, что температура газа составляет 253 К. Теперь вводим данные в соответствующие ячейки и смотрим на результат: конечная температура теперь равна 210 К или –63 градуса Цельсия. Очевидно, что газ подчинился приведенным выше законам и при уменьшении объема его температура также уменьшилась.
Заключение
Газовые законы — серьезная тема школьного курса физики, которую более подробно разбирают на первом году обучения в вузах. Комбинированный закон газа прост на первый взгляд, но обилие параметров может запутать школьника, а выведение пропорций и вовсе способно превратить задачу в ад. Для упрощения расчетов используйте наш онлайн-калькулятор, не забывая переводить все заданные параметры в систему СИ.
Уравнение Клапейрона-Менделеева. Связь между числом молей газа, его температурой, объемом и давлением.
Калькулятор ниже предназначен для решения задач на использование уравнения Клапейрона-Менделеева, или уравнение состояния идеального газа. Некоторая теория изложена под калькулятором, ну а чтобы было понятно, о чем идет речь — пара примеров задач:
Примеры задач на уравнение Менделеева-Клапейрона
В колбе объемом 2,6 литра находится кислород при давлении 2,3 атмосфер и температуре 26 градусов Цельсия .
Вопрос: сколько молей кислорода содержится в колбе?
Некоторое количество гелия при 78 градусах Цельсия и давлении 45,6 атмосфер занимает объем 16,5 литров.
Вопрос: Каков объем этого газа при нормальных условиях? (Напомню, что нормальными условиями для газов считается давление в 1 атмосферу и температура 0 градусов Цельсия)
В калькулятор вводим начальные условия, выбираем, что считать (число моль, новые объем, температуру или давление), заполняем при необходимости оставшиеся условия, и получаем результат.
Уравнение Клапейрона-Менделеева. Связь между числом молей газа, его температурой, объемом и давлением.
Теперь немного формул.
где
P — давление газа (например, в атмосферах)
V — объем газа (в литрах);
T — температура газа (в кельвинах);
R — газовая постоянная (0,0821 л·атм/моль·K).
Если используется СИ, то газовая постоянная равна 8,314 Дж/K·моль
Так как m-масса газа в (кг) и M-молярная масса газа кг/моль, то m/M — число молей газа, и уравнение можно записать также
где n — число молей газа
И как нетрудно заметить, соотношение
есть величина постоянная для одного и того же количества моль газа.
И эту закономерность опытным путем установили еще до вывода уравнения. Это так называемые газовые законы — законы Бойля-Мариотта, Гей-Люссака, Шарля.
Так, закон Бойля-Мариотта гласит (это два человека):
Для данной массы газа m при неизменной температуре Т произведение давления на объем есть величина постоянная.
Закон Гей-Люссака (а вот это один человек):
Для данной массы m при постоянном давлении P объем газа линейно зависит от температуры
Закон Шарля:
Для данной массы m при постоянном объеме V давление газа линейно зависит от температуры
Посмотрев на уравнение, нетрудно убедиться в справедливости этих законов.
Уравнение Менделеева-Клапейрона, также как и опытные законы Бойля-Мариотта, Гей-Люссака и Шарля справедливы для широкого интервала давлений, объемов и температур. То есть во многих случаях эти законы удобны для практического применения. Однако не стоит забывать, что когда давления превышают атмосферное в 300-400 раз, или температуры очень высоки, наблюдаются отклонения от этих законов.
Собственно, идеальный газ потому и называют идеальным, что по определению это и есть газ, для которого не существует отклонений от этих законов.
Введение
Задача измерения параметров газовой смеси широко распространена в промышленности и торговле. Проблема получения достоверной информации при измерении параметров состояния газовой среды и её характеристик с помощью технических средств разрешается принятыми в стандартах методиками выполнения измерений (МВИ), например, при измерении расхода и количества газов с помощью стандартных сужающих устройств [1], или с помощью турбинных, ротационных и вихревых расходомеров и счётчиков [2].
Периодический газовый анализ позволяет установить соответствие между реальной анализируемой смесью и её моделью, по которой в МВИ учитываются физико-химические параметры газа: состав газовой смеси и плотность газа при стандартных условиях.
Также в МВИ учитываются теплофизические характеристики газа: плотность при рабочих условиях (давление и температура газа, при которых выполняют измерение его расхода или объёма), вязкость, фактор и коэффициент сжимаемости.
К измеряемым в реальном режиме времени параметрам состояния газа относятся: давление (перепад давлений), температура, плотность. Для измерения этих параметров применяются соответственно средства измерительной техники: манометры (дифманометры), термометры, плотномеры. Измерение плотности газовой среды допускается измерять прямым или косвенным методами измерения. Результаты как прямых, так и косвенных методов измерения зависят от погрешности средств измерения и методической погрешности. В рабочих условиях, сигналы измерительной информации могут быть подвержены влиянию значительного шума, среднее квадратичное отклонение которого может превышать инструментальную погрешность. В этом случае, актуальной задачей является эффективная фильтрация сигналов измерительной информации.
В данной статье рассматривается методика косвенного измерения плотности газа при рабочих и стандартных условиях c применением фильтра Калмана.
Математическая модель определения плотности газа
Обратимся к классике и вспомним уравнение состояния идеального газа [3]. Имеем:
1. Уравнение Менделеева-Клапейрона:
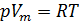
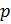
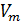
R — универсальная газовая постоянная,
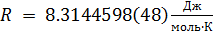
T — абсолютная температура, T=273.16 К.
2. Два измеряемых параметра:
p – давление газа, Па
t – температура газа, °С.
Известно, что молярный объём 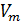
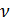
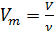
Также известно, что
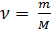
где: m – масса газа, M – молярная масса газа.
Учитывая (2) и (3) перепишем (1) в виде:
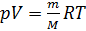
Как известно, плотность вещества

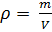
Из (4) и (5) выведем уравнение для плотности газа

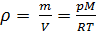
и введём обозначение параметра
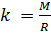
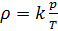
Если состав газовой смеси не меняется, то параметр k является константой.
Итак, для расчёта плотности газа необходимо рассчитать молярную массу газовой смеси.
Молярную массу смеси веществ определяем, как среднее арифметическое взвешенное молярной массы массовых долей, входящих в смесь индивидуальных веществ.
Примем известным состав веществ в газовой смеси – в воздухе, который состоит из:
Молярные массы этих веществ воздуха будут соответственно равны:
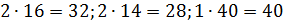
Вычисляем молярную массу воздуха, как среднее арифметическое взвешенное:
Теперь, зная значение константы
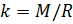
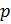
Приведение плотности газа к нормальным, стандартным условиям
Практически, измерения свойств газов проводят в различных физических условиях, и для обеспечения сопоставления между различными наборами данных должны быть установлены стандартные наборы условий [4].
Стандартные условия для температуры и давления – это установленные стандартом физические условия, с которыми соотносят свойства веществ, зависящие от этих условий.
Различные организации устанавливают свои стандартные условия, например: Международный союз чистой и прикладной химии (IUPAC), установил в области химии определение стандартной температуры и давления (STP): температура 0 °C (273.15 K), абсолютное давление 1 бар ( Па); Национальный институт стандартов и технологий (NIST) устанавливает температуру 20 °C (293,15 K) и абсолютное давление 1 атм (101.325 кПа), и этот стандарт называют нормальной температурой и давлением (NTP); Международная организация по стандартизации (ISO) устанавливает стандартные условия для природного газа (ISO 13443: 1996, подтверждённый в 2013 году): температура 15.00 °С и абсолютное давление 101.325 кПа.
Поэтому, в промышленности и торговле необходимо указывать стандартные условия для температуры и давления, относительно которых и проводить необходимые расчёты.
Плотность воздуха мы рассчитываем по уравнению (8) в рабочих условиях температуры и давления. В соответствии с (6) запишем уравнение для плотности воздуха в стандартных условиях: температура 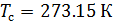
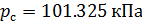
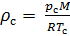
Делаем расчёт плотности воздуха, приведенной к стандартным условиям. Разделим уравнение (9) на уравнение (6) и запишем это отношение для 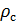
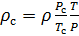
Подобным образом, получим уравнение для расчёта плотности воздуха, приведенной к нормальным условиям: температура 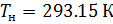
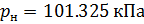

В уравнениях (10) и (11) используем значения параметров воздуха 
Реализация измерительного канала давления и температуры
Для решения многих задач получения информации, в зависимости от их сложности, удобно создавать прототип будущей системы на базе одной из микроконтроллерных платформ типа Arduino, Nucleo, Teensy, и др.
Что может быть проще? Давайте сделаем микроконтроллерную платформу для решения конкретной задачи – создание системы измерения давления и температуры, затрачивая меньше, возможно, средств, и используя все преимущества разработки программного обеспечения в среде Arduino Software (IDE).
Для этого, на аппаратном уровне, нам понадобятся компоненты:
- Arduino (Uno, …) – используем как программатор;
- микроконтроллер ATmega328P-PU – микроконтроллер будущей платформы;
- кварцевый резонатор на 16 МГц и пара керамических конденсаторов на 12-22 пФ каждый (по рекомендациям фирмы-изготовителя);
- тактовая кнопка на перезагрузку микроконтроллера и подтягивающий плюс питания к выводу RESET микроконтроллера резистор на 1 кОм;
- BMP180 — измерительный преобразователь температуры и давления с интерфейсом I2C;
- преобразователь интерфейсов TTL/USB;
- расходные материалы – провода, припой, монтажная плата, и др.
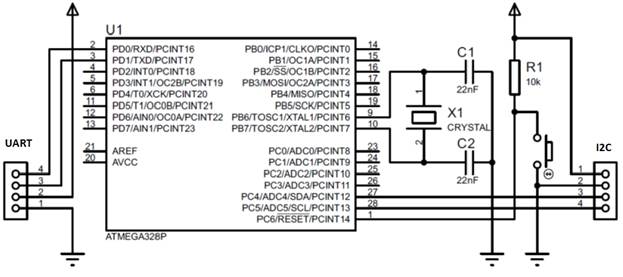
Принципиальная схема платформы, с учетом необходимых интерфейсов: стандартного последовательного интерфейса, I2C, и ничего более, представлена на рис. 1.
Рис. 1 — Принципиальная схема микроконтроллерной платформы для реализации системы измерения давления и температуры
Теперь рассмотрим этапы осуществления нашей задачи.
1. Прежде, нам нужен программатор. Подключаем Arduino (Uno, …) к компьютеру. В среде Arduno Software из меню по пути Файл->Примеры->11. ArdunoISP добираемся до программы программатора ArduinoISP, которую зашиваем в Arduino. Предварительно из меню Инструменты выбираем соответственно Плату, Процессор, Загрузчик, Порт. После Загрузки программы ArduinoISP в плату, наша Arduino превращается в программатор и готова к использованию по назначению. Для этого в среде Arduno Software в меню Инструменты выбираем пункт Программатор: “Arduino as ISP”.
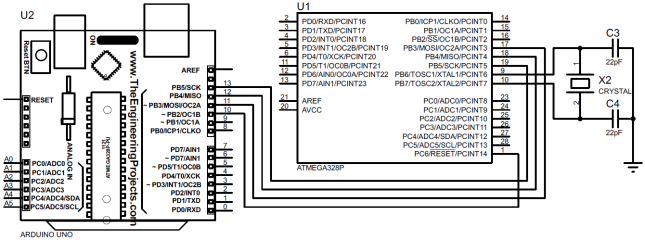
2. Подключаем по интерфейсу SPI ведомый микроконтроллер ATmega328P к ведущему программатору Arduino (Uno, …), рис. 2. Следует заметить, что предварительно биты регистра Low Fuse Byte микроконтроллера ATmega328P были установлены в незапрограммированное состояние. Переходим в среду Arduno Software и из меню Инструменты выбираем пункт Записать Загрузчик. Прошиваем микроконтроллер ATmega328P.
Рис. 2 – Схема подключения микроконтроллера к программатору
3. После успешной прошивки, микроконтроллер ATmega328P готов к установке на разработанную микроконтроллерную платформу (рис. 3), которую программируем также, как и полноценную Arduino (Uno, …). Программа опроса измерительного преобразователя давления и температуры представлена на листинге 1.
Рис. 3 Система измерения давления и температуры
Программа Python для фильтрации по каналам температуры и давления, и получение результатов
Программа Python методики определения плотности газа по результатам измерений давления и температуры представлена на листинге 2. Информация из измерительной системы выводится в реальном режиме времени.
Результаты расчёта представлены листингом и рис. 4, 5, 6.
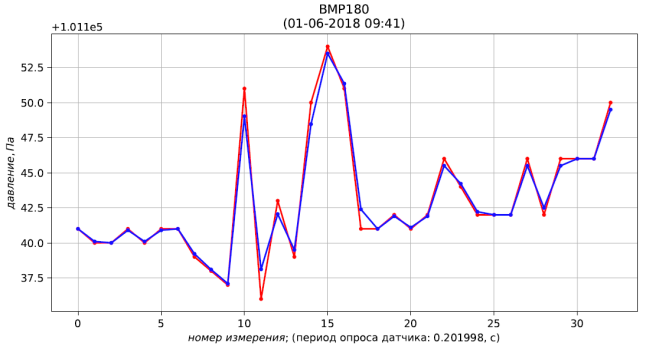
Рис. 4 – результаты измерения (красный) и фильтрации (синий) давления
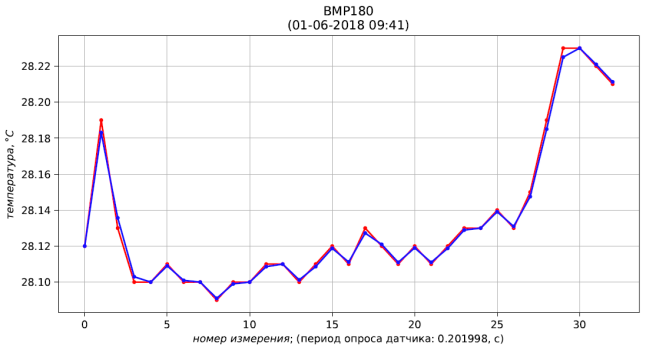
Рис. 5 – результаты измерения (красный) и фильтрации (синий) температуры
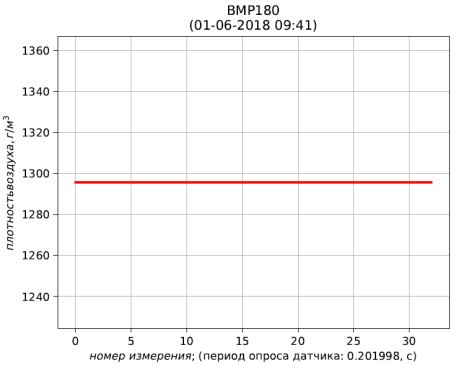
Рис. 6 – результаты расчёта плотности воздуха, приведенной к стандартным условиям (температура 273.15 К; абсолютное давление 101.325 кПа)
Выводы
Разработана методика определения плотности газа по результатам измерения давления и температуры с применением датчиков Arduino и программных средств Python.
Уравнение состояния идеального газа. Газовые законы.
Уравнение состояния идеального газа
(уравнение Менделеева – Клапейрона).
Уравнением состояния называется уравнение, связывающее параметры физической системы и однозначно определяющее ее состояние.
В 1834 г. французский физик Б. Клапейрон, работавший дли тельное время в Петербурге, вывел уравнение состояния идеального газа для постоянной массы газа. В 1874 г. Д. И. Менделеев вывел уравнение для произвольного числа молекул.
В МКТ и термодинамике идеального газа макроскопическими параметрами являются: p, V, T, m.
Мы знаем, что 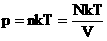
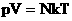
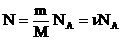
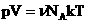
Произведение постоянных величин есть величина постоянная, следовательно: 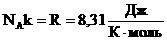
Таким образом, имеем:
— уравнение состояния (уравнение Менделеева – Клапейрона).
Другие формы записи уравнения состояния идеального газа.
1.Уравнение для 1 моля вещества.
Если n=1 моль, то, обозначив объем одного моля Vм, получим: .
Для нормальных условий получим:
2. Запись уравнения через плотность: — плотность зависит от температуры и давления!
3. Уравнение Клапейрона.
Часто необходимо исследовать ситуацию, когда меняется состояние газа при его неизменном количестве (m=const) и в отсутствие химических реакций (M=const). Это означает, что количество вещества n=const. Тогда:
Эта запись означает, что для данной массы данного газа справедливо равенство:
Для постоянной массы идеального газа отношение произведения давления на объем к абсолютной температуре в данном состоянии есть величина постоянная: .
Газовые законы.
1. Закон Авогадро.
В равных объемах различных газов при одинаковых внешних условиях находится одинаковое число молекул (атомов).
Доказательство:
Следовательно, при одинаковых условиях (давление, объем, температура) число молекул не зависит от природы газа и одинаково.
2. Закон Дальтона.
Давление смеси газов равно сумме парциальных (частных) давлений каждого газа.
Доказательство:
3. Закон Паскаля.
Давление, производимое на жидкость или газ, передается во все стороны без изменения.
http://planshet-info.ru/kompjutery/kak-najti-plotnost-znaja-temperaturu-i-davlenie
http://www.eduspb.com/node/1742
Density is referred to as the ratio of the mass per unit of volume of a substance under specific conditions of pressure and temperature. Mathematically, it can be defined as mass divided by volume. It is generally represented by “ρ” or “D”. The density of a substance varies depending on its pressure and temperature. For example, the density of an ideal gas can be doubled as the pressure doubles or by halving its absolute temperature. That means the density of gas always increases as the pressure increases and decreases as the temperature increases. We can determine the molar mass of a substance if we know its density. Generally, the density of a substance is different for different materials. At standard conditions for temperature and pressure, osmium and iridium are the densest known elements.
Density (ρ) = m/V
Where “m” is the mass, and “V” is the volume.
The SI unit of density of a substance is kilogram per cubic meter (kg/m3). Some other units of measurement of density are kilogram per liter (kg/L), gram per milliliter (g/mL), tonne per cubic meter (t/m3), etc.
Density of Gas Formula
The formula to determine the density of a gas is given as follows:
Density of a gas (ρ) = PM/RT
Where,
“P” is the pressure of the gas,
“M” is the molar mass (g/mol),
“R” is the universal gas constant (R = 0.082 L⋅ atm⋅ K−1⋅ mol−1), and
“T” is the temperature of the gas (K)
Derivation For the Density of Gas formula
The density of a gas is equal to the total mass of the gas to the total volume of the gas. To determine the molar mass of a gas, we have to consider the ideal gas equation.
From the ideal gas equation, we have
PV = nRT …………(1)
where,
“P” is the pressure of the gas,
“V” is the volume of the gas
“n” is the number of moles
“R” is the universal gas constant (R = 0.082 L⋅ atm⋅ K−1⋅ mol−1), and
“T” is the temperature of the gasWe know that, number of moles (n) = m/M
where,
“m” is the mass of the gas,
“M” is the molecular mass of the gas.Now, substitute n = m/M in equation (1).
Thus, PV = mRT/M
P = mRT/MV ……….(2)
we know that density (ρ) = m/V. So, substitute the value of ρ in equation (2).
Thus, we get
P = ρ RT/M
ρ = PM/RT
Thus, the ideal gas density formula is ρ = PM/RT.
Solved Examples on Gas Density
Example 1: What will be the density of a gas at 37 °C and a pressure of 5 atm and a molar mass of 84 g/mol?
Solution:
Given data:
Molar mass (M) = 84 g/mol
The pressure of the gas (P) =5 atm
The temperature of the gas (T) = 37 °C = 310 K
Universal gas constant (R) = 0.082 L⋅atm⋅K−1⋅mol−1
From the ideal gas density formula, we have
ρ = MP/RT
ρ = (84 × 5)/ (0.082 × 310)
ρ = 420/25.42 g/L
ρ = 16.522 g/L
Hence, the density of a gas is 16.522 g/L.
Example 2: Determine the density of a gas at 27 °C at a pressure of 7 atm and a molar mass of 54 g/mol. (R = 0.082 L⋅atm⋅K−1⋅mol−1)
Solution:
Given data:
Molar mass (M) = 54 g/mol
The pressure of the gas (P) =7 atm
The temperature of the gas (T) = 27 °C = 300 K
Universal gas constant (R) = 0.082 L⋅atm⋅K−1⋅mol−1
From the ideal gas density formula, we have
ρ= MP/RT
ρ= (54 × 7)/ (0.082 × 300)
ρ= 378/24.6 g/L
ρ= 15.37 g/L
Hence, the density of a gas is 15.37 g/L.
Example 3: Determine the density of carbon monoxide at 40 °C and a pressure of 730 Torr. (R = 0.082 L⋅atm⋅K−1⋅mol−1)
Solution:
Given data:
Molar mass of carbon monoxide (M) = 28 g/mol
Pressure (P) =730 Torr = 730/760 atm = 0.9605 atm
Temperature (T) = 40 °C = 313 K
Universal gas constant (R) = 0.082 L⋅atm⋅K−1⋅mol−1
From the ideal gas density formula, we have
ρ= MP/RT
ρ= (28 × 0.9605)/ (0.082 × 313)
ρ= 26.894/25.666 g/L
ρ= 1.0478 g/L
Hence, the density of carbon monoxide at 40 °C and a pressure of 730 Torr is 1.0478 g/L.
Example 4: If the density of a gas is 9.35 g/L at STP, then determine its density at 30 °C and a pressure of 700 mmHg.
Solution:
Given data:
The density of a gas (ρ1) = 9.35 g/L
We know that at STP pressure is equal to 0.987 atm and temperature is equal to 273.15 K.
So, P1 = 0.987 atm
T1 = 273.15 K
Let the density of the gas at 30 °C and pressure of 700mmHg be ρ2.
P2 = 700mmHg = 700 × 0.00131579 atm = 0.9210 atm
T2 = 30 °C = 303K
From the ideal gas density formula, we have
ρ= MP/RT
As we are calculating the density of the same gas at different conditions, the mass of the gas remains the same.
ρ ∝ P/T
ρ1/ρ2 = (P1/T1)/ (P2/T2)
9.35/ρ2 = (0.987/273.15)/ (0.9210/303)
9.35/ρ2 = (0.987 × 303)/ (0.9210 × 273.15)
9.35/ρ2 = (299.061/251.57)
ρ2 = (9.35 × 251.57)/299.061
ρ2 = 7.865 g/L
Hence, the density of the gas at 30 °C and pressure of 700mmHg is 7.865 g/L.
Example 5: What is the density of nitric oxide (NO) at a temperature of 51 °C and a pressure of 6 bar? (R = 0.082 L⋅atm⋅K−1⋅mol−1)
Solution:
Given data:
Density (ρ) = 3.42 g/L
Temperature (T) = 51 + 273 = 324 K
Pressure (P)= 6 bar = 6 × 0.9869 atm = 5.9215 atm
The molar mass of nitric oxide = 30 g/mol
Universal gas constant (R) = 0.082 L⋅atm⋅K−1⋅mol−1
From the ideal gas density formula, we have
ρ= MP/RT
ρ= (30 × 5.9215)/ (0.082 × 324)
ρ= 177.645/26.568 g/L
ρ= 6.686 g/L
Hence, the density of nitric oxide at 51 °C and a pressure of 6 bar is 6.686 g/L.
FAQs on Gas Density
Question 1: Define the density of the gas.
Answer:
Density is referred to as the ratio of the mass per unit of volume of a substance under specific conditions of pressure and temperature. Mathematically, it can be defined as mass divided by volume. It is generally represented by “ρ” or “D”.
Density (ρ) = m/V
Where “m” is the mass, and “V” is the volume.
Question 2: What is the effect of pressure and temperature on the density of gas?
Answer:
The density of a substance varies depending on its pressure and temperature. For example, the density of an ideal gas can be doubled as the pressure doubles or by halving its absolute temperature. That means the density of gas always increases as the pressure increases and decreases as the temperature increases.
Question 3: What is meant by an ideal gas? Write down the ideal gas density formula.
Answer:
The gas that strictly follows Boyle’s law, Charles’ law, and Avogadro’s law is known as an ideal gas. It is a hypothetical gas that is proposed to simplify the calculations. Many real gases behave qualitatively like an ideal gas under various conditions of temperature and pressure, where the gas molecules act as the ideal particles.
Ideal gas density formula
ρ = PM/RT
Where “P” is the pressure of the gas,
“M” is the molar mass (g/mol),
“R” is the universal gas constant (R = 0.082 L⋅ atm⋅ K−1⋅ mol−1), and
“T” is the temperature of the gas (K)
Question 4: What are units of measurement of density?
Answer:
The SI unit of density of a substance is kilogram per cubic meter (kg/m3). Some other units of measurement of density are kilogram per liter (kg/L), gram per milliliter (g/mL), tonne per cubic meter (t/m3), etc.
Как найти плотность газа
Одной из важнейших характеристик газа является его плотность. Когда упоминают плотность газа, как правило, говорят о плотности в нормальных условиях, а именно когда она измеряется при температуре 0 °С и при давлении 760 мм рт. ст. Кроме обычной или абсолютной плотности также требуется иногда относительная плотность газа. Под относительной плотностью газа имеют ввиду не саму плотность данного газа, а ее отношение к плотности воздуха, которое рассматривается при тех же самых условиях.

Инструкция
Итак, относительная плотность газа совсем не зависит от внешних условий. Это обусловлено всеобщими законами состояния газов, согласно которым, при изменениях температуры и давления изменения объема газов происходят совершенно одинаково.
Чтобы определить плотность газа, вам понадобится колба, в которую легко будет закачать нужный газ, а также и откачать без каких-либо препятствий. Для определения плотности газа, приготовьте колбу с газом. Взвесьте эту колбу дважды. Перед тем, как взвесить ее в первый раз, откачайте из колбы, если получится, полностью весь содержащийся в ней воздух. Перед вторым взвешиванием наполните колбу газом, плотность которого вы планируете измерить. Наполняя колбу, следите, чтобы газ дошел до отметки заданного давления.
Теперь приступайте к работе с цифрами, формулами, которые необходимы для получения необходимых результатов. Для начала найдите разность масс. Затем разделите эту разность на значение объема колбы V. Для этого определите объем колбы, с которой будете производить измерения, заранее. И в результате этих вычислений вы получите плотность газа при заданных конкретных условиях. После того, как вы вычислите плотность газа при заданных условиях, обратитесь к уравнению состояния. При помощи этого уравнения вы сможете найти плотность газа при нормальных или идеальных условиях. Примите следующие значения для постановки в формулу состояния: p2=pн, V2=Vн, Т2=Тн. Затем умножайте числитель и знаменатель из левой части вашей формулы на собственно массу измеряемого газа m. В итоге у вас получится: p1/p2=m1/m2 , обратите внимание, что в этой формуле m/V1=r1, а также m/Vн=rн.
Используя информацию, полученную из формул и других обозначений, получаете: N1m1/N2m2=p1/p2.
Плотность некоторых газов вы можете найти в сводной таблице. Так что, если газ, плотность которого вам необходимо узнать относится к газам, занесенным в таблицу, нужную информацию вы сможете найти без вычисления и использования формул.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
- 2023
ÐÑÐµÐ¼Ñ Ð¸ СÑекло Так вÑпала ÐаÑÑа HD VKlipe Net
Оглавление:
- Как рассчитать плотность газа
- Как решить, есть ли у вас настоящий газ
Если молекулярная масса газа известна, законом идеального газа можно манипулировать, чтобы найти плотность газа. Это просто вопрос подключения правильных переменных и выполнения нескольких вычислений.
Как рассчитать плотность газа
Какова плотность газа с молярной массой 100 г / моль при 0,5 атм и 27 градусах Цельсия?
Прежде чем начать, имейте в виду, что вы ищете в качестве ответа с точки зрения единиц.
Плотность определяется как масса на единицу объема, которая может быть выражена в граммах на литр или граммах на миллилитр. Возможно, вам придется сделать преобразование единиц. Следите за несоответствиями единиц измерения при включении значений в уравнения.
Сначала начнем с закона идеального газа:
PV = nRT
где P = давление, V = объем, n = количество молей газа, R = газовая постоянная = 0,0821 л · атм / моль · K и T = абсолютная температура (в Кельвинах).
Изучите единицы R тщательно. Это где многие люди попадают в беду. Вы получите неправильный ответ, если введете температуру в градусах Цельсия или давление в Паскалях и т. Д. Всегда используйте атмосферу для давления, литры для объема и Кельвин для температуры.
Чтобы найти плотность газа, вам нужно знать массу газа и объем. Сначала найдите объем. Вот уравнение закона идеального газа, переставленное для решения для V:
V = NRT / P
После того, как вы нашли объем, вы должны найти массу.
Количество родинок — это место для начала. Число молей — это масса (м) газа, деленная на его молекулярную массу (ММ):
п = м / мм
Подставим это значение массы в уравнение объема вместо n:
V = мРт / мм · P
Плотность (ρ) — масса на объем. Разделите обе стороны на m:
В / м = RT / MM · P
Затем переверните уравнение:
м / V = ММ · P / RT
ρ = MM · P / RT
Теперь у вас есть закон об идеальном газе, переписанный в форме, которую вы можете использовать с предоставленной вами информацией. Чтобы определить плотность газа, просто введите значения известных переменных.Не забудьте использовать абсолютную температуру для T:
27 градусов по Цельсию + 273 = 300 Кельвин
ρ = (100 г / моль) (0,5 атм) / (0,0821 л · атм / моль · K) (300 К) ρ = 2,03 г / л
Плотность газа составляет 2,03 г / л при 0,5 атм и 27 градусах Цельсия.
Как решить, есть ли у вас настоящий газ
Закон идеального газа написан для идеальных или совершенных газов. Вы можете использовать значения для реальных газов, если они действуют как идеальные газы. Чтобы использовать формулу для реального газа, он должен быть при низком давлении и низкой температуре. Повышение давления или температуры повышает кинетическую энергию газа и заставляет молекулы взаимодействовать. Хотя закон идеального газа все еще может предложить приближение в этих условиях, он становится менее точным, когда молекулы находятся близко друг к другу и возбуждаются.
Если молекулярная масса газа известна, законом идеального газа можно манипулировать, чтобы найти плотность газа. Это просто вопрос подключения правильных переменных и выполнения нескольких вычислений.
Как рассчитать плотность газа
Какова плотность газа с молярной массой 100 г / моль при 0,5 атм и 27 градусах Цельсия?
Прежде чем начать, имейте в виду, что вы ищете в качестве ответа с точки зрения единиц.
Плотность определяется как масса на единицу объема, которая может быть выражена в граммах на литр или граммах на миллилитр. Возможно, вам придется сделать преобразование единиц. Следите за несоответствиями единиц измерения при включении значений в уравнения.
Сначала начнем с закона идеального газа:
PV = nRT
где P = давление, V = объем, n = количество молей газа, R = газовая постоянная = 0,0821 л · атм / моль · K и T = абсолютная температура (в Кельвинах).
Изучите единицы R тщательно. Это где многие люди попадают в беду. Вы получите неправильный ответ, если введете температуру в градусах Цельсия или давление в Паскалях и т. Д. Всегда используйте атмосферу для давления, литры для объема и Кельвин для температуры.
Чтобы найти плотность газа, вам нужно знать массу газа и объем. Сначала найдите объем. Вот уравнение закона идеального газа, переставленное для решения для V:
V = NRT / P
После того, как вы нашли объем, вы должны найти массу.
Количество родинок — это место для начала. Число молей — это масса (м) газа, деленная на его молекулярную массу (ММ):
п = м / мм
Подставим это значение массы в уравнение объема вместо n:
V = мРт / мм · P
Плотность (ρ) — масса на объем. Разделите обе стороны на m:
В / м = RT / MM · P
Затем переверните уравнение:
м / V = ММ · P / RT
ρ = MM · P / RT
Теперь у вас есть закон об идеальном газе, переписанный в форме, которую вы можете использовать с предоставленной вами информацией. Чтобы определить плотность газа, просто введите значения известных переменных.Не забудьте использовать абсолютную температуру для T:
27 градусов по Цельсию + 273 = 300 Кельвин
ρ = (100 г / моль) (0,5 атм) / (0,0821 л · атм / моль · K) (300 К) ρ = 2,03 г / л
Плотность газа составляет 2,03 г / л при 0,5 атм и 27 градусах Цельсия.
Как решить, есть ли у вас настоящий газ
Закон идеального газа написан для идеальных или совершенных газов. Вы можете использовать значения для реальных газов, если они действуют как идеальные газы. Чтобы использовать формулу для реального газа, он должен быть при низком давлении и низкой температуре. Повышение давления или температуры повышает кинетическую энергию газа и заставляет молекулы взаимодействовать. Хотя закон идеального газа все еще может предложить приближение в этих условиях, он становится менее точным, когда молекулы находятся близко друг к другу и возбуждаются.