Относительная плотность по… задачи
24-Фев-2013 | комментариев 26 | Лолита Окольнова
В ЕГЭ иногда встречаются задачи (часть С последнее задание), где в условии дана относительная плотность вещества по… водороду, кислороду, воздуху, азоту и т.д.
Например:
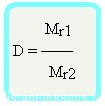
Относительная плотность вещества – отношение плотности вещества Б к плотности вещества А
Относительная плотность — величина безразмерная
Формула достаточно простая, и из нее вытекает другая формула —
Формула молярной массы вещества
Mr1 = D•Mr2
- Если дана относительная плотность паров по водороду, то Mr (вещества)=Mr(H2)•D=2 гмоль • D;
- если дана относительная плотность по воздуху, то Mr (вещества)=Mr(воздуха)•D=29 гмоль • D (обратите внимание, Mr(воздуха) принята равной 29 гмоль);
и т.д.
В условии задачи может быть полная формулировка — «относительная плотность (паров)…», а может быть просто «плотность вещества по…»
Давайте решим нашу задачу:
Дана плотность паров вещества по воздуху, значит, нам подходит формула молярной массы вещества —
Mr (вещества)=Mr(воздуха)•D=29 гмоль • D
Mr(вещества)=29 гмоль • 1.448 = 42 гмоль
Нам дан углеводород — СхHy, значит, мы можем найти Mr(Cx и Mr(Hy). Обратите внимание, именно молярные массы, т.к.у нас несколько атомов углерода и водорода.
Для этого надо молярную массу вещества умножить на процентное содержание элемента:
Mr(Cx)=Mr(вещества)•ω
Mr(Cx)= 42 гмоль · 0.8571=36 гмоль
x=Mr(Cx)Ar(C)=36 гмоль ÷ 12 гмоль =3.
Точно так же находим все данные для водорода:
Mr(Hy)=Mr(вещества)•ω
Mr(Hy)= 42 гмоль · 0.1429=6 гмоль
x=Mr(Hy)Ar(H)=6 гмоль ÷ 1 гмоль =6.
Искомое вещество — C3H6 — пропен.
Еще раз повторим определение —
Относительная плотность газа – это сравнение молярной или относительной молекулярной массы одного газа с аналогичным показателем другого газа.
Дана относительная плотность по аргону.
Mr (вещества)=Ar(Ar)•D
Mr (CxHy)=40 гмоль ·1.05=42 гмоль
Запишем уравнение горения:
СхHy + O2 = xCO2 + y2H2O
Найдем количество углекислого газа и воды:
n(CO2)=V22,4 лмоль = 33.622.4=1.5
n(H2O)=mMr=2718=1.5
Соотношение х : y2 как 1.5 : 1.5, т.е. y=2x, что соответствует общей формуле алкенов: CnH2n
Выражаем в общем виде молярную массу: Mr=Mr(C) + Mr(H)
12n +2n=42
n=3
Наше вещество — C3H6 — пропен
- pадание ЕГЭ по этой теме — задачи С5
Обсуждение: «Относительная плотность по… задачи»
(Правила комментирования)
Учебник по Химии. 8 класс. Григорович — Новая программа
Этот учебник можно скачать в PDF формате на сайте тут.
§ 27. Относительная плотность газов
Вспомните:
• плотность вещества равна отношению массы вещества к его объему;
• единица измерения плотности — кг/м3 (или г/л, г/мл);
Относительная плотность газов
Плотность газов очень мала, поэтому измерять массы газообразных веществ очень неудобно. Намного удобнее сравнивать плотности газов, т. е. определять отношение их плотностей. Эту величину называют относительной плотностью газа В по газу А и обозначают DA(B). Методику экспериментального определения относительной плотности газов разработал французский химик Жан Дюма и с помощью этого метода определял молекулярные массы неизвестных газообразных веществ. Это возможно благодаря тому, что относительная плотность газов равна как отношению плотностей газообразных веществ, так и отношению их молярных масс:
Поскольку относительная плотность является отношением двух величин с одинаковой размерностью, то сама относительная плотность является безразмерной величиной.
Для вычисления относительной плотности газов по определенному газу необходимо вычислить отношение молярных масс газов.
Относительная плотность кислорода по водороду будет равна:
Жан Батист Андре Дюма (1800-1884)
Известный французский химик-органик и государственный деятель, президент французского химического общества. В юности работал аптекарем. С 1823 г. работал в Париже сначала репетитором, а затем — профессором в Сорбонне. В 1832 г. основал собственную лабораторию. Своими работами Дюма оказал влияние на развитие органической химии, открыл новые органические вещества (хлороформ, хлоруксусную кислоту), разработал новые методы органического синтеза. Предложил метод определения относительной плотности паров, с помощью которого определил атомную массу многих химических элементов и молекулярную массу многих соединений.
Относительную плотность кислорода по гелию, азоту или воздуху вычисляют таким же образом. При вычислении относительной плотности по воздуху используют среднюю молярную массу воздуха, равную 29 г/моль.
Относительная плотность показывает, во сколько раз плотность одного газа больше плотности другого. Например, если относительная плотность углекислого газа по водороду равна 22 (DН2(СO2) = 22), это означает, что углекислый газ тяжелее водорода в 22 раза. А если относительная плотность метана по кислороду равна 0,5 (DO2(СН4) = 0,5), это означает, что метан легче кислорода в два раза.
Формулируя свой закон, Авогадро писал: «Плотность разных газов является мерой массы их молекул». Рассмотрим два газа — А и В — количеством 1 моль, которые находятся при одинаковых условиях. Плотность газа можно определить как отношение его массы к объему:
Если масса и объем известны для одного моля газа, то в это уравнение можно подставить, соответственно, молярную массу и молярный объем:
Молярные объемы разных газов при одинаковых условиях равны, поэтому плотность газа при заданных условиях прямо пропорциональна его молярной массе. То есть, чем больше масса одной молекулы (одного моля молекул), тем больше масса определенного объема газа — его плотность. А отношение плотностей двух газов будет равно отношению их молярных масс:
Расчеты с использованием относительной плотности газов
Задача 1. Определите, во сколько раз азот тяжелее гелия.
Задача 2. Относительная плотность газообразного простого вещества по воздуху равна 2,45. Вычислите молярную массу этого вещества. Какое это может быть вещество?
Выводы
1. Если взять два образца газообразных веществ одинакового объема при одинаковых условиях, то можно измерить отношение их плотностей и получить относительную плотность этих газов.
2. Относительная плотность газов — безразмерная величина, она показывает, какой из газов тяжелее (имеет большую плотность) и во сколько раз. Она равна отношению молярных масс газов, поэтому позволяет определить молярную массу неизвестного газа.
Контрольные вопросы
1. Какой физический смысл имеет относительная плотность газа?
2. Запишите формулу для вычисления относительной плотности неизвестного газа по водороду, гелию и углекислому газу.
3. Чему равна средняя молярная масса воздуха?
4. Для определения относительной плотности любого газа по водороду необходимо молярную массу этого газа: а) умножить на молярную массу водорода; б) разделить на молярную массу водорода; в) сложить с молярной массой водорода.
Задания для усвоения материала
1. Почему для воздуха нельзя использовать понятие «молярная масса», а только «средняя молярная масса»?
2. Во сколько раз кислород тяжелее; а) водорода; б) азота?
3. У какого из газов наименьшая относительная плотность по водороду; азот; кислород; гелий?
4. Определите относительную плотность гелия и неона: а) по водороду; б) по воздуху.
5. Найдите относительную плотность по гелию газов: Н2, СН4, N2, O2, SO2.
6. Определите относительную плотность: а) хлора Сl2 по воздуху; б) азота по гелию; в) аммиака NH3 по кислороду; г) пропана С3Н8 по хлору; д) углекислого газа СO2 по воздуху; е) аммиака по водороду; ж) сернистого газа SO2 по озону; з) кислорода по азоту; и) метана по хлору.
7. Относительная плотность неизвестного газа по водороду равна 17. Определите молярную массу этого газа. Запишите его химическую формулу.
8. Масса 1 л газа при нормальных условиях равна 1,251 г. Вычислите относительную плотность этого газа по водороду.
9. Относительная плотность неизвестного газа по воздуху равна 1,656. Вычислите массу 1 л этого газа при нормальных условиях. Какой газ это мог бы быть?
10. Почему относительные плотности всех газов по водороду больше 1?
11. Относительная плотность некоторого газа по кислороду равна 2. Чему равна относительная плотность этого газа по водороду?
12. Какой газ тяжелее по кислороду в 1,5 раза и образован одним элементом? тяжелее в 2 раза и образован двумя элементами?
13. У соединений Карбона и Нитрогена с Оксигеном при одинаковых условиях одинаковая плотность. Определите формулы этих соединений.
14*. Предложите способ экспериментального измерения относительной плотности двух газов.
Проверьте свои знания по теме «Количество вещества. Расчеты по химическим формулам».
ХИМИЯ 9 КЛАСС Еремина В.В. Кузьменко Н.Е. Дроздова А.А. Лунина В.В. §6 Относительная плотность газов РЕШЕБНИК ОТВЕТЫ
Красным цветом приводится решение, а фиолетовым ― объяснение.
Задание 1
Во сколько раз кислород тяжелее:
а) водорода;
DH2(O2)=M(O2):M(H2)=32 г/моль : 2 г/моль=16
Ответ: кислород тяжелее водорода в 16 раз.
б) воздуха?
Dвоздуха(O2)=M(O2):M(воздуха)=32 г/моль : 29 г/моль=1,1
Ответ: кислород тяжелее воздуха в 1,1 раза.
Задание 2
Найдите относительную плотность гелия и неона:
а) по водороду;
DH2(He)=M(He):M(H2)=4 г/моль : 2 г/моль=2
DH2(Ne)=M(Ne):M(H2)=20 г/моль : 2 г/моль=10
б) по воздуху.
Dвоздуха(He)=M(He):M(воздуха)=42 г/моль : 9 г/моль=0,14
Dвоздуха(Ne)=M(Ne):M(воздуха)=20 г/моль : 29 г/моль=0,69
Задание 3
Объясните, почему относительные плотности всех газов по водороду больше 1. Водород имеет наименьшую молярную массу среди всех элементов (является самым лёгким газом).
Задание 4
Найдите относительную плотность по гелию следующих газов: H2, CH4, N2, O2, SO2.
DHe(H2)=M(H2):M(He)=2 г/моль : 4 г/моль=0,5
DHe(CH4)=M(CH4):M(He)=16 г/моль : 4 г/моль=4
DHe(N2)=M(N2):M(He)=28 г/моль : 4 г/моль=7
DHe(O2)=M(O2):M(He)=32 г/моль : 4 г/моль=8
DHe(SO2)=M(SO2):M(He)=64 г/моль : 4 г/моль=16
Задание 5
Из таблицы 2 выпишите газы, которые:
а) легче воздуха; H2, N2, CH4, NH3
Легче воздуха ― газы, относительная плотность которых по воздуху меньше единицы.
Dвоздуха(H2)=M(H2):M(воздуха)=2 г/моль : 29 г/моль=0,07<1
Dвоздуха(N2)=M(N2):M(воздуха)=28 г/моль : 29 г/моль=0,96<1
Dвоздуха(CH4)=M(O2):M(воздуха)=16 г/моль : 29 г/моль=0,55<1
Dвоздуха(NH3)=M(SO2):M(воздуха)=17 г/моль : 29 г/моль=0,58<1
б) тяжелее воздуха. O2, F2, Cl2, Br2, CO2
Тяжелее воздуха ― газы, относительная плотность которых по воздуху больше единицы.
Dвоздуха(O2)=M(O2):M(воздуха)=32 г/моль : 29 г/моль=1,1>1
Dвоздуха(F2)=M(F2):M(воздуха)=38 г/моль : 29 г/моль=1,3>1
Dвоздуха(Cl2)=M(Cl2):M(воздуха)=71 г/моль : 29 г/моль=2,45>1
Dвоздуха(Br2)=M(Br2):M(воздуха)=160 г/моль : 29 г/моль=5,52>1
Dвоздуха(CO2)=M(CO2):M(воздуха)=44 г/моль : 29 г/моль=1,52>1
Какой газ из приведённых в ней самый лёгкий; самый тяжёлый? Самый лёгкий газ водород H2, а самый тяжёлый ― бром Br2.
Задание 6
Плотность некоторого газа по кислороду равна 2. Чему равна плотность этого газа по водороду?
Дано: DO2(газа)=2
Найти: DH2(газа)-?
Решение
По условию задачи DO2(газа)=2, поэтому M(газа)/M(O2)=2, отсюда M(газа)=2•M(O2)=2•32 г/моль=64 г/моль
DH2(газа)=M(газа)/M(H2)=64 г/моль : 2 г/моль=32
Ответ: DH2(газа)=32
Задание 7
Какой газ тяжелее азота, но легче кислорода? Воздух
Mr(N2)<Mr(газ)<Mr(O2)
Mr(N2)=2•Ar(N)=2•14=28
Mr(O2)=2•Ar(O)=2•16=32
Mr(воздуха)=29
28<29<32
Задание 8
Приведите формулы пяти газов, которые легче воздуха. H2, He, Ne, N2, CH4, NH3.
Легче воздуха ― газы, относительная плотность которых по воздуху меньше единицы.
Задание 9
Оксид углерода и оксид азота имеют одинаковую плотность при одних и тех же условиях. Определите формулы оксидов.
Существуют два оксида углерода CO (28 г/моль) и CO2(44 г/моль) и пять оксидов азота N2O (44 г/моль), NO (30 г/моль), N2O3(76 г/моль), NO2(46 г/моль) и N2O5(108 г/моль). Если оксид углерода и оксид азота имеют одинаковую плотность ― это значит они имеют одинаковые молярные массы, следовательно, формулы оксида углерода (IV) CO2 и оксида азота (I) N2O.
Задание 10
Углерод образует два газообразных оксида. Чему равна плотность более тяжёлого оксида по более лёгкому?
DCO(CO2)=M(CO2)/M(CO)=44 г/моль : 28 г/моль=1,57
Задание 11
Самый тяжёлый газ при комнатной температуре ― гексафторид теллура TeF6. Чему равна его относительная плотность:
а) по воздуху;
Dвоздуха(TeF6)=M(TeF6)/M(воздуха)=242 г/моль : 29 г/моль=8,35
б) по водороду?
DH2(TeF6)=M(TeF6)/M(H2)=242 г/моль : 2 г/моль=121
Задание 12
Трёхвалентный элемент образует газообразное соединение с водородом, которое в 2 раза тяжелее аммиака. Какова формула соединения?
Дано: E ― элемент V группы (8-5=3) и его формула имеет вид EH3, M(EH3)=2•M(NH3)
Найти: формулу соединения EH3 -?
По условию задачи Mr(EH3)=2•Mr(NH3), отсюда Mr(EH3)=2•Mr(NH3)=2•17=34
Mr(EH3)=Ar(E)+3•Ar(H)=Ar(E)+3•1=Ar(E)+3
Ar(E)+3=34
Ar(E)=34-3
Ar(E)=31 ― такую относительную атомную массу имеет элемент V группы фосфор Р, следовательно, формула имеет вид PH3.
Ответ: PH3
Задание 13
Хлор образует газообразные оксиды, в которых его валентность равна I и IV. Какой из оксидов легче хлора, а какой тяжелее?
Дано: оксиды Cl2O и ClO2
Найти: DCl2(Cl2O)-?, DCl2(ClO2)-?
Решение
DCl2(Cl2O)=M(Cl2O):M(Cl2)=87 г/моль : 71 г/моль=1,23
DCl2(ClO2)=M(ClO2):M(Cl2)=67,5 г/моль : 71 г/моль=0,95
Ответ: оксид хлора (IV) легче хлора, а оксид хлора (I) ― тяжелее.
Найди верный ответ на вопрос ✅ «относительная плотность некоторого газа по воздуху равна 1.571. вычислите плотность этого газа по неону …» по предмету 📙 Химия, а если ответа нет или никто не дал верного ответа, то воспользуйся поиском и попробуй найти ответ среди похожих вопросов.
Искать другие ответы
Главная » Химия » относительная плотность некоторого газа по воздуху равна 1.571. вычислите плотность этого газа по неону
МБОУ «Новофедоровская школа-лицей
имени Героя Российской Федерации Т.А.Апакидзе»
Конспект урока химии
«Относительная плотность
газов.»
для 8 класса
Подготовила:
Гончарук Ирина Александровна
учитель биологии и химии
Тема урока: Относительная плотность газов
Цель урока: Научить
вычислять по химическим уравнениям объём газа (по известной массе или
количеству вещества),
массу или количество вещества (по известному
объёму газа)
одного из вступивших в реакцию или
получившихся в результате реакции веществ. Сформировать представления об
относительной плотности газов. Научить производить расчёты, используя понятие
«относительная плотность газов».
|
Тип урока |
урок «открытия» нового знания |
|
Предметные результаты |
познакомиться научиться рассчитывать по химическому уравнению массу, |
|
Личностные результаты |
Формировать ответственное отношение к учению. |
|
Развивать умения ставить и формулировать для себя новые задачи в |
Основные понятия:
Относительная плотность газов, плотность вещества, количество вещества, молярный
объём газов.
Ресурсы:
Учебник, раздаточный материал.
Содержание и технология урока
1.Организационный момент -1 минута.
Приветствие.
Проверка
готовности
учащихся
к
уроку.
2.Актуализация
опорных знаний — 12 минут
Проверка домашнего задания. К
доске
вызывается
два ученика
для
выполнения
индивидуального
задания,
остальные
учащиеся
отвечают на вопросы
учителя по принципу поднятой руки или побуждение к ответу по выбору учителя. По
готовности, ученик у доски объясняет решение выполненной задачи из домашнего
задания с предыдущего урока.
Вопросы
для фронтального опроса:
—
Какими свойствами обладают газы по сравнению с твердыми веществами?
— Какие
предположения и доказательства выдвинул А. Авогадро когда формулировал свой
закон? Сформулируйте закон Авогадро для газов.
— Что
означает величина молярный объём газа?
— Какой
объём занимает 1 моль любого газа при нормальных условиях.
—
Как доказать, что 1 моль любого газа занимает объём равный 22,4литра.
Задания
для учащихся у доски:
1.
Вычислите массу кислорода, взятого объемом 400 л. (571,4 г)
2.
Масса газа объемом 448 л составляет 88 г. Определите молярную массу этого газа.
(44г/моль)
3.Мотивация учебной деятельности.
— 3 минуты
Есть математическое обоснование понятия «относительная плотность
газов».
-Существуют
понятия масса и относительная атомная масса, чем они отличаются?
Ar и mатома ; Mr и mмолекулы ?
Относительные
массы равны отношению фактической массы к 1/12 массы атома естественного
изотопа углерода С-12
— Вспомните из курса физики, что такое
плотность вещества?
Физическая величина равная отношению массы
тела к его объёму.
-Как можно определить плотность газа при
нормальных условиях?
В ходе урока мы «избавимся» от физической
величины – плотность и научимся использовать – относительную плотность газов
для количественных расчетов в химии.
4.Изучение нового
материала -10 минут.
Любые параметры предметов окружающего мира
можно сравнить относительно друг друга, если речь идет об одних и тех же
величинах: длину, ширину, объём, вес и Т.Д., используя выражение, «больше –
меньше»
Давайте представим, что у нас есть два
различных газа.
Согласно основной формуле
для газообразного вещества 1 справедливо ρ1
= М1 /
Vm
для газообразного вещества 2 справедливо ρ2
= М2 /
Vm .
Значит, если газы будут «выяснять
отношения», то ρ1 / ρ2 = М1 / Vm : М2
/ Vm
Молярный объём как величина одинаковая при равных условиях,
сократится, и мы получим ρ1 / ρ2 = М1 / М2
Для
того чтобы «избавиться» от отношения плотностей, ввели понятие «относительная
плотность газов», которое показывает во сколько раз один газ тяжелее или легче
другого.
M1 m1
D = —— = ——-
M2 m2
Отношение масс одинаковых объёмов различных газов при одинаковых
условиях равно отношению их молярных масс.
D – как все
относительные величины не имеет единицы измерения.
Например:
DНе (О2) = М(О2) / М(Не) = 32г/моль / 4г/моль = 8 > 1 ,
значит азот тяжелее гелия
D О2 (N2) =
М(N2) / М(О2) = 28г/моль / 32г/моль = 0,875 < 1, значит азот легче кислорода
Есть стандартный, наиболее используемый
«набор» относительных плотностей — относительная плотность газа по кислороду, водороду
и воздуху.
DO2 (газа)= Mr(газа)/Mr(O2)=Mr(газа)/32;
DH2 (газа)= Mr(газа)/Mr(H2)=Mr(газа)/2;
Dвоздуха (газа)= Mr(газа)/Mr(воздуха)=Mr(газа)/29
5.
Первичное закрепление знаний -5 минут.
Расчеты с
использованием относительной плотности газов
Задача 1. Определите относительную плотность кислорода по
гелию.
DНе (О2) = М(О2) / М(Не) = 32 / 4
= 8 > 1, значит азот тяжелее гелия в 8 раз
Задача
2.
Относительная
плотность газа по воздуху равна 2. Чему равна молярная масса этого газа?
Dвоздуха (Х)
= М(Х) / М(воздуха) = М(Х) / 29; значит
М(Х) = Dвоздуха (Х)
* 29 = 2 * 29 = 58 г/моль
6.Формирование
умений и навыков – 10 минут
Существуют
ситуации, когда ядовитые газообразные вещества образуются в бытовых ситуациях
или происходит их утечка из резервуаров хранилища при техногенных катастрофах. Например, хлор(Cl2), аммиак (NH3),
угарный газ (СО). Используя знания, полученные на этом уроке, определите
относительную плотность этих газов по воздуху и дайте обоснованные рекомендации
по поиску укрытия с целью предотвращения отравления ими населения.
Класс
делится на 3 группы по вариантам. Дети делают расчёты и выборочно по принципу
поднятой руки озвучивают результаты.
1
вариант
Хлор при обычных условиях — ядовитый газ желтовато-зелёного цвета, с
резким запахом и
сладковатым, «металлическим» вкусом.
Dвоздуха (Cl2) = М(Cl2) / М(воздуха) = 71 / 29 = 2,45 > 1, значит хлор
тяжелее воздуха и он будет распространяться по низу, заполняя все пустоты
(впадины , подвалы и т.д.). Поэтому искать убежище необходимо, наверху здания,
например на чердаке.
2
Вариант
Аммиак (NH3), при обычных условиях — бесцветный газ с резким
характерным запахом.
Dвоздуха (NH3) = М(NH3) / М(воздуха) = 17 / 29 = 0,6 < 1, значит
аммиак легче воздуха и он будет распространяться по верху. Поэтому искать
убежище необходимо, в нижней части здания, например в подвале.
3
Вариант
Угарный газ(CO)
— бесцветный чрезвычайно токсичный газ без вкуса и запаха.
Dвоздуха (СО) = М(СО)
/ М(воздуха) = 28 / 29 = 0,97 < 1, значит угарный газ немного легче воздуха,
а с учётом повышенной температуры (пожар), будет собираться в верхней части
помещения.
Вывод:
1) При оповещении об утечке хлора прячемся …
(на чердаке).
2) При оповещении об утечке аммиака прячемся …
(в подвале).
Дополнительные
задания (на каждой парте распечатка) для тех кто справился раньше.
1)
Определить относительную плотность неона по воздуху. Он легче или тяжелее
воздуха?( на 3)
2)
Определите относительную молекулярную массу газа, который в 32 раз тяжелее
водорода. (на 4)
3)
Относительная плотность паров белого фосфора по водороду равна 62. Найдите
формулу белого фосфора.(на 5)
6.Итоги урока. Рефлексия — 3 минуты.
1.
Чему мы сегодня научились? Понравился ли вам урок?
2.
Возникли ли у вас трудности при выполнении самостоятельной работы?
3.
Как вы считаете, можно ли использовать знания, полученные на уроке, в
повседневной жизни?
7. Домашнее задание – 1 минута.
Выучить параграф 38, задания 2, 3 стр 128.
Дополнительные задания размещаю на странице класса на Дневник.ру
1)
Определить относительную плотность углекислого газа (СО2) по
воздуху. Он легче или тяжелее воздуха? (3)
2)
Определите относительную молекулярную массу газа, который в 16 раз тяжелее
гелия.
(4
)
3)
Относительная плотность паров серы по неону равна 12,8. Найдите формулу
простого вещества серы. (5)