Пример.
Вычислить плотность углекислого газа
по воздуху.
Решение:
Молекулярная
масса СО2
равна 44.
М
= 29 d.
d
=
d
=
= 1,5.
Ответ:
углекислый газ тяжелее воздуха
приблизительно в 1,5 раза.
Задания:
1)Вычислить
относительную плотность бутана по
воздуху. (Ответ: 2)
2)Вычислить
относительную плотность пропана по
кислороду.
(Ответ:
1, 375)
3.7 Нахождение плотности газа по воздуху, если известна плотность газа по водороду.
Пример.
Плотность сернистого газа по водороду
(D)
равна 32. Найти плотность сернистого
газа по воздуху (d).
Решение:
d
=
d
=
= 2,2.
Ответ:
Плотность сернистого газа по воздуху
равна 2,2 .
Задания:
1)Плотность
метана по водороду равна 8. Найдите
плотность метана по воздуху. (Ответ:
0,55)
2)Плотность
этана по воздуху равна 1,035. Найдите
плотность этана по водороду. (Ответ: 15)
3.8 Вычисления по химическим уравнениям с использованием понятия о молярном объёме газа при нормальных условиях.
Пример.
Сколько литров водорода можно получить
при электролизе 6 г воды при нормальных
условиях?
Решение:
6 г Х л
2H2O
= 2H2
+ O2
2
моль 2 моль 1 моль
36
г 22,4 × 2 л 22,4 л
36 Г воды выделяют 44,8 л водорода
6 Г воды выделяют х л водорода
36
: 6 = 44,8 : Х
Х
=
=
=
7,47 л.
Ответ:
при электролизе 6 г воды образуется
приблизительно 7, 47 л водорода.
Задания:
1)Сколько
литров углекислого газа выделится при
разложении 10,6 г карбоната натрия? (Ответ:
2,24 л)
2)Сколько
литров оксида серы(4) затратиться в
реакции соединения с оксидом калия
массой 96 г? (Ответ: 22,4 л)
39
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
La плотность газообразного тела через относительно воздуха se рассчитанный по связь между массой данного объема этого газа и массой того же объемавоздух (взятые при тех же условиях температуры и давления). и массой 22,4 л.воздух : соответствует молярной массевоздух и составляет 29 г/моль.
Итак, что такое NL min?
Стандартные условия температуры и давления (STP): Нормальные условия (ln / мин): выбираются температура 0 °C (или 32 °F) и давление 1,013 бар (14.69 фунтов на кв. дюйм). Эти эталонные условия обозначаются базовой буквой «n» в используемой единице объема.
Кроме того, какова формула плотности газа по отношению к воздуху? 0,8*28=22,4 г. Mair = 22,4 + 6,4 = 28,8 г/моль. Плотность газа по отношению к воздуху получается делением массы объема V этого газа на массу равного объема воздуха, взятого при тех же условиях температуры и давления.
кроме того, как рассчитывается плотность? Как рассчитать плотность
Плотность ρ объекта или материала определяется как масса m, деленная на объем V, т. е. по формуле ρ = m/V.
Какова плотность газа? Плотность газов рассчитывается по плотности воздуха. За исходное значение принимается масса одного литра воздуха при 0°С и давлении 760 мм рт.ст., или 1,293 г. вокруг.
Какова величина вакуумметрического давления?
Идеальный вакуум имеет абсолютное давление 0,0000,000 мбар.
Как рассчитать количество воздуха?
Масса объема воздуха будет дана путем вычитания конечной массы из начальной массы. Из исходной массы вычитают конечную массу, чтобы получить массу 1,5 л воздуха. Полтора литра воздуха весят 1,5 грамма.
Как рассчитать расход сжатого воздуха?
Предположим, что электричество стоит 0,20 евро за кВтч. Компрессор мощностью 7,5 кВт, производящий 1 м³ сжатого воздуха в минуту, имеет затраты энергии 0,025 евро на м³ сжатого воздуха. Баллон со сжатым воздухом на 1000 литров на 11 бар обойдется вам в 10 раз дороже или 0,25 евро за электроэнергию.
Как рассчитать количество газа?
Объем газа выражается в литрах: V(CH4) = Vgas = 15 м3 = 15 × 103 л = 1,5 × 104 л. При обычных условиях молярный объем газа равен: Vm = 24,1 л·моль–1. Vm=Vgazngaz, поэтому ngaz=VgazVm, т.е. n(CH4)=1,5×10424,1=6,2×102 мол.
Как рассчитать массу воздуха?
Таким образом, мы можем вычислить массу одного литра воздуха: Масса одного литра воздуха = 355,3 – 354,1 = 1,2 г. По условиям эксперимента: один литр воздуха весит 1,2 грамма. При нормальной температуре и давлении: 1 литр воздуха весит 1,2 грамма.
Как рассчитать объем воздуха?
- Куб: куб.
- Паве: a × b × c.
- Правая призма: площадь основания × высота.
- Цилиндр: × R² × высокий.
- Пирамида: площадь основания × высота: 3.
- Cône: R² × hauteur: 3.
- Сфера: 4/3 × × R³
Как рассчитать плотность региона?
Плотность населения – это среднее количество людей в данной местности на квадратный километр. Получается путем деления общей численности населения на площадь области.
Как рассчитать плотность и относительную плотность?
Относительная плотность жидкости или твердого вещества почти равна плотности, измеренной в граммах на кубический сантиметр (г/см³), потому что плотность воды почти равна 1 г/см³.
Как рассчитать массу по плотности?
Увеличьте объем по плотности.
Пример: у нас есть ромб объемом 5 см3 и плотность 3,52 г / см3. Чтобы найти массу алмаза, умножьте 5 см.3 на 3,52 г/см3 чтобы получить 17 грамм.
Какой газ тяжелее воздуха?
Газ пропан: он поступает с месторождений или нефтеперерабатывающих заводов. Его основным химическим соединением является пропан C3H8. Этот газ тяжелее воздуха, его можно хранить и транспортировать в жидкой фазе под низким давлением.
Каково значение R?
Этот продукт стоит ровно 8,314 462 618 153 24 Дж моль—1 K—1.
Как измеряется вакуум?
В науке вакуум измеряется так называемым абсолютным давлением. Точкой отсчета является абсолютный нуль, следовательно, пустое пространство воздуха, и его значению предшествует положительный знак. На практике и для промышленных применений используется так называемое относительное давление.
Как определить пустоту?
В физике вакуум — это отсутствие всякой материи. Таким образом, абсолютный вакуум является средой, статистически лишенной элементарных частиц. Таким образом, пространство, в котором молекулы сильно разрежены, можно оставить в качестве первого определения приблизительного вакуума.
Смотрите также
Какова плотность вакуума?
Вакуум в лаборатории соответствует 10^-13 кг на м3, или еще 1 миллиарду молекул на м3. В межзвездной среде плотность падает до 10^-21 кг на м3, или от 100.000 1 до 3 млн атомов или молекул на мXNUMX.
Как рассчитать количество воздуха в бутылке?
Баллоны с бутаном и пропаном содержат по 13 кг сжиженного газа на 13 кг контейнера. V = 13/0,6 = 21,7 литра. Этот объем не может меняться, но масса воздуха ДА.
Как рассчитать объем воздуха в химии?
Мы знаем, что литр воздуха имеет массу около 1 г.
Следовательно, мы должны перевести объем воздуха, выраженный в м3 в вопросе 1, в литры (л).Мы знаем, что 1 дм3 = 1 л. V = 35 м3 = 35 000 дм3. 35 л воздуха имеет массу около 000 г.
Как рассчитать объем воздуха в литрах?
Как мы только что видели, 1 л равен 0,001 м³. Мы также можем определить, что 1 м³ равен 1 литров. Таким образом, если мы возьмем за основу формулу расчета объема: длина х ширина х высота, и переведем результат, мы получим объем в литрах.
Какой компрессор для гвоздезабивного пистолета?
Компрессор Bostitch RC10SQ-E используется для питания пневматических гвоздезабивных станков, оснащенных двигателем 2CV и баком емкостью 9,4 литра. Благодаря ограниченному весу его можно брать с собой на все крытые площадки.
Какой поток воздуха для пневматической шлифовальной машины?
Двигатель пневматической шлифовальной машины
Мощность пневматического двигателя варьируется от 300 до 1000 Вт в зависимости от давления и объема воздуха, подаваемого компрессором, от 4 до 6 бар и от 60 до 500 литров в минуту.
Когда воздух сжат?
Сжатый воздух относится к воздуху, давление которого превышает атмосферное давление. Абсолютно идентичный воздуху, которым мы дышим, сжатый воздух собирается в меньшем объеме и хранится под давлением. Воздух состоит из азота (78%), кислорода (20-21%), других газов и водяного пара (1-2%).
Не забудьте поделиться статьей!
Закон Авогадро: в равных объёмах различных газов при одинаковых условиях (температуре и давлении) содержится одинаковое число молекул. (1811 г, итальянский учёный Амедео Авогадро)
Cледствия из закона Авогадро:
2 следствие:
Отношение масс одинаковых объёмов различных газов при одинаковых условиях равно отношению их молярных масс (поскольку в равных объёмах газов при одинаковых условиях содержится одинаковое число молекул и, следовательно, одинаковое число молей):
Это отношение называется относительной плотностью D ( или d) одного газа по другому.
D – показывает во сколько раз один газ тяжелее или легче другого и является безразмерной величиной.
Например,
DO2 (газа) = Mr(газа)/Mr(O2) = Mr(газа)/32;
DH2 (газа) = Mr(газа)/Mr(H2) = Mr(газа)/2;
Dвоздуха (газа) = Mr(газа)/Mr(воздуха) = Mr(газа)/29.
Задача
Образец: Найдите относительную плотность газа N2 по воздуху?
Решение:
Dвоздуха (N2)= Mr(N2)/Mr(воздуха)=Mr(N2)/29.
Mr(N2) = 2·Ar(N) = 2· 14 = 28 г/моль
Dвоздуха (N2)= Mr(N2)/Mr(воздуха)=Mr(N2)/29=28/29= 0,97
Ответ: Газ азот легче воздуха в 0,97 раз Dвоздуха (N2)= 0,97
Задачи для самостоятельного решения
Решите задачи по приведённому образцу:
1. Найдите относительную плотность газа О2 по водороду?
2. Найдите относительную плотность газа СО2 по воздуху?
Решите задачу для закрепления:
-
Относительная плотность газа этана по водороду равна 15. Найдите молярную массу этана.
-
Найдите относительную плотность газов по воздуху следующих газов: О2, Аr.
Как вам известно, вещества могут находиться в твёрдом, жидком и газообразном состоянии. Молекулы жидкости и твёрдого вещества располагаются близко друг к другу. Это возможно благодаря тому, что молекулы притягиваются друг к другу. То есть существуют силы, которые удерживают молекулы жидкости или твёрдого вещества вместе. Из курса химии 8-го класса вы знаете, что эти силы называются силами межмолекулярного взаимодействия. Молекулы газов находятся на значительно большем расстоянии друг от друга, чем в случае жидкостей и твёрдых веществ. На таком расстоянии молекулы практически не взаимодействуют друг с другом. Поэтому, чтобы превратить жидкость или твёрдое вещество в газ, необходимо преодолеть силы межмолекулярного взаимодействия, отдалив молекулы друг от друга.
Переход в газообразное состояние осуществляется в результате нагревания веществ, находящихся в твёрдом или жидком состоянии (кипение жидкостей, возгонка твёрдых веществ).
Так как расстояние между молекулами газов значительно больше размеров самих молекул, то объём, который занимает газ, — это, по существу, объём свободного пространства между хаотически движущимися молекулами газа. Величина этого пространства определяется условиями, при которых находится газ, т. е. температурой и давлением. Эта величина примерно одинакова для всех газов. При этом объёмом, занимаемым самими молекулами, можно пренебречь. Отсюда следует закон Авогадро — в равных объёмах различных газов при одинаковых условиях содержится одинаковое число молекул.

Авогадро (1776—1856)
Интересно знать
Из курса химии 8-го класса вы уже знакомы с постоянной Авогадро, равной 6,02 ∙ 1023 моль–1, которая показывает, сколько частиц содержится в одном моле вещества. Эта величина названа в честь выдающегося итальянского учёного Амедео Авогадро, внёсшего значительный вклад в развитие молекулярной физики, электрохимии и других областей естествознания. На основании исследования соотношения объёмов реагирующих и образующихся газов, таких как водород и хлор, кислород и азот, Авогадро впервые предположил, что молекулы азота, кислорода, водорода и хлора состоят из двух атомов. Это предположение, сначала долго не находившее понимания у учёных того времени, впоследствии блестяще подтвердилось.
Из закона Авогадро вытекают два основных следствия.
Первое следствие. Один моль любого газа при одинаковых условиях занимает одинаковый объём. Этот объём называется молярным объёмом газа (Vm), и измеряется в дм3/моль. Молярный объём газа равен отношению объёма газа к его количеству:
.
Величина Vm зависит от температуры и давления. Например, при нагревании газы расширяются. Значит, при нагревании увеличивается молярный объём газа. В связи с этим сравнение характеристик различных газовых смесей необходимо осуществлять при одинаковых условиях — температуре и давлении. В качестве эталона таких условий приняты нормальные условия (н. у.): температура таяния льда (0 °С или 273,15 K) и атмосферное давление (101,3 кПа). При нормальных условиях Vm = 22,4 дм3/моль.
Таким образом, из закона Авогадро следует, что 22,4 дм3 любого газа при нормальных условиях содержат 6,02 ∙ 1023 молекул.
Второе следствие. Плотности газов относятся между собой как молярные массы газов.
Это видно из следующих соображений. Пусть имеется две порции различных газов. Рассчитаем их плотности:
газ 1: 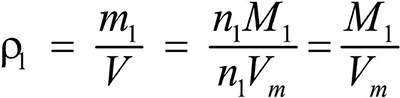
газ 2: 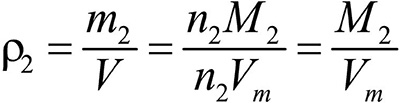
Разделив плотность первого газа на плотность второго, получим: 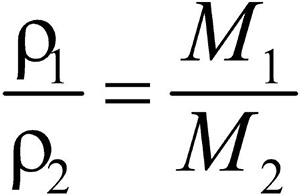
Отношение плотностей газов, равное отношению молярных масс, называется относительной плотностью одного газа по другому (D). D — величина безразмерная.
Зная D и молярную массу одного газа, легко найти молярную массу другого газа:
Пример 1. Относительная плотность газа по водороду равна 8. Определите молярную массу газа.
М(Х) = М(Н2) ∙ D = 2 ∙ 8 = 16 г/моль.
Газ с такой молярной массой — метан СH4.
Пример 2. Относительная плотность некоторого газообразного углеводорода по воздуху равна 2. Определите молярную массу углеводорода.
Средняя молярная масса воздуха равна 29 г/моль;
М(Х) = М(возд.) ∙ D = 29 ∙ 2 = 58 г/моль.
Углеводород с такой молярной массой — бутан С4Н10.
Следует отметить, что газы с молярной массой меньше 29 легче воздуха, больше 29 — тяжелее.
В расчётных задачах могут быть даны относительные плотности неизвестного газа по азоту, кислороду и другим газам. В этом случае для нахождения молярной массы неизвестного газа необходимо умножить относительную плотность на молярную массу соответственно азота (28 г/моль), кислорода (32 г/моль) и т. д.
Закон Авогадро широко применяется в химических расчётах. Поскольку для газов объёмы пропорциональны количествам (моль) веществ, то коэффициенты в уравнении реакции между газообразными веществами, отражающие количественное соотношение реагирующих веществ, пропорциональны объёмам взаимодействующих газов. Очевидно, что объёмы должны быть измерены при одинаковых условиях.
Пример 3. Какой объём кислорода потребуется для сжигания 2 дм3 пропана? Объёмы измерены при н. у.
Уравнение реакции горения пропана:
С3Н8 + 5О2 3СО2 + 4Н2О
Из закона Авогадро следует, что равные объёмы различных газов содержат одинаковое количество (моль) веществ. Пусть объём пропана равен 1 дм3. Тогда, согласно приведённому уравнению, для сжигания 1 дм3 пропана потребуется 5 дм3 кислорода. Следовательно, для сжигания 2 дм3 пропана потребуется:
1 дм3 С3Н8 — 5 дм3 O2,
2 дм3 С3Н8 — 10 дм3 О2
Ответ: V(О2) = 10 дм3.
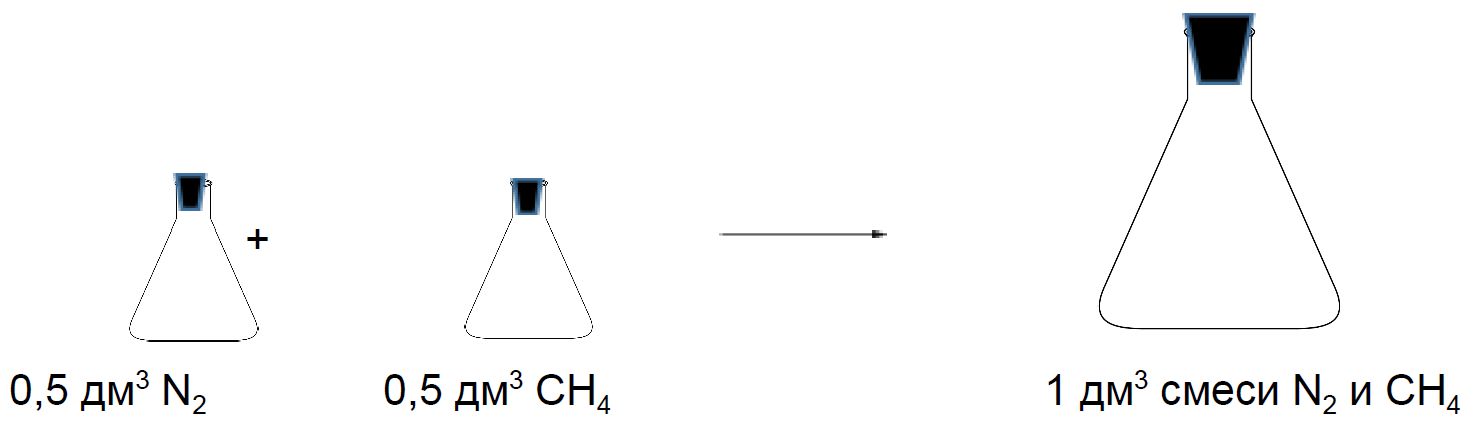
Смеси газов
Рассмотрим две колбы объёмом 0,5 дм3. Одна колба заполнена азотом, а другая метаном. Давление и температура в колбах одинаковые. Если смешать содержимое этих колб, то полученная смесь займёт при таких же условиях объём 1 дм3.
Состав смеси газов часто выражают в объёмных долях. Объёмная доля газа обозначается греческой буквой φ (фи) и равна отношению объёма данного газа к объёму смеси. Рассчитаем объёмную долю азота в полученной выше смеси газов:
φ = = 0,5, или 50 %.
Пример 4. В результате пропускания 150 дм3 (н. у.) воздуха через избыток известковой воды выпало 0,201 г осадка. Найдите объёмную долю (%) углекислого газа в данном образце воздуха.
Уравнение реакции взаимодействия углекислого газа с известковой водой:
СО2 + Са(ОН)2 = СаСО3 + Н2О
Найдём количество (моль) карбоната кальция, выпавшего в осадок (M(CaCO3) = 100 г/моль):
n(СаСО3) = 0,201/100 = 0,00201 моль.
По уравнению реакции:
n(СаСО3) = n(СО2).
Рассчитаем объёмную долю углекислого газа в воздухе:
V(CO2) = 0,00201 ∙ 22,4 = 0,045 дм3;
φ(СО2) = 0,045/150 = 0,0003, или 0,03 %.
Ответ: φ(СО2) = 0,03 %.
Пример 5. Объём смеси водорода с хлором составляет 50 см3. После взаимодействия газов осталось 10 см3 хлора. Найдите состав исходной смеси в объёмных долях. Все объёмы измерены при н. у.
Уравнение реакции взаимодействия водорода с хлором:
H2 + Cl2 2HCl
Поскольку после взаимодействия осталось 10 см3 хлора, то 40 см3 исходной смеси прореагировало. Хлор и водород реагируют между собой в равных объёмных отношениях. Исходя из этих соображений, в реакцию вступили по 20 см3 хлора и водорода. Поскольку осталось 10 см3 хлора, то в первоначальной смеси было 20 см3 водорода и 30 см3 хлора.
Рассчитаем объёмные доли газов в исходной смеси:
φ(H2) = 20/50 = 0,4, или 40 %;
φ(Cl2) = 30/50 = 0,6, или 60 %.
Ответ: φ(H2) = 40 %; φ(Cl2) = 60 %.
Согласно закону Авогадро, в равных объёмах различных газов при одинаковых условиях содержится одинаковое количество молекул.
Один моль любого газа при нормальных условиях (температура таяния льда, атмосферное давление) занимает объём
22,4 дм3. Эта величина называется молярным объёмом газа (Vm).
Плотности газов, измеренные при одинаковых условиях, относятся между собой как их молярные массы. Это отношение называется относительной плотностью одного газа по другому газу.
Газы, имеющие молярную массу более 29 г/моль, тяжелее воздуха, а менее 29 г/моль — легче воздуха.
Объёмная доля газа в смеси равна отношению объёма данного газа к общему объёму смеси.
Объёмные отношения газов при химических реакциях. Относительная плотность газов
I. Закон объемных отношений
«Объемы газов, вступающих в химические реакции, и объемы газов, образующихся в результате реакции, относятся между собой как небольшие целые числа».
Следствие. Стехиометрические коэффициенты в уравнениях химических реакций для молекул газообразных веществ показывают, в каких объемных отношениях реагируют или получаются газообразные вещества.
V1:V2:V3 = ν1:ν2:ν3.
Примеры:
2CO + O2 → 2CO2
При окислении двух объемов оксида углерода (II) одним объемом кислорода образуется 2 объема углекислого газа, т.е. объем исходной реакционной смеси уменьшается на 1 объем.
V(CO):V(О2):V(CO2) = ν(CO):ν(О2):ν(CO2) = 2 : 1 : 2
При синтезе аммиака из элементов:
N2 + 3H2 → 2NH3
Один объем азота реагирует с тремя объемами водорода; образуется при этом 2 объема аммиака — объем исходной газообразной реакционной массы уменьшится в 2 раза.
V(N2):V(H2):V(NH3) = ν(N2):ν(H2):ν(NH3) = 1 : 3 : 2
II. Решите задачу по образцу
Вычислите объём кислорода, который потребуется для сжигания 5 м3 метана СН4н.у.?
Образец:
Какой объём кислорода (н.у.) потребуется для полного сгорания 10 м3 пропана С3Н8 (н.у.)?
|
Дано: V(С3Н8) = 10 м3 |
Решение: 1. Запишем УХР С3Н8 +5О2 → 3СО2+ 4Н2О 1моль 5моль 2. Согласно закону объёмных отношений для газов: V(С3Н8):V(О2) = ν(С3Н8):ν(О2) = 1 : 5 10 м3 :V(О2) = 1 : 5 V(О2) = (10 · 5) /1= 50 м3 Ответ: для сжигания 10 м3 пропана потребуется 50 м3 кислорода. |
|
Найти: V(О2) = ? |
III. Относительная плотность газов
Закон Авогадро: в равных объёмах различных газов при одинаковых условиях (температуре и давлении) содержится одинаковое число молекул. (1811 г, итальянский учёный Амедео Авогадро)
Cледствия из закона Авогадро:
2 следствие:
Отношение масс одинаковых объёмов различных газов при одинаковых условиях равно отношению их молярных масс (поскольку в равных объёмах газов при одинаковых условиях содержится одинаковое число молекул и, следовательно, одинаковое число молей):
Это отношение называется относительной плотностью D ( или d) одного газа по другому.
D – показывает во сколько раз один газ тяжелее или легче другого и является безразмерной величиной.
Например,
DO2 (газа)= Mr(газа)/Mr(O2)=Mr(газа)/32;
DH2 (газа)= Mr(газа)/Mr(H2)=Mr(газа)/2;
Dвоздуха (газа)= Mr(газа)/Mr(воздуха)=Mr(газа)/29.
Задача
Образец: Найдите относительную плотность газа N2 по воздуху?
|
Дано: N2 М(воздуха) = 29 |
Решение: Dвоздуха (N2)= Mr(N2)/Mr(воздуха)=Mr(N2)/29. Mr(N2) = 2·Ar(N) = 2· 14 = 28 г/моль Dвоздуха (N2)= Mr(N2)/Mr(воздуха)=Mr(N2)/29=28/29= 0,97 |
|
Найти: Dвоздух — ? |
Ответ: газ азот легче воздуха в 0,97 раз Dвоздуха (N2)= 0,97 |
Задачи для самостоятельного решения
- Найдите относительную плотность газа О2 по водороду?
- Найдите относительную плотность газа СО2 по воздуху?
Решите задачуи для закрепления:
- Относительная плотность газа этана по водороду равна 15. Найдите молярную массу этана.
- Найдите относительную плотность газов по воздуху следующих газов: О2, Аr.
- Параграф 39
- Стр. 130 упр. 2,3 (письменно); тест