Относительная плотность по… задачи
24-Фев-2013 | комментариев 26 | Лолита Окольнова
В ЕГЭ иногда встречаются задачи (часть С последнее задание), где в условии дана относительная плотность вещества по… водороду, кислороду, воздуху, азоту и т.д.
Например:
Относительная плотность вещества – отношение плотности вещества Б к плотности вещества А
Относительная плотность — величина безразмерная
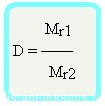
Формула достаточно простая, и из нее вытекает другая формула —
Формула молярной массы вещества
Mr1 = D•Mr2
- Если дана относительная плотность паров по водороду, то Mr (вещества)=Mr(H2)•D=2 гмоль • D;
- если дана относительная плотность по воздуху, то Mr (вещества)=Mr(воздуха)•D=29 гмоль • D (обратите внимание, Mr(воздуха) принята равной 29 гмоль);
и т.д.
В условии задачи может быть полная формулировка — «относительная плотность (паров)…», а может быть просто «плотность вещества по…»
Давайте решим нашу задачу:
Дана плотность паров вещества по воздуху, значит, нам подходит формула молярной массы вещества —
Mr (вещества)=Mr(воздуха)•D=29 гмоль • D
Mr(вещества)=29 гмоль • 1.448 = 42 гмоль
Нам дан углеводород — СхHy, значит, мы можем найти Mr(Cx и Mr(Hy). Обратите внимание, именно молярные массы, т.к.у нас несколько атомов углерода и водорода.
Для этого надо молярную массу вещества умножить на процентное содержание элемента:
Mr(Cx)=Mr(вещества)•ω
Mr(Cx)= 42 гмоль · 0.8571=36 гмоль
x=Mr(Cx)Ar(C)=36 гмоль ÷ 12 гмоль =3.
Точно так же находим все данные для водорода:
Mr(Hy)=Mr(вещества)•ω
Mr(Hy)= 42 гмоль · 0.1429=6 гмоль
x=Mr(Hy)Ar(H)=6 гмоль ÷ 1 гмоль =6.
Искомое вещество — C3H6 — пропен.
Еще раз повторим определение —
Относительная плотность газа – это сравнение молярной или относительной молекулярной массы одного газа с аналогичным показателем другого газа.
Дана относительная плотность по аргону.
Mr (вещества)=Ar(Ar)•D
Mr (CxHy)=40 гмоль ·1.05=42 гмоль
Запишем уравнение горения:
СхHy + O2 = xCO2 + y2H2O
Найдем количество углекислого газа и воды:
n(CO2)=V22,4 лмоль = 33.622.4=1.5
n(H2O)=mMr=2718=1.5
Соотношение х : y2 как 1.5 : 1.5, т.е. y=2x, что соответствует общей формуле алкенов: CnH2n
Выражаем в общем виде молярную массу: Mr=Mr(C) + Mr(H)
12n +2n=42
n=3
Наше вещество — C3H6 — пропен
- pадание ЕГЭ по этой теме — задачи С5
Обсуждение: «Относительная плотность по… задачи»
(Правила комментирования)
Содержание
- Как решать задачи с плотностью по газу
- Стехиометрические расчёты
- Стехиометрические расчёты
- Решение задач по уравнениям химических реакций
- Закон авогадро и молярный объем газов
- Доказательство закона Авогадро
- Определение плотности газов
- Нахождение объема, числа молекул, количества вещества по известной массе газа и обратные задачи
- Относительная плотность газов
- Нахождение относительной плотности
- Расчет молярных масс газов по относительным плотностям газов
- Расчет массы неизвестного газа по значению относительной плотности
- Закон объемных отношений
Как решать задачи с плотностью по газу
РАЗДЕЛ И. ОБЩАЯ ХИМИЯ
Примеры решения типовых задач
III. Вычисление относительной плотности газа
Формулы и понятия, которые используются:
где Dn ов. ( X ) — относительная плотность газа X по воздуху,
DA ( X ) — относительная плотность газа X по газу А,
М(Х) — молярная масса газа X, г/моль,
М(А) — молярная масса газа А, г/моль,
М(пов.) — молярная масса Воздуха, г/моль,
Мr ( Х) — относительная молекулярная масса газа X,
Мr(А) — относительная молекулярная масса газа А,
М r (пов.) — относительная молекулярная масса воздуха.
Задача 16. Вычислите относительную плотность сульфур(И V ) оксида: а) с кислородом; б) по воздуху.
Ответ:
Задача 17. Вычислите относительную плотность газа X по гелием, если известна его относительная плотность по воздуху и она составляет 1,517.
1. Вычислим относительную молекулярную массу газа Х. М r (пов.) = 29 :
2. Вычислим относительную плотность газа X по гелием. М r (Не) = 4. Итак:
Задача 18. При нормальных условиях 12,75 г неизвестного газа X занимает объем 16,8 л. Вычислите относительную плотность этого газа по водороду.
1. Поскольку
Вычислим молярну массу газа X. VM = 22,4 л/моль:
2. Вычислим относительную плотность газа X по водороду. М(Н2) = 2 г/моль:
Источник
Стехиометрические расчёты
Одним из важнейших химических понятий, на котором основываются стехиометрические расчёты, является химическое количество вещества. Количество некоторого вещества X обозначается n(X). Единицей измерения количества вещества является моль.
Моль – это количество вещества, в котором содержится 6,02·10 23 молекул, атомов, ионов или других структурных единиц, из которых состоит вещество.
На странице -> решение задач по химии собраны решения задач и заданий с решёнными примерами по всем темам химии.
Стехиометрические расчёты
Стехиометрическими расчетами называют нахождение значений количества, масс и объемов веществ (реагентов и продуктов), участвующих в химических реакциях. Формульное количество вещества B (nB) и масса этого вещества (mB) связаны между собой соотношением.
Решение задач по уравнениям химических реакций
Вспомните! Уравнения химических реакций. Закон сохранения массы вещества. Составление и решение пропорции
По уравнениям химических реакций можно решать множество количественных задач. Мы остановимся на расчетных задачах по нахождению массы (m) и числа молей 
Решение задач осуществляется по следующему алгоритму:







Задача 1. Сколько граммов хлорида натрия образуется при взаимодействии 92 г натрия с хлором?

Задача 2. Сколько молей углекислого газа образуется при горении 36 г углерода?

Задача 3. Вычислите массу цинка (Zn), который должен взаимодействовать с соляной кислотой с выделением 10 г водорода.

Задача 4. Рассчитайте количество веществ оксида меди (CuO) и углекислого газа, полученных при разложении 5 г малахита 


а) 1 моль (м-т) : 2 моля (CuO) = 0,0225 моль (м-т) : х моль (CuO)
х = 0,045 моль (CuO)

0,0225 моль 
Закон авогадро и молярный объем газов
Какие газы вы знаете? Что такое плотность?
Многие химические вещества существуют в газообразном состоянии, например 




Объем газов зависит от температуры и давления. При постоянном давлении и температуре расстояния между молекулами газообразных веществ примерно одинаковы.
Из курса физики вам известно понятие «плотность»

В таблице 8 приведены некоторые величины, характеризующие известные вам газы.
Рассчитаем объем 1 моля каждого газа (при н.у.):
Как видно из этих расчетов, объемы одного моля различных газов при нормальных условиях (н. у.), т. е. при температуре 0°С и давлении 1 атм (101,3 кПа), примерно одинаковы и составляют 22,4 л. При стандартных условиях (t = 25°С, p = 101,3 кПа) молярный объем составляет 24 л. Эта величина называется молярным объемом и обозначается 

количеству вещества
В 1 моль любых веществ, в том числе и газах, содержится одинаковое число молекул, которое называется числом Авогадро 
В равных объемах газов, взятых при одинаковых условиях, содержится одинаковое число молекул. Этот закон был сформулирован итальянским ученым Авогадро в 1811 году.
Плотностью газа при н. у. называется отношение молярной массы газа на молярный объем.
Плотность газа при нормальных условиях:
Доказательство закона Авогадро
Найдите число молекул и массы кислорода и углекислого газа объемом 50 л, взятых при нормальных условиях (н. у.).
Число молекул равных объемов (50 л) газов, взятых при одинаковых условиях (н. у.), одинаково.
Определение плотности газов
Найдите плотности кислорода и углекислого газа при нормальных условиях.
Нахождение объема, числа молекул, количества вещества по известной массе газа и обратные задачи
а) Определите объем, число молекул, количество вещества 8,8 г углекислого газа при н. у.
б) Рассчитайте массу, количество вещества и число молекул 67,2 л кислорода при н. у.
в) Рассчитать объем, массу, число молекул в 0,5 моль аммиака (н. у.).
г) Определите объем (н. у), массу и количество вещества сернистого газа числом молекул
Нормальные и стандартные условия, молярный объем, число и закон Авогадро.
Относительная плотность газов
Кроме плотности веществ, в химии часто применяют понятие относительная плотность.
Относительной плотностью (D) одного газа по отношению к другому газу называется отношение масс газов, взятых в равных объемах при одинаковых условиях.
Часто относительную плотность различных газов определяют по отношению к водороду или воздуху.
По формулам относительных плотностей можно рассчитать значение молярной массы газов.
Нахождение относительной плотности
Рассчитайте относительные плотности кислорода и углекислого газа по водороду и воздуху
Расчет молярных масс газов по относительным плотностям газов
Рассчитать молярные массы газов, если известны относительные плотности:
Расчет массы неизвестного газа по значению относительной плотности
Рассчитайте массу 50 л (н. у.) неизвестного газа, если относительная плотность этого газа по воздуху равна 0,586. Какова относительная плотность по водороду?
Закон объемных отношений
Напишем уравнение реакции между газообразными веществами, когда в результате реакции также образуется газ:
Отношение количеств реагирующих и образовавшихся веществ выглядит следующим образом: 2 : 1 : 2. Теперь возьмем отношение объемов этих газов при нормальных условиях:
Как видим, отношения объемов газов соответствуют отношениям коэффициентов перед формулами веществ в уравнении.
При одинаковых условиях объемы реагирующих газов и газообразных продуктов реакции относятся между собой как небольшие целые числа. Это закон объемных отношений Гей-Люссака.
Из рассмотренных примеров можно сделать вывод, что при решении задач удобно пользоваться коэффициентами, т.к. они в уравнениях химических реакций указывают объемные отношения веществ.
Определите объем кислорода, необходимого для окисления 60 л оксида серы (IV) до оксида серы (VI) по уравнению:
- 1. Моль — мера количества вещества. В 1 моль любого вещества содержится число Авогадро структурных единиц (6,02-1023).
- 2. Молярная масса вещества (М) численно равна относительной молекулярной массе (Мг).
- 3. Расчеты по химическим уравнениям производятся на основе закона сохранения масс веществ.
- 4. В равных объемах газов, взятых при одинаковых условиях, содержится одинаковое число молекул. (Закон Авогадро.)
- 5. Относительной плотностью одного газа по отношению к другому газу (Dy(X)) называется отношение масс газов, взятых в равных объемах при одинаковых условиях.
- 6. Объемы реагирующих газообразных веществ относятся между собой и к объемам образующихся газообразных продуктов, как небольшие целые числа, равные коэффициентам в уравнении химической реакции. (Закон объемных отношений Гей-Люссака.)
- 7. При нормальных условиях (н. у.) любой газ занимает 22,4 л. Эта величина называется молярным объемом (У = 22,4 л/моль).
Услуги по химии:
Лекции по химии:
Лекции по неорганической химии:
Лекции по органической химии:
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
Источник
Как вычислять относительную плотность вещества
Такая характеристика, как относительная плотность вещества, показывает, во сколько раз оно тяжелее или легче другого соединения. Этот параметр можно определять по отношению к любому газообразному веществу. В большинстве случаев проводятся расчеты относительно воздуха или водорода. Однако могут попадаться задания, в которых необходимо вычислить относительную плотность и по другим газам, таким как кислород, аммиак или сероводород. В любом случае принцип решения задания един.

Вам понадобится
- — периодическая система химических элементов Д.И. Менделеева;
- — калькулятор.
Инструкция
Для того чтобы справиться с задачей, необходимо использовать формулы на определение относительной плотности:
D (воздух) = Mr (газа)/ Mr (воздуха), где:
D (воздух) – относительная плотность;
Mr (газа) – относительная молекулярная масса газообразного вещества;
Mr (воздуха) — относительная молекулярная масса воздуха.
Все три параметра единиц измерения не имеют.
Mr (воздуха) = 29 (величина постоянная), следовательно формула будет иметь вид:
D (воздух) = Mr (газа)/ 29.
По аналогии выглядит формула на определение относительной плотности по водороду, с тем исключением, что вместо воздуха стоит водород. А значит, и в расчет берется относительная молекулярная масса водорода.
D (водород) = Mr (газа)/ Mr (водорода);
D (водород) – относительная плотность;
Mr (газа) – относительная молекулярная масса газообразного вещества;
Mr (водорода) — относительная молекулярная масса водорода.
Mr (водорода) = 2, следовательно и формула будет иметь вид:
D (воздух) = Mr (газа)/ 2.
Пример № 1. Вычислите относительную плотность аммиака по воздуху. Аммиак имеет формулу NH3.
Сначала найдите относительную молекулярную массу аммиака, которую можно рассчитать по таблице Д.И. Менделеева.
Ar (N) = 14, Ar (H) = 3 х 1 = 3, отсюда
Mr (NH3) = 14 + 3 = 17
Подставьте полученные данные в формулу на определение относительной плотности по воздуху:
D (воздух) = Mr (аммиака)/ Mr (воздуха);
D (воздух) = Mr (аммиака)/ 29;
D (воздух) = 17/ 29 = 0, 59.
Пример № 2. Вычислите относительную плотность аммиака по водороду.
Подставьте данные в формулу на определение относительной плотности по водороду:
D (водород) = Mr (аммиака)/ Mr (водорода);
D (водород) = Mr (аммиака)/ 2;
D (водород) = 17/ 2 = 8, 5.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Учебник по Химии. 8 класс. Григорович — Новая программа
Этот учебник можно скачать в PDF формате на сайте тут.
§ 27. Относительная плотность газов
Вспомните:
• плотность вещества равна отношению массы вещества к его объему;
• единица измерения плотности — кг/м3 (или г/л, г/мл);
Относительная плотность газов
Плотность газов очень мала, поэтому измерять массы газообразных веществ очень неудобно. Намного удобнее сравнивать плотности газов, т. е. определять отношение их плотностей. Эту величину называют относительной плотностью газа В по газу А и обозначают DA(B). Методику экспериментального определения относительной плотности газов разработал французский химик Жан Дюма и с помощью этого метода определял молекулярные массы неизвестных газообразных веществ. Это возможно благодаря тому, что относительная плотность газов равна как отношению плотностей газообразных веществ, так и отношению их молярных масс:
Поскольку относительная плотность является отношением двух величин с одинаковой размерностью, то сама относительная плотность является безразмерной величиной.
Для вычисления относительной плотности газов по определенному газу необходимо вычислить отношение молярных масс газов.
Относительная плотность кислорода по водороду будет равна:
Жан Батист Андре Дюма (1800-1884)
Известный французский химик-органик и государственный деятель, президент французского химического общества. В юности работал аптекарем. С 1823 г. работал в Париже сначала репетитором, а затем — профессором в Сорбонне. В 1832 г. основал собственную лабораторию. Своими работами Дюма оказал влияние на развитие органической химии, открыл новые органические вещества (хлороформ, хлоруксусную кислоту), разработал новые методы органического синтеза. Предложил метод определения относительной плотности паров, с помощью которого определил атомную массу многих химических элементов и молекулярную массу многих соединений.
Относительную плотность кислорода по гелию, азоту или воздуху вычисляют таким же образом. При вычислении относительной плотности по воздуху используют среднюю молярную массу воздуха, равную 29 г/моль.
Относительная плотность показывает, во сколько раз плотность одного газа больше плотности другого. Например, если относительная плотность углекислого газа по водороду равна 22 (DН2(СO2) = 22), это означает, что углекислый газ тяжелее водорода в 22 раза. А если относительная плотность метана по кислороду равна 0,5 (DO2(СН4) = 0,5), это означает, что метан легче кислорода в два раза.
Формулируя свой закон, Авогадро писал: «Плотность разных газов является мерой массы их молекул». Рассмотрим два газа — А и В — количеством 1 моль, которые находятся при одинаковых условиях. Плотность газа можно определить как отношение его массы к объему:
Если масса и объем известны для одного моля газа, то в это уравнение можно подставить, соответственно, молярную массу и молярный объем:
Молярные объемы разных газов при одинаковых условиях равны, поэтому плотность газа при заданных условиях прямо пропорциональна его молярной массе. То есть, чем больше масса одной молекулы (одного моля молекул), тем больше масса определенного объема газа — его плотность. А отношение плотностей двух газов будет равно отношению их молярных масс:
Расчеты с использованием относительной плотности газов
Задача 1. Определите, во сколько раз азот тяжелее гелия.
Задача 2. Относительная плотность газообразного простого вещества по воздуху равна 2,45. Вычислите молярную массу этого вещества. Какое это может быть вещество?
Выводы
1. Если взять два образца газообразных веществ одинакового объема при одинаковых условиях, то можно измерить отношение их плотностей и получить относительную плотность этих газов.
2. Относительная плотность газов — безразмерная величина, она показывает, какой из газов тяжелее (имеет большую плотность) и во сколько раз. Она равна отношению молярных масс газов, поэтому позволяет определить молярную массу неизвестного газа.
Контрольные вопросы
1. Какой физический смысл имеет относительная плотность газа?
2. Запишите формулу для вычисления относительной плотности неизвестного газа по водороду, гелию и углекислому газу.
3. Чему равна средняя молярная масса воздуха?
4. Для определения относительной плотности любого газа по водороду необходимо молярную массу этого газа: а) умножить на молярную массу водорода; б) разделить на молярную массу водорода; в) сложить с молярной массой водорода.
Задания для усвоения материала
1. Почему для воздуха нельзя использовать понятие «молярная масса», а только «средняя молярная масса»?
2. Во сколько раз кислород тяжелее; а) водорода; б) азота?
3. У какого из газов наименьшая относительная плотность по водороду; азот; кислород; гелий?
4. Определите относительную плотность гелия и неона: а) по водороду; б) по воздуху.
5. Найдите относительную плотность по гелию газов: Н2, СН4, N2, O2, SO2.
6. Определите относительную плотность: а) хлора Сl2 по воздуху; б) азота по гелию; в) аммиака NH3 по кислороду; г) пропана С3Н8 по хлору; д) углекислого газа СO2 по воздуху; е) аммиака по водороду; ж) сернистого газа SO2 по озону; з) кислорода по азоту; и) метана по хлору.
7. Относительная плотность неизвестного газа по водороду равна 17. Определите молярную массу этого газа. Запишите его химическую формулу.
8. Масса 1 л газа при нормальных условиях равна 1,251 г. Вычислите относительную плотность этого газа по водороду.
9. Относительная плотность неизвестного газа по воздуху равна 1,656. Вычислите массу 1 л этого газа при нормальных условиях. Какой газ это мог бы быть?
10. Почему относительные плотности всех газов по водороду больше 1?
11. Относительная плотность некоторого газа по кислороду равна 2. Чему равна относительная плотность этого газа по водороду?
12. Какой газ тяжелее по кислороду в 1,5 раза и образован одним элементом? тяжелее в 2 раза и образован двумя элементами?
13. У соединений Карбона и Нитрогена с Оксигеном при одинаковых условиях одинаковая плотность. Определите формулы этих соединений.
14*. Предложите способ экспериментального измерения относительной плотности двух газов.
Проверьте свои знания по теме «Количество вещества. Расчеты по химическим формулам».
Ульяна Власова
Эксперт по предмету «Химия»
Задать вопрос автору статьи
Плотность и способы ее определения
Определение 1
Плотность – это физическая величина.
Плотность равна отношению массы тела к объему, который оно занимает.
$mathrm {rho = frac {m}{V}}$, $mathrm {г/см^3}$
Где:
- m – масса вещества, г,
- V – объем данного вещества, $mathrm {см^3}$.
Данная формула применяется для определения плотности вещества в твердом состоянии.
Для газообразных веществ используют другую формулу: $mathrm {rho = frac {M_{в-ва}}{V_m}, г/л}$, где $mathrm {V_m}$ — молярный объем газа, при нормальных условиях равный 22,4 л/моль
Относительная плотность газов
Для того, чтобы перейти к определению относительной плотности газов, необходимо упомянуть о законе Авогадро, который заключается в том, что в равных объемах разных газов при одинаковых условиях содержится равное число молекул (число Авогадро $mathrm {N_A = 6,022 cdot 10^{23}}$
Сдай на права пока
учишься в ВУЗе
Вся теория в удобном приложении. Выбери инструктора и начни заниматься!
Получить скидку 3 000 ₽
Из данного закона вытекают два следствия:
- Один моль любого газа занимает равный объем при одинаковых условиях: $mathrm {V_m = frac {V}{n}}$.
- Отношение плотностей разных газов относятся между собой как молярные массы этих газов.
$mathrm {rho_1 = frac {m_1}{V} = frac {n_{1}M_{1}}{n_{1}V_{m}} = frac {M_1}{V_m}}$
$mathrm {rho_2 = frac {m_2}{V} = frac {n_{2}M_{2}}{n_{2}V_{m}} = frac {M_2}{V_m}}$
$mathrm {frac {rho_1}{rho_2} = frac {M_1}{M_2} = D}$, где D – относительная плотность газа
Пример решения задачи
Необходимо определить плотность и относительную плотность оксида азота (II) по воздуху. При этом $mathrm {M_{NO} = 30 г/моль, V_{NO} = 22,4 л/моль}$
1) Определим плотность соединения с помощью формулы $mathrm {rho = frac {M_{NO}}{V_m} = frac {30 г/моль}{22,4 л/моль} = 1,34 г/л}$.
2) Рассчитаем относительную плотность газа по формуле: $mathrm {D_{возд.} = frac {M_{NO}}{M_{возд.}} = frac {30 г/моль}{29 г/моль} = 1,03 г/л}$.
Ответ: $mathrm {rho = 1,34 г/л}$, $mathrm {D_{возд.} = 1,03 г/л}$
Находи статьи и создавай свой список литературы по ГОСТу
Поиск по теме