|
Что означают понятия «главная подгруппа» и «побочная подгруппа» в периодической таблице? Как отличить главную подгруппу от побочной подгруппы? Я упоминала о побочной и главной подгруппе в своем ответе на ваш предыдущий вопрос. Причина разделение группы на главную подгруппу (A) и побочную подгруппу (B латинская или Б русская) — различные химических свойства каждой подгруппы. Так VIIA группа представляет собой галогены — F фтор, Cl хлор, Br бром, I йод, At астат, которые являются типичными неметаллами, сильными окислителями. А вот в VIIB расположены Mn марганец, Tc технеций, Re рений, Bh борий, которые являются металлами. Вообще, все элементы побочных подгрупп являются металлами. В таблице ячейки с элементами побочных подгрупп обычно окрашивают в синий цвет, и символ пишут справа (элементы главных подгрупп — слева). автор вопроса выбрал этот ответ лучшим Ксарфакс 3 года назад Вертикальный ряд в периодической таблице Д.И. Менделеева называется группой. В короткой форме периодической таблицы каждая группа подразделяется на главную подгруппу и побочную подгруппу. В главную подгруппу входят s-элементы и p-элементы. В побочную подгруппу входят d-элементы (их также называют переходными элементами или переходными металлами). Побочная подгруппа обозначается голубым или синим цветом. Например, главная подгруппа 2 группы включает в себя элементы Be, Mg, Ca, Sr, Ba, Ra, а побочная — Zn, Cd, Hg. ** В длинной же форме периодической таблицы подгрупп нет, есть только группы. В ней все d-элементы (которые в короткой форме таблицы входят в побочную подгруппу) находятся в 3 — 12 группе. VeneraD 3 года назад Для того, чтобы ответить на вопрос, нужно посмотреть на таблицу Менделеева. Дело в том, что в этой таблице есть деление элементов. Это как раз и будет деление на главную подгруппу и побочную подгруппу. При этом есть элементы, с обозначением s и p, это и будет главная подгруппа. А есть элементы под буквой d, это побочная группа. Элементы данной группы ещё называют переходными элементами. С помощью рисунка ниже можно определить, к какой же группе относится элемент. Алиса в Стране 3 года назад Химию я в школе любила, два последние класса даже как-то умудрялась пятерки за год получить, хотя было непросто, но до этого я этот предмет как-то не воспринимала, а в 9-10 классе увлеклась, разобралась, но, конечно, я сейчас уже не очень хорошо все помню. Итак, начнем разбираться. Чтобы понять, что такое подгруппа, вспомним в начале, что такое группа в таблице Менделеева, это вертикальный ряд, у них есть номера, которые написаны сверху римскими цифрами. Так вот элементы в каждой группе делятся на главную подгруппу и побочную подгруппу, которые выделяются разными цветами — элементы побочной группы выделяются синим цветом, в побочную подгруппу входят переходные элементы (переходные металлы) — d-элементы. а в главную подгруппу — s-элементы и p-элементы. Вот на этой табличке очень наглядно все это видно: То есть определить можно по цвету. Например, в первой группе элементы побочной группы это: Cu, Ag, Au, Rg. Ладлен 3 года назад Конечно существуют различные варианты расположения элементов в периодической системе. иногда применяются разные цвета. Но честно говоря меня просто удивляют, что в интернете большинство ответов не дают реального ответа. А ведь в названии и заложен ответ на данный вопрос. Так главные подгруппы и в них химические элементы расположены слева в своей клетке, а в побочных подгруппах расположены правее. как говорится с боку. Вот как это выглядит в таблице. У элементов побочных подгрупп идет заполнение d и f уровней. А в главных подгруппах у химических элементов электроны находятся на S и P уровнях. и естественно в таблицы они изображены разными цветами. Бекки Шарп 3 года назад Деление на главную и побочную подгруппы объясняется теорией строения атома (различии в заполнении электронами энергетических уровней). Главная подгруппа состоит из s-элементов и p-элементов. Число валентных электронов на внешнем уровне такое же как номер группы. Побочные подгруппы содержат d-элементы (переходные элементы и переходные металлы). Визуально элементы побочной подгруппы синего цвета. Атомы, имеющие одинаковое строение внешнего электронного уровня относятся к одной подгруппе. В главной подгруппе одной укрупненной группы химических элементов, s и p элементы, побочная группа это элементы d. Определять их не нужно, нужно просто видеть разницу в цвете ячейки и расположение букв латинского алфавита названия элемента в главной группе буквы слева, в побочной — справа. И цвет побочной группы синий. Для это сделан таблица разноцветной, хотя можно было бы просто сделать черно-белой. Марина Вологда 3 года назад Периодическая система химических элементов или по другому «Таблица Менделеева» — это такая таблица, в которой все химические элементы классифицируются по каким-либо свойствам. Интересен тот факт, что можно встретить несколько сотен вариантов данной таблицы, но чаще всего используется двумерная таблица. Рассматривая структуру таблицы, стоит выделить группы, которые подразделяются на главные и побочные. А теперь дадим характеристику понятия «группа». Группа состоит из главной (в таблице обозначается буквой «А») и побочной (в таблице обозначается буквой «В») подгрупп. А теперь рассмотрим таблицу, где видим, что каждая группа элементов подразделяется на главную и побочную подгруппы. Главные подгруппы образуют элементы малых и больших периодов, а побочные – только элементы больших периодов. На таблице это легко разобрать, ведь элементы главных подгрупп сдвинуты влево, а элементы побочных подгрупп сдвинуты в право (и ячейки окрашены в голубые цвета). В главной подгруппе — s-элементы и p-элементы, в побочной- d-элементы. Приведем пример: TheSun 3 года назад В таблице Менделеева все элементы разделены на главную и побочную подгруппу. Сначала уточним, что называется группой в таблице Менделеева. Группой называется вертикальный ряд в периодической таблице Менделеева. Каждая группа подразделяется на главную подгруппу и побочную подгруппу. Теперь ответим на вопрос, какие элементы в таблице Менделеева относятся к главной и побочной подгруппам. В главную подгруппу входят s и p-элементы, а в побочную подгруппу входят d-элементы. Для удобства определения элементов по подгруппам, элементы имеют различное цветовое обозначение в таблице Менделеева. Элементы побочная подгруппы обозначается голубым (синим) цветом. Бархатные лапки 3 года назад Все из нас знают таблицу Менделеева, она делится на главные и побочные подгруппы. Так в главную подгруппу входят s и p-элементы. Побочная подгруппа состоит из d-элементов. Определить какой элемент относится к какой подгруппе несложно, так элементы, которые относятся к побочной группе выделены синим цветом. Знаете ответ? |

- Периодическая система Менделеева систематизирует элементы и их свойства. В ней все элементы упорядочены с учетом их атомного числа и повторяющихся химических свойств.
- Периодический закон: свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера).
Расшифровка обозначений элементов
Каждому химическому элементу в таблице отведена одна клеточка, в которой указаны символ и название элемента, порядковый номер и относительная атомная масса.
Расшифровка обозначений элементов таблицы Менделеева:
- Обозначение: одной или двумя латинскими буквами.
- Порядковый номер элемента или атомный номер равен числу протонов в его ядре. Обычно пишется в левом верхнем углу.
- Относительная атомная масса (сумма масс протонов и нейтронов). Это усреднённая величина, для расчёта которой используются атомные массы всех изотопов элемента с учетом их содержания в природе. Поэтому обычно она является дробным числом.
- Если округлить атомную массу до ближайшего целого, мы получим так называемое массовое число.
- Разность массового числа и атомного числа дает количество нейтронов в ядре. Так, число нейтронов в ядре гелия равно двум, а у лития – четырем.
- Число положительных протонов, как правило, равно числу отрицательных электронов в атоме (за исключением изотопов).
- Электронная конфигурация — формула расположения электронов по различным электронным оболочкам атома химического элемента или молекулы.
-
Чтобы узнать количество нейтронов в ядре элемента, необходимо из относительной атомной массы (массового числа) вычесть порядковый номер.
Элементы периодической таблицы Менделеева
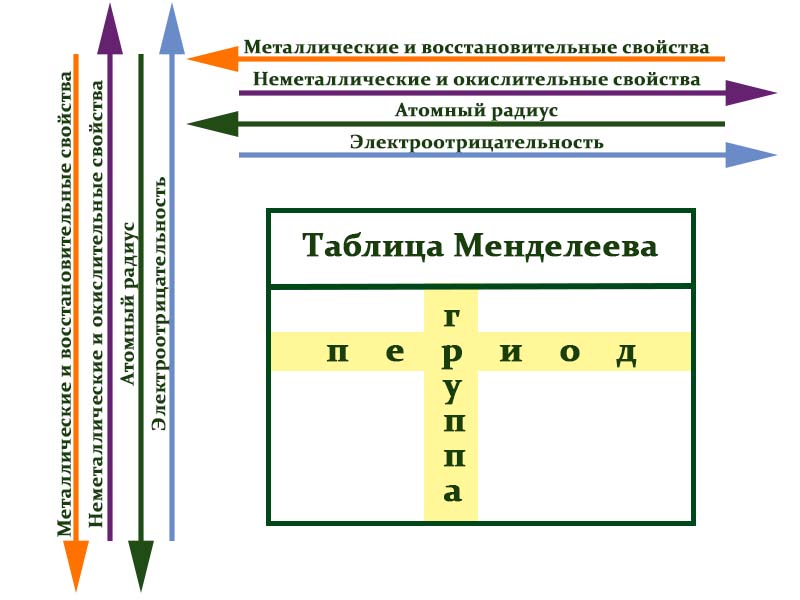
Металлы расположены в левом нижнем углу таблицы, неметаллы — в правом верхнем углу. Между ними находятся полуметаллы. Все периоды, кроме первого, начинается щелочным металлом. Каждый период заканчивается инертным газом.
- Металлы обладают хорошей электро- и теплопроводностью, способны отражать яркий свет, имеют высокую температуру плавления (остаются твердыми при нормальных значениях окружающей среды, исключение — ртуть).
- Неметаллы встречаются в природе в трех состояниях: газ (например, водород), жидкость (например, бром) и твердые вещества (например, фосфор). Он не способны проводить тепло и электричество. Имеют более низкую температуру плавления в сравнении с металлами, более хрупкие и ломкие. Могут иметь разнообразный внешний вид (элементы с низкой плотностью и яркостью).
- Металлоиды имеют смешанные свойства металлов и неметаллов (например, кремний). Они имеют среднюю тепло- и электропроводность. Различаются между собой по температуре плавления, плотности, цвету и форме. Внешний вид может быть схож с металлами или неметаллами.
Расшифровка групп и периодов таблицы Менделеева
В таблице химические вещества расположены в специальном порядке: слева направо по мере роста их атомных масс. Все они в периодической системе объединены в периоды и группы.
Периоды — это горизонтальные ряды в таблице. У всех элементов одного периода одинаковое количество заполненных электронами энергетических уровней.
Номер периода, в котором находится элемент, совпадает с номером его валентной оболочки. Эта валентная оболочка постепенно заполняется от начала к концу периода.
Закономерности периодов:
- Металлические свойства убывают, неметаллические и окислительные -возрастают. Каждый период начинается активным металлом и заканчивается инертным газом.
- Уменьшается атомный радиус.
- Увеличивается электроотрицательность.
Группы — это столбцы. Элементы во всех группах имеют одинаковое электронное строение внешних электронных оболочек. В каждой группе на внешнем энергетическом атома одинаковое число электронов, то есть номер группы совпадает с числом валентных электронов, которые могут участвовать в образовании химических связей. Поэтому номер группы часто совпадает с валентностью элементов. Например, номер группы совпадает с валентностью s-элементов и с наибольшей возможной валентностью p-элементов.
Закономерности групп:
- Металлические свойства увеличиваются, неметаллические и окислительные- убывают.
- Увеличивается радиус атома элементов в рамках одной группы.
- Уменьшается электроотрицательность.
Атомное число показывает, сколько протонов содержит ядро атома элемента и сколько электронов в атоме находятся вокруг него. Атом каждого последующего элемента содержит на один протон больше, чем предыдущий.
Валетность — это свойство элементов образовывать химические связи. То есть это количество химических связей, которые образует атом или число атомов, которое может присоединить или заместить атом данного элемента. Валентность бывает: постоянная и переменная (зависит от состава вещества, в которое входит элемент).
Определить валентность:
— Постоянная валентность идентична номеру группы главной подгруппы. Номера групп в таблице изображаются римскими цифрами.
— Переменная валентность (часто бывает у неметаллов) определяется по формуле: 8 вычесть № группы, в которой находится вещество.
Расшифровка периодов и групп периодической таблицы Менделеева
Каждый элемент имеет свой порядковый (атомный) номер, располагается в определённом периоде и определённой группе.
Периоды
- Малые периоды: первый, второй и третий периоды. В них содержится соответственно 2, 8 и 8 элементов;
- Большие периоды: остальные элементы. В четвёртом и пятом периодах расположены по 18 элементов, в шестом — 32, а в седьмом (пока незавершенном) — 31 элемент.
В таблице 7 периодов. В каждом содержится определённое число элементов:
1-й период — 2 элемента (малый период),
2-й период — 8 элементов (малый период),
3-й период — 8 элементов (малый период),
4-й период — 18 элементов (большой период),
5-й период — 18 элементов (большой период),
6-й период — 32 элемента (18+14) (большой период),
7-й период — 32 элемента (18+14) (большой период).
Группы и подгруппы
- Главные подгруппы включают в себя элементы малых периодов и одинаковые с ним по свойствам элементы больших периодов.
- Побочные подгруппы состоят только из элементов больших периодов. Химические свойства элементов главных и побочных подгрупп значительно различаются.
В Периодической таблице может использоваться разное обозначение групп. Поэтому согласно такому обозначению бывает разная расшифровка групп таблицы менделеева:
- 18 групп, пронумерованных арабскими цифрами.
- 8 групп, пронумерованных цифрами с добавлением букв A или B.
Группы A — это главные подгруппы.
Группы B — это побочные подгруппы в больших периодов. Это только металлы.
IA, VIIIA — по 7 элементов;
IIA — VIIA — по 6 элементов;
IIIB — 32 элемента (4+14 лантаноидов +14 актиноидов);
VIIIB — 12 элементов;
IB, IIB, IVB — VIIB — по 4 элемента.
Римский номер группы, как правило, показывает высшую валентность в оксидах (но для некоторых элементов не выполняется).
Элементы с порядковыми номерами 58–71 (лантаноиды) и 90–103 (актиноиды) вынесены из таблицы и располагаются под ней. Это элементы IIIB группы. Лантаноиды относятся к шестому периоду, а актиноиды — к седьмому.
Элементы главной подгруппы
1 группа главная подгруппа элементов (IA) — щелочные металлы.
Это мягкие металлы, серебристого цвета, хорошо режутся ножом. Все они обладают одним электроном на внешней оболочке и прекрасно вступают в реакцию.
Литий Li (3), Натрий Na (11), Калий K (19), Рубидий Rb (37), Цезий Cs (55), Франций Fr (87).
2 группа главная подгруппа (IIА) -щелочноземельными металлами.
Имеют серебристый оттенок. На внешнем уровне помещено по два электрона, и, соответственно, эти металлы менее охотно взаимодействуют с другими элементами. По сравнению со щелочными металлами, щелочноземельные металлы плавятся и кипят при более высоких температурах.
Кальций Ca (20), Стронций Sr (38), Барий Ba (56), Радий Ra (88).
3 группа главная подгруппа (IIIА).
Все элементы данной подгруппы, за исключением бора, металлы. Главную подгруппу составляют составляют бор, алюминий, галлий, индий и таллий. На внешнем электронном уровне элементов по три электрона. Они легко отдают эти электроны или образуют три неспаренных электрона.
4 группа главная подгруппа (IVА) .
Углерод и кремний обладают всеми свойствами неметаллов, германий и олово занимают промежуточную позицию, а свинец имеет выраженные металлические свойства. Большинство элементов подгруппы углерода — полупроводники (проводят электричество за счёт примесей, но хуже, чем металлы).
5 группа главная подгруппа (VA).
Физические свойства элементов подгруппы азота различны. Азот является бесцветным газом. Фосфор, мягкое вещество, образует несколько вариантов аллотропных модификаций — белый, красный и чёрный фосфор. Мышьяк — твёрдый полуметалл, способный проводить электрический ток. Висмут — блестящий серебристо-белый металл с радужным отливом.
6 группа главной подгруппы (VIA) .
Для завершения внешнего электронного уровня атомам этих элементов не хватает лишь двух электронов, поэтому они проявляют сильные окислительные (неметаллические) свойства.
7 группа главная подгруппа (VIIA) — галогены .
(F, Cl, Br, I, At). Имеют семь электронов на внешнем электронном слое атома. Это сильнейшие окислители, легко вступающие в реакции. Галогены («рождающие соли») назвали так потому, что они реагируют со многими металлами с образованием солей.
Самый активный из галогенов — фтор. Он способен разрушать даже молекулы воды, за что и получил своё грозное имя (слово «фтор» переводится на русский язык как «разрушительный»). А его «близкий родственник» — иод — используется в медицине в виде спиртового раствора для обработки ран.
8 группа главная подгруппа (VIIIA) — инертные (благородные) газы.
(He, Ne, Ar, Kr, Xe, Rn, Og). У них полностью заполнен внешний электронный уровень. Они практически не способны участвовать в реакциях. Поэтому их иногда называют «благородными». У инертных газов есть способность: они светятся под действием электромагнитного излучения, поэтому используются для создания ламп. Так, неон используется для создания светящихся вывесок и реклам, а ксенон — в автомобильных фарах и фотовспышках.
Элементы побочной подгруппы
Элементы побочных подгрупп кроме лантаноидов и актиноидов — переходные металлы.
Твёрдые (исключение жидкая ртуть), плотные, обладают характерным блеском, хорошо проводят тепло и электричество.
Переходные металлы занимают группы 3—12 в периодической таблице. Большинство из них плотные, твердые, с хорошей электро- и теплопроводностью. Их валентные электроны (при помощи которых они соединяются с другими элементами) находятся в нескольких электронных оболочках.
3 группа побочная подгруппа (IIIB) шестого и седьмого периодов — лантаноиды и актиноиды.
Для удобства их помещают под основной таблицей.
- Лантаноиды иногда называют «редкоземельными элементами», поскольку они были обнаружены в небольшом количестве в составе редких минералов и не образуют собственных руд.
- Актиноиды имеют одно важное общее свойство — радиоактивность. Все они, кроме урана, практически не встречаются в природе и синтезируются искусственно.
Неметаллы
Правый верхний угол таблицы до инертных газов -неметаллы.
Неметаллы плохо проводят тепло и электричество и могут существовать в трёх агрегатных состояниях: твёрдом (как углерод или кремний), жидком (как бром) и газообразном (как кислород и азот). Водород может проявлять как металлические, так и неметаллические свойства, поэтому его относят как к первой, так и к седьмой группе.
Кислородные и водородные соединения
Все элементы, кроме гелия, неона и аргона, образуют кислородные соединения.
Существует 8 форм кислородных соединений: R2O, RO, R2O3, RO2, R2O5, RO3, R2O7, RO4,
где R — элемент группы.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения. Существуют 4 формы водородных соединений: RH4, RH3, RH2, RH.
Характер соединений: RH — сильнокислый; RH2 — слабокислый; RH3 — слабоосновный; RH4 — нейтральный.
Как определить элементы главной и побочной подгруппы?
Как отличить главную подгруппу от побочной в таблице Менделеева? Главная подгруппа слева, а побочная — справа. То есть, если элемент выровнен по левому краю, то группа главная, а если по правому — то побочная.
В чем причина разделения элементов на основные и побочные подгруппы?
В элементах главных подгрупп периодической системы элементов происходит заполнение электронами орбиталей внешнего электронного уровня. … В элементах побочных подгрупп происходит заполнение электронами орбиталей предпоследнего электронного уровня.
Что означают А и Б в таблице Менделеева?
Группы A начинаются элементами малых периодов, включают также и элементы больших периодов; содержат и металлы, и неметаллы. … Группы B содержат элементы больших периодов, и это только металлы. В коротком варианте Периодической таблицы это побочные подгруппы.
Что значит побочная подгруппа?
Химические элементы в периодической системе по вертикали образуют группы. … ✓ Побочная подгруппа — вертикальный ряд химических элементов только больших периодов. Принято элементы главных подгрупп обозначать заглавной буквой А, а элементы побочных подгрупп – В.
Какие подгруппы называют главными?
Подгруппы, в которых расположены s- и p-элементы, называют ГЛАВНЫМИ, а подгруппы с d-элементами — ПОБОЧНЫМИ ПОДГРУППАМИ. Главные и побочные подгруппы иногда обозначают соответственно буквами «А» и «Б», или «А» и «В», или «а» и «б».
Как определить в какой группе находится элемент?
Гру́ппа периодической системы химических элементов — последовательность атомов по возрастанию заряда ядра, обладающих однотипным электронным строением. Номер группы определяется количеством электронов на внешней оболочке атома (валентных электронов) и, как правило, соответствует высшей валентности атома.
Сколько групп элементов в периодической системе?
Современная форма Периодической системы химических элементов (в 1989 году Международным союзом теоретической и прикладной химии рекомендована длинная форма таблицы) состоит из семи периодов (горизонтальных последовательностей элементов, расположенных по возрастанию порядкового номера) и 18 групп (вертикальных …
Что называют периодом и группой периодической системы?
Пери́од — строка периодической системы химических элементов, последовательность атомов по возрастанию заряда ядра и заполнению электронами внешней электронной оболочки. … Первый период, содержащий 2 элемента, а также второй и третий, насчитывающие по 8 элементов, называются малыми.
Какие формы периодической таблицы вы знаете?
Формы периодической таблицы Наиболее распространёнными являются 3 формы таблицы Менделеева: «короткая», «длинная», «сверхдлинная». В «короткой» форме записи четвертый и последующие периоды занимают по 2 строчки.
Что такое ряды в таблице Менделеева?
В периодической таблице Менделеева все элементы упорядочены с учетом их атомного числа, электронной конфигурации и повторяющихся химических свойств. Ряды в таблице называются периодами, а столбцы группами. … Периодическая система Менделеева систематизирует не только элементы, но и самые разнообразные их свойства.
Что означают цифры в таблице Менделеева?
Периоди́ческая систе́ма хими́ческих элеме́нтов (табли́ца Менделе́ева) — классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда их атомного ядра. Система является графическим выражением периодического закона, открытого русским учёным Д.
Чем различаются короткий и длинный варианты периодической таблицы?
В коротком варианте таблицы каждую группу делят на две подгруппы — главную и побочную. В побочную подгруппу входят только элементы больших периодов — переходные металлы. В длинном варианте периодической системы подгрупп нет, а количество групп равно 18. … В длинном варианте группы обозначаются арабскими цифрами.
Сколько групп в таблице Менделеева?
Группа периодической системы — последовательность атомов по возрастанию заряда ядра, включающая один или несколько столбцов в таблице Менделеева. В периодической системе восемь групп элементов. Положение в группах s- и р-элементов определяется общим числом электронов внешнего слоя.
В каком году была отменена короткая форма таблицы?
1989
Какие из химических элементов в таблице Менделеева связаны с Россией?
Менделеева связаны с Россией? Рутений – первооткрыватель элемента К. К. Клаус назвал рутений в честь России; дубний – назван в честь российского центра по исследованиям в области ядерной физики – Дубны; менделевий – назван в честь великого русского учёного Д.
Какой химический элемент нашли в России?
Рутений Рутений (Ruthenium, символ — Ru) — химический элемент с атомным номером 44.
Какой из этих химических элементов был открыт в России?
К тому времени чуть ли не весь мир включился в гонку за сверхтяжёлыми ядрами. В 1964 году новый химический элемент с атомным номером 104 впервые синтезировали в СССР, в Объединённом институте ядерных исследований (ОИЯИ), который находится в подмосковной Дубне. Позднее этот элемент получил имя «резерфордий».
Что такое с в химии?
s-Элементы в периодической таблице элементов — химические элементы, электронная оболочка которых включает в себя первые два s-электрона. Такие элементы объединяются в группу, называемую s-блок.
Как произносится сера?
Для правильного произношения названий и символов в русских названиях и произношениях проставлены ударения….Химические элементы: названия, символы и произношение символов
| Русское название элемента | Се́ра |
|---|---|
| Латинское название элемента | Sulfur |
| Символ элемента | S |
| Произношение символа | эс |
Как определить какой химический элемент?
Хими́ческий элеме́нт — совокупность атомов с одинаковым зарядом атомных ядер. Атомное ядро состоит из протонов, число которых равно атомному номеру элемента, и нейтронов, число которых может быть различным.
Что обозначают химические элементы?
Современные символы химических элементов состоят из первой буквы или из первой и одной из следующих букв латинского названия элементов. При этом только первая буква — заглавная. Например, H — водород (лат. Hydrogenium), N — азот (лат.
Как расположены химические элементы в таблице Менделеева?
В своей таблице (сегодня мы ее называем периодической таблицей, или системой, элементов) Менделеев расположил химические элементы по рядам в порядке возрастания их массы, подобрав длину рядов таким образом, чтобы химические элементы в одной колонке имели похожие химические свойства.
Какие элементы в таблице Менделеева металлы?
К металлам относятся все s-элементы (кроме водорода и гелия), d- и f-элементы, а также p-элементы под чертой бор-астат. Для типичных металлов характерен большой размер атомов, что способствует легкости отдачи валентных электронов.
Какие бывают химические элементы?
Список химических элементов
| № | Название | Латинское название |
|---|---|---|
| 1 | Водород | Hydrogenium |
| 2 | Гелий | Helium |
| 3 | Литий | Lithium |
| 4 | Бериллий | Beryllium |
Сколько элементов простые вещества которых неметаллы представлены в таблице Менделеева?
В отличие от металлов, неметаллов гораздо меньше, всего их насчитывается 22 элемента.
Сколько химических элементов в главной подгруппе четвертой группы?
К элементам IV группы главной подгруппы относят: углерод С, кремний Si, германий Ge, олово Sn и свинец РЬ.
Как называются элементы 4 группы?
а) Углерод (С), кремний (Si), германий (Ge), олово (Sn), свинец (РЬ) — элементы 4 группы главной подгруппы ПСЭ.
Как называются элементы главной подгруппы 8 группы?
Некоторые свойства элементов 8 группы
| Атомный номер | Химический элемент | Электронная оболочка |
|---|---|---|
| 26 | железо | 2, 8, 14, 2 |
| 44 | рутений | 2, 8, 18, 15, 1 |
| 76 | осмий | 2, 8, 18, 32, 14, 2 |
| 108 | хассий | 2, 8, 18, 32, 32, 14, 2 |
Сколько элементов в главной подгруппе пятой группы?
включает в себя 5 элементов азотN, фосфорP, мышьякAa, сурьмуSb и висмут Bi.
Как определить главную и побочную подгруппы в таблице Д. И. Менделеева?
Автор Mem На чтение 1 мин Просмотров 554 Опубликовано 26.11.2021
Обновлено 26.11.2021
В качестве основной подсказки я на картинке приведу таблицу, вернее сказать периодическую таблицу Менделеева.
Вам также может понравиться
На кого желательно учиться, чтобы точно стать нужным
36
В какой колледж лучше пойти выпускнику, какие специальности
312
На какие специальности (профессии) сейчас наиболее
39
На какие специальности, по каким профессиям можно поступить
38
Вопрос из Олимпиады «Россия — сердце единства»
367
Каким профессиям стоит обучаться в ВУЗах и колледжах
320