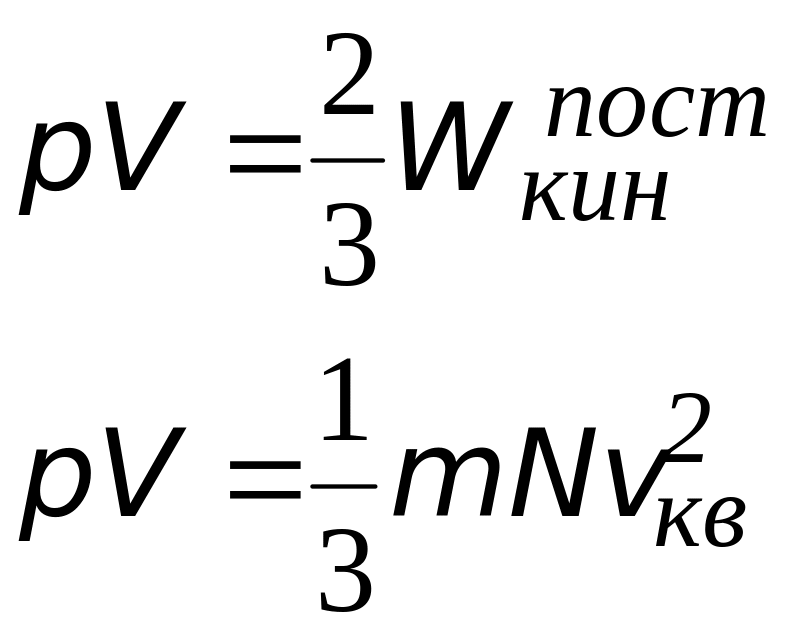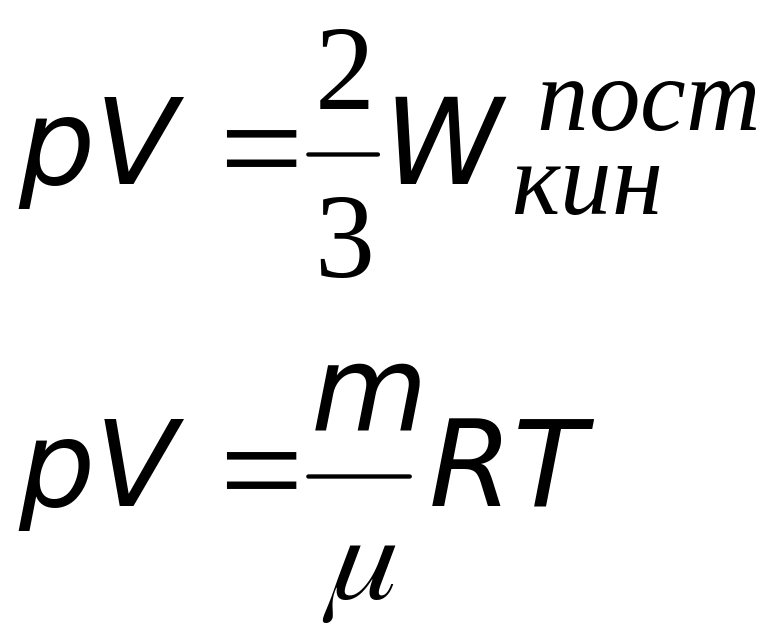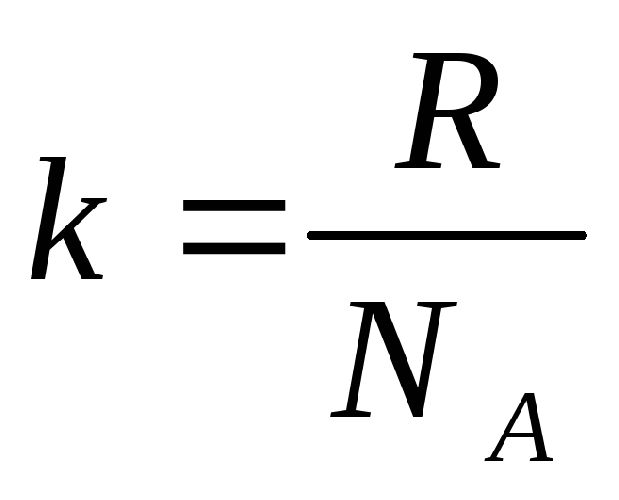Уравнение состояния идеального газа
Автор статьи — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев
Темы кодификатора ЕГЭ: модель идеального газа, связь между давлением и средней кинетической энергией теплового движения молекул идеального газа, связь температуры газа со средней кинетической энергией его частиц, уравнение  , уравнение Менделеева—Клапейрона.
, уравнение Менделеева—Клапейрона.
Из трёх агрегатных состояний вещества наиболее простым для изучения является газообразное. В достаточно разреженных газах расстояния между молекулами намного больше размеров самих молекул (тогда как в жидкостях и твёрдых телах молекулы «упакованы» весьма плотно).Поэтому силы взаимодействия между молекулами таких газов очень малы.
Для описания разреженных газов в физике используется модель идеального газа. В рамках этой модели делаются следующие допущения.
1. Пренебрегаем размерами молекул. Иными словами, молекулы газа считаются материальными точками.
2. Пренебрегаем взаимодействием молекул на расстоянии.
3. Соударения молекул друг с другом и со стенками сосуда считаем абсолютно упругими.
Таким образом, идеальный газ — это газ, частицы которого являются не взаимодействующими на расстоянии материальными точками и испытывают абсолютно упругие соударения друг с другом и со стенками сосуда.
Средняя кинетическая энергия частиц газа
Оказывается, что ключевую роль в описании идеального газа играет средняя кинетическая энергия его частиц.
Частицы газа двигаются с разными скоростями. Пусть в газе содержится частиц, скорости которых равны
. Масса каждой частицы равна
. Кинетические энергии частиц:
Средняя кинетическая энергия частиц газа это среднее арифметическое их кинетических энергий:
Последний множитель — это средний квадрат скорости, обозначаемый просто :
Тогда формула для средней кинетической энергии приобретает привычный вид:
(1)
Корень из среднего квадрата скорости называется средней квадратической скоростью:
Основное уравнение МКТ идеального газа
Cвязь между давлением газа и средней кинетической энергией его частиц называется основным уравнением молекулярно-кинетической теории идеального газа. Эта связь выводится из законов механики и имеет вид:
(2)
где — концентрация газа (число частиц в единице объёма). С учётом (1) имеем также:
(3)
Что такое ? Произведение массы частицы на число частиц в единице объёма даёт массу единицы объёма, то есть плотность:
. Получаем третью разновидность основного уравнения:
(4)
Энергия частиц и температура газа
Можно показать, что при установлении теплового равновесия между двумя газами выравниваются средние кинетические энергии их частиц. Но мы знаем, что при этом становятся равны и температуры газов. Следовательно, температура газа — это мера средней кинетической энергии его частиц.
Собственно, ничто не мешает попросту отождествить эти величины и сказать, что температура газа — это средняя кинетическая энергия его молекул. В продвинутых курсах теоретической физики так и поступают. Определённая таким образом температура измеряется в энергетических единицах — джоулях.
Но для практических задач удобнее иметь дело с привычными кельвинами. Связь средней кинетической энергии частиц и абсолютной температуры газа даётся формулой:
(5)
где Дж/К — постоянная Больцмана.
Благодарим за то, что пользуйтесь нашими публикациями.
Информация на странице «Уравнение состояния идеального газа» подготовлена нашими редакторами специально, чтобы помочь вам в освоении предмета и подготовке к экзаменам.
Чтобы успешно сдать нужные и поступить в высшее учебное заведение или техникум нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими материалами из данного раздела.
Публикация обновлена:
08.05.2023
|
|
Эти выражения называют
основным уравнением МКТ.
Измерив давление и объем газа, можно
оценить кинетическую энергию молекул
и их среднюю квадратичную скорость. Из
этих уравнений можно получить и уравнение
состояния газа, учитывая, что из опыта:
.
|
|
|
|
|
Сопоставляя основное
уравнение МКТ с уравнением состояния
идеального газа, можно найти выражение
для кинетической энергии поступательного
движения молекул. Из формул видно, что
кинетическая энергия молекул
пропорциональна абсолютной температуре.
Следовательно, абсолютная
температура газа является количественной
мерой кинетической энергии теплового
движения молекул. При
абсолютном нуле (Т = 0), согласно МКТ,
любое тепловое движение молекул должно
прекратиться. Однако, это не означает
полной неподвижности молекул. Остается
движение (но не тепловое) с некоторой
минимальной энергией, которую называют
нулевой энергией.
Вопрос 4.Средняя кинетическая энергия
|
|
средняя кинетическая
энергия поступательного движения одной
молекулы и всех молекул в
сосуде
Вопрос 5.Степени свободы молекул.
Числом степеней
свободы ( i
)системы
называется наименьшее число независимых
величин, полностью определяющих состояние
системы. В качестве степеней свободы
можно рассматривать координаты, углы
по отношению к осям координат, моменты
инерции кинетическую и потенциальную
энергию и др. Нас интересует только
положение молекулы в пространстве,
поэтому проще всего в качестве степеней
свободы взять 3 координаты центра масс
молекулы xC
, yC
, zC
и 3 ее момента
инерции IX,
IY,
IZ
относительно осей координат.
|
|
|
|
|
одноатомная молекула (мат. точка) |
жесткая двухатомная молекула |
жесткая 3-х и более атомная молек. |
|
x y |
xC |
xC |
|
i=iпост |
i=iпост |
i=iпост |
В МКТ существует
закон равного
распределения энергии по степеням
свободы молекул:
«В состоянии
теплового равновесия на каждую степень
свободы приходится в среднем одна и та
же кинетическая энергия, равна
½ кТ».
Теперь мы можем записать выражения для
полной кинетической энергии молекул с
учетом их поступательного и вращательного
движений.
|
|
для одной молекулы |
Полная |
|
|
Для всех молекул |
Тема 13.Классическая статика.
Вопрос 1.Распределение молекул по скоростям(Закон Максвелла).
|
|
f |
|
|
|
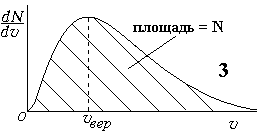
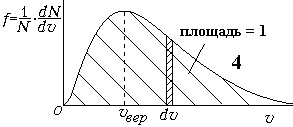
Заштрихованная
площадь под кривой на графике 3 равна
общему числу молекул, а под кривой на
графике 4 — равна 1. Скорость, соответствующая
максимуму на кривой Максвелла, называется
наиболее вероятной скоростью — vвер
– это скорость, вблизи которой находятся
скорости большинства молекул. Ее можно
найти, если производную приравнять
нулю:df/dv=0.
|
|
Запишем формулу |
|
|
возьмем производную |
|
|
получим выражение |
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Научная статья
на тему: “Кинетическая энергия газа”
В этой статье мы займемся кинетической энергией
газа. Мы покажем вам формулы для расчета кинетической энергии и пример. Эта
статья относится к области термодинамики.Формулы кинетической теории газа
устанавливают взаимосвязь между величинами энергии, массы, скорости, давления,
количества частиц и объема для газов и позволяют рассчитывать кинетическую
энергию газов.
Средняя кинетическая
энергия:
Где:
●
«E KIN » — это средняя кинетическая
энергия частиц в Ньютон-метрах [Нм]
●
«m» — масса в килограммах [кг]
● «v»
— средняя скорость частиц в метрах в секунду [м / с]
Пример:
Масса газа 5 кг,
средняя скорость 480 м / с. Что такое средняя кинетическая энергия?
Формула, которая
является основным уравнением кинетической теории газа, также соответствует
этому:
Основные уравнения
кинетической теории газа:
Где:
●
«p» — это давление в Ньютонах на квадратный
метр [Н / м 2 ].
●
«V» — объем в кубических метрах [м 3
]
●
«N» — количество частиц без единицы измерения.
● «E
KIN » — это средняя кинетическая энергия частиц в Ньютон-метрах [Нм]
2017-05-27
Найти среднюю квадратичную скорость, среднюю кинетическую энергию поступательного движения и среднюю полную кинетическую энергию молекул гелия и азота при температуре $t = 27^{ circ} С$. Определить полную энергию всех молекул 100 г каждого из газов.
Решение:
Средняя кинетическая энергия поступательного движения одной молекулы любого газа однозначно определяется его термодинамической температурой:
$langle W_{0п} rangle = frac{3}{2} kT$, (1)
где $k = 1,38 cdot 10^{-23} Дж/К$ — постоянная Больцмана.
Однако средняя квадратичная скорость молекул газа зависит от массы его молекул:
$v_{кв} = sqrt{3kT/m_{0}}$, (2)
где $m_{0}$ — масса одной молекулы.
Средняя-полная энергия молекулы зависит не только от температуры, но и от структуры молекул — от числа £ степеней свободы:
$langle W_{0} rangle = ikT/2$. (3)
Полная кинетическая энергия всех молекул, равная для идеального газа его внутренней энергии, может быть найдена как произведение $langle W_{0} rangle$ на число $N$ всех молекул:
$W = U = langle W_{0} rangle N$. (4)
Очевидно,
$N = N_{A} m / mu$, (5)
где $m$ — масса всего газа, отношение т/ц определяет число молей, а $N_{A}$ — постоянная Авогадро. Выражение (4) с учетом уравнения Клапейрона — Менделеева позволит рассчитать полную энергию всех молекул газа.
Согласно равенству (1), $langle W_{0п} rangle = 6,2 cdot 10^{-21} Дж$, причем средние энергии поступательного движения одной молекулы и гелия, и азота одинаковы.
Для расчета средней квадратичной скорости выражение (2) удобно несколько преобразовать, умножив числитель и знаменатель на $N_{A}$.
Тогда
$v_{кв} = sqrt{3RT/ mu}$,
где $R = 8,31 Дж/(моль cdot К)$. Для гелия $v_{кв} = 13,7 cdot 10^{2} м/с$, для азота $v_{кв} = 5,17 cdot 10^{2} м/с$.
Для расчета средней полной энергии молекулы [см. (3)] надо знать число степеней свободы молекулы.
Гелий — одноатомный газ, следовательно, $i = 3$, тогда
$langle W_{0п} rangle = langle W_{0} rangle = 6,2 cdot 10^{-21} Дж$.
Азот — двухатомный газ, следовательно, $i = 5$ и
$langle W_{0} rangle = frac{5}{2} kT = 10,4 cdot 10^{-21} Дж$.
Полная энергия всех молекул после подстановки выражений (3) и (5) в (4) равна
$W = frac{i}{2} kT frac{m}{ mu} N_{0} = frac{i}{2} frac{m}{ mu} RT$.
Для гелия $W = 93,5 кДж$; для азота $W = 22,3 кДж$.
Внутренняя энергия идеального газа

4.2
Средняя оценка: 4.2
Всего получено оценок: 205.
4.2
Средняя оценка: 4.2
Всего получено оценок: 205.
С помощью понятия внутренней энергии в физике объясняются процессы, когда работа может совершаться покоящимся телом за счет энергии отдельных частиц, из которых состоит это тело. В большинстве случаев величина внутренней энергии тела представляет собой сумму потенциальной энергии взаимодействия молекул, составляющих тело, и кинетической энергии их хаотического теплового движения. Для описания тепловых явлений в веществах, находящихся в газообразном состоянии, используется модель идеального газа, которая позволяет получить достаточно простые формулы для величины внутренней энергии идеального газа.
Что такое идеальный газ
Газ – это агрегатное состояние вещества, для которого характерна большая подвижность его частиц (большие длины пробега) и очень слабая связь между молекулами и атомами. В газообразном состоянии вещество не имеет определенной формы и объема. Любое вещество может быть переведено в газообразное состояние с помощью подбора необходимых параметров давления и температуры.
Идеальным называется газ, имеющий следующий набор свойств:
- Молекулы имеют пренебрежимо малые размеры;
- Молекулы не взаимодействуют между собой (отсутствуют силы притяжения и отталкивания);
- Расстояния между молекулами много больше размеров молекул;
- Молекулы отталкиваются только при соударениях друг с другом и со стенками сосуда, где они находятся. Соударения описываются формулами из раздела механики для соударения шаров;
- Движение молекул происходит по законам Ньютона;
- Газ оказывает давление на стенки сосуда за счет ударов молекул газа.
Определение внутренней энергии
Внутренняя энергия вещества U — это сумма потенциальной энергии взаимодействия молекул Eп, составляющих тело, и кинетической энергии их хаотического теплового движения Ek:
$ U = { E_k + E_п } $ (1).
Для вычисления внутренней энергии газа Uг в формуле (1) можно пренебречь потенциальной составляющей энергии, то есть:
$ U_г = E_k $ (2).
Полная кинетическая энергия вещества Епк получается сложением энергий всех отдельных частиц:
$ Е^п_к = Е_1 + Е_2 + Е_3 +…. Е_N $ (2),
где N — общее число частиц в газе.
Частица массой m, движущаяся со скоростью v, обладает кинетической энергии Ек, которую можно вычислить с помощью формулы, полученной в разделе механики:
$ Ек = {m * v^2over 2} $ (3).
Найти полную кинетическую энергию всех частиц газа помощью формул (2) и (3), не представляется возможным — для этого необходимо знать скорости и массы всех частиц, а также их общее количество. Учитывая, что только в одном моле вещества находится гигантское число молекул (6,023*1023!), становится понятно, что для нахождения внутренней энергии даже такой простой системы, как идеальный газ, требуется другая модель расчета с использованием таких макроскопических параметров, как давление p и температура T.
Кинетическая энергия и температура
Эксперименты показывали, что чем горячее вещество, тем с большими скоростями (“энергичнее”) двигаются частицы вещества. Изобретение термометра и введение величины температуры T, позволило ученым не только наблюдать за тепловыми явлениями, связанными с изменением температуры (нагревом и охлаждением), но и проводить измерения, накапливать результаты экспериментов в таблицах, анализируя полученные данные для разных веществ.
Во всех приборах, придуманных в ХVIII веке, измерение температуры сводилось к измерению длины столбика ртути, спирта или воды. Но оказалось, что самыми точными оказались газовые термометры. Дело в том, что жидкостные термометры работали только в ограниченном интервале температур. Наполняющие их вещества замерзали и кипели, и поэтому нельзя было измерять очень высокие и очень низкие температуры. Поэтому газовый термометр до сих пор используется как эталонный для всех температур, достижимых в лабораториях.
Ранее было получено уравнение состояния идеального газа — соотношение между давлением p, объемом V и абсолютной температурой (по шкале Кельвина) T, названное в честь его авторов уравнением Клапейрона-Менделеева:
$ p * V = {mover μ} * R * T $ (4),
где:
μ — молярная масса газа, R = 8,3157 джоуль/моль/градус — универсальная газовая постоянная.
Газовая постоянная R равна:
$ R = k * N_a $ (5),
где: k =1,38*10-23 Дж/К — постоянная Больцмана, Na — число Авогадро.
Тогда, из уравнений (4) и (5) получим выражение для давления идеального газа в виде:
$ p = n * k * T $ (6),
где: $ n = {mover μ} * {Naover V_об } $ — концентрация молекул, Vоб — объем.
В 1860 г. немецкий физик Рудольф Клаузиус получил для давления p одноатомного идеального газа следующую формулу, которую называют основным уравнением молекулярно-кинетической теории:
$ p = {1over 3} * n * m * v^2_c $ (7),
где: v2c = <v2>ср — среднее арифметическое квадратов скоростей молекул.
Из двух формул (6) и (7) для величины давления p получаем:
$ p = {1over 3} * n * m * v^2_c = n * k * T $ (7).
Разделив части уравнения (7) на n, и умножив обе части на 3/2, получим:
$ {m * v^2_сover 2} = {3 over 2} * k * T $ (8).
Левая часть уравнения (8) представляет собой величину средней кинетической энергии хаотического движения молекул (формула (3)). Таким образом:
$ Е_к = {3 over 2} * k * T $ (9).
Последняя формула (9) демонстрирует, что средняя кинетической энергия хаотического движения молекул идеального газа, а значит и его внутренняя энергия, пропорциональна его температуре T.
Представленные уравнения справедливы для случая одноатомного газа. Дело в том, что у молекул с большим числом атомов кроме чисто поступательного движения появляются дополнительные составляющие энергии: вращательная и колебательная. Поэтому к внутренней энергии добавится энергия вращения молекул и колебаний атомов внутри молекул. Например, молекула кислорода O2, имеет энергию $ {7over 2} * k * T $, существенно превышающую энергию одноатомного газа (9).
Что мы узнали?
Итак, мы узнали какие условия должны выполняться для того, чтобы газ был идеальным. Внутренняя энергия идеального газа равна сумме кинетических энергий всех молекул газа. Средняя кинетическая энергия молекул одноатомного идеального газа прямо пропорциональна абсолютной температуре T. На основании уравнений Менделеева-Клапейрона (4) и Клаузиуса (7) получена формула зависимости средней кинетической энергии (9) от температуры T газа.
Тест по теме
Доска почёта

Чтобы попасть сюда — пройдите тест.
-
Ангелина Упорова
6/10
Оценка доклада
4.2
Средняя оценка: 4.2
Всего получено оценок: 205.
А какая ваша оценка?