From Wikipedia, the free encyclopedia
This article is about the chemical isotope. For the band, see Strontium 90 (band).

Strontium-90 test source in tin |
|
| General | |
|---|---|
| Symbol | 90Sr |
| Names | strontium-90, 90Sr, Sr-90 |
| Protons (Z) | 38 |
| Neutrons (N) | 52 |
| Nuclide data | |
| Natural abundance | syn |
| Half-life (t1/2) | 28.79 years |
| Isotope mass | 89.9077279(16)[1] Da |
| Decay products | 90Y |
| Decay modes | |
| Decay mode | Decay energy (MeV) |
| Beta decay | 0.546 |
| Isotopes of strontium Complete table of nuclides |
Strontium-90 (90
Sr
) is a radioactive isotope of strontium produced by nuclear fission, with a half-life of 28.8 years. It undergoes β− decay into yttrium-90, with a decay energy of 0.546 MeV.[2] Strontium-90 has applications in medicine and industry and is an isotope of concern in fallout from nuclear weapons, nuclear weapons testing, and nuclear accidents.[3]
Radioactivity[edit]
Naturally occurring strontium is nonradioactive and nontoxic at levels normally found in the environment, but 90Sr is a radiation hazard.[4] 90Sr undergoes β− decay with a half-life of 28.79 years and a decay energy of 0.546 MeV distributed to an electron, an antineutrino, and the yttrium isotope 90Y, which in turn undergoes β− decay with a half-life of 64 hours and a decay energy of 2.28 MeV distributed to an electron, an antineutrino, and 90Zr (zirconium), which is stable.[5] Note that 90Sr/Y is almost a pure beta particle source; the gamma photon emission from the decay of 90Y is so infrequent that it can normally be ignored.
90Sr has a specific activity of 5.21 TBq/g.[6]
| t½ (year) |
Yield (%) |
Q (keV) |
βγ | |
|---|---|---|---|---|
| 155Eu | 4.76 | 0.0803 | 252 | βγ |
| 85Kr | 10.76 | 0.2180 | 687 | βγ |
| 113mCd | 14.1 | 0.0008 | 316 | β |
| 90Sr | 28.9 | 4.505 | 2826 | β |
| 137Cs | 30.23 | 6.337 | 1176 | βγ |
| 121mSn | 43.9 | 0.00005 | 390 | βγ |
| 151Sm | 88.8 | 0.5314 | 77 | β |
Fission product[edit]
90Sr is a product of nuclear fission. It is present in significant amount in spent nuclear fuel, in radioactive waste from nuclear reactors and in nuclear fallout from nuclear tests.
For thermal neutron fission as in today’s nuclear power plants, the fission product yield from uranium-235 is 5.7%, from uranium-233 6.6%, but from plutonium-239 only 2.0%.[7]
Nuclear waste[edit]
Strontium-90 is classified as high-level waste. Its 29-year half-life means that it can take hundreds of years to decay to negligible levels. Exposure from contaminated water and food may increase the risk of leukemia and bone cancer.[8]
Remediation[edit]
Algae has shown selectivity for strontium in studies, where most plants used in bioremediation have not shown selectivity between calcium and strontium, often becoming saturated with calcium, which is greater in quantity and also present in nuclear waste.[8]
Researchers have looked at the bioaccumulation of strontium by Scenedesmus spinosus (algae) in simulated wastewater. The study claims a highly selective biosorption capacity for strontium of S. spinosus, suggesting that it may be appropriate for use of nuclear wastewater.[9]
A study of the pond alga Closterium moniliferum using stable strontium found that varying the ratio of barium to strontium in water improved strontium selectivity.[8]
Biological effects[edit]
Biological activity[edit]
Strontium-90 is a «bone seeker» that exhibits biochemical behavior similar to calcium, the next lighter group 2 element.[4][10] After entering the organism, most often by ingestion with contaminated food or water, about 70–80% of the dose gets excreted.[3] Virtually all remaining strontium-90 is deposited in bones and bone marrow, with the remaining 1% remaining in blood and soft tissues.[3] Its presence in bones can cause bone cancer, cancer of nearby tissues, and leukemia.[11] Exposure to 90Sr can be tested by a bioassay, most commonly by urinalysis.[4]
The biological half-life of strontium-90 in humans has variously been reported as from 14 to 600 days,[12][13] 1000 days,[14] 18 years,[15] 30 years[16] and, at an upper limit, 49 years.[17] The wide-ranging published biological half life figures are explained by strontium’s complex metabolism within the body. However, by averaging all excretion paths, the overall biological half life is estimated to be about 18 years.[18]
The elimination rate of strontium-90 is strongly affected by age and sex, due to differences in bone metabolism.[19]
Together with the caesium isotopes 134Cs and 137Cs, and the iodine isotope 131I, it was among the most important isotopes regarding health impacts after the Chernobyl disaster.
As strontium has an affinity to the calcium-sensing receptor of parathyroid cells that is similar to that of calcium, the increased risk of liquidators of the Chernobyl power plant to suffer from primary hyperparathyroidism could be explained by binding of strontium-90.[20]
Uses[edit]
Radioisotope thermoelectric generators (RTGs)[edit]
The radioactive decay of strontium-90 generates a significant amount of heat, 0.95 W/g in the form of pure strontium metal or approximately 0.460 W/g as strontium titanate[21] and is cheaper than the alternative 238Pu. It is used as a heat source in many Russian/Soviet radioisotope thermoelectric generators, usually in the form of strontium titanate.[22] It was also used in the US «Sentinel» series of RTGs.[23]
Industrial applications[edit]
90Sr finds use in industry as a radioactive source for thickness gauges.[3]
Medical applications[edit]
90Sr finds extensive use in medicine as a radioactive source for superficial radiotherapy of some cancers. Controlled amounts of 90Sr and 89Sr can be used in treatment of bone cancer, and to treat coronary restenosis via vascular brachytherapy. It is also used as a radioactive tracer in medicine and agriculture.[3]
Aerospace applications[edit]
90Sr is used as a blade inspection method in some helicopters with hollow blade spars to indicate if a crack has formed.[24]
Radiological warfare[edit]
In April 1943, Enrico Fermi suggested to Robert Oppenheimer the possibility of using the radioactive byproducts from enrichment to contaminate the German food supply. The background was fear that the German atomic bomb project was already at an advanced stage, and Fermi was also skeptical at the time that an atomic bomb could be developed quickly enough. Oppenheimer discussed the proposal with Edward Teller, who suggested the use of strontium-90. James Bryant Conant and Leslie R. Groves were also briefed, but Oppenheimer wanted to proceed with the plan only if enough food could be contaminated with the weapon to kill half a million people.[25]
90Sr contamination in the environment[edit]
Strontium-90 is not quite as likely as caesium-137 to be released as a part of a nuclear reactor accident because it is much less volatile, but is probably the most dangerous component of the radioactive fallout from a nuclear weapon.[26]
A study of hundreds of thousands of deciduous teeth, collected by Dr. Louise Reiss and her colleagues as part of the Baby Tooth Survey, found a large increase in 90Sr levels through the 1950s and early 1960s. The study’s final results showed that children born in St. Louis, Missouri, in 1963 had levels of 90Sr in their deciduous teeth that was 50 times higher than that found in children born in 1950, before the advent of large-scale atomic testing. Reviewers of the study predicted that the fallout would cause increased incidence of disease in those who absorbed strontium-90 into their bones.[27] However, no follow up studies of the subjects have been performed, so the claim is untested.
An article with the study’s initial findings was circulated to U.S. President John F. Kennedy in 1961, and helped convince him to sign the Partial Nuclear Test Ban Treaty with the United Kingdom and Soviet Union, ending the above-ground nuclear weapons testing that placed the greatest amounts of nuclear fallout into the atmosphere.[28]
The Chernobyl disaster released roughly 10 PBq, or about 5% of the core inventory, of strontium-90 into the environment.[29] The Fukushima Daiichi disaster had from the accident until 2013 released 0.1 to 1 PBq of strontium-90 in the form of contaminated cooling water into the Pacific Ocean.[30]
See also[edit]
- Gray and Sievert
- Radiation poisoning
- Strontium
- Yttrium-90
- Lia radiological accident
References[edit]
- ^ Wang, Meng; Huang, W.J.; Kondev, F.G.; Audi, G.; Naimi, S. (2021). «The AME 2020 atomic mass evaluation (II). Tables, graphs and references». Chinese Physics C. 45 (3): 030003. doi:10.1088/1674-1137/abddaf.
- ^ «Table of Isotopes decay data». Lund University. Retrieved 13 October 2014.
- ^ a b c d e «Strontium | Radiation Protection | US EPA». EPA. 24 April 2012. Archived from the original on 11 May 2012. Retrieved 18 June 2012.
- ^ a b c TOXICOLOGICAL PROFILE FOR STRONTIUM (PDF), Agency for Toxic Substances and Disease Registry, April 2004, retrieved 13 October 2014
- ^ Decay data from National Nuclear Data Center at the Brookhaven National Laboratory in the US.
- ^ Delacroix, D.; Guerre, J. P.; Leblanc, P.; Hickman, C. (2002). Radionuclide and Radiation Protection Data Handbook 2002 (2nd ed.). Nuclear Technology Publishing. ISBN 978-1-870965-87-3.
- ^ «Livechart — Table of Nuclides — Nuclear structure and decay data». IAEA. Retrieved 13 October 2014.
- ^ a b c Potera, Carol (2011). «HAZARDOUS WASTE: Pond Algae Sequester Strontium-90». Environ Health Perspect. 119 (6): A244. doi:10.1289/ehp.119-a244. PMC 3114833. PMID 21628117.
- ^ Liu, Mingxue; Dong, Faqin; Kang, Wu; Sun, Shiyong; Wei, Hongfu; Zhang, Wei; Nie, Xiaoqin; Guo, Yuting; Huang, Ting; Liu, Yuanyuan (2014). «Biosorption of Strontium from Simulated Nuclear Wastewater by Scenedesmus spinosus under Culture Conditions: Adsorption and Bioaccumulation Processes and Models». Int J Environ Res Public Health. 11 (6): 6099–6118. doi:10.3390/ijerph110606099. PMC 4078568. PMID 24919131.
- ^ «NRC: Glossary — Bone seeker». US Nuclear Regulatory Commission. 7 May 2014. Retrieved 13 October 2014.
- ^ https://dhss.delaware.gov/dhss/dph/files/strontiumfaq.pdf[bare URL PDF]
- ^ Tiller, B. L. (2001), «4.5 Fish and Wildlife Surveillance» (PDF), Hanford Site 2001 Environmental Report, DOE, retrieved 14 January 2014
- ^ Driver, C.J. (1994), Ecotoxicity Literature Review of Selected Hanford Site Contaminants (PDF), DOE, doi:10.2172/10136486, retrieved 14 January 2014
- ^ «Freshwater Ecology and Human Influence». Area IV Envirothon. Retrieved 14 January 2014.
- ^ «Radioisotopes That May Impact Food Resources» (PDF). Epidemiology, Health and Social Services, State of Alaska. Retrieved 14 January 2014.
- ^ «Human Health Fact Sheet: Strontium» (PDF). Argonne National Laboratory. October 2001. Retrieved 14 January 2014.
- ^ «Biological Half-life». HyperPhysics. Retrieved 14 January 2014.
- ^ Glasstone, Samuel; Dolan, Philip J. (1977). «XII: Biological Effects» (PDF). The effects of Nuclear Weapons. p. 605. Retrieved 14 January 2014.
- ^ Shagina, N B; Bougrov, N G; Degteva, M O; Kozheurov, V P; Tolstykh, E I (2006). «An application of in vivo whole body counting technique for studying strontium metabolism and internal dose reconstruction for the Techa River population». Journal of Physics: Conference Series. 41 (1): 433–440. Bibcode:2006JPhCS..41..433S. doi:10.1088/1742-6596/41/1/048. ISSN 1742-6588.
- ^ Boehm BO, Rosinger S, Belyi D, Dietrich JW (August 2011). «The Parathyroid as a Target for Radiation Damage». New England Journal of Medicine. 365 (7): 676–678. doi:10.1056/NEJMc1104982. PMID 21848480.
- ^ Harris, Dale; Epstein, Joseph (1968). Properties of Selected Radioisotopes. NASA (Report). 19680020487. Retrieved 15 May 2023.
- ^ Standring, WJF; Selnæs, ØG; Sneve, M; Finne, IE; Hosseini, A; Amundsen, I; Strand, P (2005), Assessment of environmental, health and safety consequences of decommissioning radioisotope thermal generators (RTGs) in Northwest Russia (PDF), Østerås: Norwegian Radiation Protection Authority
- ^ «Power Sources for Remote Arctic Applications» (PDF). Washington, DC: U.S. Congress, Office of Technology Assessment. June 1994. OTA-BP-ETI-129.
- ^ «Wireless blade monitoring system and process».
- ^ Rhodes, Richard (2012). The making of the atomic bomb. Simon & Schuster. pp. 510ff. ISBN 978-1-4711-1123-5. OCLC 1096260191.
- ^ «Nuclear Fission Fragments». HyperPhysics. Retrieved 18 June 2012.
- ^ Schneir, Walter (25 April 1959). «Strontium-90 in U.S. Children». The Nation. 188 (17): 355–357.
- ^ Hevesi, Dennis. «Dr. Louise Reiss, Who Helped Ban Atomic Testing, Dies at 90», The New York Times, January 10, 2011. Accessed January 10, 2011.
- ^ «II: The release, dispersion and deposition of radionuclides», Chernobyl: Assessment of Radiological and Health Impacts (PDF), NEA, 2002
- ^ Povinec, P. P.; Aoyama, M.; Biddulph, D.; et al. (2013). «Cesium, iodine and tritium in NW Pacific waters – a comparison of the Fukushima impact with global fallout». Biogeosciences. 10 (8): 5481–5496. Bibcode:2013BGeo…10.5481P. doi:10.5194/bg-10-5481-2013. ISSN 1726-4189.
External links[edit]
- «Strontium, Radioactive». Hazardous Substances Data Bank (HSDB). pubchem.ncbi.nlm.nih.gov. Retrieved 15 May 2023.
Материал из Википедии — свободной энциклопедии
Перейти к: навигация, поиск
| Стронций-90
Таблица нуклидов |
|
|---|---|
| Общие сведения | |
| Название, символ | Стронций-90, 90Sr |
| Альтернативные названия | Радиостронций |
| Нейтронов | 52 |
| Протонов | 38 |
| Свойства нуклида | |
| Атомная масса | 89,907738(3)[1] а. е. м. |
| Избыток массы | −85 941,6(29)[1] кэВ |
| Удельная энергия связи (на нуклон) | 8 695,90(3)[1] кэВ |
| Период полураспада | 28,79(6)[2] лет |
| Продукты распада | 90Y |
| Родительские изотопы | 90Rb |
| Спин и чётность ядра | 0+[2] |
| Канал распада | Энергия распада |
| β− | 0,5459(14)[1] МэВ |
Стро́нций-90 (англ. strontium-90) — радиоактивный нуклид химического элемента стронция с атомным номером 38 и массовым числом 90. Образуется преимущественно при делении ядер в ядерных реакторах и ядерном оружии.
В окружающую среду 90Sr попадает преимущественно при ядерных взрывах и выбросах с АЭС.
Стронций является аналогом кальция и способен прочно откладываться в костях. Длительное радиационное воздействие 90Sr и продуктов его распада поражает костную ткань и костный мозг, что приводит к развитию лучевой болезни, опухолей кроветворной ткани и костей.
Содержание
- 1 Образование и распад
- 2 Биологическое действие
- 3 Получение
- 4 Применение
- 5 См. также
- 6 Примечания
- 7 Литература
[править] Образование и распад
Стронций-90 является дочерним продуктом β−-распада нуклида 90Rb (период полураспада составляет 158(5)[2] c) и его изомеров[2] c:
В свою очередь, 90Sr претерпевает β−-распад, переходя в радиоактивный иттрий 90Y (вероятность 100 %[2], энергия распада 545,9(14) кэВ[1]):
Нуклид 90Y также радиоактивен, имеет период полураспада в 64 часа и в процессе β−-распада с энергией 2,28 МэВ превращается в стабильный 90Zr[2].
[править] Биологическое действие
Стронций является аналогом кальция, поэтому он наиболее эффективно откладывается в костной ткани. В мягких тканях задерживается менее 1 %. За счёт отложения в костной ткани, он облучает костную ткань и костный мозг. Так как у красного костного мозга взвешивающий коэффициент в 12 раз больше, чем у костной ткани, то именно он является критическим органом при попадании стронция-90 в организм, что увеличивает риск заболевания раком костного мозга. А при поступлении большого количества изотопа может вызвать лучевую болезнь.
[править] Получение
[править] Применение
90Sr применяется в производстве радиоизотопных источников энергии в виде титаната стронция (плотность 4,8 г/см³, энерговыделение около 0,54 Вт/см³).
Одно из широких применений 90Sr — контрольные источники дозиметрических приборов, в том числе военного назначения и Гражданской обороны. Наиболее распространенный — типа «Б-8» исполнен как металлическая подложка, содержащая в углублении каплю эпоксидной смолы, содержащей соединение 90Sr. Для обеспечения защиты от образования радиоактивной пыли через эрозию, препарат закрыт тонким слоем фольги. Фактически такие источники ионизирующего излучения являются комплексом 90Sr — 90Y, поскольку иттрий непрерывно образуется при распаде стронция. 90Sr — 90Y является практически чистым бета-источником. В отличие от гамма-радиоактивных препаратов бета-препараты легко экранировать относительно тонким (порядка 1 мм) слоем стали, что обусловило выбор бета-препарата для проверочных целей, начиная со второго поколения военной дозиметрической аппаратуры (ДП-2, ДП-12, ДП-63).
[править] См. также
- Стронций
- Радиоактивность
[править] Примечания
- ↑ 1 2 3 4 5 G. Audi, A.H. Wapstra, and C. Thibault (2003). «The AME2003 atomic mass evaluation (II). Tables, graphs, and references.». Nuclear Physics A 729: 337—676. DOI:10.1016/j.nuclphysa.2003.11.003.
- ↑ 1 2 3 4 5 6 G. Audi, O. Bersillon, J. Blachot and A. H. Wapstra (2003). «The NUBASE evaluation of nuclear and decay properties». Nuclear Physics A 729: 3–128. DOI:10.1016/j.nuclphysa.2003.11.001.
[править] Литература
- Измеритель мощности дозы (рентгенметр) ДП-5Б. Техническое описание и инструкция по эксплуатации. ЕЯ2.807.023 ТО
- Рентгенметр «ДП-2». Описание и инструкция. Технический формуляр. 1964 г.
- Гражданская оборона. Издание 8. М., «Просвещение», 1975.
В 1787 году неподалеку от шотландского поселения Стронциан, в шахте по добыче свинца, был найден до этого времени неизвестный минерал. В честь деревни он был назван стронцианитом. А название химическому элементу стронцию ученые дали в честь этого минерала. Каковы его свойства, чем это вещество может быть полезно или опасно?
Первые исследования стронция
После открытия стронцианита ученые относили этот минерал к разным категориям. Одни считали, что он принадлежит к флюоритам, другие – к витеритам. Однако немного позднее ясность относительно этого вещества была внесена шотландским химиком Т. Хопом. Тогда еще не было известно, что исследуемое вещество может иметь период полураспада. Стронций был также объектом изучения химика А. Лавуазье, а также Гемфри Дэви. Существенный вклад в открытие этого вещества был также внесен русским ученым Товием Ловицем. Он, независимо от западных коллег, обнаружил присутствие этого металла в тяжелом шпате.
Немного теории. Что такое период полураспада?
Каждому известно, что сегодня радионуклидом принято называть радиоактивные изотопы. Что же такое период полураспада? Радионуклиды отличаются от других веществ тем, что их ядра являются нестабильными. Со временем они распадаются – происходит процесс радиоактивного распада. Во время этого процесса ядра превращаются в другие изотопы, и при этом происходит испускание радиоактивных лучей. Разные радионуклиды имеют разный уровень нестабильности. Существуют короткоживущие и долгоживущие изотопы. Короткоживущие распадаются очень быстро: на это уходят секунды, дни или месяцы. Для долгоживущих необходимы сотни, тысячи, а иногда и миллиарды лет. В каком бы количестве ни был взят изотоп, для того чтобы распалась половина его вещества, всегда требуется определенный промежуток времени – он и называется периодом полураспада.
Каков период полураспада стронция-90?
Как известно, радионуклиды и изотопы являются очень опасными для здоровья веществами. Что касается стронция, то его стабильные изотопы практически не представляют опасности для человека. Но радиоактивные изотопы способны к уничтожению всего живого. Причина, по которой одна из опасных форм стронция – стронций-90 – является опасной, – это его период полураспада. Стронций-90 распадается за 29 лет, и этот процесс всегда сопровождается выделением большого количества излучения. Этот элемент имеет способность быстро включаться в системы живых организмов и метаболизироваться.
Свойства стронция
На воздухе стронций очень быстро реагирует с водой, покрываясь желтой оксидной пленкой. В свободном виде этот элемент в природе не встречается. Его самые большие месторождения расположены в России, Аризоне, Калифорнии (США). Стронций является очень мягким металлом – его легко разрезать простым ножом. Но температура его плавления составляет 768 °С. Сплавы, в состав которых включен стронций, используются в пиротехнике. А также этот элемент применяют для восстановления урана.
Проникновение стронция в живые организмы
По своим химическим свойствам стронций очень похож на обычный кальций – этот элемент практически является его аналогом. Стронций-90 очень быстро откладывается в костных тканях, зубах, а также в жидкостях. При распаде этого элемента также образуется дочерний изотоп иттрий-90, который имеет очень короткий период полураспада. Стронций по этому параметру нельзя даже сравнивать с иттрием-90, который распадается всего лишь за 64 часа.
Иттрий-90 способен излучать бета-частицы. Он также очень быстро поражает костную ткань и особо чувствительный к нему костный мозг. Под действием мощного облучения в любом живом организме происходят серьезные физиологические изменения. Меняется клеточный состав, структура клеток также серьезно нарушается, что приводит к изменению в обмене веществ. Поэтому вопрос, какой период полураспада стронция-90, вовсе не праздный. В конечном счете этот элемент приводит к раку крови (лейкемии) и костей. А также он способен оказывать мощное влияние на структуру ДНК и генетику.
Скорость распространения в природе
Заражение стронцием-90 происходит в короткие сроки, так как он имеет очень короткий период полураспада. Стронций, образовавшийся после техногенных катастроф, передается по пищевым биологическим цепям, так как он заражает землю и воду. Изотоп также легко проникает в дыхательные пути животных и людей. Из земли стронций-90 быстро попадает в организм животных, растений, а затем и в организм людей, которые принимают зараженные продукты. Помимо этого изотоп способен не только поражать определенный организм, но и передавать уродства его потомкам. Стронций-90 также передается с молоком матери ребенку.
Этот изотоп принимает активное участие в обмене веществ у растений. В них вещество попадает из почвы через корни. Очень большое количество стронция накапливают такие виды растений, как бобовые, корнеплоды и клубнеплоды. В организме человека стронций накапливается главным образом в скелете. С возрастом количество отложенного стронция понижается. У мужчин изотоп накапливается больше, чем у женщин.
Самые опасные изотопы
Наряду с цезием-137 стронций-90 является одним из опаснейших и мощнейших радиоактивных загрязнителей, имеющих быстрый период полураспада. Стронций-90 очень часто попадает в окружающую среду в результате аварий на АЭС, а также ядерных испытаний. Ситуация осложняется тем, что наличие этого изотопа очень сложно определить даже в пробах почвы. В отличие от цезия, гамма-излучение которого выявляется очень легко, для определения содержания стронция-90 в почве требуется как минимум неделя.
Во время такого исследования пробу почвы или сельскохозяйственной продукции ученые сжигают особым образом, и только после этого можно говорить о том, есть ли в этом образце стронций. Этот метод абсолютно не подходит, когда нужно выявить количество изотопа, поглощенного человеческим организмом. Для такой диагностики белорусские ученые изобрели специальный шлем, регистрирующий бета-излучение.
Родственный стронцию-90 элемент
Самыми близкими по своим свойствам в данном отношении являются металлы цезий-137 и стронций-90. Период полураспада 30 лет имеет цезий-137. При радиационных катастрофах именно эти два элемента создают самое большое количество проблем. Считается, что в чудовищных последствиях аварии на ЧАЭС гамма-активный цезий виновен больше, чем стронций. Учитывая периоды полураспада этих веществ, можно сказать, что должно пройти не менее шестисот лет, прежде чем в чернобыльской зоне не останется этих изотопов.
Особенности полураспада изотопов
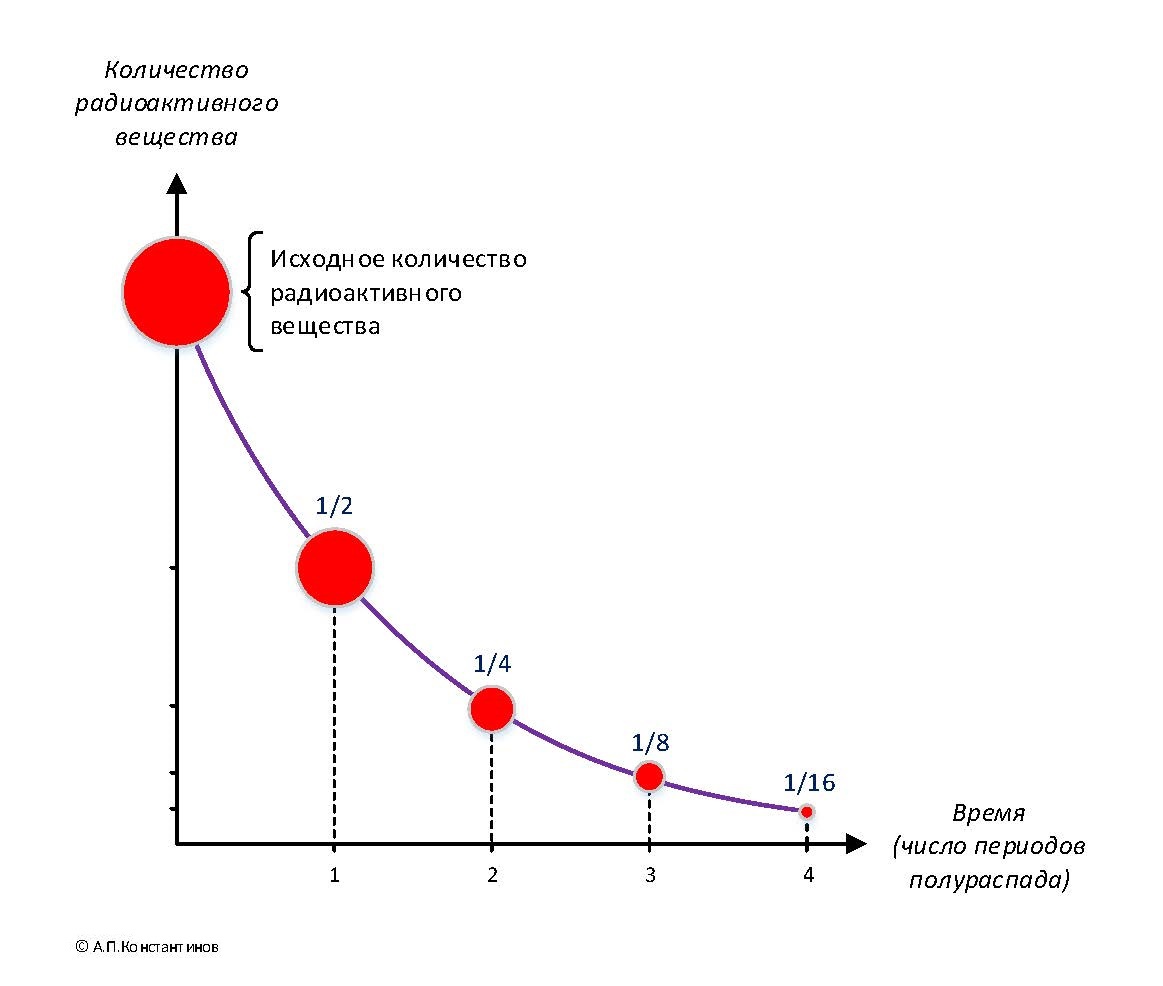
Для каждого вещества-изотопа строго определен период полураспада. Стронций-90 обладает периодом в 28 лет. Однако это не означает, что все его атомы исчезнут по прошествии 56 лет. Также не играет роли первоначальное количество изотопа. Во время распада некоторая часть стронция может меняться, превращаясь в более легкие элементы. Если период полураспада радиоактивного стронция равен 28 лет, то это означает следующее.
Через этот промежуток времени от первоначального количества изотопа останется половина. Еще по прошествии 28 лет – четверть и так далее. Получается, что стронций может загрязнить окружающую среду на десятки лет. Некоторые ученые округляют это число, обозначая, что период полураспада стронция – 29 лет. Через этот промежуток времени остается половина от вещества, но этого достаточно, чтобы стронций распространился далеко за пределы аварии.
Миф 02. Самый опасный радионуклид — стронций
Есть такой миф, будто самый опасный радионуклид — это стронций-90. Откуда взялась эта мрачная популярность? Ведь в работающем ядерном реакторе образуется 374 искусственных радионуклида, из них одного стронция — 10 разных изотопов. Нет, подавай нам стронций не абы какой, а именно стронций-90.
Возможно, в головах читателей мелькает смутная мысль о таинственном периоде полураспада, о долгоживущих и короткоживущих радионуклидах? Что же, попробуем разобраться. Кстати, не пугайтесь слова радионуклид. Сегодня этим термином принято называть радиоактивные изотопы. Именно так — радионуклид, а не исковерканный «радионуклеид» или даже «радионуклеотид». Со взрыва первой атомной бомбы прошло 70 лет, и многие термины обновились. Сегодня вместо «атомный котёл» мы говорим: «ядерный реактор», вместо «радиоактивные лучи» — «ионизирующие излучения», ну, а вместо «радиоактивный изотоп» — «радионуклид».
Но вернемся к стронцию. И в самом деле, всенародная любовь к стронцию-90 связана с его периодом полураспада. А кстати, что это такое: период полураспада? Дело в том, что радионуклиды тем и отличаются от стабильных изотопов, что их ядра неустойчивы, нестабильны. Рано или поздно они распадаются — это и называется радиоактивным распадом. При этом радионуклиды, превращаясь в другие изотопы, испускают эти самые ионизирующие излучения. Так вот, различные радионуклиды нестабильны в разной степени. Одни распадаются очень медленно, в течение сотен, тысяч, миллионов и даже миллиардов лет. Их называют долгоживущими радионуклидами. Например, все природные изотопы урана — долгоживущие. А есть короткоживущие радионуклиды, они распадаются быстро: в течение секунд, часов, суток, месяцев. Но радиоактивный распад всегда происходит по одному и тому же закону (рис. 2.1).
Рис. 2.1. Закон радиоактивного распада
Сколько бы мы ни взяли радионуклида (тонну или миллиграмм), половина этого количества всегда распадается за одинаковый (для данного радионуклида) промежуток времени. Его-то и называют «периодом полураспада» и обозначают: Т
Повторим: этот временной промежуток уникален и неизменен для каждого радионуклида. Можно делать что угодно с тем же стронцием-90: нагревать, охлаждать, сжимать под давлением, облучать лазером, — всё равно половина любой порции стронция распадётся за 29,1 лет, половина оставшегося количества — ещё в течение 29,1 лет и так далее. Считается, что через 20 периодов полураспада радионуклид исчезает полностью.
Чем быстрее распадается радионуклид, тем он более радиоактивен, ведь каждый распад сопровождается выбросом одной порции ионизирующего излучения в виде альфа- или бета-частицы, иногда «в сопровождении» гамма-излучения («чистого» гамма-распада в природе не существует). Но что значит «большая» или «маленькая» радиоактивность, в чём её измерить?
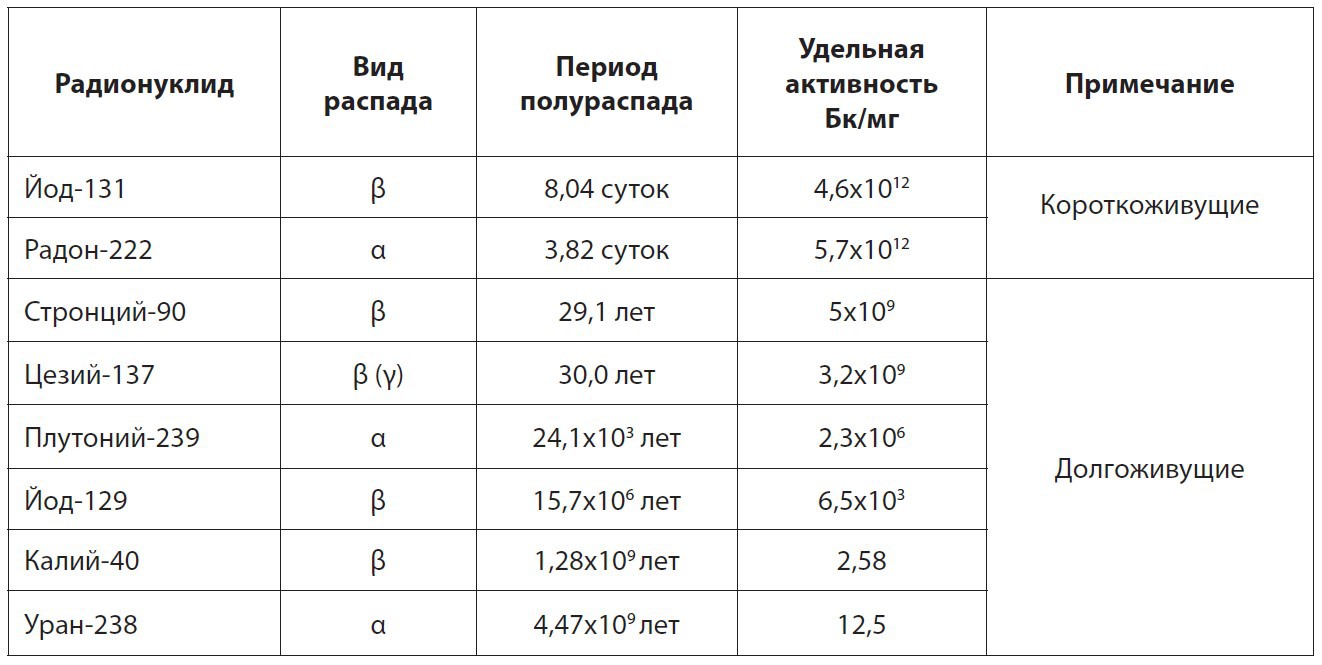
Для этой цели используют понятие активность. Активность позволяет оценить интенсивность радиоактивного распада в цифрах. Если в секунду происходит один распад, говорят: «Активность радионуклида равна одному беккерелю (1 Бк)». А раньше использовали намного более крупную единицу — кюри: 1 Ки = 37 миллиардов Бк. Конечно, сравнивать следует одинаковые количества разных радионуклидов, например 1 кг или 1 мг. Активность единицы массы радионуклида называют удельной активностью. Вот она-то, эта самая удельная активность, обратно пропорциональна периоду полураспада данного радионуклида (так, надо передохнуть). Давайте сравним эти характеристики для самых известных радионуклидов (таблица).
Так почему же всё-таки стронций-90? Вроде бы ничем особенным не выделяется — так, серединка на половинку. И как раз в этом всё дело! Сначала попробуем ответить на один (сразу предупреждаю) провокационный вопрос. Какие радионуклиды опаснее: короткоживущие или долгоживущие? Так, мнения разделились.
Таблица 2.1. Радиационные характеристики некоторых радионуклидов
С одной стороны, опаснее короткоживущие: они более активны. А с другой стороны, после быстрого распада «коротышей» проблема радиации исчезает. Кто постарше, помнит: сразу после чернобыльской аварии больше всего шума было вокруг радиоактивного йода. Короткоживущий йод-131 подорвал здоровье многих чернобыльцев. Зато сегодня с этим радионуклидом проблем нет. Уже через полгода после аварии выброшенный из реактора йод-131 распался, даже следа не осталось.
Теперь о долгоживущих изотопах. Их период полураспада может составлять миллионы и миллиарды лет. Такие нуклиды малоактивны. Поэтому в Чернобыле не было, нет и не будет проблем с радиоактивным загрязнением территорий ураном. Хотя по массе выброшенных из реактора химических элементов лидировал именно уран, причём с большим отрывом. Но кто же измеряет радиацию в тоннах? По активности, по беккерелям уран не представляет серьёзной опасности: слишком долгоживущий.
И вот теперь мы подошли к ответу на вопрос о стронции-90. У этого изотопа период полураспада равен 29 лет. Очень «противный» срок, ибо соизмерим с продолжительностью жизни человека. Стронций-90 достаточно долгоживущий, чтобы загрязнить территорию на десятки и сотни лет. Но не настолько долгоживущий, чтобы иметь низкую удельную активность. По значению периода полураспада к стронцию очень близок цезий-137 (30 лет). Вот почему при радиационных авариях именно эта «сладкая парочка» создаёт большую часть «долгоиграющих» проблем. Кстати, в негативных последствиях чернобыльской аварии гамма-активный (потерпите три странички) цезий виновен сильнее «чистого» бета-излучателя стронция.
А пройдет лет шестьсот, и в зоне чернобыльской аварии не останется ни цезия, ни стронция. И тогда на первое место выйдет… Вы уже догадались, верно? Плутоний! Но мы ещё далеки от понимания главной проблемы — опасности разных радионуклидов для здоровья. Ведь период полураспада, как и удельная активность, напрямую с такой опасностью не связан. Эти свойства характеризуют лишь сам радионуклид.
Возьмём, к примеру, одинаковые количества урана-238 и стронция-90: одинаковые по активности, а конкретно — по миллиарду беккерелей каждого. Для урана-238 — это около 80 кг, а для стронция-90 — всего 0,2 мг. Будет ли отличаться их опасность для здоровья? Как небо от земли! Рядом со слитком урана массой 80 кг можно спокойно стоять, можно посидеть на нём безо всякого вреда для здоровья, ведь почти все альфа-частицы, образующиеся в процессе распада урана, останутся внутри слитка. А вот такое же по активности и при этом ничтожно малое по массе количество стронция-90 чрезвычайно опасно. Если человек находится рядом без средств защиты, то за короткое время он получит как минимум радиационные ожоги глаз и кожи.
Знаете, на что похожа удельная активность? Тут напрашивается аналогия — скорострельность оружия. Помните, что вопрос об опасности долго- и короткоживущих радионуклидов — провокационный? Так оно и есть! Всё равно, что спросить: «Какое оружие опасней: которое делает сто выстрелов в минуту или один выстрел в час?». Здесь важнее другое: калибр оружия, чем оно стреляет и, самое главное, долетит ли пуля до цели, поразит ли её, и какие при этом будут повреждения?
Начнём с простого — с «калибра». Вы наверняка и раньше слышали об альфа-, бета- и гамма-излучениях. Именно эти виды излучений образуются при радиоактивных распадах (вернёмся к таблице 1). У таких излучений имеются как общие свойства, так и различия.
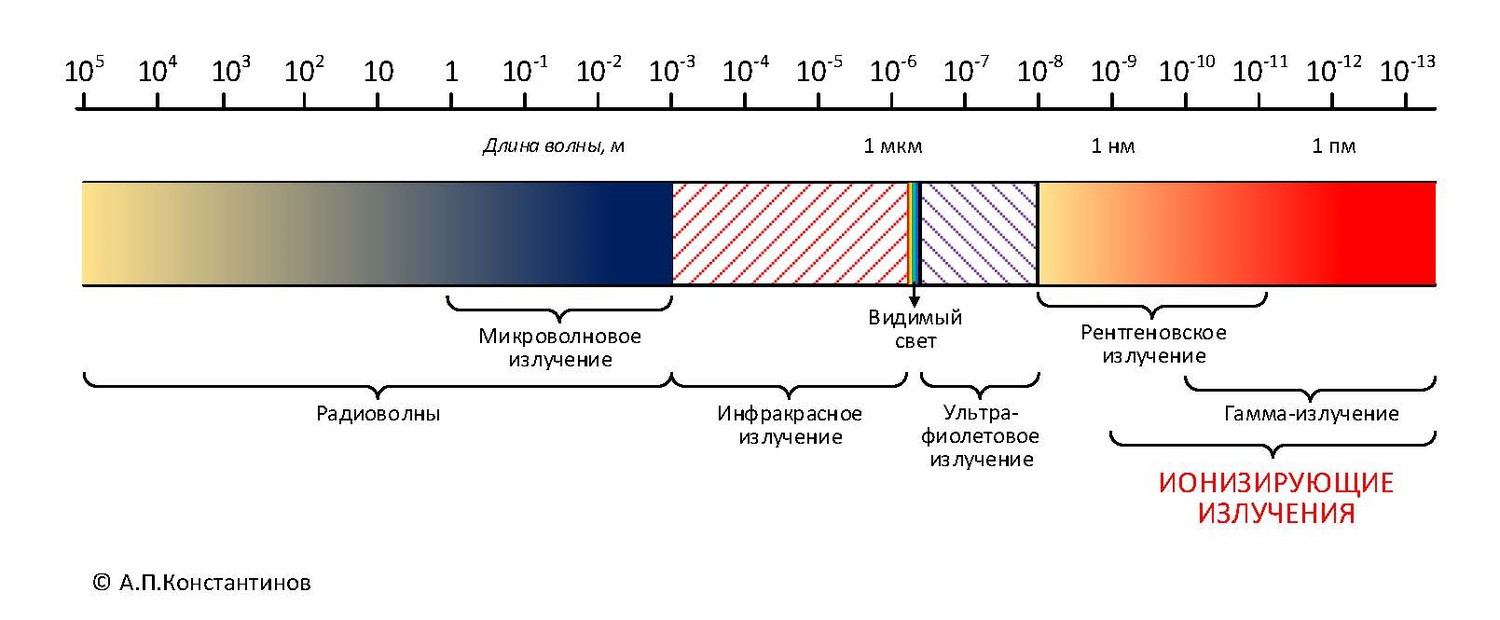
Общие свойства: все три вида излучений относят к ионизирующим. Что это значит? Энергия излучений чрезвычайно высока. Настолько, что при попадании в другой атом они выбивают с его орбиты электрон. Атом-мишень при этом превращается в положительно заряженный ион (вот почему излучения — ионизирующие). Именно высокая энергия отличает ионизирующие излучения от всех прочих излучений, например, от микроволнового или ультрафиолетового.
Чтобы стало совсем понятно, представим атом. При огромном увеличении он выглядит как маковое зерно (ядро атома), окружённое тончайшей сферической плёнкой типа мыльного пузыря диаметром несколько метров (электронная оболочка). И вот из нашего зёрнышка-ядра вылетает совсем крошечная пылинка, альфа- или бета-частица. Так выглядит радиоактивный распад. При испускании заряженной частицы заряд ядра изменяется, а значит, образуется новый химический элемент.
А наша пылинка мчится с огромной скоростью и врезается в электронную оболочку другого атома, выбивая из неё электрон. Атом-мишень, потеряв электрон, превращается в положительно заряженный ион. Но химический элемент остаётся прежним: ведь число протонов в ядре не изменилось. Такая ионизация — процесс химический: то же самое происходит с металлами при растворении в кислотах.
Вот по такой способности ионизировать атомы разные виды излучений и относят к радиоактивным. Ионизирующие излучения могут возникать не только в результате радиоактивного распада. Их источником может служить: реакция деления (атомный взрыв или ядерный реактор), реакция синтеза лёгких ядер (Солнце и другие звёзды, водородная бомба), ускорители заряженных частиц и рентгеновская трубка (сами по себе эти устройства не радиоактивны). Главное отличие радиации — высочайшая энергия ионизирующих излучений.
Различия же альфа-, бета- и гамма-излучений определяются их природой. В конце 19-го века, когда была открыта радиация, никто не знал, что это за «зверь». И вновь открываемые «радиоактивные лучи» просто обозначали первыми буквами греческого алфавита.
Сперва открыли альфа-лучи, испускаемые при распаде тяжёлых радионуклидов — урана, радия, тория, радона. Природу же альфа-частиц выяснили уже после их открытия. Оказалось, что это летящие с огромной скоростью ядра атомов гелия. То есть тяжёлые положительно заряженные «пакеты» из двух протонов и двух нейтронов. Эти «крупнокалиберные» частицы далеко пролететь не могут. Даже в воздухе они проходят не более нескольких сантиметров, а лист бумаги или, скажем, внешний омертвевший слой кожи (эпидермис) задерживает их полностью.
Бета-частицы при ближайшем рассмотрении оказались обычными электронами, но опять же летящими с огромной скоростью. Они значительно легче альфа-частиц, и электрический заряд у них поменьше. Такие «мелкокалиберные» частицы глубже проникают в разные материалы. В воздухе бета-частицы пролетают несколько метров, их способны задержать: тонкий лист металла, оконное стекло и обычная одежда. Внешнее облучение обычно приводит к ожогу хрусталика глаза или кожи, подобно солнечному ультрафиолету.
И, наконец, гамма-излучение. Оно имеет ту же природу, что и видимый свет, ультрафиолетовые, инфракрасные лучи или радиоволны. То есть гамма-лучи — это электромагнитное (фотонное) излучение, но с чрезвычайно высокой энергией фотонов. Или, другими словами, с очень короткой длиной волны (рис. 2.2).
Рис. 2.2. Шкала электромагнитных излучений
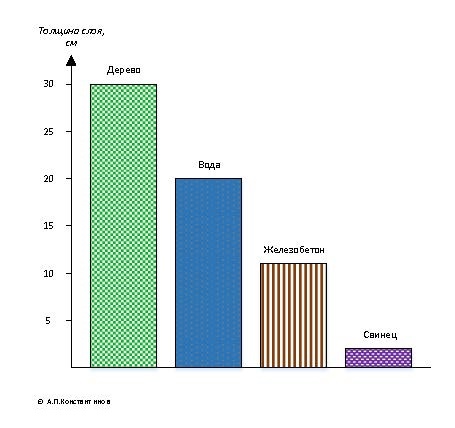
Гамма-излучение имеет очень высокую проникающую способность. Она зависит от плотности облучаемого материала и оценивается толщиной слоя половинного ослабления. Чем плотнее материал, тем лучше он задерживает гамма-лучи. Именно поэтому для защиты от гамма-излучения чаще используют бетон или свинец. В воздухе гамма-лучи могут пройти десятки, сотни и даже тысячи метров. Для других материалов толщина слоя половинного ослабления показана на рис. 2.3.
Рис. 2.3 — Значение слоёв половинного ослабления гамма-излучения
При воздействии гамма-излучения на человека могут быть повреждены и кожа, и внутренние органы. Если бета-излучение мы сравнили со стрельбой мелкокалиберными пулями, то гамма-излучение — это стрельба иголками. По природе и свойствам на гамма-излучение очень похоже излучение рентгеновское. Отличается происхождением: его получают искусственно в рентгеновской трубке.
Существуют и другие виды ионизирующих излучений. Например, при ядерной вспышке или работе ядерного реактора, кроме гамма-излучений, образуются потоки нейтронов. Космические лучи помимо этих же излучений несут протоны и много чего ещё.
Литература
1. Нормы радиационной безопасности НРБ–99/2009: санитарно-эпидемиологические правила и нормативы. — М.: Федеральный центр гигиены и эпидемиологии Роспотребнадзора, 2009. – 100 с.
| Стронций | |||
|---|---|---|---|
| ← Рубидий | Иттрий → | |||
|
|||
| Внешний вид простого вещества | |||
| Мягкий серебристо-белый металл | |||

|
|||
| Свойства атома | |||
| Название, символ, номер | Стронций / Strontium (Sr), 38 | ||
|
Атомная масса (молярная масса) |
87,62(1) а. е. м. (г/моль) | ||
| Электронная конфигурация | [Kr] 5s2 | ||
| Радиус атома | 215 пм | ||
| Химические свойства | |||
| Ковалентный радиус | 191 пм | ||
| Радиус иона | (+2e) 112 пм | ||
| Электроотрицательность | 0,95 (шкала Полинга) | ||
| Электродный потенциал | −2,89 | ||
| Степени окисления | 2 | ||
|
Энергия ионизации (первый электрон) |
549,0 (5,69) кДж/моль (эВ) | ||
| Термодинамические свойства простого вещества | |||
| Плотность (при н. у.) | 2,54 г/см³ | ||
| Температура плавления | 1042 K | ||
| Температура кипения | 1657 K | ||
| Уд. теплота плавления | 9,20 кДж/моль | ||
| Уд. теплота испарения | 144 кДж/моль | ||
| Молярная теплоёмкость | 26,79 Дж/(K·моль) | ||
| Молярный объём | 33,7 см³/моль | ||
| Кристаллическая решётка простого вещества | |||
| Структура решётки | кубическая гранецентрированая | ||
| Параметры решётки | 6,080 Å | ||
| Температура Дебая | 147 K | ||
| Прочие характеристики | |||
| Теплопроводность | (300 K) (35,4) Вт/(м·К) | ||
| Номер CAS | 7440-24-6 |
Стро́нций — химический элемент с атомным номером 38. Принадлежит к 2-й группе периодической таблицы химических элементов (по устаревшей короткой форме периодической системы принадлежит к главной подгруппе II группы, или к группе IIA), находится в пятом периоде таблицы. Атомная масса элемента 87,62(1) а. е. м.. Обозначается символом Sr (от лат. Strontium). Простое вещество стронций — мягкий, ковкий и пластичный щёлочноземельный металл серебристо-белого цвета. Обладает высокой химической активностью, на воздухе быстро реагирует с влагой и кислородом, покрываясь жёлтой оксидной плёнкой.
Содержание
- 1 История и происхождение названия
-
2 Нахождение в природе
- 2.1 Месторождения
- 3 Получение
- 4 Физические свойства
- 5 Химические свойства
-
6 Применение
- 6.1 Металлургия
- 6.2 Металлотермия
- 6.3 Магнитные материалы
- 6.4 Пиротехника
- 6.5 Ядерная энергетика
- 6.6 Высокотемпературная сверхпроводимость
- 6.7 Вакуумные электронные приборы
- 6.8 Химические источники тока
- 6.9 Медицина
-
7 Биологическая роль
- 7.1 Влияние на организм человека
-
8 Изотопы
- 8.1 Стронций-90
- 9 Примечания
- 10 Ссылки
История и происхождение названия
Новый элемент обнаружили в минерале стронцианите, найденном в 1764 году в свинцовом руднике близ шотландской деревни Стронти́ан (англ. Strontian, гэльск. Sròn an t-Sìthein), давшей впоследствии название новому элементу. Присутствие в этом минерале оксида нового металла было установлено в 1787 году Уильямом Крюйкшенком и Адером Кроуфордом. Выделен в чистом виде сэром Хемфри Дэви в 1808 году.
Нахождение в природе
В свободном виде стронций не встречается ввиду его высокой химической активности. Он входит в состав около 40 минералов. Из них наиболее важный — целестин SrSO4 (51,2 % Sr). Добывают также стронцианит SrCO3 (64,4 % Sr). Эти два минерала имеют промышленное значение. Чаще всего стронций присутствует как примесь в различных кальциевых минералах.
Среди прочих минералов стронция:
- SrAl3(AsO4)SO4(OH)6 — кеммлицит;
- Sr2Al(CO3)F5 — стенонит;
- SrAl2(CO3)2(OH)4·Н2О — стронциодрессерит;
- SrAl3(PO4)2(OH)5·Н2О — гойясит;
- Sr2Al(PO4)2OH — гудкенит;
- SrAl3(PO4)SO·4(OH)6 — сванбергит;
- Sr(AlSiO4)2 — слосонит;
- Sr(AlSi3O8)2·5Н2О — брюстерит;
- Sr5(AsO4)3F — ферморит;
- Sr2(B14O23)·8Н2О — стронциоджинорит;
- Sr2(B5O9)Cl·Н2О — стронциохильгардит;
- SrFe3(PO4)2(OH)5·Н2О — люсуньит;
- SrMn2(VO4)24Н2О — сантафеит;
- Sr5(PO4)3OH — беловит;
- SrV(Si2O7) — харадаит;
- SrB2Si2O8 — пековит.
По уровню физической распространённости в земной коре стронций занимает 23-е место — его массовая доля составляет 0,014 % (в литосфере — 0,045 %). Мольная доля металла в земной коре 0,0029 %.
Стронций содержится в морской воде (8 мг/л).
Месторождения
Известны месторождения в Калифорнии, Аризоне (США); Новой Гранаде; Турции, Иране, Китае, Мексике, Канаде, Малави.
В России обнаружены, но в настоящее время не разрабатываются месторождения стронциевых руд: Синие камни (Дагестан), Мазуевское (Пермский край), Табольское (Тульская область), а также месторождения в Бурятии, Иркутской области, Красноярском крае, Якутии и на Курильских островах.
Получение
Существуют три способа получения металлического стронция:
- термическое разложение некоторых соединений;
- электролиз;
- восстановление оксида или хлорида.
Основным промышленным способом получения металлического стронция является термическое восстановление его оксида алюминием. Далее полученный стронций очищается возгонкой.
Электролитическое получение стронция электролизом расплава смеси SrCl2 и NaCl не получило широкого распространения из-за малого выхода по току и загрязнения стронция примесями.
При термическом разложении гидрида или нитрида стронция образуется мелкодисперсный стронций, склонный к лёгкому воспламенению.
Физические свойства
Стронций — мягкий серебристо-белый металл, обладает ковкостью и пластичностью, легко режется ножом.
Полиморфен — известны три его модификации. До 215 °С устойчива кубическая гранецентрированная модификация (α-Sr), между 215 и 605 °С — гексагональная (β-Sr), выше 605 °С — кубическая объёмноцентрированная модификация (γ-Sr).
Температура плавления: 768 °С, температура кипения: 1390 °С.
Химические свойства
Стронций в своих соединениях всегда проявляет степень окисления +2. По свойствам стронций близок к кальцию и барию, занимая промежуточное положение между ними.
В электрохимическом ряду напряжений стронций находится среди наиболее активных металлов (его нормальный электродный потенциал равен −2,89 В). Энергично реагирует с водой, образуя гидроксид:
Взаимодействует с кислотами, вытесняет тяжёлые металлы из их солей. С концентрированными кислотами (H2SO4, HNO3) реагирует слабо.
Металлический стронций быстро окисляется на воздухе, образуя желтоватую плёнку, в которой, помимо оксида SrO, всегда присутствуют пероксид SrO2 и нитрид Sr3N2. При нагревании на воздухе загорается, порошкообразный стронций на воздухе склонен к самовоспламенению.
Энергично реагирует с неметаллами — серой, фосфором, галогенами. Взаимодействует с водородом (выше 200 °С), азотом (выше 400 °С). Практически не реагирует со щелочами.
При высоких температурах реагирует с CO2, образуя карбид:
Легкорастворимы соли стронция с анионами Cl−, I−, NO3−. Соли с анионами F−, SO42−, CO32−, PO43− малорастворимы.
Из-за высокой химической активности стронция его хранят в закрытой стеклянной посуде под слоем керосина.
Применение
Основные области применения стронция и его химических соединений — это радиоэлектронная промышленность, пиротехника, металлургия, пищевая промышленность.
Металлургия
Стронций применяется для легирования меди и некоторых её сплавов, для введения в аккумуляторные свинцовые сплавы, для десульфурации чугуна, меди и сталей.
Металлотермия
Стронций чистотой 99,99—99,999 % применяется для восстановления урана.
Магнитные материалы
Магнитотвёрдые ферриты стронция широко употребляются в качестве материалов для производства постоянных магнитов.
Пиротехника
В пиротехнике применяются карбонат, нитрат, перхлорат стронция для окрашивания пламени в карминово-красный цвет.
Сплав магний-стронций обладает сильнейшими пирофорными свойствами и находит применение в пиротехнике для зажигательных и сигнальных составов.
Ядерная энергетика
Уранат стронция играет важную роль при получении водорода (стронций-уранатный цикл, Лос-Аламос, США) термохимическим способом (атомно-водородная энергетика), и, в частности, разрабатываются способы непосредственного деления ядер урана в составе ураната стронция для получения тепла при разложении воды на водород и кислород.
Высокотемпературная сверхпроводимость
Оксид стронция применяется в качестве компонента сверхпроводящих керамик.
Вакуумные электронные приборы
Оксид стронция, в составе твёрдого раствора оксидов других щёлочноземельных металлов — бария и кальция (BaO, CaO), используется в качестве активного слоя катодов косвенного накала в вакуумных электронных приборах.
Сплавы стронция с оловом и свинцом применяются для отливки токоотводов аккумуляторных батарей. Сплавы стронций-кадмий — для анодов гальванических элементов.
Медицина
Изотоп с атомной массой 89, имеющий период полураспада 50,55 суток, применяется (в виде хлорида) в качестве противоопухолевого средства.
Биологическая роль
Влияние на организм человека
Не следует путать действие на организм человека природного стронция (не радиоактивного, малотоксичного и более того, широко используемого для лечения остеопороза) и радиоактивных изотопов стронция.
Стронций природный — составная часть микроорганизмов, растений и животных. Стронций является аналогом кальция, поэтому он наиболее эффективно откладывается в костной ткани. В мягких тканях задерживается менее 1 %. Стронций с большой скоростью накапливается в организме детей до четырёхлетнего возраста, когда идёт активное формирование костной ткани. Обмен стронция изменяется при некоторых заболеваниях органов пищеварения и сердечно-сосудистой системы.
Пути попадания:
- вода (предельно допустимая концентрация стронция в воде в РФ — 8 мг/л, а в США — 4 мг/л)
- пища (томаты, свёкла, укроп, петрушка, редька, редис, лук, капуста, ячмень, рожь, пшеница)
- интратрахеальное поступление
- через кожу (накожное)
- ингаляционное (через лёгкие)
- люди, работа которых связана со стронцием (в медицине радиоактивный стронций используют в качестве аппликаторов при лечении кожных и глазных болезней.
Основные области применения:
- природного стронция — радиоэлектронная промышленность, пиротехника, металлургия, металлотермия, пищевая промышленность, производство магнитных материалов;
- радиоактивного — производство атомных электрических батарей, атомно-водородная энергетика, радиоизотопные термоэлектрические генераторы и другое).
Влияние нерадиоактивного стронция проявляется крайне редко и только при воздействии других факторов (дефицит кальция и витамина D, неполноценное питание, нарушения соотношения микроэлементов таких, как барий, молибден, селен и другие). Тогда он может вызывать у детей «стронциевый рахит» и «уровскую болезнь» — поражение и деформацию суставов, задержку роста и другие нарушения.
Радиоактивный стронций практически всегда негативно воздействует на организм человека. Откладываясь в костях, он облучает костную ткань и костный мозг, что увеличивает риск заболевания злокачественными опухолями костей, а при поступлении большого количества может вызвать лучевую болезнь.
Изотопы
В природе стронций встречается в виде смеси четырёх стабильных изотопов 84Sr (0,56(2) %), 86Sr (9,86(20) %), 87Sr (7,00(20) %), 88Sr (82,58(35) %). Проценты указаны по числу атомов. Известны также радиоактивные изотопы стронция с массовым числом от 73 до 105. Лёгкие изотопы (до 85Sr включительно, а также изомер 87mSr) испытывают электронный захват, распадаясь в соответствующие изотопы рубидия. Тяжёлые изотопы, начиная с 89Sr, испытывают β−-распад, переходя в соответствующие изотопы иттрия. Наиболее долгоживущим и важным в практическом плане среди радиоактивных изотопов стронция является 90Sr.
Стронций-90
Изотоп стронция 90Sr является радиоактивным с периодом полураспада 28,78 года. 90Sr претерпевает β−-распад, переходя в радиоактивный 90Y (период полураспада 64 часа), который, в свою очередь, распадается в стабильный цирконий-90. Полный распад стронция-90, попавшего в окружающую среду, произойдёт лишь через несколько сотен лет.
90Sr образуется при ядерных взрывах и внутри ядерного реактора во время его работы. Образование стронция-90 при этом происходит как непосредственно в результате деления ядер урана и плутония, так и в результате бета-распада короткоживущих ядер с массовым числом A = 90 (в цепочке 90Se → 90Br → 90Kr → 90Rb → 90Sr), образующихся при делении.
Применяется в производстве радиоизотопных источников энергии в виде титаната стронция (плотность 4,8 г/см³, а энерговыделение — около 0,54 Вт/см³).
- Стронций на Webelements
- Стронций в Популярной библиотеке химических элементов