Химическая кинетика
| Напечатано:: | Гость |
| Дата: | среда, 24 мая 2023, 20:01 |
Описание
Законы химической термодинамики позволяют определить направление и предел протекания возможного при данных условиях химического процесса, а также его энергетический эффект. Однако термодинамика не может ответить на вопросы о том, как осуществляется данный процесс и с какой скоростью. Эти вопросы – механизм и скорость химической реакции – и являются предметом химической кинетики.
Оглавление
- 1. Скорость химической реакции
- 1.1. Кинетическое уравнение химической реакции. Порядок реакции
- 1.2. Реакции нулевого порядка
- 1.3. Реакции первого порядка
- 1.4. Реакции второго порядка
- 1.5. Методы определения порядка реакции
1. Скорость химической реакции
Дадим определение основному понятию химической кинетики – скорости химической реакции:
Скорость химической реакции есть число элементарных актов химической реакции, происходящих в единицу времени в единице объема (для гомогенных реакций) или на единице поверхности (для гетерогенных реакций).
Скорость химической реакции есть изменение концентрации реагирующих веществ в единицу времени.
Первое определение является наиболее строгим; из него следует, что скорость химической реакции можно также выражать как изменение во времени любого параметра состояния системы, зависящего от числа частиц какого-либо реагирующего вещества, отнесенное к единице объема или поверхности – электропроводности, оптической плотности, диэлектрической проницаемости и т.д. и т.п. Однако наиболее часто в химии рассматривается зависимость концентрации реагентов от времени. В случае односторонних (необратимых) химических реакций (здесь и далее рассматриваются только односторонние реакции) очевидно, что концентрации исходных веществ во времени постоянно уменьшаются (ΔСисх < 0), а концентрации продуктов реакции увеличиваются (ΔСпрод > 0). Скорость реакции считается положительной, поэтому математически определение средней скорости реакции в интервале времени Δt записывается следующим образом:
(II.1)
В различных интервалах времени средняя скорость химической реакции имеет разные значения; истинная (мгновенная) скорость реакции определяется как производная от концентрации по времени:
(II.2)
Графическое изображение зависимости концентрации реагентов от времени есть кинетическая кривая (рисунок 2.1).
Рис. 2.1 Кинетические кривые для исходных веществ (А) и продуктов реакции (В).
Истинную скорость реакции можно определить графически, проведя касательную к кинетической кривой (рис. 2.2); истинная скорость реакции в данный момент времени равна по абсолютной величине тангенсу угла наклона касательной:
Рис. 2.2 Графическое определение Vист.
(II.3)
Необходимо отметить, что в том случае, если стехиометрические коэффициенты в уравнении химической реакции неодинаковы, величина скорости реакции будет зависеть от того, изменение концентрации какого реагента определялось. Очевидно, что в реакции
2Н2 + О2 → 2Н2О
концентрации водорода, кислорода и воды изменяются в различной степени:
ΔС(Н2) = ΔС(Н2О) = 2 ΔС(О2).
Скорость химической реакции зависит от множества факторов: природы реагирующих веществ, их концентрации, температуры, природы растворителя и т.д.
Одной из задач, стоящих перед химической кинетикой, является определение состава реакционной смеси (т.е. концентраций всех реагентов) в любой момент времени, для чего необходимо знать зависимость скорости реакции от концентраций. В общем случае, чем больше концентрации реагирующих веществ, тем больше скорость химической реакции. В основе химической кинетики лежит т. н. основной постулат химической кинетики:
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в некоторых степенях.
Т. е. для реакции
аА + bВ + dD + … → еЕ + …
можно записать
(II.4)
Коэффициент пропорциональности k есть константа скорости химической реакции. Константа скорости численно равна скорости реакции при концентрациях всех реагирующих веществ, равных 1 моль/л.
Зависимость скорости реакции от концентраций реагирующих веществ определяется экспериментально и называется кинетическим уравнением химической реакции. Очевидно, что для того, чтобы записать кинетическое уравнение, необходимо экспериментально определить величину константы скорости и показателей степени при концентрациях реагирующих веществ. Показатель степени при концентрации каждого из реагирующих веществ в кинетическом уравнении химической реакции (в уравнении (II.4) соответственно x, y и z) есть частный порядок реакции по данному компоненту. Сумма показателей степени в кинетическом уравнении химической реакции (x + y + z) представляет собой общий порядок реакции. Следует подчеркнуть, что порядок реакции определяется только из экспериментальных данных и не связан со стехиометрическими коэффициентами при реагентах в уравнении реакции. Стехиометрическое уравнение реакции представляет собой уравнение материального баланса и никоим образом не может определять характера протекания этой реакции во времени.
В химической кинетике принято классифицировать реакции по величине общего порядка реакции. Рассмотрим зависимость концентрации реагирующих веществ от времени для необратимых (односторонних) реакций нулевого, первого и второго порядков.
1.1. Кинетическое уравнение химической реакции. Порядок реакции
Одной из задач, стоящих перед химической кинетикой, является определение состава реакционной смеси (т.е. концентраций всех реагентов) в любой момент времени, для чего необходимо знать зависимость скорости реакции от концентраций. В общем случае, чем больше концентрации реагирующих веществ, тем больше скорость химической реакции. В основе химической кинетики лежит т. н. основной постулат химической кинетики:
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в некоторых степенях.
Т. е. для реакции
аА + bВ + dD + … → еЕ + …
можно записать
(II.4)
Коэффициент пропорциональности k есть константа скорости химической реакции. Константа скорости численно равна скорости реакции при концентрациях всех реагирующих веществ, равных 1 моль/л.
Зависимость скорости реакции от концентраций реагирующих веществ определяется экспериментально и называется кинетическим уравнением химической реакции. Очевидно, что для того, чтобы записать кинетическое уравнение, необходимо экспериментально определить величину константы скорости и показателей степени при концентрациях реагирующих веществ. Показатель степени при концентрации каждого из реагирующих веществ в кинетическом уравнении химической реакции (в уравнении (II.4) соответственно x, y и z) есть частный порядок реакции по данному компоненту. Сумма показателей степени в кинетическом уравнении химической реакции (x + y + z) представляет собой общий порядок реакции. Следует подчеркнуть, что порядок реакции определяется только из экспериментальных данных и не связан со стехиометрическими коэффициентами при реагентах в уравнении реакции. Стехиометрическое уравнение реакции представляет собой уравнение материального баланса и никоим образом не может определять характера протекания этой реакции во времени.
В химической кинетике принято классифицировать реакции по величине общего порядка реакции. Рассмотрим зависимость концентрации реагирующих веществ от времени для необратимых (односторонних) реакций нулевого, первого и второго порядков.
1.2. Реакции нулевого порядка
Для реакций нулевого порядка кинетическое уравнение имеет следующий вид:
(II.5)
Скорость реакции нулевого порядка постоянна во времени и не зависит от концентраций реагирующих веществ; это характерно для многих гетерогенных (идущих на поверхности раздела фаз) реакций в том случае, когда скорость диффузии реагентов к поверхности меньше скорости их химического превращения.
1.3. Реакции первого порядка
Рассмотрим зависимость от времени концентрации исходного вещества А для случая реакции первого порядка А → В. Реакции первого порядка характеризуются кинетическим уравнением вида (II.6). Подставим в него выражение (II.2):
(II.6)
(II.7)
После интегрирования выражения (II.7) получаем:
(II.8)
Константу интегрирования g определим из начальных условий: в момент времени t = 0 концентрация С равна начальной концентрации Со. Отсюда следует, что g = ln Со. Получаем:
(II.9)
Рис. 2.3 Зависимость логарифма концентрации от времени для реакций первого порядка.
Т.о., логарифм концентрации для реакции первого порядка линейно зависит от времени (рис. 2.3) и константа скорости численно равна тангенсу угла наклона прямой к оси времени.
(II.10)
Из уравнения (II.9) легко получить выражение для константы скорости односторонней реакции первого порядка:
(II.11)
Еще одной кинетической характеристикой реакции является период полупревращения t1/2 – время, за которое концентрация исходного вещества уменьшается вдвое по сравнению с исходной. Выразим t1/2 для реакции первого порядка, учитывая, что С = ½Со:
(II.12)
Отсюда
(II.13)
Как видно из полученного выражения, период полупревращения реакции первого порядка не зависит от начальной концентрации исходного вещества.
1.4. Реакции второго порядка
Для реакций второго порядка кинетическое уравнение имеет следующий вид:
(II.14)
либо
(II.15)
Рассмотрим простейший случай, когда кинетическое уравнение имеет вид (II.14) или, что то же самое, в уравнении вида (II.15) концентрации исходных веществ одинаковы; уравнение (II.14) в этом случае можно переписать следующим образом:
(II.16)
После разделения переменных и интегрирования получаем:
(II.17)
Постоянную интегрирования g, как и в предыдущем случае, определим из начальных условий. Получим:
(II.18)
Таким образом, для реакций второго порядка, имеющих кинетическое уравнение вида (II.14), характерна линейная зависимость обратной концентрации от времени (рис. 2.4) и константа скорости равна тангенсу угла наклона прямой к оси времени:
(II.19)
(II.20)
Рис. 2.4 Зависимость обратной концентрации от времени для реакций второго порядка.
Если начальные концентрации реагирующих веществ Cо,А и Cо,В различны, то константу скорости реакции находят интегрированием уравнения (II.21), в котором CА и CВ – концентрации реагирующих веществ в момент времени t от начала реакции:
(II.21)
В этом случае для константы скорости получаем выражение
(II.22)
Порядок химической реакции есть формально-кинетическое понятие, физический смысл которого для элементарных (одностадийных) реакций заключается в следующем: порядок реакции равен числу одновременно изменяющихся концентраций. В случае элементарных реакций порядок реакции может быть равен сумме коэффициентов в стехиометрическом уравнении реакции; однако в общем случае порядок реакции определяется только из экспериментальных данных и зависит от условий проведения реакции. Рассмотрим в качестве примера элементарную реакцию гидролиза этилового эфира уксусной кислоты (этилацетата), кинетика которой изучается в лабораторном практикуме по физической химии:
СН3СООС2Н5 + Н2О → СН3СООН + С2Н5ОН
Если проводить эту реакцию при близких концентрациях этилацетата и воды, то общий порядок реакции равен двум и кинетическое уравнение имеет следующий вид:
(II.23)
При проведении этой же реакции в условиях большого избытка одного из реагентов (воды или этилацетата) концентрация вещества, находящегося в избытке, практически не изменяется и может быть включена в константу скорости; кинетическое уравнение для двух возможных случаев принимает следующий вид:
1) Избыток воды:
(II.24)
(II.25)
2) Избыток этилацетата:
(II.26)
(II.27)
В этих случаях мы имеем дело с так назывемой реакцией псевдопервого порядка. Проведение реакции при большом избытке одного из исходных веществ используется для определения частных порядков реакции.
1.5. Методы определения порядка реакции
Проведение реакции в условиях, когда концентрация одного из реагентов много меньше концентрации другого (других) и скорость реакции зависит от концентрации только этого реагента, используется для определения частных порядков реакции – это т.н. метод избыточных концентраций или метод изолирования Оствальда. Порядок реакции по данному веществу определяется одним из перечисленных ниже методов.
Графический метод заключается в построении графика зависимости концентрации реагента от времени в различных координатах. Для различных частных порядков эти зависимости имеют следующий вид:
|
Порядок реакции |
Зависимость концентрации от времени |
|
1 |
|
|
2 |
|
|
3 |
|
Если построить графики этих зависимостей на основании опытных данных, то лишь одна из них будет являться прямой линией. Если, например, график, построенный по опытным данным, оказался прямолинейным к координатах lnC = f(t), то частный порядок реакции по данному веществу равен единице.
Метод подбора кинетического уравнения заключается в подстановке экспериментальных данных изучения зависимости концентрации вещества от времени в кинетические уравнения различных порядков. Подставляя в приведённые в таблице уравнения значения концентрации реагента в разные моменты времени, вычисляют значения константы скорости. Частный порядок реакции по данному веществу равен порядку того кинетического уравнения, для которого величина константы скорости остаётся постоянной во времени.
|
Порядок реакции |
Выражение для константы скорости |
|
1 |
|
|
2 |
|
|
3 |
|
Метод определения времени полупревращения заключается в определении t1/2 для нескольких начальных концентраций. Как видно из приведённых в таблице уравнений, для реакции первого порядка время полупревращения не зависит от Co, для реакции второго порядка – обратно пропорционально Co, и для реакции третьего порядка – обратно пропорционально квадрату начальной концентрации.
|
Порядок реакции |
Выражение для периода полупревращения |
|
1 |
|
|
2 |
|
|
3 |
|
По характеру зависимости t1/2 от Co нетрудно сделать вывод о порядке реакции по данному веществу. Данный метод, в отличие от описанных выше, применим и для определения дробных порядков.
Для определения
порядка реакции в целом необходимо
определить частные порядки по каждому
веществу, вступающему в реакцию, а затем
суммировать их. Для определения порядка
по данному веществу необходимо создать
условия, при которых будет изменяться
концентрация только этого вещества.
Укажем некоторые
из таких условий:
-
В реакции принимает
участие одно исходное вещество. -
Скорость реакции
зависит от концентрации одного реагента
и катализатора, а концентрация
катализатора постоянна по ходу реакции. -
Все реагенты,
кроме одного, берутся в большом избытке,
в результате чего их концентрации мало
меняются по ходу реакции и могут
рассматриваться как постоянные. -
Концентрация всех
реагентов, кроме одного, поддерживается
постоянной каким-либо искусственным
путем. Например, проводя реакции с
участием иона ОН—
как реагента, можно обеспечить присутствие
буфера для поддержания концентрации
ОН—.
При определении
порядка реакции используется основное
свойство кинетического уравнения
,
согласно которому константа скорости
и порядок реакции по ее компонентам
остаются постоянными в течение всей
реакции, а так же при изменении начальных
концентраций реагентов.
-
Метод подстановки
По ходу реакции
определяют текущие концентрации
исходного вещества в различные моменты
времени от начала реакции.
Предполагают, что
реакция первого порядка. По уравнению
для константы скорости первого порядка
(раздел 3.2.2, с. 78) рассчитывают все
возможные значения К. Если значения К
постоянны (в пределах ошибки опыта), то
реакция имеет первый порядок. Если же
не постоянны значения К, или закономерно
убывают или возрастают, то реакция не
первого порядка.
Аналогично проверяют на второй порядок.
Если реакция не первого и не второго
порядка, то для определения порядка
используют другие методы.
-
Графический
метод
Этот метод основан
на том, что кинетическая кривая может
иметь линейный вид (x)
= f(t),
где вид (x)
соответствует конкретному порядку
реакции:
для первого порядка
ln
C
= f
(t),
для второго порядка
1/С = f
(t),
для третьего
порядка
1/С2
= f
(t),
для нулевого
порядка Спродукта
= f
(t).
Поочередно строя
такие зависимости, смотрят, в каких
координатах получается прямая линия.
Этот метод и метод
подстановки взаимосвязаны, и нет смысла
его использовать, если метод подстановки
не выявил порядок реакции.
-
Метод начальных
скоростей
Скорость расходования
вещества в начальный момент времени
определяется по уравнению:
.
Для понижения
порядка проводят ряд опытов, в которых
берется вещество А
с различной начальной концентрацией,
,
а начальная концентрацияB
во всех опытах берется одинаковой. Тогда
,
где
,
.
(3.8)
Получилось уравнение
прямой в координатах ()
с тангенсом угла наклона, равным порядку
реакции,n.
Для определения начальных скоростей
получают начальные участки кинетических
кривых, поскольку лишь в начале реакции
сохраняется постоянство концентрации
вещества В.
Порядок реакции
можно приблизительно определить по
значениям двух начальных скоростей
(),
которые соответствуют двум начальным
концентрациям реагента (),
используя соотношение (3.8):
Вычитая второе
уравнение из первого, получаем
откуда
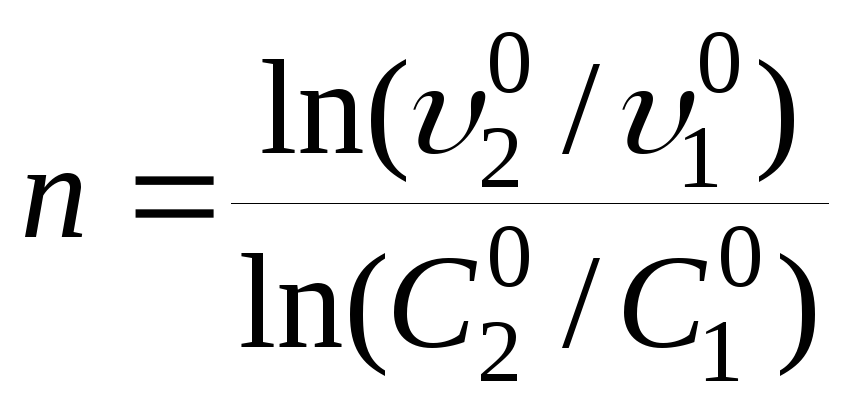
Для приближенного
расчета скоростей можно использовать
соотношение:
,
где
— изменение концентрации реагента за
промежуток времени.
-
Метод избытка
(метод Вант — Гоффа)
Это метод определения
порядка по изменяющейся во времени
скорости реакции от концентрации
реагента. Реакцию проводят при большом
избытке всех реагентов, кроме одного,
например А.
Тогда
В процессе реакции
расходуется реагент и уменьшается
скорость реакции. Скорости реакции
находят из полной кинетической кривой,
проводя графическое дифференцирование,
определяя тангенсы углов наклона
касательных к кинетической кривой
(рисунок 3.9).
Рисунок 3.9
– Графическое дифференцирование
кинетической кривой
Рисунок 3.10 –
Определение порядка реакции
По найденным
значениям u
строят график в координатах (),
согласно уравнению (3.8), и находят порядок,n
(рисунок 3.10).
Метод нахождения
общего порядка реакции
Для нахождения
общего порядка реакции необходимо взять
реагенты в стехиометрическом соотношении.
Если стехиометрическое уравнение
реакции:
аА + вВ
→ продукты
то при СА
: СВ
= а : в,
.
Тогда кинетическое
уравнение примет вид:
.
Далее логарифмирование
приведет к линейной зависимости
от
и определению (n
+ m)
как тангенс угла наклона (аналогично
нахождению в методах 3 и 4).
-
Метод по доле
непревращенного вещества к моменту
времени t
Если
— доля исходного вещества, не вступившего
в химическую реакцию к моменту времениt,
то
.
Подставляя выражение дляС
в уравнение
получаем:
Интегрирование в
пределах (а = 1; а) и (t
= 0; t)
приводит к уравнению:
.
(3.9)
Уравнение сложно
для расчета «n»,
поэтому его применяют в двух частных
случаях:
а) проводят ряд
опытов, в которых взяты разные начальные
концентрации, но во всех опытах реакция
доведена до одинаковой доли а.
В таких условиях левая часть уравнения
(3.9) постоянна, обозначим ее В:
Полученное уравнение
прямой в координатах (lnt;
lnC0)
позволяет графически найти «n»,
поскольку
.
Если проведено
два опыта с одинаковым значением а,
то, записав уравнение 3.10 для обоих опытов
и вычитая одно из другого, получаем
уравнение для n:
—
б) Можно определить
порядок, располагая одной полной
кинетической кривой. Выбирают на кривой
два значения а,
связанные между собой соотношением:
и отвечающие этим значениямt2
и t1.
При этом скобка в
левой части уравнения (3.9) для а2
будет иметь вид:
.
Записав уравнение
(3.9) для второго опыта и для первого и
поделив уравнения одно на другое
получаем, сократив общие множители:
,
,
.
После логарифмирования
получаем:
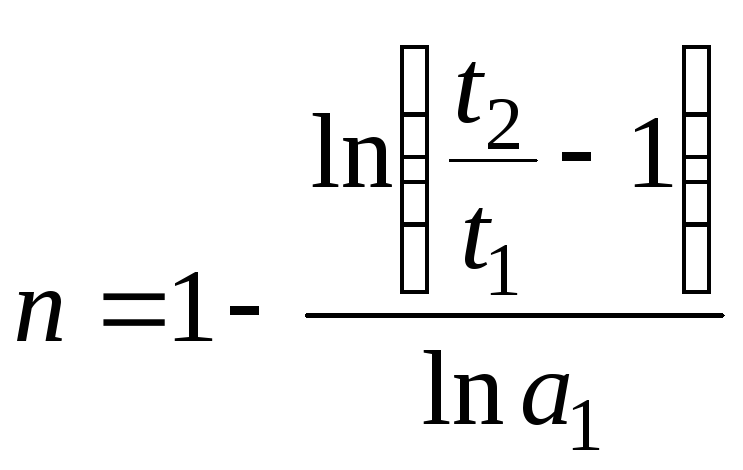
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Порядок реакции: понятие, виды
В химической кинетике одной из важных задач является нахождение порядка реакции.
Хоть эта величина и формальная, но позволяет наилучшим образом отразить экспериментальную зависимость скорости какой-либо реакции от концентрации.
Как правило, для нахождения скорости реакции используют концентрации исходных соединений, взятых в степенях, соответствующих их стехиометрическим коэффициентам. Но это справедливо лишь для очень простых реакций.
Порядком химической реакции по веществу является значение степени n, в которой концентрация этого соединения входит в формулу для нахождения скорости реакции, полученную опытным путем.
А вот общий порядок составляет сумму всех порядков по веществам: n = n1 + n2. Значения n1 и n2 соответствуют стехиометрическим коэффициентам в уравнениях одностадийных реакций.
Фактически, они могут иметь положительные или отрицательные значения, быть целыми или дробными числами.
Например, для уравнения взаимодействия H2+ Ι2 ― > 2HΙ, которому соответствует формула для определения скорости v=kCHCI, порядки по веществам равны nH=1 и nI=1, общий порядок реакции n=nH+nI=1+1=2.
Нулевой порядок
Некоторые реакции имеют нулевой порядок реакции. Как правило, на них не влияют концентрации исходных соединений. Происходит это в следующих случаях:
- если какое-либо исходное вещество взято в существенном избытке;
- если скорость регулируется энергией активации молекул, участвующих в реакции, например, в фотосинтезе.
В качестве примера рассмотрим реакцию взаимодействия этилуксусного эфира с водой, т.е. его омыления.
СΗ3СООС2Η5 + Η2О ―> СΗ3СООΗ + С2Η5ОΗ
Поскольку взаимная растворимость исходных веществ крайне мала, то основная их масса находится в разных фазах. При расходовании эфира в химической реакции из эфирного слоя своевременно поступает новая его порция, то есть концентрация его в растворе не уменьшается.
Реакции первого порядка
Такое взаимодействие веществ можно условно записать уравнением: А―>В. Примером может послужить разложение диметилового эфира:
СΗ3ОСΗ3―>СΗ4+Η2+СО
Для которого скорость реакции определяется как v=kCС2Н6О. В данном случае порядок по веществу и общий порядок совпадают и равны единице.
Практическое значение для реакций первого порядка имеет время (τ) определения некой заданной концентрации С, если известна начальная концентрация Со, а также период полураспада τ1/2, это время, в течение которого успевает прореагировать половина исходного вещества.
Реакции второго порядка
К таким взаимодействиям можно отнести реакции типа А + В ―> продукты. Примером может послужить уже приводимая выше реакция получения йодоводорода или щелочное омыление этилацетата:
СΗ3СООС2H5 + ОΗ- ―> СН3СОО- + С2H5ОΗ, v=kCС4Н8О2СОН-.
Также (к) второй порядок имеют отдельные реакции разложения типа: 2А ―> продукты. В качестве примеров можно привести следующие:
- 2NOCl ―> 2NO + Cl2, v=kC2NOCl.
- 2О3 ―> 3O2, v=kC2О3.
- 2NO2 ―> 2NO + O2, v=kC2NO2.
Последующие реакции
Реакции третьего и последующего порядков встречаются реже, чем предыдущие варианты. Это объясняется низкой вероятностью одновременной встречи в пространстве трех и более частиц. Тем не менее, примером таких взаимодействий может послужить образование диоксидов азота и углерода из их монооксидов:
- 2NΟ+Ο2→ 2NΟ2, v=kC2NOСО2.
- 2СО+О2→ 2СО2, v=kC2СОСО2.
Для таких реакций также существует своя зависимость концентраций реагентов от времени ее протекания. Формулы для нахождения периода полупревращения и констант скоростей реакций унифицированы за счет введения индекса n, равного порядку этих самых реакций.
Молекулярность реакции
Не нужно путать порядок реакции с ее молекулярностью, которая определяется именно числом молекул, которые совершают акт химического превращения.
В отличие от порядка, который определяется экспериментально, молекулярность химической реакции имеет теоретическую основу.
Для ее определения нужно понимать суть процесса, как именно взаимодействуют молекулы между собой, через какие стадии превращения они проходят.
Сравнительная характеристика
| Порядок | Молекулярность |
| Формальная величина | Есть физический смысл, показывает число реагирующих молекул |
| Может принимать различные числовые значения | Принимает только одно из трех значений: 1,2,3 |
| Применяется к реакциям любой сложности и многостадийности | Применяется только к элементарным одностадийным реакциям |
Существует несколько причин, по которым не совпадает для одной и той же реакции порядок и молекулярность:
- если один из реагентов взят в большом избытке, о чем уже говорилось выше;
- для многих гетерогенных реакций порядок может изменяться в ходе их осуществления, особенно если при этом меняются условия их протекания;
- каталитические реакции имеют многостадийный механизм, суть которого не всегда отражается стехиометрическим уравнением;
- в сложных многостадийных реакциях на суммарное значение скорости может повлиять только одна из промежуточных, которая в результате и будет определять порядок всего превращения.
К мономолекулярным относят реакции распада молекул:
I2 ―> 2I
В бимолекулярных реакциях сталкиваются две молекулы. Причем это могут быть молекулы как разных веществ, так и одного и того же:
H2+ Ι2 ―> 2HΙ
Тримолекулярными называют такие реакции, для осуществления которых нужны три молекулы исходных веществ:
2NΟ + H2 ―> N2Ο + H2О
H2 + О2 ―> 2H2О
определить [Первый ,второй,Нуль] Порядок реакции, Примеры
Много раз вопрос возникают или могут быть заданы преподавателем или в каком-то экзамене- Как определить порядок реакции, Первый, второй, Нулевой порядок реакции & Примеры. Давайте обсудим каждый член один на один.
Это определяется как число молекул концентрация которых (изменения) определяет Скорость реакции. Другими словами, это сумма степеней концентрации реагентов в уравнении скорости (закон ставка).
Как определить порядок реакции?
Рассмотрим реакцию,
Как определяется законом ставки. Rate = K [НЕТ]2 [O2]1
- Поэтому порядок реакции по отношению к NO является 2.
- порядок реакции по отношению к O 2 является 1.
- Общий порядок реакции 2 + 1 знак равно 3.
Первый порядок реакции
Реакции которых скорость определяется изменением концентрации одного термина только известно как реакции первого порядка.
Рассмотрим общую реакцию первого порядка
Скорость такой реакции в любой момент времени будет, таким образом, определяется выражением
Где CA является концентрация реагента А в момент, когда скорость реакции определяется а К константа скорости, специфическая константа скорости или постоянная скорость.
Примеры
Так как медленный (лимитирующий) шаг включает в себя только одну молекулу, реакция заказа 1 и не 2, хотя реакция обычно записывается в виде
- где а = Начальная концентрация вещества
- х = количество вещества разлагаются в момент времени Т
- таким образом (a – Икс) = Сумма осталось в момент времени т.
Экспоненциальная форма выражения для реакции первого порядка является
[ a – Икс ]знак равно[a]е-кт
Характеристики реакции первого порядка
- Скорость реакции. Скорость реакции прямо пропорциональна концентрации реагирующего вещества.
- константа скорости первого порядка. Это является характерной константой конкретной реакции при заданной температуре. Это не зависит от начальной концентрации реагентов, время реакции и Степень реакции. Его единица времени-1, т.е.
. Если T выражается в секундах, К выражается в секундах-1, Если T выражается в минутах, К выражается в минутах-1. Значение K не изменяется с единицей концентрации, так как /(a – Икс) будет такой же, какова бы ни была единица концентрации.
- Участок журнала а /(а-х) в зависимости от времени линейно, проходящее через происхождение с наклоном = – K / 2,303
- Период полураспада (Время полураспада, T1/2). Полураспада реакции является время, необходимое для преобразования исходной концентрации реагента до половины.
Для реакции первого порядка, в перерыве т.е.
, в T1/2, х становится / 2. Следовательно, ввод т = T1/2 и А = а / 2 в уравнении. (я) мы получаем
Следует отметить, что период полураспада первого порядка реакции постоянна и не зависит от исходной концентрации реагента.
Второй порядок реакции
Реакции которых скорость определяется изменением концентрации двух слагаемых.
Например, для общей реакции
Характеристики Реакции второго порядка
(я) Скорость реакции прямо пропорциональна квадрату концентрации реагирующего вещества.
(б) Единица постоянной скорости второго порядка является л моль-1 время-1. Величина К зависит от единицы, в которой концентрация реагента(s) выражается.
(III) Полураспада реакции второго порядка обратно пропорциональна первоначальной концентрации реагентов т.е., T1/2α1 / а (сравни. Период полураспада первого порядка реакции обратно пропорциональна К и зависит от а).
(IV) Когда график строится между т и 1/(a – Икс), прямая линия получается; наклон линии дает 1 / K.
Нулевой порядок реакции
Реакции скорость которых не зависят от концентрации или в которой концентрация реагентов не изменяется со временем.Таким образом, скорость таких реакций остается постоянная.
Rate = K
Многие фотохимические реакции (например. образование HCl из H2 и Cl2) и некоторая гетерогенная реакция (например. разложение йодистого водорода и аммиака на поверхности золота и вольфрама) являются примерами реакций нулевого порядка.
Характеристики Реакции нулевого порядка
(я) Скорость реакции не зависит от концентрации реагирующего вещества.
К = х / T
Концентрация продуктов линейно возрастает со временем. График концентрации продуктов со временем представляет собой прямую линию, проходящую через начало координат.
(б) Единица нулевой константы скорости порядка моль л-1 время-1.
(III) Полураспада прямо пропорциональна начальной концентрации реагентов.
T1/2 α
Это все об основах – Как определить порядок реакции, Первый, второй, Нулевой порядок реакции & Примеры.
если вы хотите чувствовать себя свободно делиться с другими.
Химическая кинетика – раздел физической химии, который изучает влияние различных факторов на скорости и механизмы химических реакций.
Под механизмом химической реакции понимают те промежуточные реакции, которые протекают при превращении исходных веществ в продукты реакции.
Основным понятием химической кинетики является понятие скорости химической реакции. В зависимости от системы, в которой протекает реакция, определение понятия «скорость реакции» несколько отличается.
Гомогенными химическими реакциями называются реакции, в которых реагирующие вещества находятся в одной фазе. Это могут быть реакции между газообразными веществами или реакции в водных растворах. Для таких реакций средняя скорость (равна изменению концентрации любого из реагирующих веществ в единицу времени)
.
Мгновенная или истинная скорость химической реакции равна
.
Знак минус в правой части говорит об уменьшении концентрации исходного вещества. Значит, скоростью гомогенной химической реакции называют производную концентрации исходного вещества по времени.
Гетерогенной реакцией называется реакция, в которой реагирующие вещества находятся в разных фазах. К гетерогенным относятся реакции между веществами, находящимися в разных агрегатных состояниях.
Скорость гетерогенной химической реакции равна изменению количества любого исходного вещества в единицу времени на единицу площади поверхности раздела фаз:
.
Кинетическим уравнением химической реакции называют математическую формулу, связывающую скорость реакции с концентрациями веществ. Это уравнение может быть установлено исключительно экспериментальным путём.
В зависимости от механизма все химические реакции классифицируют на простые (элементарные) и сложные. Простыми называются реакции, протекающие в одну стадию за счёт одновременного столкновения молекул, записанных в левой части уравнения. В простой реакции могут участвовать одна, две или, что встречается крайне редко, три молекулы.
Поэтому простые реакции классифицируют на мономолекулярные, бимолекулярные и тримолекулярные реакции. Так как с точки зрения теории вероятности одновременное столкновение четырёх и более молекул маловероятно, реакции более высокой, чем три, молекулярности не встречаются. Для простых реакций кинетические уравнения относительно просты.
Например, для реакции H2 + I2 = 2 HIкинетическое уравнение имеет вид
= k ∙ C(I2) ∙ C(H2).
Сложные реакции протекают в несколько стадий, причём все стадии связаны между собой. Поэтому кинетические уравнения сложных реакций более громоздки, чем простых реакций. Например, для сложной реакции H2 + Br2 = 2 HBrизвестно
= .
Сложность кинетического уравнения напрямую связана со сложностью механизма реакции.
Основным законом химической кинетики является постулат, вытекающий из большого числа экспериментальных данных и выражающий зависимость скорости реакции от концентрации. Этот закон называют законом действующих масс.Он утверждает, что скорость химической реакции в каждый момент времени пропорциональна концентрациям реагирующих веществ, возведённым в некоторые степени.
Если уравнение химической реакции имеет вид
a A + b B + d D → продукты,
то формулу закона действующих масс можно представить в виде
= k ∙ .
В этом уравнении k – константа скорости химической реакции – важнейшая характеристика реакции, не зависящая от концентраций, а зависящая от температуры. Константа скорости химической реакции равна скорости реакции, если концентрации всех веществ равны 1 моль/л. Показатели степеней n1, n2, n3 называют частными порядками химической реакции по веществам А, В и D.
Для простых реакций частные порядки – небольшие целые числа от нуля до трёх. Для сложных реакций частные порядки могут быть и дробными, и отрицательными числами. Сумма частных порядков называется порядком химической реакции n = n1+ n2+ n3. Таким образом, порядком химической реакции называют сумму показателей степеней концентраций в кинетическом уравнении.
Кинетическая классификация простых гомогенных химических реакций
С точки зрения химической кинетики простые химические реакции классифицируют на реакции нулевого, первого, второго и третьего порядков. Реакции нулевого порядка встречаются чрезвычайно редко.
Для того чтобы реакция протекала по нулевому порядку необходимы специфические условия её проведения.
Например, реакция разложения оксида азота (5+) N2O5 → N2O4 + ½ O2 протекает как реакция нулевого порядка только в случае твёрдого оксида азота (5+).
Если же взят газообразный оксид, то реакция протекает как реакция первого порядка.
В то же время следует сказать, что встречается большое количество реакций, в которых частный порядок по какому-либо веществу равен нулю. Обычно это реакции, в которых данное вещество взято в большом избытке по сравнению с остальными реагентами. Например, в реакции гидролиза сахарозы
С12Н22О11 + Н2О → С6Н12О6 + С6Н12О
Сахароза Глюкоза Фруктоза
частный порядок реакции по воде равен нулю.
Самыми распространёнными являются реакции первого и второго порядков. Реакций третьего порядка мало.
Рассмотрим для примера математическое описание кинетики химической реакции первого порядка. Решим кинетическое уравнение такой реакции
= kC.
Разделим переменные dC = – kdt. После интегрирования
∫ = -∫kdt.
получим
lnС = – kt + const.
Найдём постоянную интегрирования, учитывая начальное условие: в момент времени t = 0 концентрация равна начальной С = С0. Отсюда const = lnC0 и
ln С = ln С0 – kt,
ln С – ln С0 = – kt,
ln= – kt,
C = C0∙ e-kt.
Это интегральное кинетическое уравнение реакции первого порядка.
Важной кинетической характеристикой реакции любого порядка является время полупревращения τ½. Временем полупревращения называют время, в течение которого реагирует половина начального количества вещества. Найдём выражение для времени полупревращения реакции первого порядка. Для t = τ½C = C0/2. Поэтому
ln = ln = – kt,
k τ½ = ln 2.
Отсюда
τ½ = = .
Результаты решения дифференциальных кинетических уравнений для реакций всех порядков представим в виде таблицы (табл. 2). Данные этой таблицы относятся к случаю, когда все вступающие в реакцию вещества имеют одинаковые начальные концентрации.
Таблица – Кинетические характеристики простых гомогенных реакций
Способы определения порядка реакции
Для определения порядков химических реакций используют дифференциальные и интегральные способы. Дифференциальные способы используют дифференциальные кинетические уравнения. Порядок реакции с помощью этих способов рассчитывается и представляется в виде числа. При этом, так как способ базируется на кинетическом эксперименте, результат расчёта содержит в себе некоторую погрешность.
Химическая кинетика
Химическая кинетика или кинетика химических реакций — раздел физической химии, изучающий закономерности протекания химических реакций во времени, зависимости этих закономерностей от внешних условий, а также механизмы химических превращений[1].
Предметом химической кинетики является изучение всех факторов, влияющих на скорость как суммарного процесса, так и всех промежуточных стадий.
Основные понятия[ | ]
Гомогенная реакция — реакция, в которой реагирующие вещества находятся в одной фазе.
Гетерогенная реакция — реакция, происходящая на границах раздела фаз – между газообразным веществом и раствором, между раствором и твёрдым веществом, между твёрдым и газообразным веществами.
Реакция называется простой, если продукт образуется в результате непосредственного взаимодействия молекул (частиц) реагентов.
Реакция называется сложной, если конечный продукт получается в результате осуществления двух и более простых реакций (элементарных актов) с образованием промежуточных продуктов[2].
Скорость химической реакции[ | ]
Основная статья: Скорость химической реакции
Важным понятием химической кинетики является скорость химической реакции. Эта величина определяет, как изменяется концентрация компонентов реакции с течением времени.
Скорость химической реакции — величина всегда положительная, поэтому, если она определяется по исходному веществу (концентрация которого убывает в процессе реакции), то полученное значение умножается на −1.
Например, для реакции скорость можно выразить так:
A + B → C + D , {displaystyle A+B o C+D,} v = ∂ C ∂ t = − ∂ A ∂ t . {displaystyle v={frac {partial C}{partial t}}=-{frac {partial A}{partial t}}.}
В 1865 году Н. Н. Бекетовым и в 1867 году К. М. Гульдбергом и П.
Вааге был сформулирован закон действующих масс, согласно которому скорость химической реакции в каждый момент времени пропорциональна концентрациям реагентов, возведённым в некоторые степени.
Кроме концентрации на скорость химической реакции оказывают влияние следующие факторы: природа реагирующих веществ, наличие катализатора, температура (правило Вант-Гоффа) и площадь поверхности раздела фаз.
Экспериментальные методы химической кинетики[ | ]
Экспериментальные методы химической кинетики подразделяются на химические, физические, биохимические в зависимости от способа измерения количества вещества или его концентрации в ходе реакции.
К химическим относятся методы кинетики, основанные на традиционных способах количественного химического анализа — титриметрических, гравиметрических и др.
В современной экспериментальной кинетике к числу наиболее широко применяемых физических методов относятся различные спектральные методы.
Эти методы основаны на измерениях, как правило спектров поглощения реагентов или продуктов в ультрафиолетовой, видимой и инфракрасной областях.
Широко используют также спектры электронного парамагнитного резонанса (ЭПР) и ядерного магнитного резонанса (ЯМР)[3].
Порядок химической реакции[ | ]
График зависимости концентрации реагента A в реакции A → B от времени для нулевого порядка реакции График зависимости концентрации реагента A для первого порядка реакции График зависимости концентрации реагента A для второго порядка реакции
Порядок реакции по данному веществу — показатель степени при концентрации этого вещества в кинетическом уравнении реакции.
Реакция нулевого порядка[ | ]
Кинетическое уравнение имеет следующий вид:
V 0 = k 0 {displaystyle V_{0}=k_{0}}
Скорость реакции нулевого порядка постоянна во времени и не зависит от концентраций реагирующих веществ. Нулевой порядок характерен, например, для гетерогенных реакций в том случае, если скорость диффузии реагентов к поверхности раздела фаз меньше скорости их химического превращения.
Реакция первого порядка[ | ]
Кинетическое уравнение реакции первого порядка:
V 1 = k 1 ⋅ C = − d C d τ {displaystyle V_{1}=k_{1}cdot C=-{frac {dC}{d au }}}
Приведение уравнения к линейному виду даёт уравнение:
ln C = ln C 0 − k 1 ⋅ τ {displaystyle ln C=ln C_{0}-k_{1}cdot au }
Константа скорости реакции вычисляется как тангенс угла наклона прямой к оси времени:
k 1 = − t g α {displaystyle k_{1}=-mathrm {tg} alpha }
Период полупревращения:
τ 1 2 = ln 2 k 1 {displaystyle au _{frac {1}{2}}={frac {ln 2}{k_{1}}}}
Реакция второго порядка[ | ]
Для реакций второго порядка кинетическое уравнение имеет следующий вид:
V = k 2 C A 2 {displaystyle V=k_{2}{C_{A}}{2}}
или
V = k 2 C A ⋅ C B {displaystyle V=k_{2}C_{A}cdot C_{B}}
В первом случае скорость реакции определяется уравнением:
V = k 2 C A 2 = − d C d τ {displaystyle V=k_{2}{C_{A}}{2}=-{frac {dC}{d au }}}
Линейная форма уравнения:
1 C = k 2 ⋅ τ + 1 C 0 {displaystyle {frac {1}{C}}=k_{2}cdot au +{frac {1}{C_{0}}}}
Константа скорости реакции равна тангенсу угла наклона прямой к оси времени:
k 2 = − t g α {displaystyle k_{2}=-mathrm {tg} alpha } k 2 = 1 τ ( 1 C − 1 C 0 ) {displaystyle k_{2}={frac {1}{ au }}left({frac {1}{C}}-{frac {1}{C_{0}}}
ight)}
Во втором случае выражение для константы скорости реакции будет выглядеть так:
k 2 = 1 τ ( C 0 , A − C 0 , B ) ln C 0 , B ⋅ C A C 0 , A ⋅ C B {displaystyle k_{2}={frac {1}{ au (C_{0,A}-C_{0,B})}}ln {frac {C_{0,B}cdot C_{A}}{C_{0,A}cdot C_{B}}}}
Период полупревращения (для случая равных начальных концентраций!):
τ 1 2 = 1 k 2 ⋅ 1 C 0 {displaystyle au _{frac {1}{2}}={frac {1}{k_{2}}}cdot {frac {1}{C_{0}}}}
Молекулярность реакции[ | ]
Молекулярность элементарной реакции — число частиц, которые, согласно экспериментально установленному механизму реакции, участвуют в элементарном акте химического взаимодействия.
Мономолекулярные реакции — реакции, в которых происходит химическое превращение одной молекулы (изомеризация, диссоциация и т. д.):
H 2 S → H 2 + S {displaystyle {mathsf {H_{2}S
ightarrow H_{2}+S}}}
Бимолекулярные реакции — реакции, элементарный акт которых осуществляется при столкновении двух частиц (одинаковых или различных):
C H 3 B r + K O H → C H 3 O H + K B r {displaystyle {mathsf {CH_{3}Br+KOH
ightarrow CH_{3}OH+KBr}}}
Тримолекулярные реакции — реакции, элементарный акт которых осуществляется при столкновении трёх частиц:
N O + N O + O 2 → 2 N O 2 {displaystyle {mathsf {NO+NO+O_{2}
ightarrow 2NO_{2}}}}
Реакции с молекулярностью более трёх неизвестны.
Для элементарных реакций, проводимых при близких концентрациях исходных веществ, величины молекулярности и порядка реакции совпадают. Чётко определённой взаимосвязи между понятиями молекулярности и порядка реакции нет, так как порядок реакции характеризует кинетическое уравнение реакции, а молекулярность — механизм реакции.
Катализ[ | ]
Основная статья: Катализ
Катализ — процесс, заключающийся в изменении скорости химических реакций в присутствии веществ, называемых катализаторами. Каталитические реакции — реакции, протекающие в присутствии катализаторов.
Положительным называют катализ, при котором скорость реакции возрастает, отрицательным (ингибированием) — при котором она убывает.
Примером положительного катализа может служить процесс окисления аммиака на платине при получении азотной кислоты.
Примером отрицательного — снижение скорости коррозии при введении в жидкость, в которой эксплуатируется металл, нитрит натрия, хромат и дихромат калия.
Многие важнейшие химические производства, такие, как получение серной кислоты, аммиака, азотной кислоты, синтетического каучука, ряда полимеров и др., проводятся в присутствии катализаторов.
Катализ в биохимии[ | ]
Ферментативный катализ неразрывно связан с жизнедеятельностью организмов растительного и животного мира.
Многие жизненно важные химические реакции, протекающие в клетке (что-то около десяти тысяч), управляются особыми органическими катализаторами, именуемыми ферментами или энзимами.
Термину «особый» не следует уделять пристального внимания, так как уже известно, из чего построены эти ферменты. Природа избрала для этого один-единственный строительный материал — аминокислоты и соединила их в полипептидные цепи различной длины и в разной последовательности.
Это так называемая первичная структура фермента, где R — боковые остатки, или важнейшие функциональные группы белков, возможно, выступающие в качестве активных центров ферментов.
На эти боковые группы и ложится основная нагрузка при работе фермента, пептидная же цепь играет роль опорного скелета.
Согласно структурной модели Полинга — Кори, она свернута в спираль, которая в обычном состоянии стабилизирована водородными связями между кислотными и основными центрами:
Для некоторых ферментов установлены полный аминокислотный состав и последовательность расположения их в цепи, а также сложная пространственная структура. Но это всё же очень часто не может помочь нам ответить на два главных вопроса:
1) почему ферменты так избирательны и ускоряют химические превращения молекул только вполне определённой структуры (которая нам тоже известна)?
2) каким образом фермент снижает энергетический барьер, то есть выбирает энергетически более выгодный путь, благодаря чему реакции могут протекать при обычной температуре?
Строгая избирательность и высокая скорость — два основных признака ферментативного катализа, отличающие его от лабораторного и производственного катализа.
Ни один из созданных руками человека катализаторов (за исключением, пожалуй, 2-оксипиридина) не может сравниться с ферментами по силе и избирательности воздействия на органические молекулы.
Активность фермента, как и любого другого катализатора, тоже зависит от температуры: с повышением температуры возрастает и скорость ферментативной реакции. При этом обращает на себя внимание резкое снижение энергии активации Е по сравнению с некаталитической реакцией.
Правда, это происходит не всегда. Известно много случаев, когда скорость возрастает благодаря увеличению не зависящего от температуры предэкспоненциального множителя в уравнении Аррениуса.
Типы ферментативных реакций[ | ]
- Тип «пинг-понг» — фермент сначала взаимодействует с субстратом А, отбирая у него какие либо химические группы и превращая в соответствующий продукт. Затем к ферменту присоединяется субстрат В, получающий эти химические группы. Примером являются реакции переноса аминогрупп от аминокислот на кетокислоты: трансаминирование.
- Тип последовательных реакций — к ферменту последовательно присоединяются субстраты А и В, образуя «тройной комплекс», после чего осуществляется катализ. Продукты реакции также последовательно отщепляются от фермента.
- Тип случайных взаимодействий — субстраты А и В присоединяются к ферменту в любом порядке, неупорядоченно, и после катализа так же отщепляются.
Равновесие[ | ]
Константа химического равновесия
Примечания[ | ]
- ↑ КИНЕТИКА ХИМИЧЕСКАЯ — химическая энциклопедия
- ↑ Ершов Ю.А. Общая химия.Биофизическая химия.Химия биогенных элементов. — Москва: Высшая школа.
- ↑ Ю.А. Ершов, В.А. Попков, А.С. Берлянд, А.З. Книжник. Общая химия: биофизическая химия, химия биогенных элементов. — Издание 8, стереотипное. — Москва: «Высшая школа», 2010.
Ссылки[ | ]
- Химическая кинетика и катализ Лекции А. А. Кубасова, к. хим. н,, доцента кафедры физической химии Химического факультета МГУ.
- Кнорре Д. Г., Эмануэль Н. М. Курс химической кинетики. 4-е издание, М.: Высшая школа, 1984. — 463 с.
- В. И. Коробова, В. Ф. Очкова «Химическая кинетика: введение с Mathcad/Maple/MCS» М.: Горячая линия-Телеком, 2009.
- Г. С. Яблонский, В. И. Быков, А. Н. Горбань, Кинетические модели каталитических реакций, Новосибирск: Наука (Сиб. отделение), 1983.- 255 c.
- Курс
Меня зовут Кузьмин Владимир Александрович.
Я репетитор по Химии
Вам нужны консультации по Химии по Skype?
Если да, подайте заявку. Стоимость договорная.
Чтобы закрыть это окно, нажмите «Нет».
Реакции первого порядка
Реакции первого порядка – это реакции, в которых показатель степени в уравнении зависимости скорости от концентрации, в которую возводится концентрация, равен единице.
Все реакции радиоактивного распада являются реакциями первого порядка. Также можно привести в пример реакции изомеризации, распада некоторых молекул в газовой фазе: N2O5, CH3-O-CH3 и т.д.
Выражение для мгновенной скорости реакции по какому-либо из реагентов записывается в виде:
, где v – мгновенная скорость, dc – бесконечно малое изменение молярной концентрации, dt – бесконечно малый промежуток времени.
Напомним, что знак минус перед правой частью уравнения ставиться для того, чтобы скорость была положительной величиной (изменение концентрации реагента – величина отрицательная, так как концентрация реагентов во время протекания реакции уменьшается).
По закону действующих масс – закону Гульберга-Вааге, скорость реакции прямо пропорциональная концентрации. Для реакций первого порядка (порядок – показатель степени в которую возводится концентрация) математическое выражение этого закона принимает вид:
, где k – константа скорости.
Приравняем правые части приведенных выше уравнений друг к другу:
Для того чтобы понять сколько вещества вступит в реакцию за определенный интервал времени, нам необходимо решить данное дифференциальное уравнение, т.е. найти его первообразную.
Запишем выражение для вычисления определённого интеграла, чтобы в дальнейшем не решать задачу Коши (решение дифференциального уравнения, удовлетворяющего начальным условиям, для нас это исходная концентрация и исходное время). Хотя, можно поступить иначе и вычислить неопределенный интеграл данного уравнения, а затем через начальные условия определить константу интегрирования (т.е. решить задачу Коши).
Для нахождения интеграла, напомним, что:
, где С – постоянная интегрирования
Результат интегрирования следующий:
Отсюда найдем уравнение для нахождения концентрации регента в момент времени t:
Если изменить порядок действий, то легко прийти к уравнению для нахождения константы реакции первого порядка:
Выведем уравнение для нахождения константы реакции первого порядка через период полупревращения.
Период полупревращения – время, которое необходимо для превращения половины исходного количества вещества.
Т.е. к моменту времени t молярная концентрация вещества будет равна ½ её исходного значения:
Для решения расчётных задач можно использовать формулу:
Из формулы видно, что время полупревращения для реакций первого порядка не зависит от количества, или концентрации исходного вещества.
Это уравнение есть ни что иное как линейная зависимость ln(c) от t .
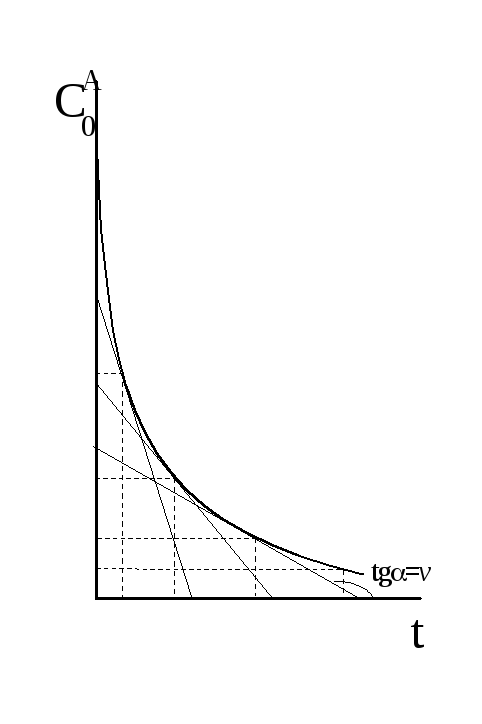
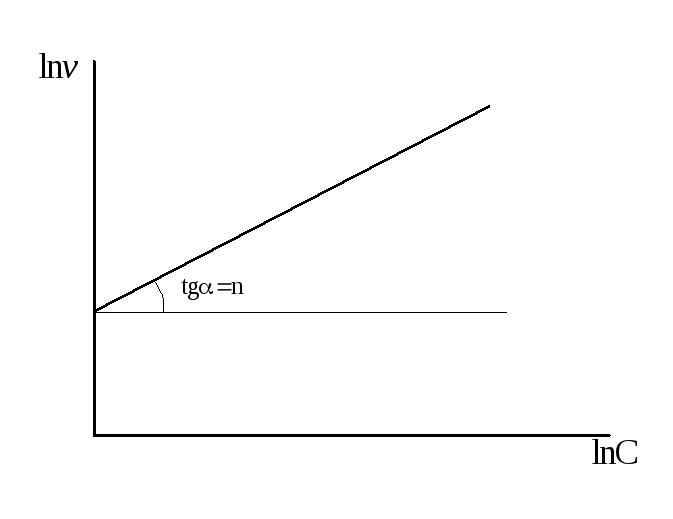
Построим график этой зависимости.
Отсюда, константа скорости реакции первого порядка численно равна тангенсу угла наклона прямой к оси t.
Определим размерность константы реакции первого порядка. Для этого в уравнение:
подставим размерности скорости и молярной концентрации:
Отсюда размерность константы реакции первого порядка.

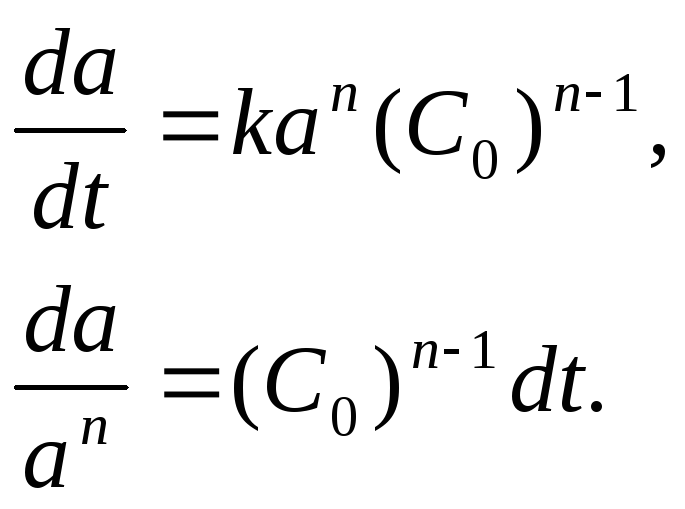

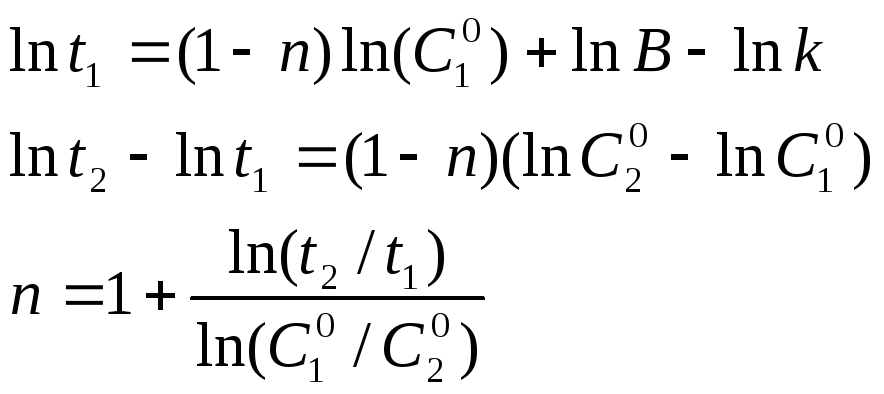



![[[pictureof]]](https://dist-tutor.info/s3/dist-tutor/user/2/ava/thumbnails/RgocnqRS3C4j3ys.jpg)



















