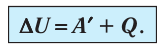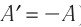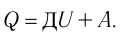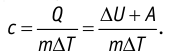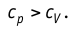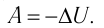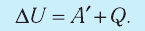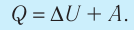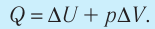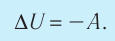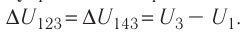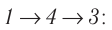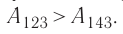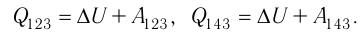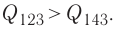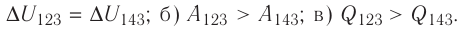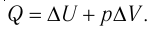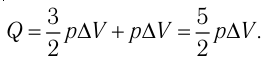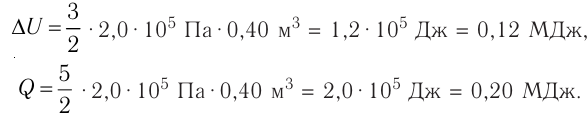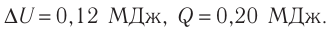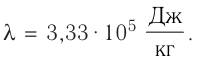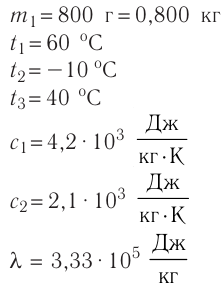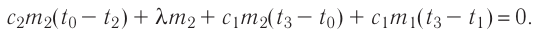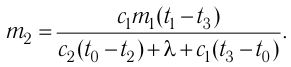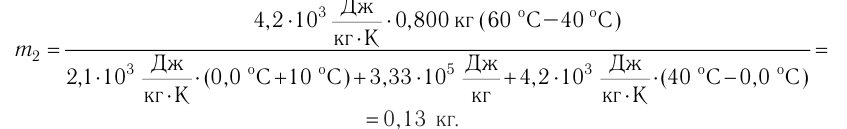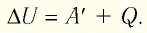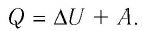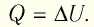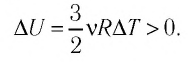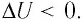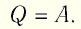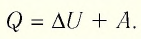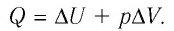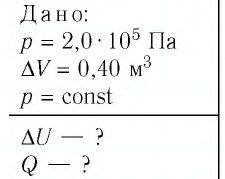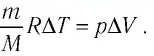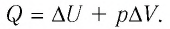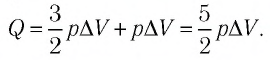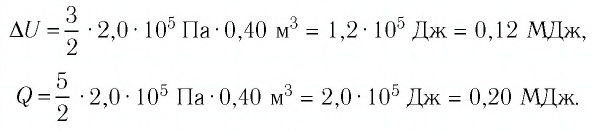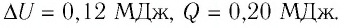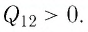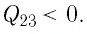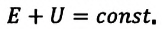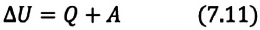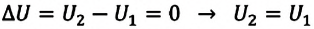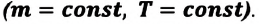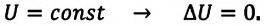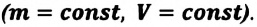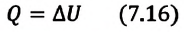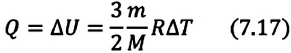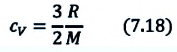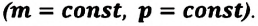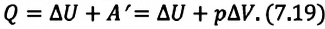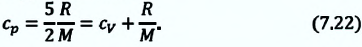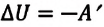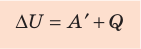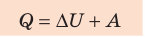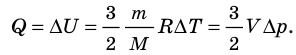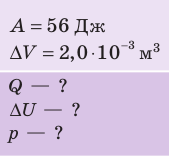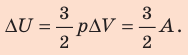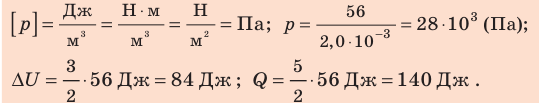Задача. Определите приращение внутренней энергии идеального одноатомного газа, количество вещества которого моль, при его нагревании на
оС.
Решение
Думаем: любое изменение можно найти как разность начального и конечного состояния системы
(1)
- где
По определению внутренней энергии:
(3)
Решаем: для начального и конечного состояния газа
(2)
(3)
Тогда, подставляя (2) и (3) в (1), получим:
(4)
Обратим внимание на — изменение температуры газа в Кельвинах. Однако помним, что изменение температуры и в градусах Кельвина и в градусах Цельсия одинаково, тогда
. Тогда исходя из (4):
(5)
Считаем: помним о константах ( м
*кг*с
*К
*Моль
).
Дж
Ответ: Дж.
Ещё задачи на тему «Работа и внутренняя энергия идеального газа«.
Содержание:
Первый закон термодинамики:
При изучении физики в 9 классе вы узнали, что полная механическая энергия замкнутой системы тел сохраняется только при отсутствии трения, а при наличии трения она уменьшается. Куда девается механическая энергия? Если бутылку, заполненную до половины водой при комнатной температуре, встряхивать в течение нескольких минут, то окажется, что вода нагрелась на 1—2 °С. Каким образом нагрелась вода?
В середине XIX века известный английский физик Дж. Джоуль (1818— 1889), проведя многочисленные опыты, показал, что совершённая при перемешивании воды механическая работа практически равна увеличению её внутренней энергии. Опыты Джоуля, а также исследования немецкого врача и естествоиспытателя Р. Майера (1814—1878), немецкого профессора физиологии и одного из самых знаменитых физиков второй половины XIX века Г. Гельмгольца (1821 —1894) позволили сформулировать закон сохранения и превращения энергии, распространив его на все явления природы. Согласно этому закону при любых взаимодействиях материальных объектов энергия не исчезает и не возникает из ничего, она только передаётся от одних объектов к другим или превращается из одной формы в другую.
Для термодинамических систем (в термодинамике обычно рассматривают макроскопически неподвижные системы) закон сохранения и превращения энергии называют первым законом термодинамики. Согласно первому закону термодинамики, приращение внутренней энергии термодинамической системы при переходе из одного состояния в другое равно алгебраической сумме работы, совершённой внешними силами, и количества теплоты, полученного или отданного системой при взаимодействии с внешними телами:
Поскольку работа внешних сил равна работе, совершаемой термодинамической системой, взятой с противоположным знаком (
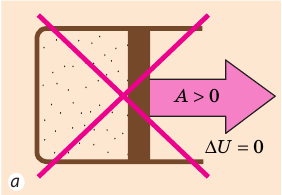
Если система представляет собой действующее устройство, периодически возвращающееся в исходное состояние, то при этом AU-0 и A-Q. Механизм, который мог бы совершать работу без изменения состояния составляющих его тел и без теплопередачи от внешних тел, называют «вечным двигателем первого рода». Поэтому первый закон термодинамики можно сформулировать и следующим образом: невозможен вечный двигатель первого рода, т. е. такой двигатель, который при неизменном значении собственной внутренней энергии совершал бы работу большую, чем энергия, получаемая им извне.
Применим первый закон термодинамики к различным изопроцессам, происходящим с идеальным одноатомным газом.
Изохорный процесс
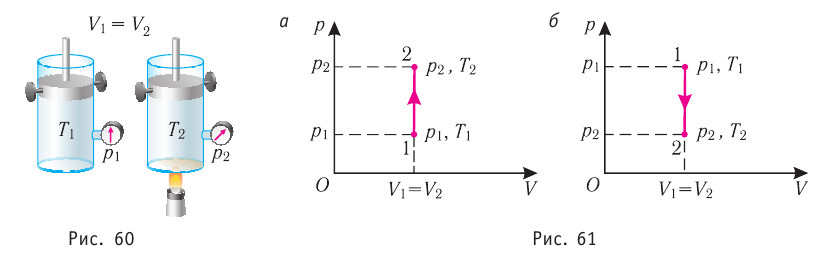
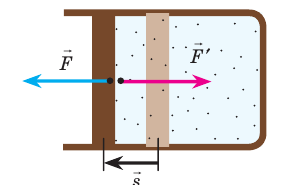
Пусть идеальный одноатомный газ находится в цилиндрическом сосуде, закрытом неподвижным поршнем (V = const). Нагреем сосуд с газом. Объём газа остаётся практически постоянным (тепловым расширением сосуда пренебрегаем) (рис. 60), следовательно, работа силы давления газа А= 0. Тогда первый закон термодинамики примет вид
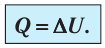
Это означает, что всё передаваемое газу количество теплоты идёт на увеличение его внутренней энергии. При этом приращение внутренней энергии газа 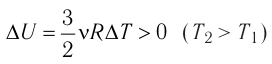
процессе отдаёт количество теплоты, то его внутренняя энергия убывает:
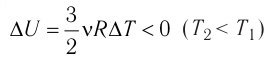
Изотермический процесс
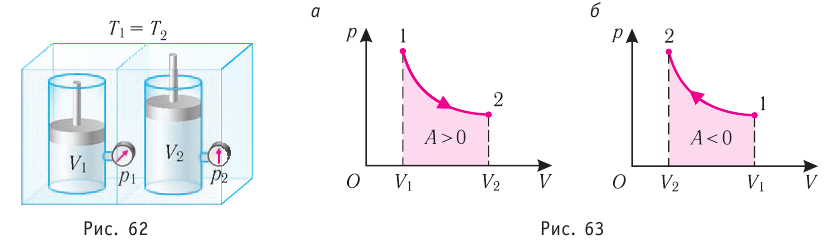
Пусть цилиндрический сосуд с газом под поршнем находится в термостате — устройстве, в котором поддерживается постоянная температура. В этом случае внутренняя энергия идеального одноатомного газа 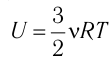
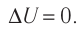
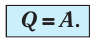
Какие выводы следуют из этого? Если с помощью внешнего устройства медленно перемещать поршень в сосуде так, чтобы объём газа увеличивался (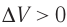
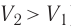
Если же внешнее устройство обеспечивает медленное уменьшение объёма газа в сосуде (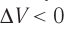
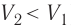
Изобарный процесс
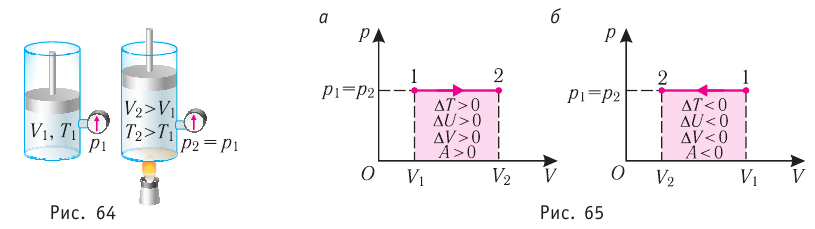
Пусть газ находится в цилиндрическом сосуде, закрытом поршнем, который может свободно или под постоянной нагрузкой перемещаться (рис. 64). Нагреем газ, передав ему некоторое количество теплоты (Q > 0). Согласно первому закону термодинамики (11.2) переданное газу количество теплоты частично расходуется на увеличение внутренней энергии 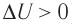
При изобарном процессе работа расширения (сжатия) газа 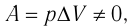
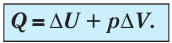
При изобарном сжатии газа внешние силы совершают работу А’ > 0. Чтобы давление газа при этом оставалось постоянным, газ необходимо охлаждать, т. е. он должен отдавать в окружающую среду некоторое количество теплоты (Q < 0). Понижение температуры газа при изобарном сжатии приводит к уменьшению его внутренней энергии (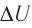
Удельная теплоёмкость вещества зависит не только от его свойств, но и от характера осуществления процесса теплопередачи. Действительно, из формулы (10.4) следует, что удельная теплоемкость
Тогда согласно первому закону термодинамики при изохорном процессе (11.3)
удельная теплоёмкость идеального газа 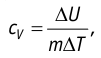
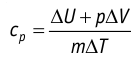
Это объясняется тем, что при постоянном давлении часть подводимой энергии расходуется на совершение силой давления газа работы при расширении.
Расширение жидких и твёрдых тел при нагревании при постоянном давлении значительно меньше, чем газов, поэтому для них 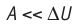
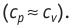
Адиабатный процесс
Адиабатным называют процесс, в ходе которого термодинамическая система не получает и не отдаёт энергию путём теплопередачи. Таким образом, при адиабатном процессе
Q = 0.
Применяя к этому процессу первый закон термодинамики, получим:
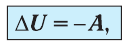
или
При адиабатном процессе изменение внутренней энергии системы происходит только за счёт совершения работы. Если внешние силы совершают работу по сжатию газа (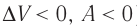
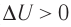
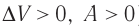
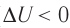
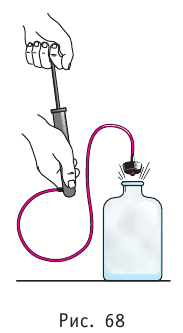
Если процесс протекает очень быстро, то теплопередача практически не сказывается. Очень нагляден опыт, иллюстрирующий уменьшение температуры газа при его адиабатном расширении. Используя насос, через отверстие в пробке будем накачивать в стеклянный сосуд воздух (рис. 68). Через некоторый промежуток времени накачивания сжатый воздух совершит работу по преодолению силы трения, с которой сосуд действует на пробку, и силы атмосферного давления. Теплопередача между сосудом и окружающими телами не успевает проявиться за тот малый промежуток времени, пока пробка вылетает из сосуда. Уменьшение внутренней энергии воздуха в сосуде выражается в понижении его температуры, что приводит к конденсации водяных паров, т. е. к образованию тумана.
В качестве примера адиабатного процесса можно привести охлаждение воздуха в атмосфере. Нагретый возле поверхности Земли воздух при быстром подъёме в верхние слои атмосферы расширяется почти адиабатно и при этом резко охлаждается. Водяной пар в нём конденсируется в маленькие капли воды и кристаллики льда, образуя облака. Близкий к адиабатному процесс используют в двигателях внутреннего сгорания.
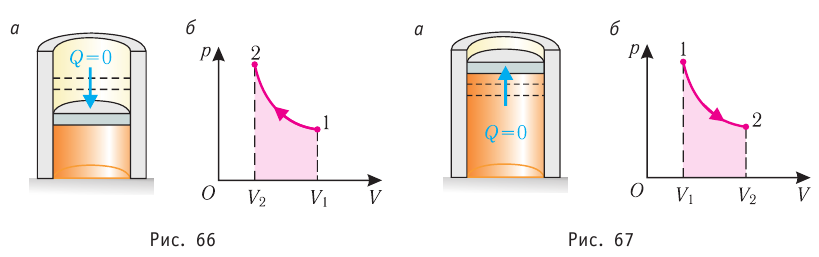
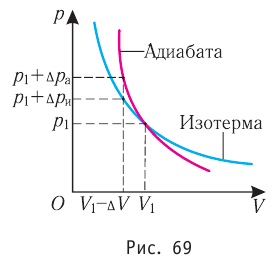
Обратимый адиабатный процесс относят к изопроцессам, так как он характеризуется постоянством функции состояния, называемой энтропией. В отличие от остальных изопроцессов при обратимом адиабатном процессе происходят изменения давления, объёма и температуры. График адиабатного процесса в координатах (р, V) похож на график изотермического процесса (рис. 69). Однако одному и тому же изменению объёма 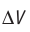
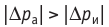
Это объясняется тем, что в случае адиабатного расширения давление 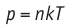
1. Приращение внутренней энергии термодинамической системы при
переходе из одного состояния в другое равно алгебраической сумме работы, совершённой внешними силами, и количества теплоты, полученного или отданного системой при взаимодействии с внешними телами:
2. Количество теплоты, полученное или отданное термодинамической системой при взаимодействии с внешними телами при её переходе из одного состояния в другое, идёт на приращение внутренней энергии системы и на работу, которую система совершает при расширении:
3. При изохорном процессе всё передаваемое системе количество теплоты идёт на увеличение её внутренней энергии:
4. При изотермическом процессе работа расширения или сжатия идеального газа сопровождается теплопередачей между газом и термостатом:
A=Q.
5. При изобарном процессе переданное идеальному газу количество теплоты частично расходуется на увеличение внутренней энергии газа и частично идёт на совершение работы газом при его расширении:
6. При адиабатном процессе приращение внутренней энергии газа равно работе, которую совершает сила давления газа, взятой с противоположным знаком:
Пример №1
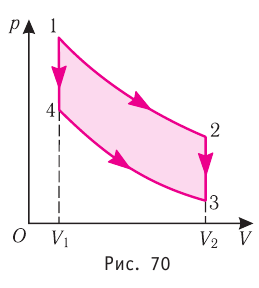
Идеальный газ, масса которого постоянна, переводят из состояния / в состояние 3 двумя различными способами: 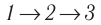
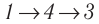
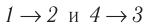
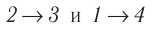
Решение, а) Так как начальное и конечное состояния для обоих переходов одинаковы, то будут одинаковы и приращения внутренней энергии:
б) Из рисунка 70 видно, что площадь фигуры, ограниченной осью OV, изотермой и изохорами, проходящими через точки 3 и 4, меньше площади фигуры, ограниченной осью ОV, изотермой и изохорами, проходящими через точки 1 и 2. Следовательно, в процессе перехода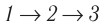
в) Из первого закона термодинамики следует:
Поскольку приращения внутренней энергии в обоих случаях одинаковы, а совершённая силой давления газа работа больше при переходе 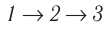
Ответ: а)
Пример №2
Идеальный одноатомный газ, давление которого 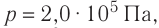
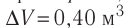
Дано:
р = 2,0 • 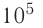
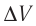
р =const
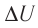
Решение. Приращение внутренней энергии идеального одноатомного газа 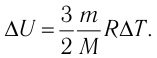
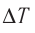
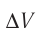
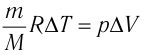
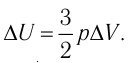
Отсюда
Ответ:
Пример №3
В сосуд налита вода массой 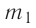
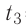
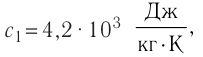
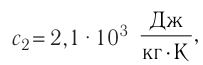
Дано
Решение. Если пренебречь потерями энергии в окружающую среду, то термодинамическая система «сосуд—вода—лёд» является изолированной. Поэтому учитываем только обмен энергией между входящими в систему телами при теплопередаче. Рассмотрим тепловые процессы, происходящие в системе: 1) нагревание льда от температуры 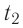
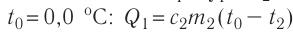
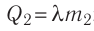
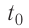
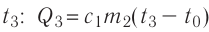
массой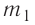
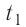
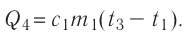
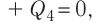
Отсюда масса льда
Ответ: 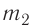
Первый закон термодинамики
В 9-м классе вы узнали, что полная механическая энергия замкнутой системы тел сохраняется только при отсутствии трения, а при наличии трения она уменьшается. Куда девается механическая энергия?
Закон сохранения энергии
В середине XIX в. известный английский физик Дж. Джоуль (1818—1889), проведя многочисленные опыты, показал, что совершённая при перемешивании воды механическая работа практически равна увеличению её внутренней энергии. Опыты Джоуля, а также исследования немецкого врача и естествоиспытателя Р. Майера (1814—1878), немецкого профессора физиологии и одного из самых знаменитых физиков второй половины XIX в. Г. Гельмгольца (1821 — 1894) позволили сформулировать закон сохранения и превращения энергии, распространив его на все явления природы.
Закон сохранения и превращения энергии: при любых взаимодействиях материальных объектов энергия не исчезает и не возникает из ничего, она только передаётся от одних объектов к другим или превращается из одной формы в другую.
Закон сохранения и превращения энергии является всеобщим законом природы и связывает воедино все физические явления. Этот закон выполняется абсолютно точно, на нём базируется всё современное естествознание.
Первый закон термодинамики:
В предыдущих параграфах мы рассматривали процессы, в которых внутренняя энергия системы изменялась или при совершении работы, или в результате теплообмена. Однако чаще всего при переходе системы из одного состояния в другое внутренняя энергия изменяется как за счёт совершения работы, так и за счёт теплообмена с окружающими телами.
Для термодинамических систем закон сохранения и превращения энергии называют первым законом термодинамики.
Первый закон термодинамики: приращение внутренней энергии термодинамической системы при переходе из одного состояния в другое равно алгебраической сумме работы, совершённой внешними силами, и количества теплоты, полученного (или отданного) системой при взаимодействии с внешними телами.
Поскольку работа внешних сил равна работе, совершаемой термодинамической системой, взятой с противоположным знаком 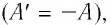
Количество теплоты, полученное (или отданное) термодинамической системой при взаимодействии с внешними телами при её переходе из одного состояния в другое, идёт на приращение внутренней энергии системы и на работу, которую она совершает против внешних сил:
Применим первый закон термодинамики к различным изопроцессам изменения состояния идеального одноатомного газа.
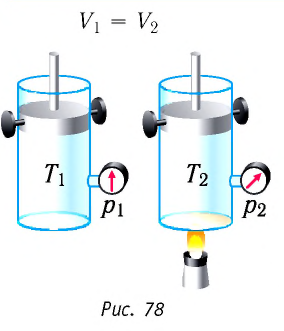
Рассмотрим в качестве термодинамической системы идеальный одноатомный газ, находящийся в цилиндрическом сосуде, закрытом поршнем.
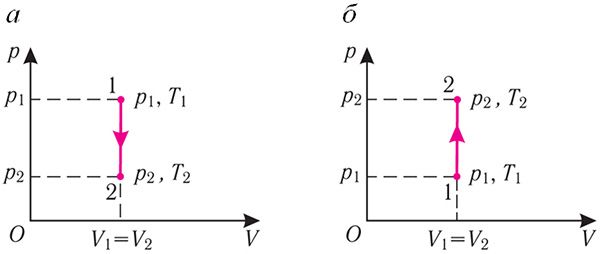
Изохорный процесс:
Если сосуд закрыт неподвижным поршнем, то при нагревании объём газа остаётся постоянным 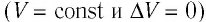
При изохорном процессе всё передаваемое газу количество теплоты идёт на увеличение его внутренней энергии:
Если газ при изохорном процессе отдаёт количество теплоты, то его внутренняя энергия убывает:
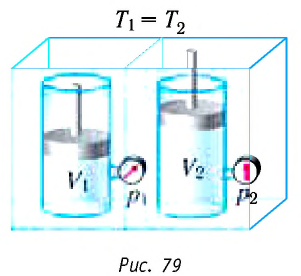
Изотермический процесс:
Поместим сосуд с газом, находящимся под подвижным поршнем, в термостат — устройство, в котором поддерживается постоянная температура (рис. 79). С помощью внешнего устройства медленно переместим поршень в сосуде так, чтобы объём газа увеличился (или уменьшился). Значения температуры газа в начальном и конечном состояниях одинаковы. В этом случае внутренняя энергия идеального одноатомного газа 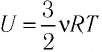
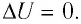
При изотермическом процессе переданное газу количество теплоты расходуется на совершение газом работы.
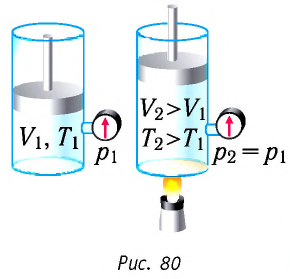
Изобарный процесс:
Если сосуд закрыт подвижным поршнем, то при нагревании увеличится как температура газа, так и его объём (рис. 80). Тогда первый закон термодинамики имеет вид:
При изобарном процессе переданное газу количество теплоты частично расходуется на увеличение внутренней энергии системы и частично идёт на совершение работы силой давления газа при его расширении.
С учётом того, что при изобарном процессе работа расширения (сжатия) газа 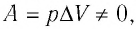
Пример №4
Идеальный одноатомный газ, давление которого 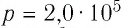
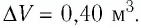
Решение. 11риращение внутренней энергии идеального одноатомного газа 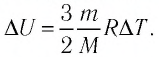
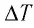
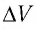
Тогда 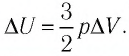
Следовательно,
Ответ:
Пример №5
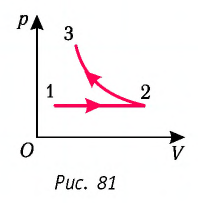
На рисунке 81 представлен график процесса изменения состояния некоторой массы идеального газа (участок 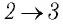
Решение. Участок 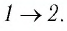
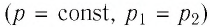
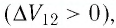
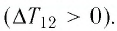
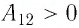
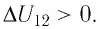
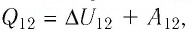
Участок 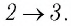
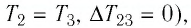
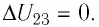
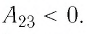
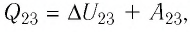
Ответ:
Определение первого закона термодинамики
Невозможно представить себе повседневную жизнь без разноцелевой техники, облегчающей нашу жизнь. При помощи этой техники люди вспахивают землю, добывают нефть, газ, руду и другие полезные ископаемые, «сокращают» большие расстояния и т.д. Главное свойство всей техники — способность совершения ими работы.
По этой причине еще с древних времен люди пытались создать способный работать вечно perpetuum mobile, то есть вечный двигатель. Как одну из интересных работ в этом направлении можно показать оригинальный проект, предложенный английским священником Джоном Уилкенсином в XVII веке, основанный на действии магнитного поля. По идее проекта, вечный двигатель должен работать так: шарообразный магнит помещен на высокую опору, к которой прикрепляются две наклонные плоскости, верхняя плоскость прямолинейная, а нижняя изогнутая (а).
В результате притяжения магнитом шарик, помещенный в нижней части прямой плоскости, начинает подниматься вверх и проваливается на нижнюю плоскость через отверстие 1 в верхней части плоскости. Затем, скатываясь вниз по изогнутой плоскости, снова попадает на прямую плоскость через отверстие 2, и всё повторяется снова.
Первый закон термодинамики:
Согласно одному из фундаментальных законов природы — закону сохранения энергии, полная энергия (механическая и внутренняя энергия) замкнутой системы остается постоянной при всех процессах, происходящих внутри этой системы:
Закон сохранения энергии, применяемый к тепловым процессам, называют первым законом термодинамики:
Изменение внутренней энергии термодинамической системы равно количеству теплоты, переданному этой системе, и работе внешних сил, совершенной над системой:
Над замкнутой и изолированной системой внешние силы не совершают работу 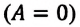
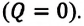
Так как работа, совершаемая системой над внешними силами, равна работе, совершаемой внешними силами над системой с противоположным знаком: 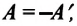
Количество теплоты, сообщенное термодинамической системе, затрачивается на изменение ее внутренней энергии и работу, которую система совершает против внешних сил:
После открытия закона сохранения энергии стала очевидной невозможность создания вечного двигателя первого рода:
Вечный двигатель первого рода (perpetuum mobile I) — это двигатель, который будучи однажды приведен в действие и не получая энергию извне, совершает работу вечно.
Согласно выражению (7.11), для совершения работы система или должна получать энергию извне, или использовать свою внутреннюю энергию:
В противном случае, то есть если 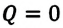
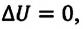
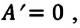
Применение первого закона термодинамики к разным процессам
1. Изотермический процесс
Так как в этом процессе температура системы остается постоянной, то и ее внутренняя энергия остается постоянной, изменение же внутренней энергии равно нулю:
Из выражений первого закона термодинамики (7.11) и (7.12) получаем:
• При изотермическом процессе все количество теплоты, переданное системе, затрачивается на совершение работы.
2. Изохорный процесс
Так как в этом процессе объем системы остается постоянным, то из выражения (7.10) следует, что работа не совершается 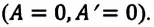
Для одноатомного идеального газа:
• При изохорном процессе количество теплоты, переданное системе, целиком затрачивается на изменение внутренней энергии.
Удельная теплоемкость одноатомного идеального газа, при постоянном объеме
Если в выражении (7.17) учесть выражения внутренней энергии одноатомного идеального газа (7.7) и количества теплоты (7.4), то получим формулу для удельной теплоемкости при постоянном объеме:
3. Изобарный процесс
В этом процессе давление системы остается постоянным, а температура и объем изменяются. Для этого процесса первый закон термодинамики записывается, так:
• При изобарном процессе (расширении) переданное системе количество теплоты затрачивается на увеличение его внутренней энергии и на совершение газом работы против внешних сил.
Удельная теплоемкость одноатомного идеального газа при постоянном давлении
Приняв в (7.19) во внимание выражения для одноатомного идеального газа:
получим:
С учетом этих выражений можно определить удельную теплоемкость одноатомного идеального газа при постоянном давлении как:
Из сравнения выражений (7.20) и (7.21) видно, что при изобарном процессе для одноатомного идеального газа существуют следующие соотношения между переданным количеством теплоты, изменением внутренней энергии и совершенной работой:
4. Адиабатный процесс
Адиабатный процесс — это процесс, происходящий без теплообмена системы с окружающей средой.
Так как в этом процессе отсутствует теплообмен системы со сторонними телами, то первый закон термодинамики можно записать так:
или
При адиабатном расширении газа его температура и внутренняя энергия уменьшаются, то есть газ охлаждается, а при адиабатном же сжатии, наоборот, его температура и внутренняя энергия увеличиваются, то есть газ нагревается.
История первого закона термодинамики
Один из фундаментальных законов природы — закон сохранения и превращения энергии. Первым этот закон сформулировал немецкий врач и физик Юлиус Роберт фон Майер (1814–1878). интересно, что к открытию ученого подтолкнули наблюдения над цветом крови у людей. Майер заметил, что венозная кровь у жителей тропиков светлее, чем у жителей его страны, и по цвету напоминает артериальную. он сделал вывод, что разница в цвете обусловлена количеством потребления кислорода, или «силой процесса сгорания», происходящего в организме. независимо от Майера и совсем иначе к открытию закона сохранения энергии пришли английский промышленник и ученый Джеймс Прескотт Джоуль (1818–1889) и немецкий физик, физиолог и психолог Герман Людвиг Фердинанд фон Гельмгольц (1821–1894). закон сохранения и превращения энергии управляет всеми явлениями природы, неизвестно ни одного случая, когда бы этот закон не выполнялся.
В термодинамике рассматривают системы, механическая энергия которых при переходе из одного термодинамического состояния в другое не изменяется. Тогда, если внешние силы совершили работу A′ и одновременно системе передано определенное количество теплоты Q, вся энергия идет на изменение внутренней энергии системы (∆U) . Закон сохранения и превращения энергии в таком случае называют первым законом (началом) термодинамики:
Изменение внутренней энергии системы ( ∆U) при переходе из одного термодинамического состояния в другое равно сумме работы A′ внешних сил и количества теплоты Q, сообщенного системе или переданного системой окружающим телам в процессе теплообмена:
Рис. 38.1. согласно третьему закону ньютона сила 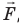
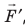
Обратите внимание! Если система получает некоторое количество теплоты, то в приведенной формуле Q берется со знаком «+», если отдает, то со знаком «–». На практике чаще рассматривают не работу A′ внешних сил, а работу A совершаемую данной системой против внешних сил. Учитывая, что A = −A ′ (рис. 38.1), первый закон (начало) термодинамики можно сформулировать так:
Количество теплоты Q, переданное системе, идет на изменение внутренней энергии системы (∆U) и на совершение системой работы A против внешних сил:
Согласно первому закону термодинамики невозможно создать вечный двигатель первого рода — циклическое устройство, которое совершало бы механическую работу без потребления энергии извне (рис. 38.2, а) или совершало бы работу большую, чем потребляемая им энергия (рис. 38.2, б).
Рис. 38.2. Циклические процессы, которые невозможны с точки зрения первого закона термодинамики
Какой вид имеет первый закон термодинамики для изопроцессов
Рассмотрим, какой вид принимает первый закон термодинамики в случаях, когда идеальному газу неизменной массы передают некоторое количество теплоты таким образом, что один из макроскопических параметров газа (V, p или T) остается неизменным.
- Изохорный процесс (рис. 38.3). В ходе изохорного процесса объем газа не изменяется (∆V=0) и газ работу не совершает (A = 0), поэтому уравнение первого закона термодинамики имеет вид: Q=∆U . При изохорном процессе все переданное газу количество теплоты расходуется на увеличение внутренней энергии газа. Если идеальный газ одноатомный, то количество теплоты, переданное газу, равно:
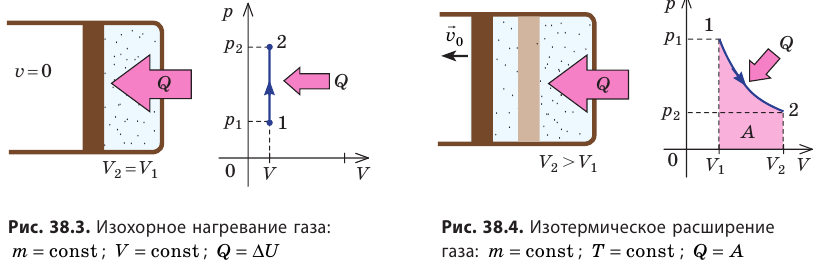
- Изотермический процесс (рис. 38.4). В ходе изотермического процесса температура, а значит, и внутренняя энергия газа не изменяются (∆U=0), поэтому уравнение первого закона термодинамики имеет вид: Q=A.
При изотермическом процессе все переданное газу количество теплоты идет на совершение механической работы.
Каковы особенности адиабатного процесса
Адиабатный процесс — это процесс, который происходит без теплообмена с окружающей средой. При адиабатном процессе количество теплоты Q, переданное системе, равно нулю, поэтому первый закон термодинамики имеет вид: Q=∆U + A, или A = −∆U.
При адиабатном расширении газ совершает положительную работу за счет уменьшения внутренней энергии; температура газа уменьшается.
Поскольку p =nkT, при адиабатном сжатии давление газа возрастает намного быстрее, чем при изотермическом, ведь одновременно с увеличением концентрации молекул газа увеличивается и его температура (рис. 38.6).
Рис. 38.6. изменение давления газа в ходе адиабатного сжатия. синим цветом показана адиабата, красным — изотермы
Аналогично при адиабатном расширении давление падает быстрее, чем при изотермическом, ведь одновременно уменьшаются и концентрация, и температура газа.
В реальных условиях процесс, близкий к адиабатному, можно осуществить, если газ будет находиться в оболочке с очень хорошими термоизоляционными свойствами. Адиабатными можно считать и процессы, которые происходят очень быстро: в таком случае газ не успевает обменяться теплотой с окружающей средой (например, расширение и сжатие воздуха при распространении звуковых волн, расширение газа при взрыве).
Увеличение температуры при резком сжатии воздуха используется в дизельном двигателе, в котором нет системы зажигания горючей смеси.
Пример №6
При изобарном расширении неон совершил работу 56 Дж. Какое количество теплоты передано газу? Каково изменение его внутренней энергии? При каком давлении происходил процесс, если объем газа увеличился на 2,0 л?
Решение:
Для изобарного процесса работа газа равна: A=p∆V. Отсюда 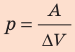
Согласно первому закону термодинамики: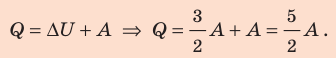
Ответ: Q = 140 Дж; ∆U = 84 Дж; p = 28 кПа.
Выводы:
- Закон сохранения энергии, записанный для тепловых процессов, называют первым законом (началом) термодинамики: количество теплоты, переданное системе, идет на изменение внутренней энергии системы и на совершение системой работы против внешних сил: Q=∆U + A.
- При изохорном процессе газ не выполняет работу (A = 0 ) , поэтому вся теплота, переданная газу, идет на увеличение его внутренней энергии: Q=∆U.
- При изотермическом процессе внутренняя энергия газа не изменяется (∆U=0), поэтому вся теплота, переданная газу, идет на совершение газом работы: Q=A.
- При изобарном процессе теплота, переданная газу, идет как на увеличение внутренней энергии газа, так и на совершение газом работы: Q=∆U + A.
- При адиабатном процессе газ не получает теплоты (Q = 0) , поэтому увеличение его внутренней энергии происходит за счет совершения над газом работы (адиабатное сжатие): ∆U=A′. Если газ сам совершает работу (адиабатное расширение), его внутренняя энергия уменьшается: A = −∆U.
- Второй закон термодинамики
- Тепловые двигатели и их КПД
- Тепловое состояние тел
- Изменение агрегатного состояния вещества
- Необратимость тепловых процессов
- Адиабатический процесс
- Молекулярно-кинетическая теория
- Работа в термодинамике
Печатать книгу
| Сайт: | Профильное обучение |
| Курс: | Физика. 10 класс |
| Книга: | § 14. Первый закон термодинамики. Применение первого закона термодинамики к изопроцессам изменения состояния идеального газа |
| Напечатано:: | Гость |
| Дата: | Воскресенье, 28 Май 2023, 07:22 |
Оглавление
- Закон сохранения энергии
- Первый закон термодинамики
- Изохорный процесс
- Изотермический процесс
- Изобарный процесс
- Адиабатный процесс
- Примеры решения задач
- Упражнение 10
В 9-м классе вы узнали, что полная механическая энергия замкнутой системы тел сохраняется только при отсутствии трения, а при наличии трения она уменьшается. Куда девается механическая энергия?
Закон сохранения энергии. В середине XIX в. известный английский физик Дж. Джоуль (1818–1889), проведя многочисленные опыты, показал, что совершённая при перемешивании воды механическая работа практически равна увеличению её внутренней энергии. Опыты Джоуля, а также исследования немецкого врача и естествоиспытателя Р. Майера (1814–1878), немецкого профессора физиологии и одного из самых знаменитых физиков второй половины XIX в. Г. Гельмгольца (1821–1894) позволили сформулировать закон сохранения и превращения энергии, распространив его на все явления природы.
Закон сохранения и превращения энергии: при любых взаимодействиях материальных объектов энергия не исчезает и не возникает из ничего, она только передаётся от одних объектов к другим или превращается из одной формы в другую.
Закон сохранения и превращения энергии является всеобщим законом природы и связывает воедино все физические явления. Этот закон выполняется абсолютно точно, на нём базируется всё современное естествознание.
От теории к практике
Если бутылку, заполненную до половины водой при комнатной температуре, встряхивать в течение нескольких минут, то окажется, что вода нагрелась на 1–2 °С. Что является причиной повышения температуры воды?
Первый закон термодинамики. В предыдущих параграфах мы рассматривали процессы, в которых внутренняя энергия системы изменялась или при совершении работы, или в результате теплообмена. Однако чаще всего при переходе системы из одного состояния в другое внутренняя энергия изменяется как за счёт совершения работы, так и за счёт теплообмена с окружающими телами.
Для термодинамических систем закон сохранения и превращения энергии называют первым законом термодинамики.
Первый закон термодинамики: приращение внутренней энергии термодинамической системы при переходе из одного состояния в другое равно алгебраической сумме работы, совершённой внешними силами, и количества теплоты, полученного (или отданного) системой при взаимодействии с внешними телами.
ΔU = A′ + Q.
Поскольку работа внешних сил равна работе, совершаемой термодинамической системой, взятой с противоположным знаком (A′ = –A), то первый закон термодинамики можно сформулировать иначе:
Количество теплоты, полученное (или отданное) термодинамической системой при взаимодействии с внешними телами при её переходе из одного состояния в другое, идёт на приращение внутренней энергии системы и на работу, которую она совершает против внешних сил:
Q = ΔU + A.
От теории к практике
Идеальный газ получил количество теплоты Q = 340 Дж. Каково приращение внутренней энергии газа, если при этом сила давления газа совершила работу А = 300 Дж?
Если термодинамическая система представляет собой действующее устройство, периодически возвращающееся в исходное состояние, то при этом ΔU = 0 и A = Q. Механизм, который мог бы совершать работу без изменения состояния составляющих его тел и без теплообмена с внешними телами, называют «вечным двигателем первого рода». Поэтому первый закон термодинамики можно сформулировать и следующим образом: невозможен вечный двигатель первого рода, т. е. такой двигатель, который при неизменном значении собственной внутренней энергии совершал бы работу большую, чем энергия, получаемая им извне.
Применим первый закон термодинамики к различным изопроцессам изменения состояния идеального одноатомного газа.
Рассмотрим в качестве термодинамической системы идеальный одноатомный газ, находящийся в цилиндрическом сосуде, закрытом поршнем.
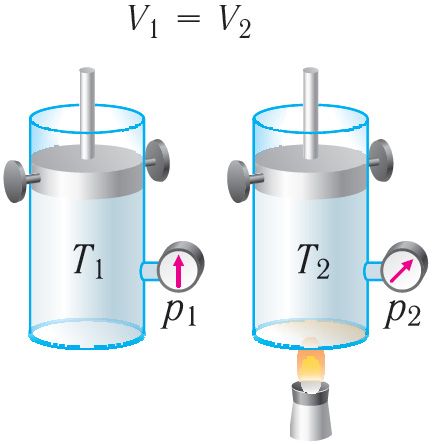
Изохорный процесс. Пусть идеальный одноатомный газ находится в цилиндрическом сосуде, закрытом неподвижным поршнем (V = const). Нагреем цилиндр с газом. Объём газа остаётся практически постоянным (тепловым расширением сосуда пренебрегаем) (рис. 78), следовательно, работа силы давления газа A = 0. Тогда первый закон термодинамики примет вид
Это означает, что всё передаваемое газу количество теплоты идёт на увеличение его внутренней энергии. При этом приращение внутренней энергии газа (рис. 78.1, а). Если же газ при изохорном процессе отдаёт количество теплоты, то его внутренняя энергия убывает:
(рис. 78.1, б).
От теории к практике
1. Каково приращение внутренней энергии идеального газа, если при изохорном процессе от него было отведено количество теплоты Q = –560 Дж?
2. Как изменяются внутренняя энергия и давление определённой массы идеального газа при изохорном повышении температуры?
Изотермический процесс. Пусть цилиндр с газом под поршнем находится в термостате — устройстве, в котором поддерживается постоянная температура. И пусть цилиндр изготовлен из вещества с хорошей теплопроводностью. В этом случае внутренняя энергия идеального одноатомного газа, находящегося в цилиндре, остаётся постоянной, и при медленном перемещении поршня её изменение ΔU = 0. Тогда первый закон термодинамики примет вид
Q = A.
Если с помощью внешнего устройства медленно перемещать поршень в сосуде так, чтобы объём газа увеличивался (ΔV > 0, поскольку V2 > V1) (рис. 79), то работа силы давления расширяющегося газа A > 0 (рис. 79.1, а). При одинаковой первоначальной температуре термостата и газа теплопередача не происходит. Положительная работа силы давления расширяющегося газа совершается за счёт уменьшения его внутренней энергии, а значит, и температуры. Тут же возникает теплопередача от термостата газу. При медленном перемещении поршня в цилиндре температура газа успевает выравняться и реально происходящий процесс близок к изотермическому, при котором расширяющийся газ получает некоторое количество теплоты (Q > 0) от термостата.
Если же внешнее устройство обеспечивает медленное уменьшение объёма газа в сосуде (ΔV < 0, так как V2 < V1), то работа силы давления при сжатии газа A < 0 (рис. 79.1, б) приводит к увеличению внутренней энергии, а следовательно, и его температуры. В результате возникает теплопередача от газа термостату. При сжатии газ отдаёт термостату некоторое количество теплоты Q < 0. Изотермическое сжатие газа происходит за счёт работы внешних сил: A’ > 0.
От теории к практике
1. Сила давления идеального газа при изотермическом расширении совершила работу А = 3640 Дж. Какое количество теплоты получил газ?
2. Возможно ли изотермическое сжатие (расширение) определённой массы идеального газа без теплообмена?
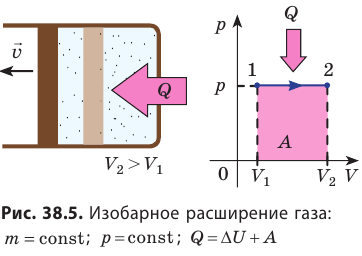
Изобарный процесс. Пусть газ находится в цилиндре, закрытом поршнем, который может свободно или под постоянной нагрузкой перемещаться (рис. 80). Нагреем газ, передав ему некоторое количество теплоты (Q > 0). Согласно первому закону термодинамики, переданное газу количество теплоты частично расходуется на увеличение внутренней энергии (ΔU > 0) системы и частично идёт на совершение работы силой давления газа при его расширении (А > 0, рис. 80.1, а): Q = ΔU + A.
При изобарном процессе работа расширения (сжатия) газа A = pΔV ≠ 0 и первый закон термодинамики принимает вид
Q = ΔU+ pΔV.
При изобарном сжатии газа внешние силы совершают работу A’ > 0. Чтобы давление газа при этом оставалось постоянным, газ необходимо охлаждать, т. е. он должен отдавать в окружающую среду некоторое количество теплоты (Q < 0). Понижение температуры газа при изобарном сжатии приводит к уменьшению его внутренней энергии (ΔU < 0). Работа силы давления газа при сжатии А < 0 (рис. 80.1, б).
От теории к практике
Сила давления идеального газа при изобарном расширении совершила работу А = 320 Дж. При этом газ получил количество теплоты Q = 680 Дж. Каково приращение внутренней энергии идеального газа?
Удельная теплоёмкость вещества зависит не только от его свойств, но и от характера осуществляемого процесса теплообмена. Действительно, из формулы Q = cmΔT следует, что удельная теплоёмкость .
Тогда, согласно первому закону термодинамики, при изохорном процессе удельная теплоёмкость идеального газа , а при изобарном —
. Таким образом, для одинакового увеличения температуры при изобарном нагревании единице массы газа необходимо передать большее количество теплоты, чем при изохорном нагревании, т. е. cp > cV. Это объясняется тем, что при постоянном давлении часть подводимой энергии расходуется на совершение силой давления газа работы при расширении.
Расширение жидких и твёрдых тел при нагревании при постоянном давлении значительно меньше, чем газов, поэтому для них АΔU и их удельные теплоёмкости слабо зависят от характера осуществляемого процесса (ср ≈ сV).
Адиабатный процесс. Адиабатным называют процесс, в ходе которого термодинамическая система не получает и не отдаёт энергию путём теплообмена. Таким образом, при адиабатном процессе:
Q = 0.
Применяя к этому процессу первый закон термодинамики, получим:
ΔU = −A , или A = −ΔU.
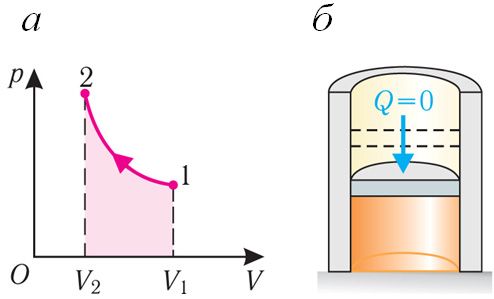
При адиабатном процессе изменение внутренней энергии системы происходит только за счёт совершения работы. Если внешние силы совершают работу по сжатию газа (ΔV < 0, А < 0) (рис. 80.2, а, б), то внутренняя энергия газа увеличивается (ΔU > 0), газ нагревается.
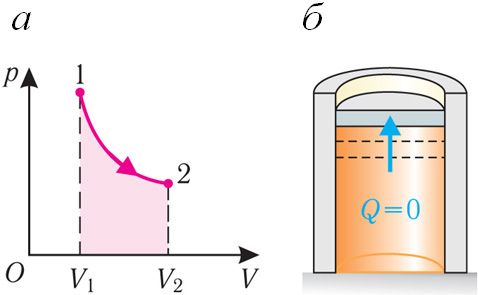
Если сила давления газа совершает работу по расширению (ΔV > 0, А > 0) (рис. 80.3, а, б), то внутренняя энергия газа уменьшается (ΔU < 0), газ охлаждается.
От теории к практике
1. При адиабатном расширении силой давления идеального газа совершена работа А = 265 Дж. Как изменилась при этом температура газа? Определите приращение внутренней энергии газа.
2. В цилиндре с подвижным поршнем находится идеальный газ, давление которого р1 и объём V1. В каком случае сила давления газа совершит большую работу: при изотермическом или адиабатном его расширении до объёма V2?
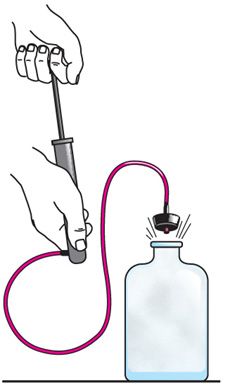
На практике адиабатный процесс осуществляют главным образом не за счёт теплоизоляции (нельзя окружить систему оболочкой, которая абсолютно не допускает теплообмена), а за счёт скорости протекания процесса. Если процесс протекает очень быстро, то теплообмен практически не проявляется. Очень нагляден опыт, иллюстрирующий уменьшение температуры газа при его адиабатном расширении. Если, используя насос, через отверстие в пробке накачивать в стеклянный сосуд воздух (рис. 80.4), то через некоторый промежуток времени сила давления сжатого воздуха совершит работу по преодолению силы трения, которой сосуд действует на пробку, и силы атмосферного давления. Теплообмен между сосудом и окружающими телами не успевает проявиться за тот малый промежуток времени, в течение которого пробка вылетает из сосуда и часть газа выходит из него. Уменьшение внутренней энергии воздуха в сосуде обусловлено не только уменьшением массы, но и понижением его температуры, что приводит к конденсации водяных паров, т. е. к образованию тумана.
Примером адиабатного процесса может служить охлаждение воздуха в атмосфере. Нагретый возле поверхности земли воздух при быстром подъёме в верхние слои атмосферы расширяется почти адиабатно и при этом существенно охлаждается. Водяной пар в нём конденсируется в маленькие капли воды и кристаллики льда, образуя облака. Процесс, близкий к адиабатному, используют в двигателях внутреннего сгорания.
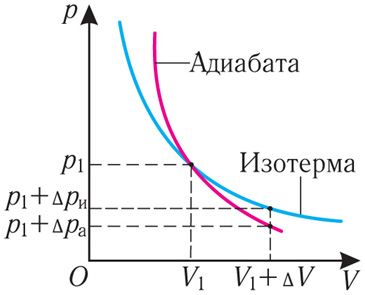
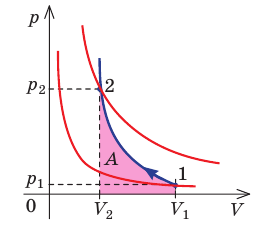
График адиабатного процесса в координатах (p, V) похож на график изотермического процесса (рис. 80.5). Однако одному и тому же изменению объёма ΔV при адиабатном процессе соответствует большее изменение давления, чем при изотермическом: . Это объясняется тем, что в случае адиабатного расширения давление p = nkT уменьшается не только за счёт увеличения объёма газа (и уменьшения концентрации частиц), но и за счёт уменьшения температуры. При изотермическом расширении давление газа уменьшается только за счёт уменьшения концентрации частиц.
1. Приведите две формулировки первого закона термодинамики.
2. Чему равно изменение внутренней энергии при изохорном процессе?
3. На что расходуется количество теплоты, сообщаемое системе при изотермическом процессе?
4. На что расходуется количество теплоты, сообщаемое системе при изобарном процессе?
5. При быстром сжатии газа произошло повышение его температуры. Означает ли это, что газу сообщили некоторое количество теплоты? Можно ли утверждать, что внутренняя энергия газа увеличилась?
6. Почему невозможно создать «вечный двигатель первого рода»?
7. Можно ли передать газу некоторое количество энергии путём теплообмена, не вызывая при этом повышения его температуры? Приведите примеры.
8. Какой процесс изменения состояния газа называют адиабатным? Как этот процесс можно осуществить?
9. В § 12 мы утверждали, что работа, совершаемая при переходе системы из одного состояния в другое, является функцией процесса, т. е. зависит не только от начального и конечного состояний, но и от вида процесса. Используя первый закон термодинамики, докажите, что количество теплоты, получаемое или отдаваемое системой при её переходе из одного состояния в другое, также является функцией процесса.
10. Заполните таблицу в тетради.
| Процесс | Работа силы давления газа | Количество теплоты | Изменение внутренней энергии | Вывод |
| Изохорный (V = const и ΔV = 0) | ||||
| Изотермический (Т = const и ΔТ = 0) | ||||
| Изобарный (р = const) | ||||
| Адиабатный (ΔU = −A) |
Примеры решения задач
Пример 1. Идеальный одноатомный газ, давление которого p = 2,0 · 105 Па, изобарно расширяется так, что его объём возрастает на ΔV = 0,40 м3. Определите приращение внутренней энергии газа и количество теплоты, получаемое им в этом процессе.
Дано:
p = 2,0 · 105 Па
ΔV = 0,40 м3
р = const
ΔU — ?
Q — ?
Решение: Приращение внутренней энергии идеального одноатомного газа При изобарном расширении идеального газа изменение его температуры
связано с изменением объёма
газа соотношением
Тогда . Согласно первому закону термодинамики для изобарного процесса
.
Следовательно, .
Ответ: ΔU = 0,12 МДж, Q = 0,20 МДж.
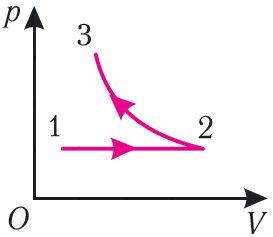
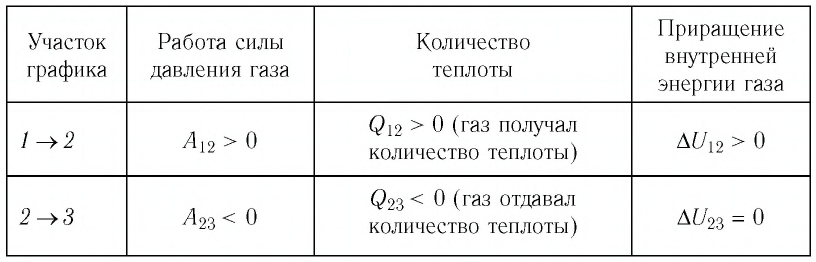
Пример 2. На рисунке 81 представлен график процесса изменения состояния некоторой массы идеального газа (участок 2 3 — изотерма). На каком участке графика работа силы давления газа: а) положительная; б) отрицательная? На каком участке графика газ: а) получал количество теплоты; б) отдавал? Как изменялась внутренняя энергия газа?
Решение. Участок 1 2. Поскольку при постоянном давлении (р = const, р1 = р2) увеличивается объём газа (ΔV12 > 0), то растёт и его температура (ΔТ12 > 0). Следовательно, работа силы давления газа А12 > 0 и приращение его внутренней энергии ΔU12 > 0. Из первого закона термодинамики, записанного в виде Q12 = ΔU12 + А12, следует, что Q12 > 0.
Участок 2 3. Поскольку температура газа не изменяется (Т = const, Т2 = Т3, ΔТ23 = 0), то приращение его внутренней энергии ΔU23 = 0. Объём газа уменьшается (изотермическое сжатие), и работа силы давления газа А23 < 0. Из первого закона термодинамики, записанного в виде Q23 = ΔU23 + А23, следует, что Q23 < 0.
Ответ:
| Участок графика | Работа силы давления газа | Количество теплоты | Приращение внутренней энергии газа |
| 1 |
А12 > 0 | Q12 > 0 (газ получал количество теплоты) | ΔU12 > 0 |
| 2 |
А23 < 0 | Q23 < 0 (газ отдавал количество теплоты) | ΔU23 = 0 |
Решение. а) Так как начальное и конечное состояния для обоих переходов одинаковы, то одинаковы и приращения внутренней энергии:
ΔU123 = ΔU143 = U3 – U1.
б) Рассмотрев рисунок, можно заключить, что площадь фигуры, ограниченной осью OV, изотермой и изохорами, проходящими через точки 3 и 4, меньше площади фигуры, ограниченной осью OV, изотермой и изохорами, проходящими через точки 1 и 2. Следовательно, в процессе перехода 12
3 сила давления газа совершает большую работу, чем в процессе перехода 1
4
3:
А123 > А143.
в) Из первого закона термодинамики следует:
Q123 = ΔU13 + А123, Q143 = ΔU13 + А143.
Поскольку приращение внутренней энергии в обоих случаях одно и то же, а совершённая силой давления газа работа больше при переходе 12
3, то количество теплоты, сообщённое газу, при переходе 1
2
3 также больше: Q123 > Q143.
Ответ: а) ΔU123 = ΔU143; б) А123 > А143; в) Q123 > Q143.
Упражнение 10
1. Определите количество теплоты, сообщённое кислороду, если при изотермическом расширении работа, совершённая силой давления газа, А = 6,4 кДж.
2. С идеальным газом определённой массы осуществлён процесс, график которого представлен на рисунке 82. Чему равна работа силы давления газа? Получал или отдавал газ количество теплоты в этом процессе? Как изменилась внутренняя энергия газа?
Заполните таблицу в тетради (см. пример 2).
| Работа силы давления газа | Количество теплоты | Приращение внутренней энергии газа |
3. С идеальным газом определённой массы осуществлён процесс, график которого представлен на рисунке 83. Определите приращение внутренней энергии газа, если он отдал количество теплоты Q12 = –2,25 кДж.
4. В герметично закрытом баллоне находится азот массой m = 4,00 кг. Определите количество теплоты, сообщённое азоту при повышении его температуры на ΔT = 120 К, если удельная теплоёмкость азота при постоянном объёме .
5. При изобарном расширении силой давления идеального одноатомного газа совершена работа А = 50,0 кДж. Определите приращение внутренней энергии газа и сообщённое ему количество теплоты.
6. Идеальный газ, количество вещества которого постоянно, испытывает адиабатное сжатие. Как изменяются в этом процессе давление и температура газа? Выберите верное утверждение.
1) Давление и температура газа уменьшаются.
2) Давление увеличивается, а температура газа уменьшается.
3) Давление уменьшается, а температура газа увеличивается.
4) Давление и температура газа увеличиваются.
5) Давление увеличивается, а температура газа не изменяется.
7. Гелий, количество вещества которого ν = 2 моль, находившийся при температуре T = 300 К, сначала изобарно нагрели, а затем изохорно перевели в состояние с температурой, равной начальной. Определите, во сколько раз увеличился объём гелия, если алгебраическая сумма количеств полученной и отданной теплоты Q = 5 кДж.
Прежде чем приступить к изучению нового материала, давайте с
вами вспомним, чем мы занимались при изучении молекулярно-кинетической теории.
Там наша основная задача заключалась в установлении связи между
макроскопическими параметрами, характеризующими состояние системы, и её микроскопическими
параметрами. Это позволило нам объяснить, почему газ оказывает давление на
стенки сосуда, что такое температура и так далее.
Также мы с вами вывели уравнение состояния идеального газа. Удалось
нам это сделать только потому, что мы рассматривали самую простую систему —
идеальный газ. Напомним, что в идеальном газе отсутствуют взаимодействия между
молекулами, и поэтому нам не нужно было учитывать потенциальную энергию их взаимодействия.
Однако, если бы мы попытались построить молекулярно-кинетическую теорию
реального газа (не говоря уже о жидкостях и твёрдых телах), то всё было бы
гораздо сложнее, а порой и почти невозможно.
Но существует ещё один раздел молекулярной физики, который
пытается установить соответствия между макроскопическими параметрами, абсолютно
не интересуясь, как устроена система (то есть без учёта молекулярного строения
тел). Этот раздел физики называется термодинамикой.
Интересно, что первой научной теорией тепловых процессов была
не молекулярная физика, а именно термодинамика. Считается, что она берёт своё
начало с работы Сади Карно «О движущей силе огня и о машинах, способных
развивать эту силу», опубликованной в 1824 году.
А становление термодинамики как науки началось примерно в
40-х годах XIX века после того, как Юлиус Майер, Герман
Гельмгольц и Джеймс Джоуль количественно определили связь между механической
работой и теплотой и сформулировали универсальный закон сохранения и
превращения энергии.
Выводы термодинамики основаны на фундаментальных законах,
называемых началами термодинамики. Это не теоретические законы. Все они
были установлены в результате обобщения многочисленных экспериментальных
фактов.
Все физические тела и их модели в термодинамике мы будем
называть термодинамическими системами. При этом для каждой
изолированной термодинамической системы существует состояние термодинамического
равновесия, в которое она переходит самопроизвольно. Это утверждение называют нулевым
началом термодинамики.
Основным понятием в термодинамике является понятие внутренней
энергии, о которой мы говорили ещё в восьмом классе. Давайте с вами
вспомним, что под внутренней энергией тела (или системы тел) понимают сумму
кинетической энергии хаотического теплового движения молекул и потенциальной
энергии их взаимодействия.
Обозначают внутреннюю энергию большой латинской буквой U. А измеряют её в тех же единицах, что и механическую
энергию, то есть в джоулях.
[U] = [Дж].
Теперь давайте с вами вспомним, от каких величин зависит
внутренняя энергия тела или системы тел. Мы уже с вами знаем, что чем выше
температура тела, тем быстрее движутся его молекулы и тем больше их
кинетическая энергия. Значит, внутренняя энергия тела зависит от его
температуры.
Также нам известно, что для перевода вещества, например, из
жидкого состояния в газообразное, нужно к веществу подвести энергию.
Следовательно, пар будет обладать большей внутренней энергией, чем жидкость той
же массы. Значит, внутренняя энергия тела при неизменной массе зависит от
его агрегатного состояния.
Ну а так как масса тела равна сумме масс составляющих его
частиц, то внутренняя энергия зависит и от массы тела.
Но внутренняя энергия тела не зависит от его механического
движения и от его взаимодействия с другими телами. Так, например, внутренняя
энергия мяча, лежащего на полу и поднятого на некоторую высоту от пола,
одинакова, так же как и мяча, неподвижного и катящегося по полу (если, конечно,
пренебречь силами сопротивления его движению).
Рассчитать внутреннюю энергию можно только для идеального
газа. Давайте с вами определим внутреннюю энергию идеального одноатомного газа,
то есть газа, состоящего из отдельных атомов (к такому газу относятся инертные
газы — гелий, неон, аргон и так далее).
Итак, согласно модели идеального газа, его молекулы не
взаимодействуют друг с другом. Поэтому внутренней энергией такого газа является
сумма кинетических энергий хаотического движения всех его молекул или атомов.
Следовательно, внутренняя энергия идеального одноатомного газа равна
произведению средней кинетической энергии теплового движения молекул на их
число:
Число молекул в данной порции газа мы можем легко выразить из
определения количества вещества:
А значение средней кинетической энергии поступательного
движения молекул мы распишем через постоянную Больцмана и абсолютную
температуру:
Перепишем формулу для внутренней энергии с учётом последних
двух формул:
Теперь давайте с вами вспомним, что произведение постоянной
Больцмана и числа Авогадро — это есть универсальная газовая постоянная R. Тогда получаем, что внутренняя энергия идеального
одноатомного газа прямо пропорциональна его абсолютной температуре и не зависит
от других макроскопических параметров системы:
Для примера давайте с вами определим внутреннюю энергию неона
массой 5 г, находящегося при температуре 27 оС.
Как правило, значение внутренней энергии в большинстве
случаев вычислить очень трудно, поскольку каждое тело состоит из огромного
числа частиц. Однако нас чаще будет интересовать не само значение внутренней
энергии, а её изменение, которое происходит при переходе системы из одного
состояния в другое.
Под приращением (или изменением) внутренней энергии
понимают разность внутренних энергий системы в конечном и начальном состояниях:
∆U = U2
– U1.
Например, переход некоторой массы идеального газа из
состояния один в состояние три можно осуществить или в ходе изохорного
нагревания и последующим изобарным расширением, или при изобарном расширении, а
затем при изохорном нагревании. Однако изменение внутренней энергии газа и в одном
и в другом случае будет одинаковым:
∆U123
= ∆U143 = U3 – U1.
Иными словами, внутренняя энергия является функцией состояния
системы. Это означает, что изменение внутренней энергии при переходе
термодинамической системы из одного состояния в другое зависит только лишь от
значений параметров этих состояний, а не от процесса перехода.
В частности, изменение внутренней энергии данной масса идеального
одноатомного газа происходит только при изменении его температуры:
В качестве примера решим такую задачу. На рисунке в
координатах (p, V) изображён процесс перехода идеального одноатомного
газа определённой массы из состояния 1 в состояние 2. Определите приращение
внутренней энергии газа, если его давление в конечном состоянии составляет 2
МПа, а объём в начальном состоянии был равен 3,0 л.
В заключении урока отметим, что при определении внутренней
энергии реальных газов, жидкостей и твёрдых тел необходимо ещё учитывать и потенциальную
энергию взаимодействия частиц, которая зависит от расстояния между ними.
Поэтому в общем случае внутренняя энергия макроскопических тел зависит не
только от абсолютной температуры, но и от объёма.
При изучении физики в восьмом классе вы узнали, что изменить
состояние термодинамической системы можно двумя способами: используя
теплопередачу или совершая работу. Процесс теплопередачи и совершение работы
характеризуют соответственно физическими величинами — количеством теплоты Q и работой А, которые являются мерами изменения
внутренней энергии системы.
Содержание:
- Определение и формула внутренней энергии
- Внутренняя энергия идеального газа
- Первое начало термодинамики
- Единицы измерения внутренней энергии
- Примеры решения задач
Определение и формула внутренней энергии
Определение
Внутренней энергией тела (системы) называют энергию, которая связана со всеми видами движения и взаимодействия частиц,
составляющих тело (систему), включая энергию взаимодействия и движения сложных частиц.
Из выше сказанного следует, что к внутренней энергии не относят кинетическую энергию движения центра масс системы и потенциальную энергию системы, вызванную действием внешних сил. Это энергия, которая зависит только от термодинамического состояния системы.
Внутреннюю энергию чаще всего обозначают буквой U. При этом бесконечно малое ее изменение станет обозначаться dU. Считается, что dU является положительной величиной, если внутренняя энергия системы растет, соответственно, внутренняя энергия отрицательна, если внутренняя энергия уменьшается.
Внутренняя энергия системы тел равна сумме внутренних энергий каждого отдельного тела плюс энергия взаимодействия между телами внутри системы.
Внутренняя энергия – функция состояния системы. Это означает, что изменение внутренней энергии системы при переходе системы из одного состояния в другое не зависит от способа перехода (вида термодинамического процесса при переходе) системы и равно разности внутренних энергий конечного и начального состояний:
$$Delta U=U_{2}-U_{1}(1)$$
Для кругового процесса полное изменение внутренней энергии системы равно нулю:
$$oint d U=0(2)$$
Для системы, на которую не действуют внешние силы и находящуюся в состоянии макроскопического покоя, внутренняя энергия – полная энергия системы.
Внутренняя энергия может быть определена только с точностью до некоторого постоянного слагаемого (U0), которое не определимо
методами термодинамики. Однако, данный факт не существенен, так как при использовании термодинамического анализа, имеют дело с изменениями
внутренней энергии, а не абсолютными ее величинами. Часто U_0 полагают равным нулю. При этом в качестве внутренней энергии рассматривают ее
составляющие, которые изменяются в предлагаемых обстоятельствах.
Внутреннюю энергию считают ограниченной и ее граница (нижняя) соответствует T=0K.
Внутренняя энергия идеального газа
Внутренняя энергия идеального газа зависит только от его абсолютной температуры (T) и пропорциональна массе:
$$U=int_{0}^{T} C_{V} d T+U_{0}=mleft(int_{0}^{T} c_{V} d T+u_{0}right)$$
где CV – теплоемкость газа в изохорном процессе; cV — удельная теплоемкость газа в изохорном процессе;
$u_{0}=frac{U_{0}}{m}$ – внутренняя энергия, приходящаяся на единицу массы газа
при абсолютном нуле температур. Или:
$$d U=frac{i}{2} nu R d T(4)$$
i – число степеней свободы молекулы идеального газа, v – число молей газа, R=8,31 Дж/(моль•К) – универсальная газовая постоянная.
Первое начало термодинамики
Как известно первое начало термодинамики имеет несколько формулировок. Одна из формулировок, которую предложил К.
Каратеодори говорит о существовании внутренней энергии как составляющей полной энергии системы.Она является функцией состояния,
в простых системах зависящей от объема (V), давления (p), масс веществ (mi), которые составляют данную систему:
$U=Uleft(p, V, sum m_{i}right)$ . В формулировке, которую дал Каратеодори внутренняя
энергия не является характеристической функцией своих независимых переменных.
В более привычных формулировках первого начала термодинамики, например, формулировке Гельмгольца внутренняя энергия системы вводится как физическая характеристика системы. При этом поведение системы определено законом сохранения энергии. Гельмгольц не определяет внутреннюю энергию как функцию конкретных параметров состояния системы:
$$Delta U=Q-A(5)$$
$Delta U$ – изменение внутренней энергии в равновесном процессе,
Q – количество теплоты, которое получила система в рассматриваемом процессе, A – работа, которую система совершила.
Единицы измерения внутренней энергии
Основной единицей измерения внутренней энергии в системе СИ является: [U]=Дж
Примеры решения задач
Пример
Задание. Вычислите, на какую величину изменится внутренняя энергия гелия имеющего массу 0,1 кг, если его температура увеличилась на 20С.
Решение. При решении задачи считаем гелий одноатомным идеальным газом, тогда для расчетов можно применить формулу:
$$d U=frac{i}{2} nu R d T(1.1)$$
Так как мы имеем с одноатомным газом, то $i=3 ; nu=frac{m}{mu}$, молярную массу
($mu$) возьмем из таблицы Менделеева
($mu_{H e}=4 cdot 10^{-3}$ кг/моль). Масса газа в представленном процессе
не изменяется, следовательно, изменение внутренней энергии равно:
$$Delta U=int_{T_{1}}^{T_{2}} d U=frac{i}{2} frac{m}{mu} R int_{T_{1}}^{T_{2}} d T=frac{i}{2} frac{m}{mu} Rleft(T_{2}-T_{1}right)$$
где $T_{2}-T_{1}=Delta T=Delta t$
Все величины необходимые для вычислений имеются:
$Delta U=frac{3}{2} cdot frac{0,1}{4 cdot 10^{-3}} cdot 20 cdot 8,31=6,2 cdot 10^{3}$ (Дж)
Ответ. $Delta U=6,2 cdot 10^{3}$ (Дж)

236
проверенных автора готовы помочь в написании работы любой сложности
Мы помогли уже 4 430 ученикам и студентам сдать работы от решения задач до дипломных на отлично! Узнай стоимость своей работы за 15 минут!
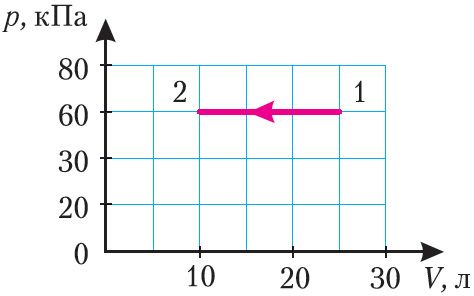
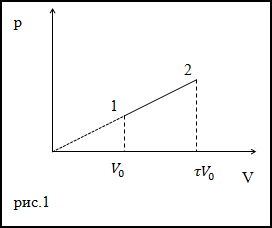
Пример
Задание. Идеальный газ расширили в соответствии с законом, который изображен графиком на рис.1. от начального объема
V0. При расширении объем сал равен $V=tau V_{0}$ .
Каково приращение внутренней энергии газа в заданном процессе? Коэффициент адиабаты равен $gamma$.
Решение. Исходя из рисунка, уравнение процесса можно представить аналитически как:
$$p=alpha V(2.1)$$
Показатель адиабаты связан с числом степеней свободы газа выражением:
$$gamma=frac{i+2}{i}(2.2)$$
Выразим число степеней свободы из (2.2):
$$i=frac{2}{gamma-1}$$
Приращение внутренней энергии для постоянной массы газа (см. Пример 1) найдем в соответствии с формулой:
$$Delta U=frac{i}{2} nu R Delta T(2.4)$$
Запишем уравнения состояний идеального газа для точек (1) и (2) рис.1:
$$
begin{aligned}
p V &=nu R T(2.5) \
p_{0} V_{0} &=nu R T_{0}
end{aligned}
$$
Тогда приращение температуры, учитывая уравнение процесса и выражения (2.5), (2.6) найдем как:
$$
begin{aligned}
Delta T &=T-T_{0}=frac{1}{nu R}left(p V-p_{0} V_{0}right)=frac{1}{nu R}left(alpha V cdot V-alpha V_{0} V_{0}right)=\
&=frac{1}{nu R}left(alpha tau V_{0} cdot tau V_{0}-alpha V_{0} V_{0}right)=frac{1}{nu R} V_{0}^{2} alphaleft(tau^{2}-1right)(2.7)
end{aligned}
$$
Подставим $Delta T$ в выражение для
$Delta U$ (2.4), получим:
$Delta U=frac{i}{2} v R frac{1}{v R} V_{0}^{2} alphaleft(tau^{2}-1right)=frac{1}{gamma-1} V_{0}^{2} alphaleft(tau^{2}-1right)$
Ответ. $Delta U=frac{1}{gamma-1} V_{0}^{2} alphaleft(tau^{2}-1right)$
Читать дальше: Формула времени.