Расчетные задачи типа «Определение выхода продукта реакции в процентах от теоретического»
Признак
В условии задачи встречается слово «выход». Теоретический выход продукта всегда выше практического.
Понятия «теоретическая масса или объём, практическая масса или объём» могут быть использованы только для веществ-продуктов.
Доля выхода продукта обозначается буквой
(эта), измеряется в процентах или долях.
Также для расчётов может использоваться количественный выход:
I. Первый тип задач
Известны масса (объём) исходного вещества и масса (объём) продукта реакции. Необходимо определить выход продукта реакции в %.
Задача 1. При взаимодействии магния массой 1,2 г с раствором серной кислоты получили соль массой 5, 5 г. Определите выход продукта реакции (%).
| 1. Записываем краткое условие задачи |
Дано: m (Mg) = 1,2 г m практическая(MgSO4) = 5,5 г _____________________ Найти: |
|
2. Запишем УХР. Расставим коэффициенты. Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции. |
|
| 3. Находим по ПСХЭ молярные массы подчёркнутых веществ |
M(Mg) = 24 г/моль M(MgSO4) = 24 + 32 + 4 · 16 = 120 г/моль |
|
4. Находим количество вещества реагента по формулам |
ν(Mg) = 1,2 г / 24(г/моль) = 0,05 моль |
| 5. По УХР вычисляем теоретическое количество вещества (νтеор) и теоретическую массу (mтеор) продукта реакции |
m = ν · M mтеор (MgSO4) = M(MgSO4) · νтеор (MgSO4) = = 120 г/моль · 0,05 моль = 6 г |
|
6. Находим массовую (объёмную) долю выхода продукта по формуле |
Ответ: Выход сульфата магния составляет 91,7% по сравнению с теоретическим |
II. Второй тип задач
Известны масса (объём) исходного вещества (реагента) и выход (в %) продукта реакции. Необходимо найти практическую массу (объём) продукта реакции.
Задача 2. Вычислите массу карбида кальция, образовавшегося при действии угля на оксид кальция массой 16,8 г, если выход составляет 80%.
|
1. Записываем краткое условие задачи |
Дано: m(CaO) = 16,8 г
___________________ Найти: m практ (CaC2) = ? |
|
2. Запишем УХР. Расставим коэффициенты. Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции. |
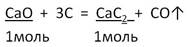 |
|
3. Находим по ПСХЭ молярные массы подчёркнутых веществ |
M(CaO) = 40 + 16 = 56 г/моль M(CaC2) = 40 + 2 · 12 = 64г/моль |
|
4. Находим количество вещества реагента по формулам |
ν(CaO)=16,8 (г) / 56 (г/моль) = 0,3 моль |
|
5. По УХР вычисляем теоретическое количество вещества (νтеор) и теоретическую массу (mтеор) продукта реакции |
|
|
6. Находим массовую (объёмную) долю выхода продукта по формуле |
m практич (CaC2) = 0,8 · 19,2 г = 15,36 г Ответ: m практич (CaC2) = 15,36 г |
III. Третий тип задач
Известны масса (объём) практически полученного вещества и выход этого продукта реакции. Необходимо вычислить массу (объём) исходного вещества.
Задача 3. Карбонат натрия взаимодействует с соляной кислотой. Вычислите, какую массу карбоната натрия нужно взять для получения оксида углерода (IV) объёмом 28,56 л (н. у.). Практический выход продукта 85%.
| 1. Записываем краткое условие задачи |
Дано: н. у. Vm = 22,4 л/моль Vпрактич(CO2) = 28,56 л = 85% или 0,85 ____________________ Найти: m(Na2CO3) =? |
| 2. Находим по ПСХЭ молярные массы веществ, если это необходимо | M (Na2CO3) =2·23 + 12 + 3·16 = 106 г/моль |
|
3. Вычисляем теоретически полученный объём (массу) и количество вещества продукта реакции, используя формулы: |
Vтеоретич(CO2) = = 28,56 л / 0,85 = 33,6 л ν(CO2) = 33,6 (л) / 22,4 (л/моль) = 1,5 моль |
|
4. Запишем УХР. Расставим коэффициенты. Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции. |
|
| 5. Находим количество вещества реагента по УХР |
По УХР:
ν(Na2CO3) = ν(CO2) = 1,5 моль |
|
6. Определяем массу (объём) реагента по формуле: m = ν · M V = ν · Vm |
m = ν · M m(Na2CO3) = 106 г/моль · 1,5 моль = 159 г |
IV. Решите задачи
Задача №1. При взаимодействии натрия количеством вещества 0, 5 моль с водой получили водород объёмом 4,2 л (н. у.). Вычислите практический выход газа (%).
Задача №2. Металлический хром получают восстановлением его оксида Cr2O3 металлическим алюминием. Вычислите массу хрома, который можно получить при восстановлении его оксида массой 228 г, если практический выход хрома составляет 95 %.
Задача №3. Определите, какая масса меди вступит в реакцию с концентрированной серной кислотой для получения оксида серы (IV) объёмом 3 л (н.у.), если выход оксида серы (IV) составляет 90%.
Задача №4. К раствору, содержащему хлорид кальция массой 4,1 г, прилили раствор, содержащий фосфат натрия массой 4,1 г. Определите массу полученного осадка, если выход продукта реакции составляет 88 %.
Загрузить PDF
Загрузить PDF
В химии теоретический выход – это максимальное количество продукта, которое получается в результате химической реакции. На самом деле большинство реакций не являются идеальными, то есть практический выход продукта всегда меньше теоретического. Чтобы вычислить эффективность реакции, необходимо найти процент выхода продукта по формуле: выход (%) = (практический выход/теоретический выход) x100. Если процент выхода равен 90%, это означает, что реакция эффективна на 90%, а 10% реагентов были потрачены впустую (они не вступили в реакцию или не соединились).
-
1
Начните со сбалансированного химического уравнения. Химическое уравнение включает реагенты (слева от знака равенства) и образующиеся продукты (справа от знака равенства). В некоторых задачах химическое уравнение дано, а в других его надо написать. Во время химической реакции атомы не создаются и не уничтожаются, поэтому у каждого элемента должно быть одинаковое число атомов слева и справа от знака равенства.[1]
-
2
Найдите молярную массу каждого исходного вещества. Определите молярную массу каждого атома вещества, а затем сложите молярные массы, чтобы вычислить молярную массу всего вещества. Сделайте это для одной молекулы реагента.
-
3
Преобразуйте массу каждого реагента из граммов в число молей. Теперь рассмотрите реакцию, которую вы собираетесь провести. Запишите массу каждого реагента в граммах. Полученное значение разделите на молярную массу вещества, чтобы преобразовать граммы в число молей.[2]
-
4
Найдите молярное соотношение реагентов. Помните, что моль – это величина, которая используется химиками для «подсчета» молекул. Вы определили количество молекул каждого исходного вещества. Разделите число молей одного реагента на число молей другого, чтобы найти молярное соотношение двух реагентов.
- Вы взяли 1,25 моль кислорода и 0,139 моль глюкозы. Молярное соотношение кислорода и глюкозы: 1,25/0,139 = 9. Это означает, что на 1 молекулу глюкозы приходятся 9 молекул кислорода.
-
5
Найдите оптимальное соотношение реагентов. Вернитесь к сбалансированному уравнению, которое вы записали ранее. С помощью этого уравнения можно определить оптимальное соотношение реагентов, то есть соотношение, при котором оба вещества будут израсходованы одновременно.
- Левая сторона уравнения:
. То есть на 1 одну молекулу глюкозы приходятся 6 молекул кислорода. Оптимальное соотношение реагентов: 6 кислород/ 1 глюкоза = 6.
- Не перепутайте вещества, которые находятся в числителе и в знаменателе дроби. Если поделить кислород на глюкозу, а потом глюкозу на кислород, вы получите неправильный результат.
- Левая сторона уравнения:
-
6
Сравните соотношения, чтобы найти ключевой компонент реакции. В химической реакции один реагент расходуется быстрее другого. Такой ключевой реагент определяет скорость химической реакции. Сравните два соотношения, которые вы вычислили, чтобы найти ключевой реагент:[3]
- Если молярное соотношение больше оптимального, вещества, которое находится в числителе дроби, слишком много. При этом вещество, которое находится в знаменателе дроби, является ключевым реагентом.
- Если молярное соотношение меньше оптимального, вещества, которое находится в числителе дроби, слишком мало и оно является ключевым реагентом.
- В нашем примере молярное соотношение (кислород/глюкоза = 9) больше оптимального соотношения (кислород/глюкоза = 6). Таким образом, вещество, которое находится в знаменателе дроби (глюкоза), является ключевым реагентом.
Реклама
-
1
Определите продукты реакции. В правой части химического уравнения перечислены продукты реакции. Каждый продукт имеет теоретический выход, то есть количество продукта, которое получится в случае идеальной реакции.
-
2
Запишите число молей ключевого реагента. Теоретический выход продукта равен количеству продукта, который получится при идеальных условиях. Чтобы вычислить теоретический выход, начните с числа молей ключевого реагента (читайте предыдущий раздел).
- В нашем примере вы выяснили, что ключевым реагентом является глюкоза. Также вы вычислили, что взяли 0,139 моль глюкозы.
-
3
Найдите соотношение молекул продукта и реагента. Вернитесь к сбалансированному уравнению. Разделите количество молекул продукта на количество молекул ключевого реагента.
-
4
Умножьте полученное соотношение на количество реагента в молях. Так вы получите теоретический выход продукта (в молях).
- Вы взяли 0,139 моль глюкозы, а отношение углекислого газа к глюкозе равно 6. Теоретический выход углекислого газа: (0,139 моль глюкозы) x (6 моль углекислого газа/1 моль глюкозы) = 0,834 моль углекислого газа.
-
5
Полученный результат преобразуйте в граммы. Полученное число молей умножьте на молярную массу продукта, чтобы найти теоретический выход в граммах. Эту единицу измерения можно использовать в большинстве экспериментов.
- Например, молярная масса CO2 приблизительно равна 44 г/моль (молярная масса углерода ≈ 12 г/моль, молярная масса кислорода ≈ 16 г/моль, поэтому 12 + 16 + 16 = 44).
- Перемножьте: 0,834 моль CO2 x 44 г/моль CO2 ≈ 36,7 г. Теоретический выход продукта равен 36,7 г CO2.
Реклама
-
1
Уясните, что такое процент выхода. Теоретический выход предполагает, что реакция прошла идеально. На самом деле, идеальных реакций не бывает: нежелательные примеси и другие непредсказуемые проблемы приводят к тому, что часть реагентов не преобразуется в продукт. Поэтому в химии используются три понятия, которые характеризуют выход продукта:
- Теоретический выход – это максимальное количество продукта, которое может получиться в результате реакции.
- Практический выход – это реальное количество продукта, масса которого измеряется на весах.
- Процент выхода = (практический выход/теоретический выход)*100%. Например, если процент выхода равен 50%, это означает, что количество продукта составляет 50% от теоретически возможного.
-
2
Запишите практический выход продукта. Если вы провели эксперимент самостоятельно, соберите продукт реакции и взвесьте его на весах, чтобы найти его массу. Если перед вами химическая задача или результаты чужого эксперимента, практический выход будет дан.
- Предположим, что в результате реакции вы получили 29 г CO2.
-
3
Разделите практический выход на теоретический. Убедитесь, что вы используете одну и ту же единицу измерения для обоих значений (обычно граммы). Результат запишите без единицы измерения.
- Практический выход равен 29 г, а теоретический выход равен 36,7 г:
- Практический выход равен 29 г, а теоретический выход равен 36,7 г:
-
4
Результат умножьте на 100, чтобы получить проценты. Так вы вычислите процент выхода продукта.
- 0,79 x 100 = 79, то есть процент выхода продукта равен 79%. Таким образом, в результате реакции получилось 79% от максимально возможного количества CO2.
Реклама
Советы
- Некоторые учащиеся путают процентный выход (количество практического выхода по отношению к теоретическому) с процентной погрешностью (как практический выход отличается от теоретического). Формула для вычисления процента выхода (процентного выхода): (практический выход/теоретический выход)*100%. Чтобы вычислить процентную погрешность, в знаменателе этой формулы нужно записать разность между практическим и теоретическим выходам.
- Если вы получили совершенно разные результаты, проверьте единицы измерения. Если практический выход отличается от теоретического на порядок или больше, скорее всего, на каком-то этапе вычислений вы использовали неправильные единицы измерения. Повторите вычисления и следите за единицами измерения.
- Если процент выхода больше 100%, и вы уверены в правильности вычислений, продукт имеет нежелательные примеси. Очистите продукт (например, высушите или отфильтруйте его), а затем снова взвесьте.
Реклама
Об этой статье
Эту страницу просматривали 51 655 раз.
Была ли эта статья полезной?
Download Article
Download Article
In chemistry, the theoretical yield is the maximum amount of product a chemical reaction could create based on chemical equations. In reality, most reactions are not perfectly efficient. If you perform the experiment, you’ll end up with a smaller amount, the actual yield. To express the efficiency of a reaction, you can calculate the percent yield using this formula: %yield = (actual yield/theoretical yield) x 100. A percent yield of 90% means the reaction was 90% efficient, and 10% of the materials were wasted (they failed to react, or their products were not captured).
-
1
Start with a balanced chemical equation. A chemical equation describes the reactants (on the left side) reacting to form products (on the right side). Some problems will give you this equation, while others ask you to write it out yourself, such as for a word problem. Since atoms are not created or destroyed during a chemical reaction, each element should have the same number of atoms on the left and right side.[1]
-
2
Calculate the molar mass of each reactant. Look up the molar mass of each atom in the compound, then add them together to find the molar mass of that compound. Do this for a single molecule of the compound.
Advertisement
-
3
Convert the amount of each reactant from grams to moles. Now it’s time to look at the specific experiment you are studying. Write down the amounts of each reactant in grams. Divide this value by that compound’s molar mass to convert the amount to moles.[2]
-
4
Find the ratio of your reactions. A mole is an exact number for the amount of a substance and it is equal to 6.022 times 10 to the 23rd power elementary entities, which could be atoms, ions, electrons, or molecules. You now know how many molecules of each reactant you started with. Divide the moles of 1 reactant with the moles of the other to find the ratio of the 2 molecules.[3]
- You started with 1.25 moles of oxygen and 0.139 moles of glucose. The ratio of oxygen to glucose molecules is 1.25 / 0.139 = 9.0. This means you started with 9 molecules of oxygen for every 1 molecule of glucose.
-
5
Find the ideal ratio for the reaction. Go back to the balanced equation you wrote down earlier. This balanced equation tells you the ideal ratio of molecules: if you use this ratio, both reactants will be used up at the same time.
- The left side of the equation is
. The coefficients tell you there are 6 oxygen molecules and 1 glucose molecule. The ideal ratio for this reaction is 6 oxygen / 1 glucose = 6.0.
- Make sure you list the reactants in the same order you did for the other ratio. If you use oxygen/glucose for 1 and glucose/oxygen for the other, your next result will be wrong.
- The left side of the equation is
-
6
Compare the ratios to find the limiting reactant. In a chemical reaction, 1 of the reactants gets used up before the others. The quantity of the product that is created in the reaction is limited by the reagent. Compare the 2 ratios you calculated to identify the limiting reactant:[4]
- If the actual ratio is greater than the ideal ratio, then you have more of the top reactant than you need. The bottom reactant in the ratio is the limiting reactant.
- If the actual ratio is smaller than the ideal ratio, you don’t have enough of the top reactant, so it is the limiting reactant.
- In the example above, the actual ratio of oxygen/glucose (9.0) is greater than the ideal ratio (6.0). The bottom reactant, glucose, must be the limiting reactant.
Advertisement
-
1
Identify your desired product. The right side of a chemical equation lists the products created by the reaction. Each product has a theoretical yield, meaning the amount of product you would expect to get if the reaction is perfectly efficient.[5]
-
2
Write down the number of moles of your limiting reactant. The theoretical yield of an experiment is the amount of product created in perfect conditions. To calculate this value, begin with the amount of limiting reactant in moles. (This process is described above in the instructions for finding the limiting reactant.)[6]
- In the example above, you discovered that glucose was the limiting reactant. You also calculated that you started with 0.139 moles of glucose.
-
3
Find the ratio of molecules in your product and reactant. Return to the balanced equation. Divide the number of molecules of your desired product by the number of molecules of your limiting reactant.[7]
-
4
Multiply the ratio by the reactant’s quantity in moles. The answer is the theoretical yield of the desired product in moles.
- You started with 0.139 moles of glucose and the ratio of carbon dioxide to glucose is 6. The theoretical yield of carbon dioxide is (0.139 moles glucose) x (6 moles carbon dioxide / mole glucose) = 0.834 moles carbon dioxide.
-
5
Convert the result to grams. Multiply your answer in moles by the molar mass of that compound to find the theoretical yield in grams. This is a more convenient unit to use in most experiments.
- For example, the molar mass of CO2 is about 44 g/mol. (Carbon’s molar mass is ~12 g/mol and oxygen’s is ~16 g/mol, so the total is 12 + 16 + 16 = 44.)
- Multiply 0.834 moles CO2 x 44 g/mol CO2 = ~36.7 grams. The theoretical yield of the experiment is 36.7 grams of CO2.
Advertisement
-
1
Understand percent yield. The theoretical yield you calculated assumes that everything went perfectly. In an actual experiment, this never happens: contaminants and other unpredictable problems mean that some of your reactants will fail to convert to the product. This is why chemists use 3 different concepts to refer to yield:[8]
- The theoretical yield is the maximum amount of product the experiment could make.
- The actual yield is the actual amount you created, measured directly on a scale.
- The percent yield =
. A percent yield of 50%, for instance, means you ended up with 50% of the theoretical maximum.
-
2
Write down the actual yield of the experiment. If you performed the experiment yourself, gather the purified product from your reaction and weigh it on a balance to calculate its mass. If you are working on a homework problem or someone else’s notes, the actual yield should be listed.[9]
- Let’s say our actual reaction yields 29 grams of CO2.
-
3
Divide the actual yield by the theoretical yield. Make sure you use the same units for both values (typically grams). Your answer will be a unit-less ratio.[10]
- The actual yield was 29 grams, while the theoretical yield was 36.7 grams.
.
- The actual yield was 29 grams, while the theoretical yield was 36.7 grams.
-
4
Multiply by 100 to convert to a percentage. The answer is the percent yield.
- 0.79 x 100 = 79, so the percent yield of the experiment is 79%. You created 79% of the maximum possible amount of CO2.
Advertisement
Add New Question
-
Question
Why is percent yield important in chemistry?
Meredith Juncker is a PhD candidate in Biochemistry and Molecular Biology at Louisiana State University Health Sciences Center. Her studies are focused on proteins and neurodegenerative diseases.
Scientific Researcher
Expert Answer
Percent yield is important because many chemical reactions form byproducts, meaning not all the reactants in the equation actually react. This is important in the manufacturing of products because a low percent yield would indicate that the company is wasting reactants and money.
-
Question
How do you increase percent yield in chemistry?
Meredith Juncker is a PhD candidate in Biochemistry and Molecular Biology at Louisiana State University Health Sciences Center. Her studies are focused on proteins and neurodegenerative diseases.
Scientific Researcher
Expert Answer
To increase percent yield, you can either increase the concentration and/or surface area of your reactants. Adding a catalyst to your reaction may also improve percent yield.
-
Question
If in the reaction is below 32 of C2H6 and produces 44 grams of CO2, what is the percent yield?
Meredith Juncker is a PhD candidate in Biochemistry and Molecular Biology at Louisiana State University Health Sciences Center. Her studies are focused on proteins and neurodegenerative diseases.
Scientific Researcher
Expert Answer
If the reaction you are referring to is 2C2H6 + 7O2 —> 4CO2 + 6H2O then you would find the percent yield as follows:
1) 32g C2H6 * (1mol C2H6/30.08g C2H6)* (4mol CO2/2mol C2H6) *(44.01g CO2/1mol CO2) = 93.64g CO2.
This is your theoretical yield based on the 32g of C2H6 you started with and the molar ratio between C2H6 and CO2 in your balanced equation.
2) Your experiment produced 44g of CO2, so your actual yield is 44g CO2.
% yield = (actual yield/theoretical yield) x 100
(44g CO2/93.64g CO2) x 100 = 46.99%
See more answers
Ask a Question
200 characters left
Include your email address to get a message when this question is answered.
Submit
Advertisement
-
Some students confuse percent yield (how much you obtained out of the total possible amount) with percent error (how far off an experimental result is from the expected result). The correct percent yield formula is
. If you’re subtracting the 2 yields, you’re using the percent error formula instead.
-
If you get wildly different results, check your units. If your actual yield is different from your theoretical yield by an order of magnitude or more, you probably used the wrong units at some point in your calculations. Repeat the calculations and keep track of your units each step of the way.
-
If your percent yield is greater than 100% (and you’re sure your math is right), other substances have contaminated your product. Purify the product (such as by drying or filtering) and weigh it again.
Advertisement
Video
About This Article
Article SummaryX
To calculate a percentage yield in chemistry, start with a balanced chemical equation, with the reactants on the left side and the products on the right. Calculate the molar mass of each reactant and convert the amount of each reactant from grams to moles. Divide the moles of one reactant with the moles of the other to find the ratio of the 2 molecules, then find the ideal ratio for the reaction. Compare the ratios to find the limiting reactant. If you want to learn more, like how to find the theoretical yield of an experiment, keep reading the article!
Did this summary help you?
Thanks to all authors for creating a page that has been read 2,662,331 times.
Did this article help you?
3 сентября 2021 г.
В химии процент выхода используется, чтобы помочь вам определить, насколько эффективным был эксперимент. Результаты часто отличаются от сделанных прогнозов или гипотез. Несоответствие между фактическим результатом и вашим ожидаемым результатом рассчитывается с использованием процентной доходности. В этой статье мы рассмотрим, что такое процентная доходность, и определим три основных этапа расчета процентной доходности.
Что такое процентная доходность?
Выход в процентах — это рассчитанное число, указывающее разницу в процентах между теоретическим выходом и фактическим выходом в эксперименте. При экспериментировании с различными растворами или при производстве химических растворов у вас есть побочные продукты и фактические предполагаемые продукты. Побочные продукты — это то, что остается и непригодно для использования после производства или эксперимента. При производстве с использованием химического процесса меньшее количество побочных продуктов снижает себестоимость производства, поскольку уменьшается количество отходов. Выход в процентах покажет, сколько продукта осталось, и поможет вам сформулировать план по уменьшению количества отходов во время химических реакций.
Теоретический выход
Теоретический выход — это количество потенциальных продуктов, образующихся при реакции химических веществ. При этом предполагается, что все продукты были использованы на полную мощность и реакция не закончилась досрочно. Теоретический выход важно знать и определять на начальных уровнях химии, а также в передовой практике химического машиностроения и других областях, поскольку он указывает на эффективность реакции. Чтобы производить продукты на основе химических веществ, вам важно знать, как снизить себестоимость производства и максимально использовать материалы с минимальными отходами или без них.
В основе этой идеи лежит прежде всего сбалансированное уравнение. Как только уравнение сбалансировано, рассчитайте теоретическую доходность.
Как рассчитать теоретическую доходность
Чтобы рассчитать теоретический выход и обеспечить наличие правильного количества каждого реагента для эффективного использования всех материалов, вы можете использовать следующую формулу в качестве основы.
1. Определяем количество родинок
В зависимости от вашего химического вещества, будь оно твердым, жидким или газообразным, вы определите количество молей для каждого используемого реагента. Для твердых тел масса химического реагента делится на его молекулярную массу. Если вы работаете с жидкостями или газами, вам нужно будет умножить объем и плотность и, наконец, разделить на молекулярную массу.
2. Определить лимитирующий реагент
Определите химический реагент с наименьшим числом молей, умножив молекулярную массу на число молей в каждом уравнении. Ответ, который дает наименьшее число, является лимитирующим реагентом. Это реагент, который у вас закончится быстрее всего, что ограничит ваши результаты или продукт.
3. Определяем соотношение
Используя химическое уравнение, умножьте соотношение между ограничивающим реагентом и продуктом, ограничив количество молей реагента.
4. Умножить снова
Последним шагом к определению теоретического выхода является умножение количества молей продукта на молекулярную массу продукта.
Прочитайте больше: Узнайте о том, чтобы быть фармацевтом
Фактическая доходность
Фактический выход – это реальное количество продукта, полученного в результате химической реакции. Если теоретический выход представляет собой количество, которое может быть получено в результате реакции, и предполагает 100%-ный результат продукта, фактический выход обычно меньше. Это связано с тем, что мало реагентов доходит до завершения или не все продукты могут быть получены. Если полученный продукт необходимо отфильтровать или он прилипает к внутренней части стакана, эти переменные влияют на фактический выход. Формула для определения фактической доходности проста: вы умножаете процентную и теоретическую доходность вместе.
Лимитирующий реагент и избыточный реагент
В химической реакции у вас есть как лимитирующие реагенты, так и избыточные реагенты. Ограничивающие реагенты имеют меньшее количество и определяют, сколько продукта получится. Поэтому лимитирующие реагенты часто равны продукту. Избыточные реагенты — это химикат или оставшиеся химикаты, побочные продукты реакции. Ограничивающий реагент важен, потому что для более высокой эффективности вам нужна сбалансированная реакция. Соотношение ограничивающего реагента или ограничивающего реагента и избытка реагента должно быть как можно ближе к 1:1. Чем более сбалансировано решение, тем меньше отходов.
Как рассчитать доходность в процентах за 4 шага
Рассчитайте доходность в процентах, используя следующие шаги:
-
Определить теоретический выход. Теоретический выход важен, потому что он указывает на потенциальные результаты или продукт реакции при максимальной производительности.
-
Запишите фактическую доходность. При расчете фактический выход показывает истинное количество продукта, полученного в результате реакции.
-
Разделите фактический выход на теоретический выход. Разделив фактический выход на теоретический, можно получить десятичный процент процентного выхода.
-
Умножьте на 100, чтобы перевести в проценты. Чтобы найти процентный выход и рассчитать полный процент, возьмите десятичные результаты из предыдущего шага и умножьте его на 100. Это процентный выход химической реакции, который помогает получить наибольшее количество продукта с наименьшими отходами, а также служит для указания эффективность метода.
Пример
В частности, при производстве лекарств знание процентного выхода сохраняет чистоту химического вещества и лекарства. Сбалансированное уравнение с самого начала при производстве или проведении химических реакций также снизит вероятность загрязнения. Вот пример шагов, которые необходимо предпринять для определения процентной доходности:
Если ваш продукт содержит 0,198 г ацетаминофена, используйте 0,157 г п-ацетаминофенола и 0,486 г ангидрида уксусной кислоты. Р-ацетаминофенол является лимитирующим реагентом.
-
Чтобы определить теоретический выход, умножьте массу ацетаминофена, указанную как 0,157 г, на молярную массу ацетаминофена. В данном случае это 151,2 г. В результате теоретический выход составляет 0,217 г.
-
Затем определите десятичный процент выхода, используя химическую формулу. Фактический выход ацетаминофена составляет 0,198 г, и его делят на теоретический выход 0,217 г. Обратите внимание, что указанный фактический выход был на 0,19 меньше теоретического выхода. Десятичный процент процентной доходности равен 0,91244.
-
Чтобы определить процентный выход и определить, насколько эффективна химическая реакция, умножьте десятичный процент 0,91244 на 100. Процентный выход равен 91,2. В этой химической реакции остается менее 10% побочных продуктов, что приводит к небольшому количеству отходов, что делает метод эффективным.
Здравствуйте! Друзья!
Сегодня
мы познакомимся и научимся решать ещё один тип расчетных задач, связанных с
вычислениями по уравнению химической реакции. Это расчетные задачи типа
«Определение выхода продукта реакции в процентах от теоретического».
На
уроке нам понадобятся:
1.
Периодическая система химических элементов Д. И. Менделеева.
2.
Калькулятор.
3.
И, как всегда, огромное желание научиться чему-то новому!
Желаю вам успехов!
Задачи
на вычисление выхода продукта реакции от теоретически возможного
Признак
В условии задачи встречается слово
«выход». Теоретический выход продукта всегда выше практического.
Понятия «теоретическая масса или объём,
практическая масса или объём» могут быть использованы только для
веществ-продуктов.
Массовая доля выхода продукта обозначается
буквой h (эта), измеряется в процентах или долях,
объёмная доля выхода продукта может обозначаться в различных источниках h (эта)
Также для расчётов может использоваться
отношения количеств веществ:
Первый
тип задач – Известны масса (объём) исходного
вещества и масса (объём) продукта реакции. Необходимо определить выход продукта
реакции в %.
Задача
1. При взаимодействии магния массой 1,2 г с раствором серной кислоты получили
соль массой 5, 5 г. Определите выход продукта реакции (%).
|
1. |
Дано: m(Mg) = 1,2 г mпрактическая (MgSO4) = 5,5 _____________________ Найти:
|
|
2. Запишем Под |
|
|
3. |
M(Mg) = 24 г/моль M(MgSO4) = 24 |
|
4. |
ν(Mg) = 1,2 г / 24(г/моль) = 0,05 |
|
5. По |
m = ν · M mтеор (MgSO4) = M(MgSO4) · νтеор (MgSO4) = = 120 г/моль · 0,05 моль = 6 г |
|
6. Находим |
Ответ: Выход сульфата магния составляет |
Второй
тип задач – Известны масса (объём) исходного
вещества (реагента) и выход (в %) продукта реакции. Необходимо найти
практическую массу (объём) продукта реакции.
Задача
2. Вычислите массу карбида кальция, образовавшегося при действии угля на оксид
кальция массой 16,8 г, если выход составляет 80%.
|
1. |
Дано: m(CaO) = 16,8 г
____________________ Найти: mпракт (CaC2) = ? |
|
2. Запишем Под |
|
|
3. |
M(CaO) = 40 + 16 = 56 M(CaC2) = 40 + |
|
4. |
ν(CaO) = 16,8 (г) / 56 |
|
5. По |
|
|
6. Находим |
mпрактич (CaC2) = 0,8 Ответ: mпрактич (CaC2) = 15,36 |
Третий
тип задач – Известны масса (объём) практически
полученного вещества и выход этого продукта реакции. Необходимо вычислить массу
(объём) исходного вещества.
Задача
3. Карбонат натрия взаимодействует с соляной кислотой. Вычислите, какую массу
карбоната натрия нужно взять для получения оксида углерода (IV)
объёмом 28,56 л (н. у.). Практический выход продукта 85%.
|
1. |
Дано: н. у. Vm = 22,4 л/моль Vпрактич(CO2) = φ = 85% или 0,85 _____________________ Найти: m(Na2CO3) =? |
|
2. Находим |
M (Na2CO3) =2·23 + |
|
3. |
Vтеоретич(CO2) = Vпрактич(CO2) / 0,85 = 28,56 л / 0,85 = 33,6 л ν(CO2) = 33,6 |
|
4. Запишем Под |
|
|
5. |
По УХР: , следовательно ν(Na2CO3) = ν(CO2) = 1,5 моль |
|
5. Определяем m V |
m = ν · M m (Na2CO3) = 106 |





















































