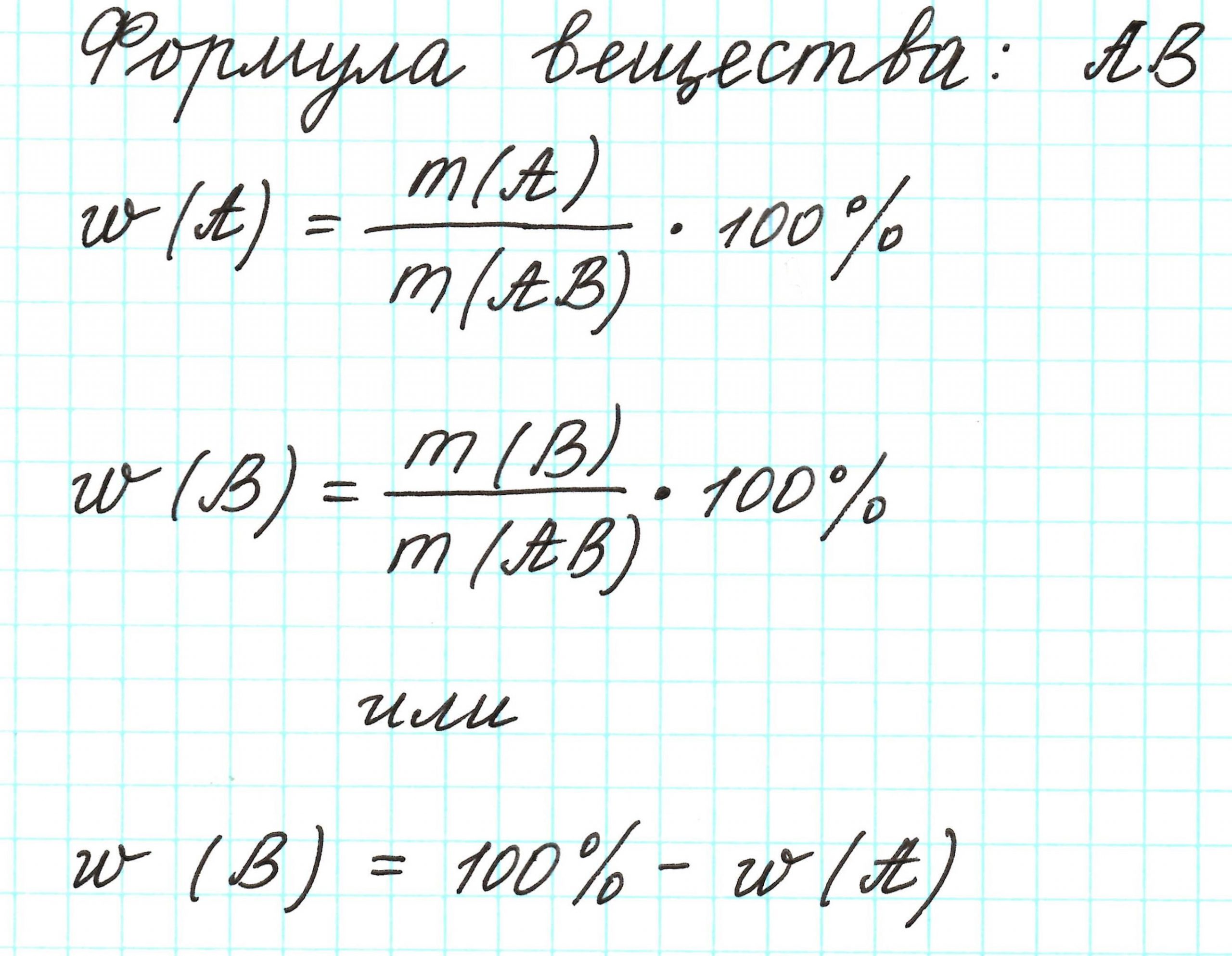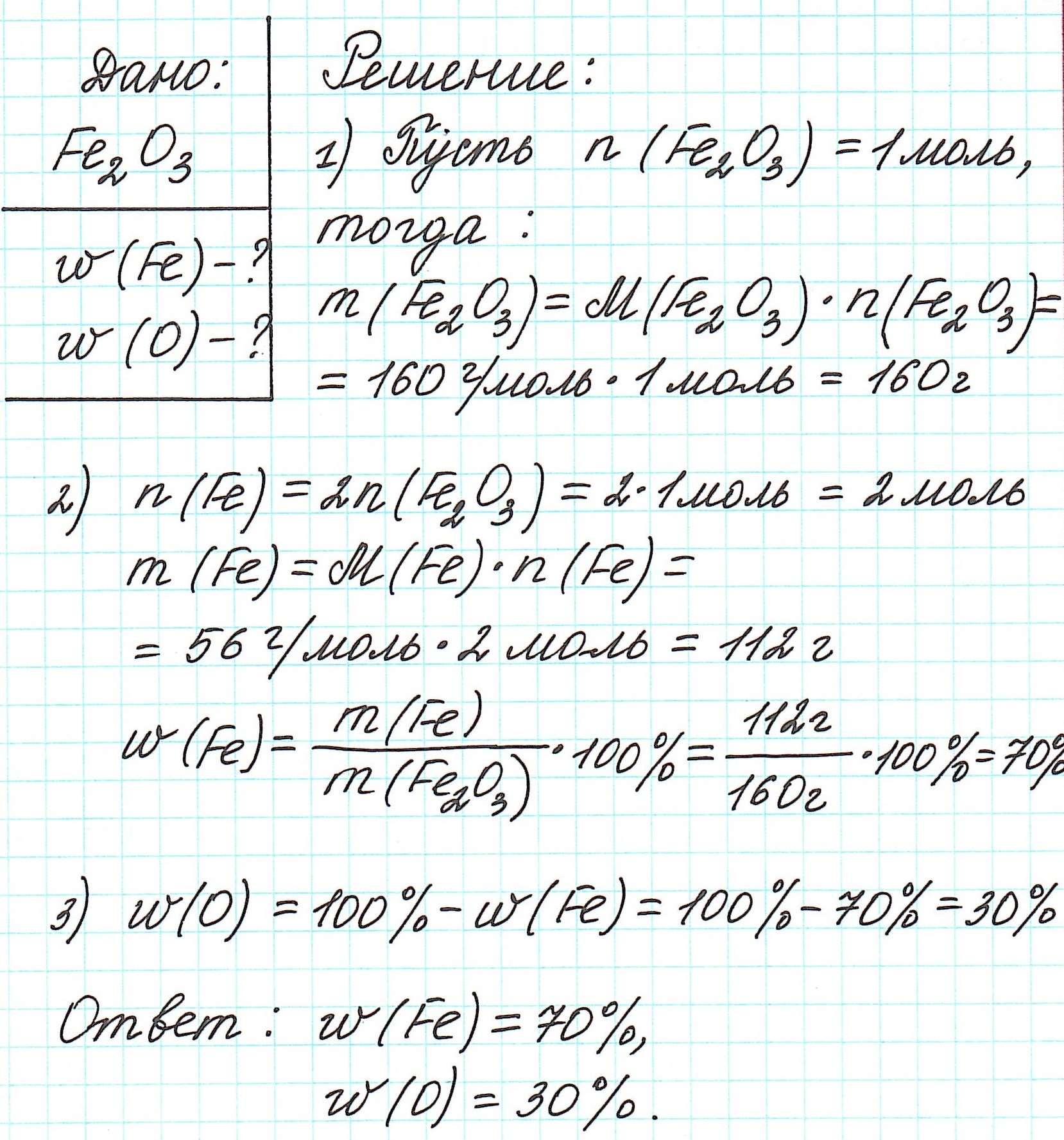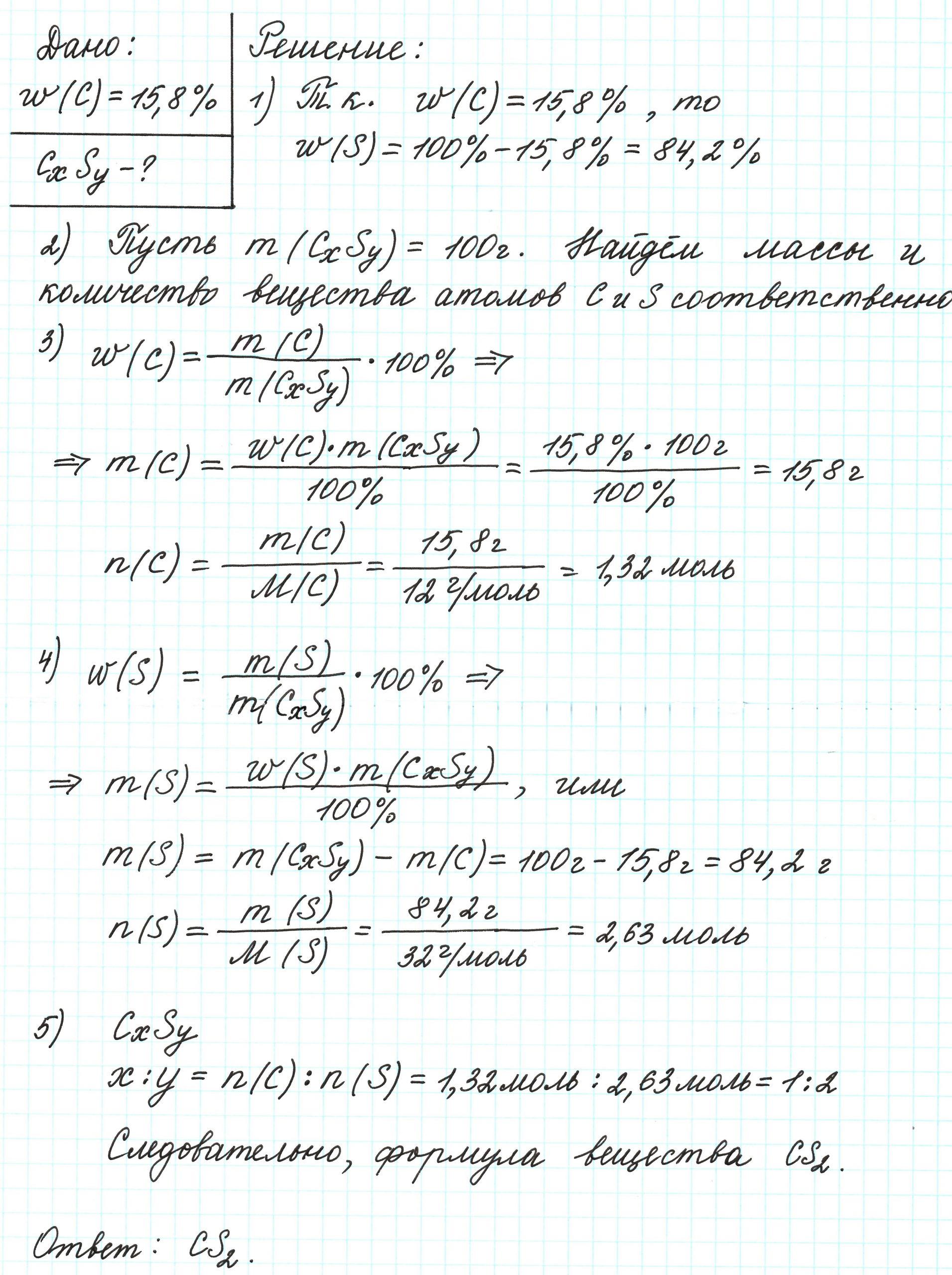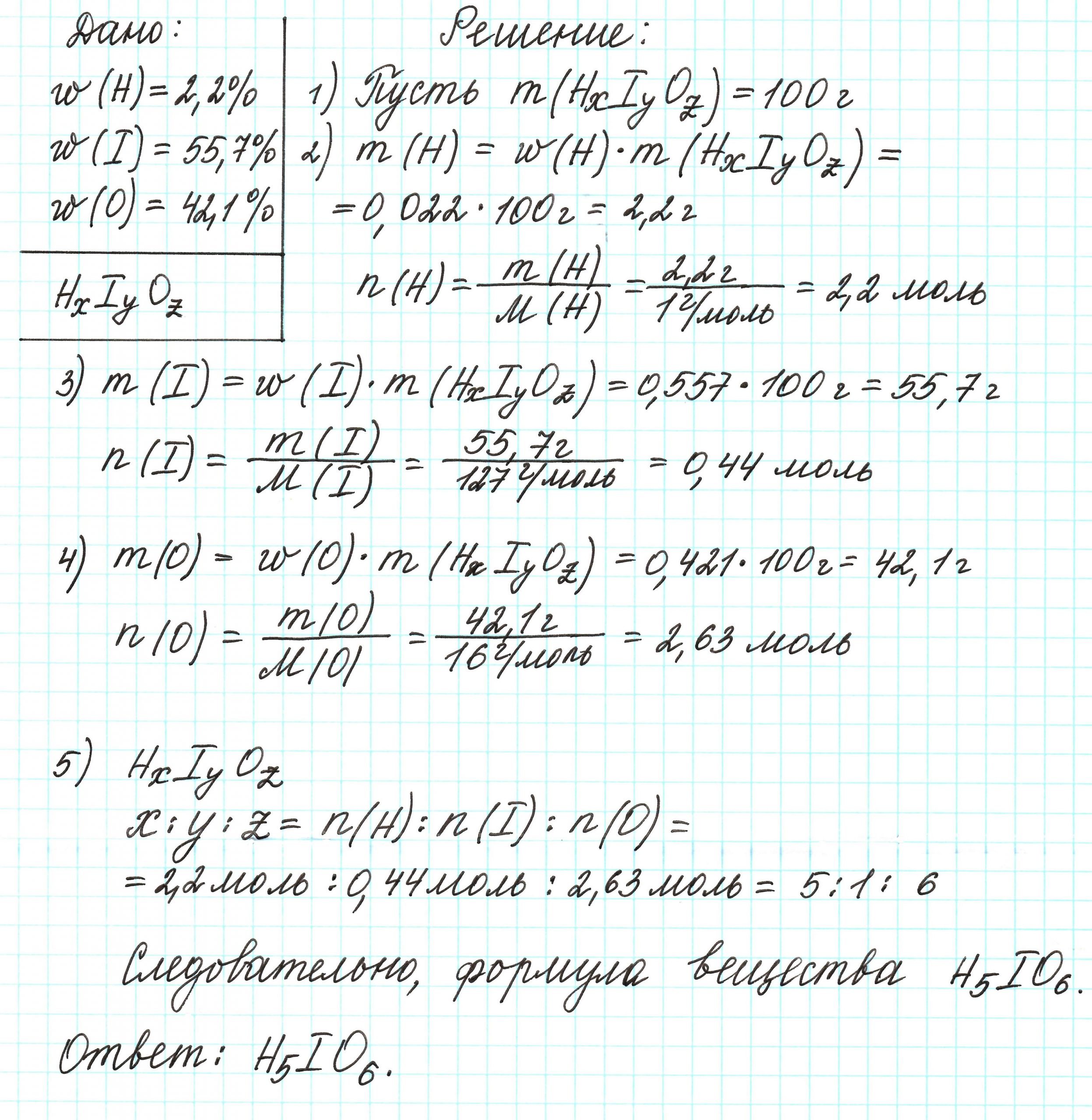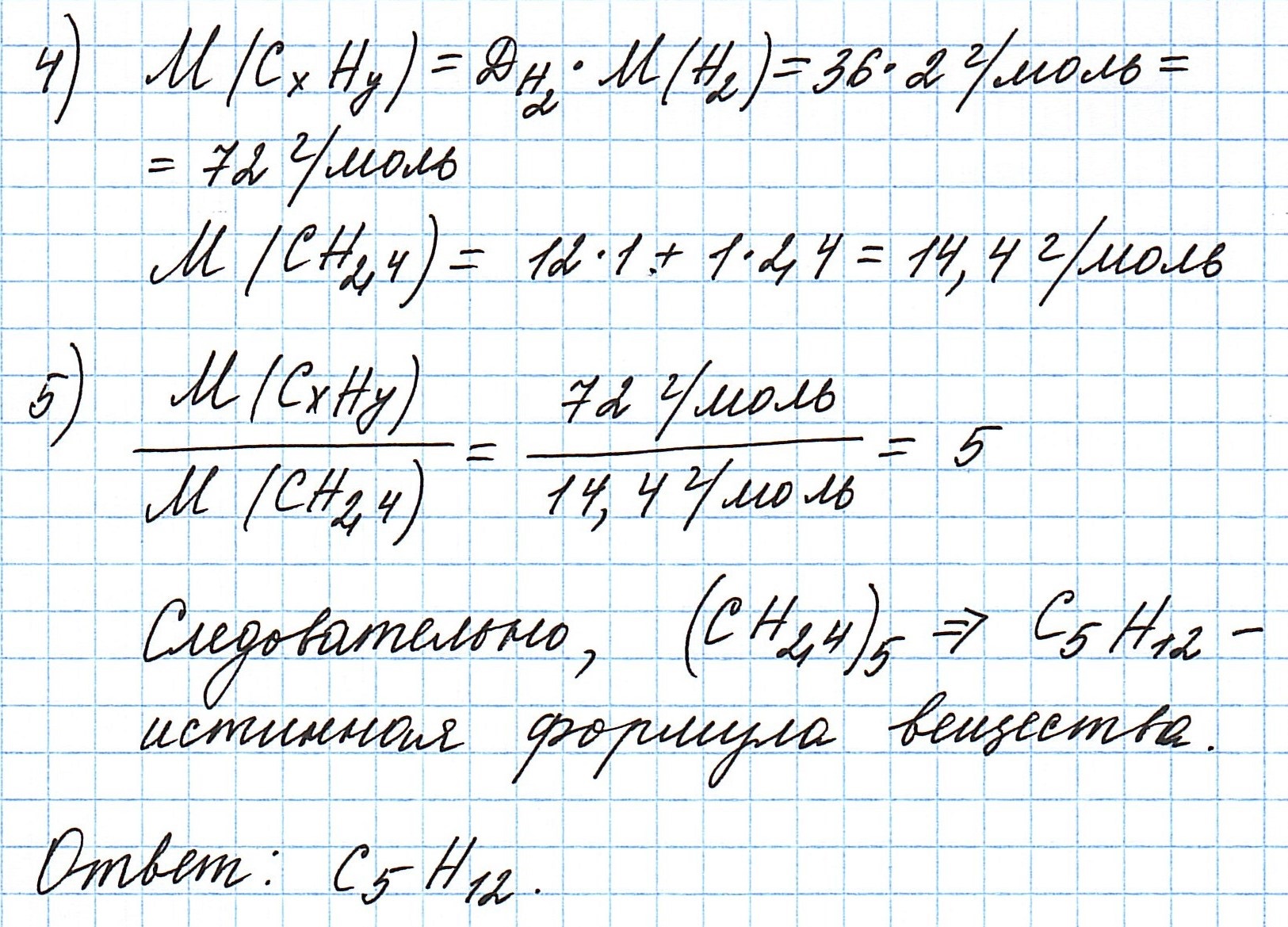Количественное
соотношение феррита и перлита в структуре
сталей зависит от содержания углерода.
С увеличением содержания углерода в
структуре увеличивается доля перлита,
соответственно уменьшается доля феррита.
В доэвтектоидных
сталях массовая доля углерода определяется
по формуле:
(8.1)
где
Fп
– площадь, занятая в структуре перлитом,
%;
0,8 – процентное содержание углерода
в перлите.
При определении
содержания углерода в заэвтектоидной
стали необходимо учитывать содержание
углерода не только в перлите, но и в
цементите. Содержание углерода в
заэвтектоидной стали определяется по
формуле:
(8.2)
где
(100–Fп)
– площадь, занятая цементитом, %.
Рассчитав массовую
долю углерода по формулам (8.1) и (8.2), можно
установить марку доэвтектоидной стали.
Для
ориентировоч-ного определения содержания
углерода доля этих площадей могут
оцениваться визуально.
2.5. Влияние содержания углерода на свойства стали
С
увеличением содержания углерода в
структуре стали возрастает количество
твёрдого и хрупкого цементита, а
количество мягкого, пластичного феррита
уменьшается. Твёрдые частицы цементита
приводят к увеличению прочности
σв,
твёрдости НВ
(рис.8.6),
и одновременному снижению пластичности
(δ, ψ) и
ударной вязкости (КСV).
В случае заэвтектоидных сталей грубые
выделения цементита вокруг зерен перлита
в виде непрерывной сетки (см.
рис. 8.5) приводят
к снижению прочности и к ещё большему
снижению пластичности стали. Низко- и
средне углеродистые стали имеют
оптимальное сочетание прочности,
твёрдости, пластичности и ударной
вязкости. Они широко применяются для
изготовления деталей машин, используются
в различных конструкциях и такие стали
получили название конструкционных.
Они содержат ≤ 0,7 % С и широко применяются
для изготовления деталей машин благодаря
дешевизне и удовлетворительных
механических свойств.
|
|
Рис. НВ σв–предел δ–относительное ψ–относитель-ное КСV |
По
качеству
они делятся на стали: 1) обыкновенного
качества с содержанием не более 0,05 % S
и не более 0,04 % P;
2) качественные с содержанием не более
0,04 % S
и не более 0,035 % P.
Стали конструкционные
углеродистые
обыкновенного
качества маркируются
сочетанием букв Ст, цифрами от 0 до 6,
показывающей номер марки, и индексами,
указывающими степень раскисленности
стали (кп, пс, сп).
Содержание углерода
в них изменяется от 0,1 % до 0,5 %. Это наиболее
дешевые стали, изготавливаемые в виде
проката (прутки, листы, швеллеры, трубы
и др.) и поковок.
Предназначены
для изготовления различных
металлоконструкций, а также слабонагруженных
деталей машин и приборов. Состав и
свойства сталей определяются ГОСТ
380-94.
Качественные
конструкционные
стали марок
сталь 08,
10, 15, 20, 25,…, 60 по
ГОСТ 1050-88 используются для изготовления
деталей ответственного назначения.
Цифры показывают содержание углерода
в сталях в сотых долях процента. По
содержанию
углерода
качественные углеродистые стали
подразделяются на низкоугле-родистые
(до 0,25 % С), среднеуглеродистые (0,3…0,5 %
С) и высокоуглеродистые конструкционные
(0,5…0,65 % С)
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Это отработанный пример задачи, показывающий, как рассчитать массовый процентный состав. Процентный состав указывает относительные количества каждого элемента в соединении. Для каждого элемента формула массового процента выглядит следующим образом:
% mass = (масса элемента в 1 моль соединения)/(молярная масса соединения) x 100%
или
массовый процент = (масса растворенного вещества/масса раствора) x 100%
Обычно единицы массы – граммы. Массовый процент также известен как массовый процент или мас./Мас.%. Молярная масса – это сумма масс всех атомов в одном моль соединения. Сумма всех массовых процентов должна составлять в сумме 100%. Следите за ошибками округления в последней значащей цифре, чтобы убедиться, что все проценты складываются.
Содержание
- Ключевые выводы
- Проблема массового процентного состава
- Процентный состав воды
- Массовый процент диоксида углерода
- Массовый процент раствора
- Советы по расчету массового процента
Ключевые выводы
- Состав в массовых процентах описывает относительные количества элементов в химическом соединении.
- Состав в массовых процентах также известен в процентах по массе. Он сокращенно обозначается как мас./Мас.%.
- Для раствора массовый процент равен массе элемента в одном моль соединения, деленной на молярную массу соединения, умноженную на 100%.
Проблема массового процентного состава
Бикарбонат соды (гидрокарбонат натрия) используется во многих коммерческих препаратах. Его формула – NaHCO 3 . Найдите массовые проценты (мас.%) Na, H, C и O в гидрокарбонате натрия.
Раствор
Сначала найдите атомные массы для элементов из Периодической таблицы. Атомные массы оказались следующими:
- Na = 22,99
- H = 1,01
- C – 12,01
- O – 16,00
Затем определите, сколько граммов каждого в одном моль NaHCO 3 :
- 22,99 г (1 моль) Na
- 1,01 г (1 моль) H
- 12,01 г (1 моль) C
- 48,00 г (3 моль x 16,00 грамм на моль) O
Масса одного моля NaHCO 3 составляет:
22,99 г + 1,01 г + 12,01 г + 48,00 г = 84,01 г
И масса процентное содержание элементов составляет
- масс.% Na = 22,99 г/84,01 г x 100 = 27,36%
- % масс H = 1,01 г/84,01 г x 100 = 1,20%
- % масс C = 12,01 г/84,01 г x 100 = 14,30%
- % масс O = 48,00 г /84,01 gx 100 = 57,14%
Ответ
- % масс Na = 27,36%
- % масс H = 1,20%
- массовый% C = 14,30%
- массовый% O = 57,14%
При вычислении массовых процентов всегда рекомендуется проверять, чтобы ваши массовые проценты в сумме составляли 100% (помогает отловить математические ошибки):
27,36 + 14,30 + 1,20 + 57,14 = 100. 00
Процентный состав воды
Другой простой пример – определение массового процентного состава элементов в воде, H 2 O.
Сначала найдите молярную массу воды, сложив атомные массы элементов. Используйте значения из периодической таблицы:
- H составляет 1,01 грамма на моль
- O составляет 16,00 граммов на моль
Получите молярную массу, сложив все массы элементов в соединении. Нижний индекс после водорода (H) указывает на наличие двух атомов водорода. После кислорода (O) нет индекса, что означает, что присутствует только один атом.
- молярная масса = (2 x 1,01) + 16,00
- молярная масса = 18,02
Теперь разделите массу каждого элемента на общую массу, чтобы получить массовые проценты:
масс% H = (2 x 1,01)/18,02 x 100%
масс% H = 11,19%
массовый% O = 16,00/18,02
массовый% O = 88,81%
Массовые проценты водорода и кислорода в сумме составляют 100%.
Массовый процент диоксида углерода
Какова масса процентное содержание углерода и кислорода в диоксиде углерода, CO 2 ?
Массовый процент раствора
Шаг 1: Найдите массу отдельных атомов.
Найдите атомные массы углерода и кислорода из Периодическая таблица. На этом этапе рекомендуется определиться с количеством значащих цифр, которые вы будете использовать. Атомные массы оказались следующими:
- C = 12,01 г/моль
- O = 16,00 г. /моль
Шаг 2: Найдите количество граммов каждого компонента, составляющего один моль CO. 2.
Один моль CO 2 содержит 1 моль атомов углерода и 2 моля атомов кислорода.
- 12,01 г (1 моль) C
- 32,00 г (2 моль x 16,00 грамм на моль) O
Масса одного моля CO 2 составляет:
- 12,01 г + 32,00 г = 44,01 г
Шаг 3: Найдите массовый процент каждого атома.
mass% = (масса компонента/масса всего) x 100
И массовые проценты элементов составляют
Для углерод:
- мас.% C = (масса 1 моля углерода/масса 1 моль CO 2 ) x 100
- мас.% C = (12,01 г/44,01 г) x 100
- массовый% C = 27,29%
Для кислорода:
- мас.% O = (масса 1 моля кислорода/масса 1 моль CO 2 ) x 100
- мас.% O = (32,00 г/44,01 г) x 100
- мас.% O = 72,71%
Ответ
- массовый% C = 27,29%
- массовый% O = 72. 71%
Опять же, убедитесь, что ваши массовые проценты в сумме составляют 100%. Это поможет выявить любые математические ошибки.
- 27,29 + 72,71 = 100,00
Сумма ответов составляет 100%, чего и ожидалось.
Советы по расчету массового процента
- Вам не всегда будет дана общая масса смеси или раствора. Часто вам нужно складывать массы. Это может быть неочевидно. Вам могут быть заданы мольные доли или моль, а затем потребуется преобразовать их в единицу массы.
- Следите за своими значащими цифрами.
- Всегда проверяйте сумму массовых процентов всех компонентов составляет 100%. В противном случае вам нужно вернуться и найти свою ошибку.
Способов, как определить формулу вещества, достаточно много. Все зависит от исходных данных. Наиболее разнообразны подобные вычисления в органической химии. И это не удивительно, так как органических соединений значительно больше, чем неорганических.
Содержание:
1.Понятие простейшей и истинной формулы вещества
2.Массовая доля химического элемента: что означает и как высчитывается
3.Как определить формулу вещества по массовым долям элементов
4.Как определить формулу органического соединения:
4.1. по общей формуле вещества
4.2. по продуктам сгорания вещества
5. Как определить формулу вещества: комбинированные задачи
1.Понятие простейшей и истинной формулы вещества
В одних задачах на определение формулы вещества необходимо найти его простейшую формулу, а в других – истинную. В чем разница?
Простейшая, или иными словами, эмпирическая формула, указывает на соотношение атомов в молекуле (или в формульной единице, если речь идет о не ковалентном соединении).
Так, например: СН2 – простейшая формула алкена – показывает, что на каждый 1 атом углерода приходится 2 водородных атома. То есть существует соотношение 1:2. Поэтому для нахождения простейшей (эмпирической) формулы вещества важно рассчитать количество вещества атомов, которые входят в его состав, то есть n(C) и n(H).
Истинная формула, или иначе молекулярная, отражает действительное количество атомов всех элементов в молекуле.
Например, для пропилена, относящегося к классу алкенов, истинная (молекулярная) формула будет C3H6. Она говорит о том, что молекула данного вещества включает 3 атома С и 6 атомов Н. Это вполне соответствует простейшей формуле, отвечающей соотношению атомов 1:2. Для нахождения истинной (молекулярной) формулы соединения требуется посчитать его относительную молекулярную (Mr) или молярную массу (M).
2.Массовая доля химического элемента: что означает и как высчитывается
Массовая доля – это отношение массы компонента системы к массе системы, выраженное в процентах или долях от единицы.
Ну, а теперь проще.
Молекула имеет массу. Все атомы в молекуле также имеют свои массы. Атомов одного химического элемента в молекуле может быть 1 или несколько. Важна масса всех атомов одного элемента. Если ее разделить на массу молекулы, то получится массовая доля этого элемента. Ее выражают либо в процентах, которые всегда меньше 100%, либо в долях от единицы, которые всегда меньше 1.
Массовая доля элемента обозначается греческой буквой «омега» — ω. И записывается, например, так: ω(Н), ω(Сl), ω(С) и т.д. и рассчитывается:
Пример 1. Каковы массовые доли элементов в оксиде железа (III) Fe2O3.
3.Как определить формулу вещества по массовым долям элементов
Нахождение формулы вещества по массовым долям элементов применимо как к органическим, так и к неорганическим соединениям.
Пример 2. Сероуглерод содержит 15,8% углерода по массе. Какова простейшая формула этого вещества?
Поскольку речь идет о массовых долях элементов, то необходимо знать массу вещества. В нашем случае – массу сероуглерода. В условии задачи о ней ничего не говорится. Поэтому допускаем, что масса вещества равна 100 г.
Почему 100 г? Это «круглое» число, и его использование облегчает все расчеты. Так как в итоге будем находить соотношения количеств веществ элементов, то какое-то особенное значение массы вещества не играет никакой роли.
Попробуйте ради эксперимента принять массу сероуглерода равной 23 г, 467 г и т.п. Результат будет один и тот же.
Допустим, что атомов углерода в молекуле х, а атомов серы – у. В таком случае формула вещества примет вид: СхSу.
Пример 3. Содержание углерода в углеводороде составляет 83,33%. Плотность паров соединения по водороду – 36. Какова молекулярная формула углеводорода?
Из данных задачи следует, что углеводород может находиться в газообразном состоянии, так как известна плотность его паров. Эта величина всегда требуется для нахождения молярной (относительной молекулярной) массы вещества. Как она находится и что это такое читайте подробнее здесь.
Чтобы не загромождать записи, массовую долю элементов будем считать не в процентах, а в долях от единицы.
Пусть вас не удивляет получившаяся простейшая формула. Ведь, исходя из определения простейшей формулы, на каждый 1 атом углерода приходится 2,4 атома водорода. Это всего лишь соотношение. Соединения с формулой СН2,4 в принципе не существует. Не всегда простейшая и истинная формулы совпадают друг с другом.
А если полученная формула СН2,4 вас все же смущает, вы можете решать задачу и вторым способом. Но это несколько более сложный способ, когда требуется составить и решить уравнение с двумя неизвестными.
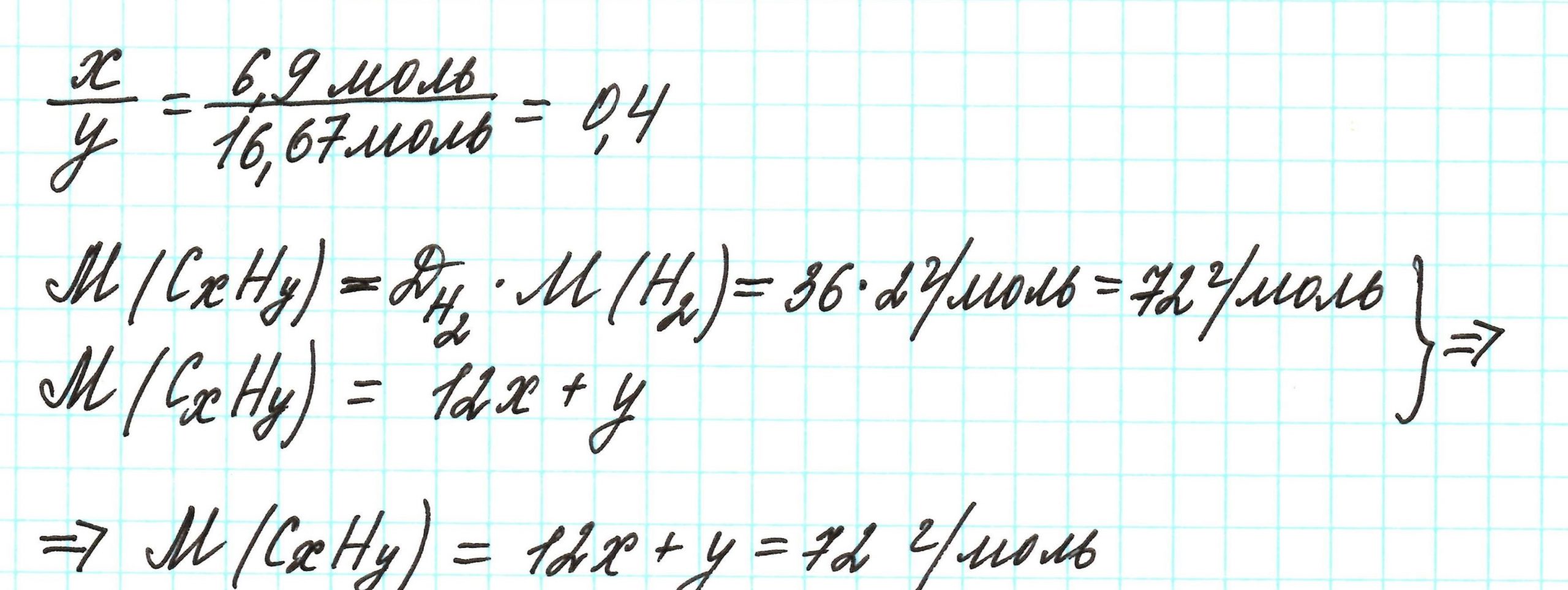
Не все химические вещества являются бинарными, то есть состоят из атомов двух химических элементов. Но в любом случае, алгоритм решения задачи тот же.
Пример 4. Некоторая кислота содержит водород (2,2%), иод (55,7%) и кислород (42,1%). Определите простейшую формулу этой кислоты.
4.Как определить формулу органического соединения
Определить формулу органического вещества можно не только зная массовые доли элементов в его составе.
4.1. Как определить формулу органического соединения
по общей молекулярной формуле вещества
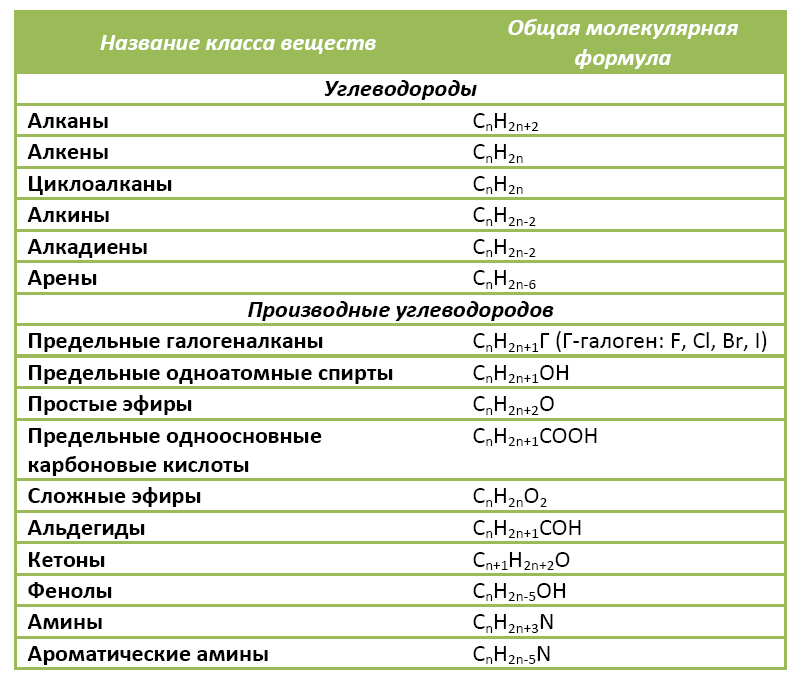
Органические вещества сгруппированы по самостоятельным классам на основе общности строения и свойств. Каждый класс соединений характеризуется своей общей молекулярной формулой. Особенно это наглядно видно на примере углеводородов.
Если другие органические вещества рассматривать как их производные, в молекулы которых введена какая-либо функциональная группа, то и для них также можно составить общую молекулярную формулу.
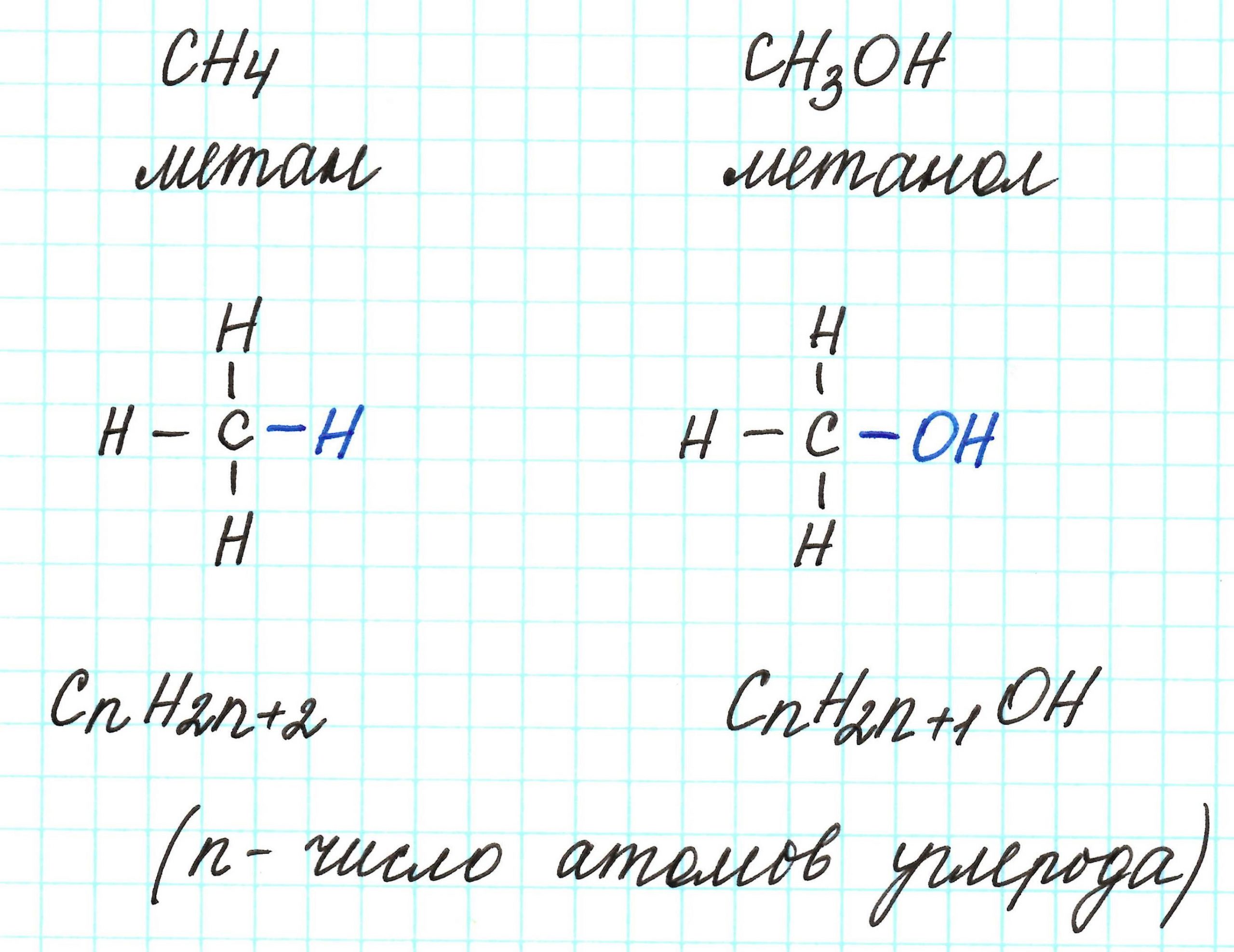
К слову, метан СН4 является представителем алканов, в молекулах которых на n атомов углерода и приходится 2n+2 атомов водорода. Алканы имеют общую молекулярную формулу, отражающую их состав: СnH2n+2.
Предельные одноатомные спирты можно рассматривать как производные алканов, в молекулах которых 1 атом водорода замещен на гидроксильную группа –ОН. Таким образом, их общая молекулярная формула такая: СnH2n+1ОН.
Ниже в таблице приведены общие молекулярные формулы основных классов органических соединений.
Пример 5. Плотность паров по воздуху некоторого алкана 4,414. Какова формула алкана?

4.2. Как определить формулу органического соединения
по продуктам его сгорания
Это еще один распространенный тип задач на определение формулы органического соединения.
Необходимо запомнить и понять основные моменты:
— так как все органические вещества содержат атомы С, Н, а также атомы О (кислородсодержащие соединения), то всегда при их сгорании выделяется углекислый газ СО2 и образуется вода Н2О;
— все углеродные атомы, входящие в состав органического соединения, окажутся в составе углекислого газа СО2; следовательно, n(С) как в соединении, так и в СО2 – это одна и та же величина;
— все атомы водорода Н, которые имеются в составе вещества, перейдут в состав воды Н2О; следовательно, n(Н) и в данном веществе, и в Н2О – это одна и та же величина;
— при сгорании веществ, включающих в себя азот (например, амины), кроме СО2 и Н2О, образуется еще и N2.
Разберем несколько примеров.
Пример 6. Сожгли 7,2 г углеводорода. Плотность его паров по водороду составляет 36. В результате реакции образовалось 22 г оксида углерода (IV) и 10,8 г воды. Какова молекулярная формула соединения?
Пример 7. В результате сгорания 4,8 г органического соединения выделилось 3,36 л (н.у.) оксида углерода (IV) и образовалось 5,4 г воды. Плотность паров искомого соединения по кислороду равна 1. Вычислите молекулярную формулу вещества.
Пример 8. Результатом сжигания 0,31 г газообразного органического соединения, имеющего плотность 1,384 г/л, стало выделение 0,224 л (с.у.) оксида углерода (IV), 0,112 л азота и образование 0,45 г воды. Вычислите молекулярную формулу этого вещества.

5. Как определить формулу вещества: комбинированные задачи
Наибольший интерес и некоторую трудность представляют комбинированные задачи, сочетающие в себе необходимость найти формулу соединения:
— используя приемы, применяемые в рассмотренных выше задачах;
— используя сведения не только о химических, но и физических свойствах вещества.
Вот несколько примеров.
Пример 9. Какова молекулярная формула предельного углеводорода, при полном сгорании 8,6 г которого выделилось 13, 44 л (н.у.) оксида углерода (IV).
В этой задаче:
1) известен класс вещества, поэтому возможно применить его общую молекулярную формулу;
2) речь идет о сгорании вещества, поэтому количество атомов в составе молекулы будем искать, используя данные о продукте сгорания – СО2.
Пример 10. Алкен нормального строения содержит двойную связь при первом углеродном атоме. Образец этого алкена массой 0,7 г присоединил бром массой 1,6 г. Вычислите формулу алкена и назовите его.
В предлагаемых условиях:
1) известен класс вещества, следовательно, применим его общую молекулярную формулу;
2) речь идет об одном из химических свойств: способности алкенов присоединять галогены по месту разрыва двойной связи.
Пример 11. После полного сжигания в кислороде арена, имевшего массу 0,92 г, выделился оксид углерода (IV). Пропуская газ через избыток раствора щелочи Ca(OH)2, получили 7 грамм осадка. Какова молекулярная формула арена?
В предлагаемой задаче:
1) известен класс вещества;
2) речь идет о сжигании соединения и образовании в качестве продукта горения углекислого газа, который при взаимодействии со щелочью Са(ОН)2 привел к выпадению осадка известной массы.
Следующий пример очень характерен для задач, встречающихся в заданиях второй части ЕГЭ по химии.
Пример 12. Некоторое соединение, образующее альдегид в реакции окисления, взаимодействует с избытком бромоводородной кислоты, образуя 9,84 г продукта (выход составляет 80% от теоретического), имеющего плотность паров по Н2 61,5. Определите строение этого соединения, а также его массу, вступившую в реакцию?
В этой задаче:
1) говорится о химических свойствах искомого соединения; анализируя их, приходим к выводу, что заданным веществом является предельный одноатомный спирт;
2) известна общая молекулярная формула предельных одноатомных спиртов;
3) более подробно говорится о взаимодействии заданного вещества с бромоводородной кислотой; спирт, реагируя с HBr, дает галогеналкан, для которого известны его масса, практический выход и относительная плотность по Н2; именно от этих данных и нужно отталкиваться при решении данной задачи.
Итак, способов, как определить формулу вещества, действительно, множество. Мы рассмотрели лишь основные из них. Важно правильно уяснить понятия «простейшая формула вещества» и «истинная формула вещества», чтобы не путать их.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.
поделиться знаниями или
запомнить страничку
- Все категории
-
экономические
43,660 -
гуманитарные
33,654 -
юридические
17,917 -
школьный раздел
611,971 -
разное
16,905
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
owity615
Вопрос по химии:
Пожалуйста объясните, как решить задачу, какими формулами (помогите понять, что от меня хотят)
найти процентное содержание углерода и водорода в молекуле бензола по отношению к его молярной массе
Трудности с пониманием предмета? Готовишься к экзаменам, ОГЭ или ЕГЭ?
Воспользуйся формой подбора репетитора и занимайся онлайн. Пробный урок — бесплатно!
Ответы и объяснения 1
jusero637
находишь массу углерода в бензоле (12*6=72), находишь массу водорода (6) и поочередно делишь на молярку бензола
w(C)=72/78=0.921 или 92.3%
w(H)=6/78=7.7%
Знаете ответ? Поделитесь им!
Гость ?
Как написать хороший ответ?
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете
правильный ответ; - Писать подробно, чтобы ответ был исчерпывающий и не
побуждал на дополнительные вопросы к нему; - Писать без грамматических, орфографических и
пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся
уникальные и личные объяснения; - Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не
знаю» и так далее; - Использовать мат — это неуважительно по отношению к
пользователям; - Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует?
Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие
вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи —
смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.