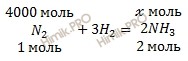Урок №20. Расчетные задачи типа «Определение выхода продукта реакции в процентах от теоретического».
Признак
В условии задачи встречается слово «выход». Теоретический выход продукта всегда выше практического.
Понятия «теоретическая масса или объём, практическая масса или объём» могут быть использованы только для веществ-продуктов.
Доля выхода продукта обозначается буквой (эта), измеряется в процентах или долях.
m практическая х100%
= m теоретичееская
V практический х100%
= V теоретичееский
Первый тип задач – Известны масса (объём) исходного вещества и масса (объём) продукта реакции. Необходимо определить выход продукта реакции в %.
Задача 1. При взаимодействии магния массой 1,2 г с раствором серной кислоты получили соль массой 5, 5 г. Определите выход продукта реакции (%).
1. Записываем краткое условие задачи
Дано:
m (Mg) = 1,2 г
m практическая (MgSO4) = 5,5 г
_____________________
Найти: =?
2. Запишем УХР. Расставим коэффициенты.
Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции.
3. Находим по ПСХЭ молярные массы подчёркнутых веществ
M(Mg) = 24 г/моль
M(MgSO4) = 24 + 32 + 4 · 16 = 120 г/моль
4. Находим количество вещества реагента по формулам
ν(Mg) = 1,2 г / 24(г/моль) = 0,05 моль
5. По УХР вычисляем теоретическое количество вещества (νтеор) и теоретическую массу (mтеор) продукта реакции
m = ν · M
mтеор (MgSO4) = M(MgSO4) · νтеор (MgSO4) =
= 120 г/моль · 0,05 моль = 6 г
6. Находим массовую (объёмную) долю выхода продукта по формуле
(MgSO4)=(5,5г ·100%)/6г=91,7%
Ответ: Выход сульфата магния составляет 91,7% по сравнению с теоретическим
Второй тип задач – Известны масса (объём) исходного вещества (реагента) и выход (в %) продукта реакции. Необходимо найти практическую массу (объём) продукта реакции.
Задача 2. Вычислите массу карбида кальция, образовавшегося при действии угля на оксид кальция массой 16,8 г, если выход составляет 80%.
1. Записываем краткое условие задачи
Дано:
m(CaO) = 16,8 г
=80% или 0,8
_________________
Найти:
m практ (CaC2) = ?
2. Запишем УХР. Расставим коэффициенты.
Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции.
3. Находим по ПСХЭ молярные массы подчёркнутых веществ
M(CaO) = 40 + 16 = 56 г/моль
M(CaC2) = 40 + 2 · 12 = 64г/моль
4. Находим количество вещества реагента по формулам
ν(CaO)=16,8 (г) / 56 (г/моль) = 0,3 моль
5. По УХР вычисляем теоретическое количество вещества (νтеор) и теоретическую массу (mтеор) продукта реакции
6. Находим массовую (объёмную) долю выхода продукта по формуле
m практич (CaC2) = 0,8 · 19,2 г = 15,36 г
Ответ: m практич (CaC2) = 15,36 г
Третий тип задач – Известны масса (объём) практически полученного вещества и выход этого продукта реакции. Необходимо вычислить массу (объём) исходного вещества.
Задача 3. Карбонат натрия взаимодействует с соляной кислотой. Вычислите, какую массу карбоната натрия нужно взять для получения оксида углерода (IV) объёмом 28,56 л (н. у.). Практический выход продукта 85%.
1. Записываем краткое условие задачи
Дано: н. у.
Vm = 22,4 л/моль
Vпрактич(CO2) = 28,56 л
= 85% или 0,85
____________________
Найти:
m(Na2CO3) =?
2. Находим по ПСХЭ молярные массы веществ, если это необходимо
M (Na2CO3) =2·23 + 12 + 3·16 = 106 г/моль
3. Вычисляем теоретически полученный объём (массу) и количество вещества продукта реакции, используя формулы:
Vтеоретич(CO2) =
= 28,56 л / 0,85 = 33,6 л
ν(CO2) = 33,6 (л) / 22,4 (л/моль) = 1,5 моль
4. Запишем УХР. Расставим коэффициенты.
Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции.
5. Находим количество вещества реагента по УХР
По УХР:
, следовательно
ν(Na2CO3) = ν(CO2) = 1,5 моль
5. Определяем массу (объём) реагента по формуле:
m = ν · M
V = ν · Vm m = ν · M m(Na2CO3) = 106 г/моль · 1,5 моль = 159 г
Первый тип задач – Известны масса (объём) исходного вещества и масса (объём) продукта реакции. Необходимо определить выход продукта реакции в %.
Задача 1. При взаимодействии магния массой 1,2 г с раствором серной кислоты получили соль массой 5, 5 г. Определите выход продукта реакции (%).
Второй тип задач – Известны масса (объём) исходного вещества (реагента) и выход (в %) продукта реакции. Необходимо найти практическую массу (объём) продукта реакции.
Задача 2. Вычислите массу карбида кальция, образовавшегося при действии угля на оксид кальция массой 16,8 г, если выход составляет 80%.
Третий тип задач – Известны масса (объём) практически полученного вещества и выход этого продукта реакции. Необходимо вычислить массу (объём) исходного вещества.
Задача 3. Карбонат натрия взаимодействует с соляной кислотой. Вычислите, какую массу карбоната натрия нужно взять для получения оксида углерода (IV) объёмом 28,56 л (н. у.). Практический выход продукта 85%.
ДЗ
№1. При взаимодействии натрия количеством вещества 0, 5 моль с водой получили водород объёмом 4,2 л (н. у.). Вычислите практический выход газа (%).
№2. Металлический хром получают восстановлением его оксида Cr2O3 металлическим алюминием. Вычислите массу хрома, который можно получить при восстановлении его оксида массой 228 г, если практический выход хрома составляет 95 %.
№3. Определите, какая масса мели вступит в реакцию с концентрированной серной кислотой для получения оксида серы (IV) объёмом 3 л (н.у.), если выход оксида серы (IV) составляет 90%.
№4. К раствору, содержащему хлорид кальция массой 4,1 г, прилили раствор, содержащий фосфат натрия массой 4,1 г. Определите массу полученного осадка, если выход продукта реакции составляет 88 %.
Первый тип задач – Известны масса (объём) исходного вещества и масса (объём) продукта реакции. Необходимо определить выход продукта реакции в %.
Задача 1. При взаимодействии магния массой 1,2 г с раствором серной кислоты получили соль массой 5, 5 г. Определите выход продукта реакции (%).
Второй тип задач – Известны масса (объём) исходного вещества (реагента) и выход (в %) продукта реакции. Необходимо найти практическую массу (объём) продукта реакции.
Задача 2. Вычислите массу карбида кальция, образовавшегося при действии угля на оксид кальция массой 16,8 г, если выход составляет 80%.
Третий тип задач – Известны масса (объём) практически полученного вещества и выход этого продукта реакции. Необходимо вычислить массу (объём) исходного вещества.
Задача 3. Карбонат натрия взаимодействует с соляной кислотой. Вычислите, какую массу карбоната натрия нужно взять для получения оксида углерода (IV) объёмом 28,56 л (н. у.). Практический выход продукта 85%.
ДЗ
№1. При взаимодействии натрия количеством вещества 0, 5 моль с водой получили водород объёмом 4,2 л (н. у.). Вычислите практический выход газа (%).
№2. Металлический хром получают восстановлением его оксида Cr2O3 металлическим алюминием. Вычислите массу хрома, который можно получить при восстановлении его оксида массой 228 г, если практический выход хрома составляет 95 %.
№3. Определите, какая масса мели вступит в реакцию с концентрированной серной кислотой для получения оксида серы (IV) объёмом 3 л (н.у.), если выход оксида серы (IV) составляет 90%.
№4. К раствору, содержащему хлорид кальция массой 4,1 г, прилили раствор, содержащий фосфат натрия массой 4,1 г. Определите массу полученного осадка, если выход продукта реакции составляет 88 %.
Расчетные задачи типа «Определение выхода продукта реакции в процентах от теоретического»
Признак
В условии задачи встречается слово «выход». Теоретический выход продукта всегда выше практического.
Понятия «теоретическая масса или объём, практическая масса или объём» могут быть использованы только для веществ-продуктов.
Доля выхода продукта обозначается буквой
(эта), измеряется в процентах или долях.
Также для расчётов может использоваться количественный выход:
I. Первый тип задач
Известны масса (объём) исходного вещества и масса (объём) продукта реакции. Необходимо определить выход продукта реакции в %.
Задача 1. При взаимодействии магния массой 1,2 г с раствором серной кислоты получили соль массой 5, 5 г. Определите выход продукта реакции (%).
| 1. Записываем краткое условие задачи |
Дано: m (Mg) = 1,2 г m практическая(MgSO4) = 5,5 г _____________________ Найти: |
|
2. Запишем УХР. Расставим коэффициенты. Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции. |
|
| 3. Находим по ПСХЭ молярные массы подчёркнутых веществ |
M(Mg) = 24 г/моль M(MgSO4) = 24 + 32 + 4 · 16 = 120 г/моль |
|
4. Находим количество вещества реагента по формулам |
ν(Mg) = 1,2 г / 24(г/моль) = 0,05 моль |
| 5. По УХР вычисляем теоретическое количество вещества (νтеор) и теоретическую массу (mтеор) продукта реакции |
m = ν · M mтеор (MgSO4) = M(MgSO4) · νтеор (MgSO4) = = 120 г/моль · 0,05 моль = 6 г |
|
6. Находим массовую (объёмную) долю выхода продукта по формуле |
Ответ: Выход сульфата магния составляет 91,7% по сравнению с теоретическим |
II. Второй тип задач
Известны масса (объём) исходного вещества (реагента) и выход (в %) продукта реакции. Необходимо найти практическую массу (объём) продукта реакции.
Задача 2. Вычислите массу карбида кальция, образовавшегося при действии угля на оксид кальция массой 16,8 г, если выход составляет 80%.
|
1. Записываем краткое условие задачи |
Дано: m(CaO) = 16,8 г
___________________ Найти: m практ (CaC2) = ? |
|
2. Запишем УХР. Расставим коэффициенты. Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции. |
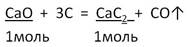 |
|
3. Находим по ПСХЭ молярные массы подчёркнутых веществ |
M(CaO) = 40 + 16 = 56 г/моль M(CaC2) = 40 + 2 · 12 = 64г/моль |
|
4. Находим количество вещества реагента по формулам |
ν(CaO)=16,8 (г) / 56 (г/моль) = 0,3 моль |
|
5. По УХР вычисляем теоретическое количество вещества (νтеор) и теоретическую массу (mтеор) продукта реакции |
|
|
6. Находим массовую (объёмную) долю выхода продукта по формуле |
m практич (CaC2) = 0,8 · 19,2 г = 15,36 г Ответ: m практич (CaC2) = 15,36 г |
III. Третий тип задач
Известны масса (объём) практически полученного вещества и выход этого продукта реакции. Необходимо вычислить массу (объём) исходного вещества.
Задача 3. Карбонат натрия взаимодействует с соляной кислотой. Вычислите, какую массу карбоната натрия нужно взять для получения оксида углерода (IV) объёмом 28,56 л (н. у.). Практический выход продукта 85%.
| 1. Записываем краткое условие задачи |
Дано: н. у. Vm = 22,4 л/моль Vпрактич(CO2) = 28,56 л = 85% или 0,85 ____________________ Найти: m(Na2CO3) =? |
| 2. Находим по ПСХЭ молярные массы веществ, если это необходимо | M (Na2CO3) =2·23 + 12 + 3·16 = 106 г/моль |
|
3. Вычисляем теоретически полученный объём (массу) и количество вещества продукта реакции, используя формулы: |
Vтеоретич(CO2) = = 28,56 л / 0,85 = 33,6 л ν(CO2) = 33,6 (л) / 22,4 (л/моль) = 1,5 моль |
|
4. Запишем УХР. Расставим коэффициенты. Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции. |
|
| 5. Находим количество вещества реагента по УХР |
По УХР:
ν(Na2CO3) = ν(CO2) = 1,5 моль |
|
6. Определяем массу (объём) реагента по формуле: m = ν · M V = ν · Vm |
m = ν · M m(Na2CO3) = 106 г/моль · 1,5 моль = 159 г |
IV. Решите задачи
Задача №1. При взаимодействии натрия количеством вещества 0, 5 моль с водой получили водород объёмом 4,2 л (н. у.). Вычислите практический выход газа (%).
Задача №2. Металлический хром получают восстановлением его оксида Cr2O3 металлическим алюминием. Вычислите массу хрома, который можно получить при восстановлении его оксида массой 228 г, если практический выход хрома составляет 95 %.
Задача №3. Определите, какая масса меди вступит в реакцию с концентрированной серной кислотой для получения оксида серы (IV) объёмом 3 л (н.у.), если выход оксида серы (IV) составляет 90%.
Задача №4. К раствору, содержащему хлорид кальция массой 4,1 г, прилили раствор, содержащий фосфат натрия массой 4,1 г. Определите массу полученного осадка, если выход продукта реакции составляет 88 %.
Выход от теоретически возможного
Сколько литров аммиака (NH3) образуется при взаимодействии 112 килограмм азота (N2) с водородом (H2)? Выход от теоретически возможного 80% (нормальные условия).
Решение задачи
Запишем уравнение реакции образования аммиака (NH3):
Напомню, что под выходом от теоретически возможного продукта реакции понимают отношение массы (объема, числа молей) практически полученного вещества к массе (объему, числу молей), теоретически рассчитанной по уравнению реакции.
Выход от теоретически возможного. Учитывая, что молярная масса азота (N2) равна 28 г/моль (смотри таблицу Менделеева), найдем химическое количество азота (N2) по формуле, устанавливающей связь между химическим количеством вещества и массой:
Получаем:
n (N2) = 112000 /28 = 4000 (моль) = 4 (кмоль).
По уравнению реакции найдем химическое количество аммиака (NH3) (теоретическое химическое количество вещества), которое выделяется в ходе реакции образования аммиака (NH3):
из 1 моль N2 образуется 2 моль NH3
из 4000 моль N2 образуется х моль NH3
Откуда:
Выход от теоретически возможного.
По формуле, устанавливающей связь между химическим количеством вещества и объемом, вычислим объем аммиака (NH3), который образуется в ходе реакции:
Получаем:
V теор.( NH3) = 8000 ∙ 22,4 = 179200 (л).
Вычислим объем аммиака (NH3) практический (выход от теоретически возможного) по формуле:
Выход от теоретически возможного.
Получаем:
V практ. (NH3) = 80 ⋅ 179200 / 100 = 143360 (л) = 143,36 (м3).
Ответ:
объем аммиака (NH3) равен 143,36 м3.
При обучении учащихся решению расчётных задач
по химии учителя сталкиваются с рядом проблем
- решая задачу, учащиеся не понимают сущности
задач и хода их решения; - не анализируют содержание задачи;
- не определяют последовательность действий;
- неправильно используют химический язык,
математические действия и обозначение
физических величин и др.;
Преодоление этих недостатков является одной из
главных целей, который ставит перед собой
учитель, приступая к обучению решению расчетных
задач.
Задача учителя состоит в том, чтобы научить
учащихся анализировать условия задач, через
составление логической схемы решения конкретной
задачи. Составление логической схемы задачи
предотвращает многие ошибки, которые допускают
учащиеся.
Цели урока:
- формирование умения анализировать условие
задачи; - формирование умения определять тип расчетной
задачи, порядок действий при ее решении; - развитие познавательных, интеллектуальных и
творческих способностей.
Задачи урока:
- овладеть способами решения химических задач с
использованием понятия “массовая доля выхода
продукта реакции от теоретического”; - отработать навыки решения расчетных задач;
- способствовать усвоению материала, имеющего
отношение к производственным процессам; - стимулировать углубленное изучение
теоретических вопросов, интерес к решению
творческих задач.
Ход урока
Определяем причину и сущность ситуации,
которые описываются в задачах “на выход
продукта от теоретического”.
В реальных химических реакциях масса продукта
всегда оказывается меньше расчетной. Почему?
- Многие химические реакции обратимы и не доходят
до конца. - При взаимодействии органических веществ часто
образуются побочные продукты. - При гетерогенных реакциях вещества плохо
перемешиваются, и часть веществ просто не
вступает в реакции. - Часть газообразных веществ может улетучиться.
- При получении осадков часть вещества может
остаться в растворе.
Вывод:
- масса теоретическая всегда больше
практической; - объём теоретический всегда больше объёма
практического.
Теоретический выход составляет 100%,
практический выход всегда меньше 100%.
Количество продукта, рассчитанное по уравнению
реакции, — теоретический выход, соответствует 100%.
Доля выхода продукта реакции ( — “этта”) — это отношение
массы полученного вещества к массе, которая
должна была бы получиться в соответствии с
расчетом по уравнению реакции.
Три типа задач с понятием “выход продукта”:
1. Даны массы исходного вещества и продукта
реакции. Определить выход продукта.
2. Даны массы исходного вещества и выход продукта
реакции. Определить массу продукта.
3. Даны массы продукта и выход продукта.
Определить массу исходного вещества.
Задачи.
1. При сжигании железа в сосуде, содержащем 21,3 г
хлора, было получено 24,3 г хлорида железа (III).
Рассчитайте выход продукта реакции.
2. Над 16 г серы пропустили водород при
нагревании. Определите объем (н.у.) полученного
сероводорода, если выход продукта реакции
составляет 85% от теоретически возможного.
3. Какой объём оксида углерода (II) был взят для
восстановления оксида железа (III), если получено
11,2г железа с выходом 80% от теоретически
возможного.
Анализ задач.
Каждая задача складывается из совокупности
данных (известные вещества) – условия задачи
(“выход” и т.п.) – и вопроса (вещества, параметры
которых требуется найти). Кроме этого, в ней есть
система зависимостей, которые связывают искомое
с данными и данные между собой.
Задачи анализа:
1) выявить все данные;
2) выявить зависимости между данными и
условиями;
3) выявить зависимости между данным и искомым.
Итак, выясняем:
1. О каких веществах идет речь?
2. Какие изменения произошли с веществами?
3. Какие величины названы в условии задачи?
4. Какие данные – практические или
теоретические, названы в условии задачи?
5. Какие из данных можно непосредственно
использовать для расчётов по уравнениям реакций,
а какие необходимо преобразовать, используя
массовую долю выхода?
Алгоритмы решения задач трёх типов:
Определение выхода продукта в % от теоретически
возможного.
1. Запишите уравнение химической реакции и
расставьте коэффициенты.
2. Под формулами веществ напишите количество
вещества согласно коэффициентам.
3. Практически полученная масса известна.
4. Определите теоретическую массу.
5. Определите выход продукта реакции (%), отнеся
практическую массу к теоретической и умножив на
100%.
6. Запишите ответ.
Расчет массы продукта реакции, если известен
выход продукта.
1. Запишите “дано” и “найти”, запишите
уравнение, расставьте коэффициенты.
2. Найдите теоретическое количество вещества
для исходных веществ. n =
3. Найдите теоретическое количество вещества
продукта реакции, согласно коэффициентам.
4. Вычислите теоретические массу или объем
продукта реакции.
m = M * n или V = Vm * n
5. Вычислите практические массу или объем
продукта реакции (умножьте массу теоретическую
или объем теоретический на долю выхода).
Расчет массы исходного вещества, если известны
масса продукта реакции и выход продукта.
1. По известному практическому объёму или массе,
найдите теоретический объём или массу (используя
долю выхода продукта).
2. Найдите теоретическое количество вещества
для продукта.
3. Найдите теоретическое количество вещества
для исходного вещества, согласно коэффициентам.
4. С помощью теоретического количества вещества
найдите массу или объем исходных веществ в
реакции.
Домашнее задание.
Решите задачи:
1. Для окисления оксида серы (IV) взяли 112 л (н.у.)
кислорода и получили 760 г оксида серы (VI). Чему
равен выход продукта в процентах от теоретически
возможного?
2. При взаимодействии азота и водорода получили
95 г аммиака NH3 с выходом 35%. Какие объёмы
азота и водорода были взяты для реакции?
3. 64,8 г оксида цинка восстановили избытком
углерода. Определите массу образовавшегося
металла, если выход продукта реакции равен 65%.
Загрузить PDF
Загрузить PDF
В химии теоретический выход – это максимальное количество продукта, которое получается в результате химической реакции. На самом деле большинство реакций не являются идеальными, то есть практический выход продукта всегда меньше теоретического. Чтобы вычислить эффективность реакции, необходимо найти процент выхода продукта по формуле: выход (%) = (практический выход/теоретический выход) x100. Если процент выхода равен 90%, это означает, что реакция эффективна на 90%, а 10% реагентов были потрачены впустую (они не вступили в реакцию или не соединились).
-
1
Начните со сбалансированного химического уравнения. Химическое уравнение включает реагенты (слева от знака равенства) и образующиеся продукты (справа от знака равенства). В некоторых задачах химическое уравнение дано, а в других его надо написать. Во время химической реакции атомы не создаются и не уничтожаются, поэтому у каждого элемента должно быть одинаковое число атомов слева и справа от знака равенства.[1]
-
2
Найдите молярную массу каждого исходного вещества. Определите молярную массу каждого атома вещества, а затем сложите молярные массы, чтобы вычислить молярную массу всего вещества. Сделайте это для одной молекулы реагента.
-
3
Преобразуйте массу каждого реагента из граммов в число молей. Теперь рассмотрите реакцию, которую вы собираетесь провести. Запишите массу каждого реагента в граммах. Полученное значение разделите на молярную массу вещества, чтобы преобразовать граммы в число молей.[2]
-
4
Найдите молярное соотношение реагентов. Помните, что моль – это величина, которая используется химиками для «подсчета» молекул. Вы определили количество молекул каждого исходного вещества. Разделите число молей одного реагента на число молей другого, чтобы найти молярное соотношение двух реагентов.
- Вы взяли 1,25 моль кислорода и 0,139 моль глюкозы. Молярное соотношение кислорода и глюкозы: 1,25/0,139 = 9. Это означает, что на 1 молекулу глюкозы приходятся 9 молекул кислорода.
-
5
Найдите оптимальное соотношение реагентов. Вернитесь к сбалансированному уравнению, которое вы записали ранее. С помощью этого уравнения можно определить оптимальное соотношение реагентов, то есть соотношение, при котором оба вещества будут израсходованы одновременно.
- Левая сторона уравнения:
. То есть на 1 одну молекулу глюкозы приходятся 6 молекул кислорода. Оптимальное соотношение реагентов: 6 кислород/ 1 глюкоза = 6.
- Не перепутайте вещества, которые находятся в числителе и в знаменателе дроби. Если поделить кислород на глюкозу, а потом глюкозу на кислород, вы получите неправильный результат.
- Левая сторона уравнения:
-
6
Сравните соотношения, чтобы найти ключевой компонент реакции. В химической реакции один реагент расходуется быстрее другого. Такой ключевой реагент определяет скорость химической реакции. Сравните два соотношения, которые вы вычислили, чтобы найти ключевой реагент:[3]
- Если молярное соотношение больше оптимального, вещества, которое находится в числителе дроби, слишком много. При этом вещество, которое находится в знаменателе дроби, является ключевым реагентом.
- Если молярное соотношение меньше оптимального, вещества, которое находится в числителе дроби, слишком мало и оно является ключевым реагентом.
- В нашем примере молярное соотношение (кислород/глюкоза = 9) больше оптимального соотношения (кислород/глюкоза = 6). Таким образом, вещество, которое находится в знаменателе дроби (глюкоза), является ключевым реагентом.
Реклама
-
1
Определите продукты реакции. В правой части химического уравнения перечислены продукты реакции. Каждый продукт имеет теоретический выход, то есть количество продукта, которое получится в случае идеальной реакции.
-
2
Запишите число молей ключевого реагента. Теоретический выход продукта равен количеству продукта, который получится при идеальных условиях. Чтобы вычислить теоретический выход, начните с числа молей ключевого реагента (читайте предыдущий раздел).
- В нашем примере вы выяснили, что ключевым реагентом является глюкоза. Также вы вычислили, что взяли 0,139 моль глюкозы.
-
3
Найдите соотношение молекул продукта и реагента. Вернитесь к сбалансированному уравнению. Разделите количество молекул продукта на количество молекул ключевого реагента.
-
4
Умножьте полученное соотношение на количество реагента в молях. Так вы получите теоретический выход продукта (в молях).
- Вы взяли 0,139 моль глюкозы, а отношение углекислого газа к глюкозе равно 6. Теоретический выход углекислого газа: (0,139 моль глюкозы) x (6 моль углекислого газа/1 моль глюкозы) = 0,834 моль углекислого газа.
-
5
Полученный результат преобразуйте в граммы. Полученное число молей умножьте на молярную массу продукта, чтобы найти теоретический выход в граммах. Эту единицу измерения можно использовать в большинстве экспериментов.
- Например, молярная масса CO2 приблизительно равна 44 г/моль (молярная масса углерода ≈ 12 г/моль, молярная масса кислорода ≈ 16 г/моль, поэтому 12 + 16 + 16 = 44).
- Перемножьте: 0,834 моль CO2 x 44 г/моль CO2 ≈ 36,7 г. Теоретический выход продукта равен 36,7 г CO2.
Реклама
-
1
Уясните, что такое процент выхода. Теоретический выход предполагает, что реакция прошла идеально. На самом деле, идеальных реакций не бывает: нежелательные примеси и другие непредсказуемые проблемы приводят к тому, что часть реагентов не преобразуется в продукт. Поэтому в химии используются три понятия, которые характеризуют выход продукта:
- Теоретический выход – это максимальное количество продукта, которое может получиться в результате реакции.
- Практический выход – это реальное количество продукта, масса которого измеряется на весах.
- Процент выхода = (практический выход/теоретический выход)*100%. Например, если процент выхода равен 50%, это означает, что количество продукта составляет 50% от теоретически возможного.
-
2
Запишите практический выход продукта. Если вы провели эксперимент самостоятельно, соберите продукт реакции и взвесьте его на весах, чтобы найти его массу. Если перед вами химическая задача или результаты чужого эксперимента, практический выход будет дан.
- Предположим, что в результате реакции вы получили 29 г CO2.
-
3
Разделите практический выход на теоретический. Убедитесь, что вы используете одну и ту же единицу измерения для обоих значений (обычно граммы). Результат запишите без единицы измерения.
- Практический выход равен 29 г, а теоретический выход равен 36,7 г:
- Практический выход равен 29 г, а теоретический выход равен 36,7 г:
-
4
Результат умножьте на 100, чтобы получить проценты. Так вы вычислите процент выхода продукта.
- 0,79 x 100 = 79, то есть процент выхода продукта равен 79%. Таким образом, в результате реакции получилось 79% от максимально возможного количества CO2.
Реклама
Советы
- Некоторые учащиеся путают процентный выход (количество практического выхода по отношению к теоретическому) с процентной погрешностью (как практический выход отличается от теоретического). Формула для вычисления процента выхода (процентного выхода): (практический выход/теоретический выход)*100%. Чтобы вычислить процентную погрешность, в знаменателе этой формулы нужно записать разность между практическим и теоретическим выходам.
- Если вы получили совершенно разные результаты, проверьте единицы измерения. Если практический выход отличается от теоретического на порядок или больше, скорее всего, на каком-то этапе вычислений вы использовали неправильные единицы измерения. Повторите вычисления и следите за единицами измерения.
- Если процент выхода больше 100%, и вы уверены в правильности вычислений, продукт имеет нежелательные примеси. Очистите продукт (например, высушите или отфильтруйте его), а затем снова взвесьте.
Реклама
Об этой статье
Эту страницу просматривали 51 655 раз.