Характеристика алюминия
Положение в ПСХЭ
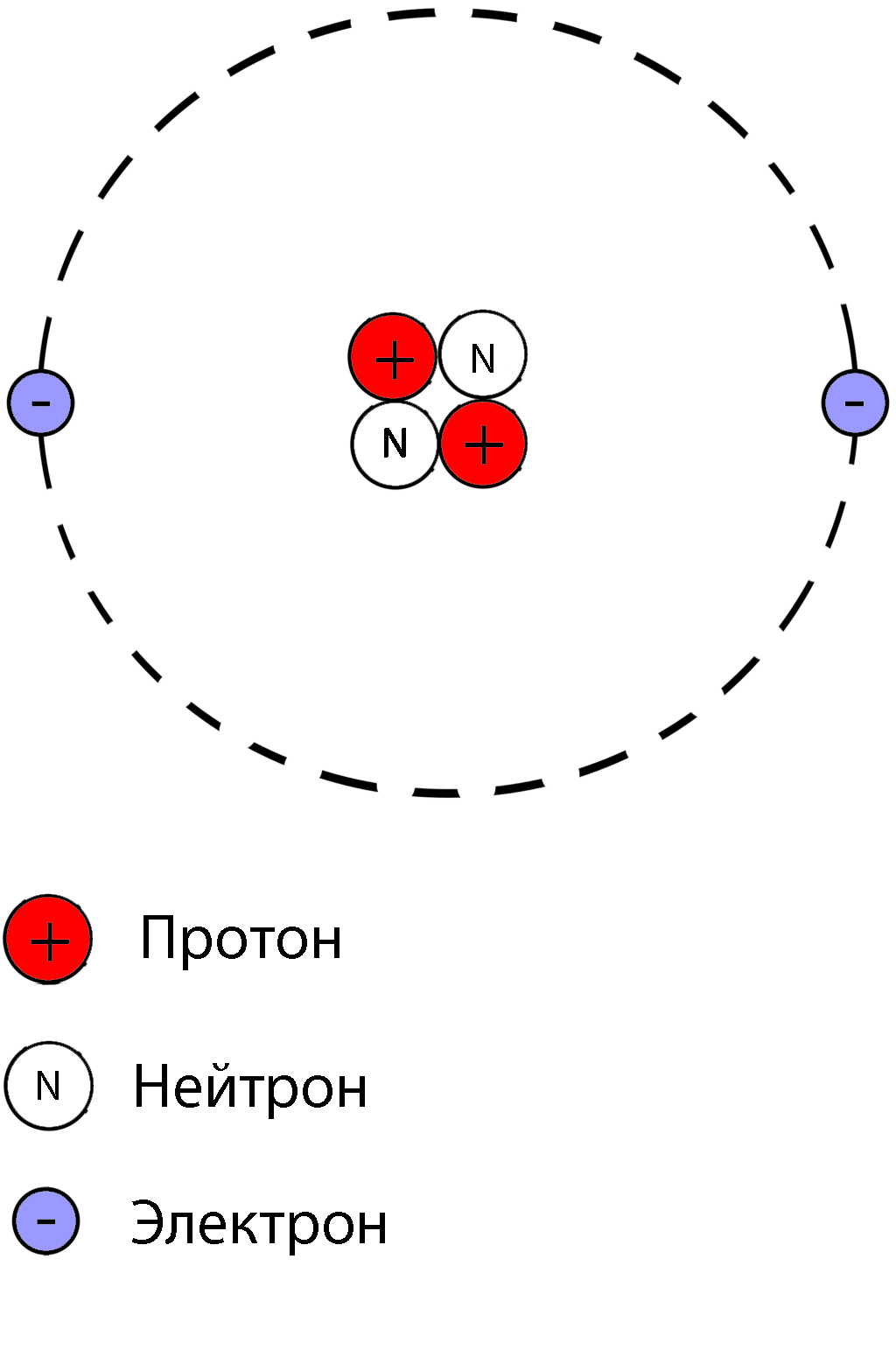
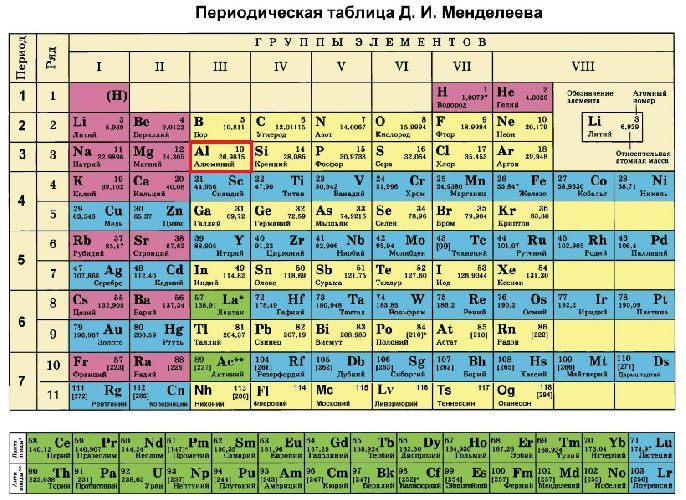
Алюминий (Al) располагается во 3 периоде, в III группе, главной подгруппе, имеет порядковый номер 13.
Атомные числа
A (массовое число) = 27
P (число протонов) = 13
N (число нейтронов) = A — Z = 27 — 13 = 14
ē (число электронов) = 13
Электронное строение атома
Al
+13
2
8
3
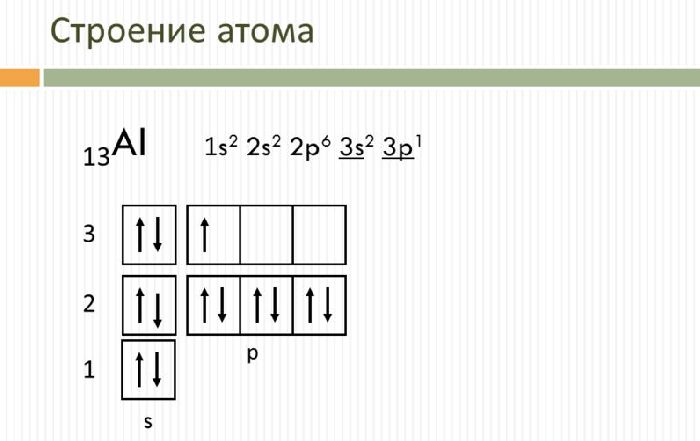
13Al 1s2 2s2 2p6 3s2 3p1
Валентные электроны
| 13Al | ↑↓ | ↑ | ||||
| 3s | 3p |
| 13Al* | ↑ | ↑ | ↑ | |||
| 3s | 3p |
Степени окисления
минимальная: 0
максимальная: +3
Свойства простого вещества
Алюминий – p-элемент, металл.
Высший оксид
Al2O3 – оксид алюминия.
Проявляет амфотерные свойства:
Al2O3 + 2NaOH + 3H2O ⟶ 2Na[Al(OH)4]
Al2O3 + 6HCl ⟶ 2AlCl3 + 3H2O
Высший гидроксид
Al(OH)3 – гидроксид алюминия.
Проявляет амфотерные свойства:
Al(OH)3 + NaOH ⟶ Na[Al(OH)4]
Al(OH)3 + 3HCl ⟶ AlCl3 + 3H2O
Al
число протонов=числу электронов=порядковому номеру элемента в таблице Менделеева. У алюминия порядковый номер — 13, значит число протонов и электронов равно 13 каждое. Число нейтронов = атомная масса элемента — (минус) число протонов, значит 27 — 13 = 14
Na
Его порядковый номер 11, значит число протонов и электронов = 11 каждое. Число нейтронов = 23-11 = 12
S
Его порядковый номер — 16, значит число протонов и электронов = 16 каждое. Число нейтронов = 32 — 16 = 16
Нахождение числа нейтронов, протонов и электронов в атоме .
Атом состоит из ядра и вращающихся вокруг ядра электронов.
Ядро состоит из протонов и нейтронов
Протон- положительно заряженная частица
масса протона равна единице, заряд протона равен единице
Нейтрон-нейтральная частица
масса нейтрона равна единице, заряд нейтрона равен нулю
Электрон- отрицательно заряженная частица
Заряд электрона равен -1, а масса электрона равна нулю
Порядковый номер элемента в таблице Менделеева указывает на число электронов в атоме
Количество протонов в атоме равно количеству электронов , так как атом электрически нейтрален
Масса атома складывается из числа протонов и числа нейтронов, масса электрона не учитывается
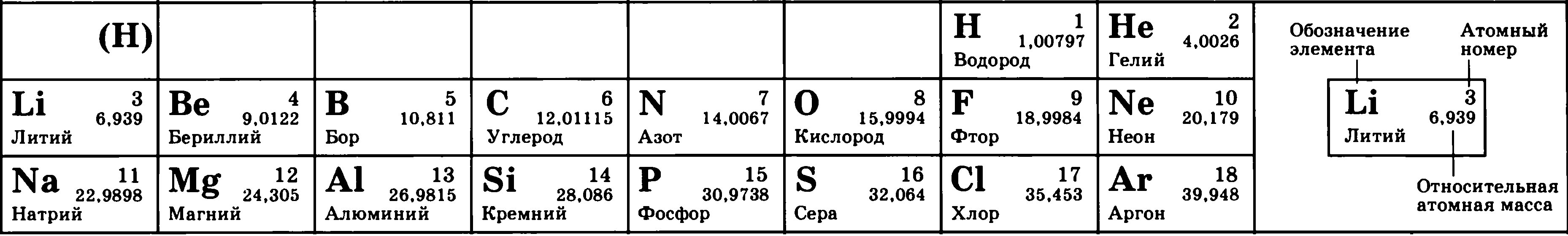
Рассмотрим фрагмент таблицы Менделеева и найдем количество протонов, нейтронов и электронов
в атоме водорода
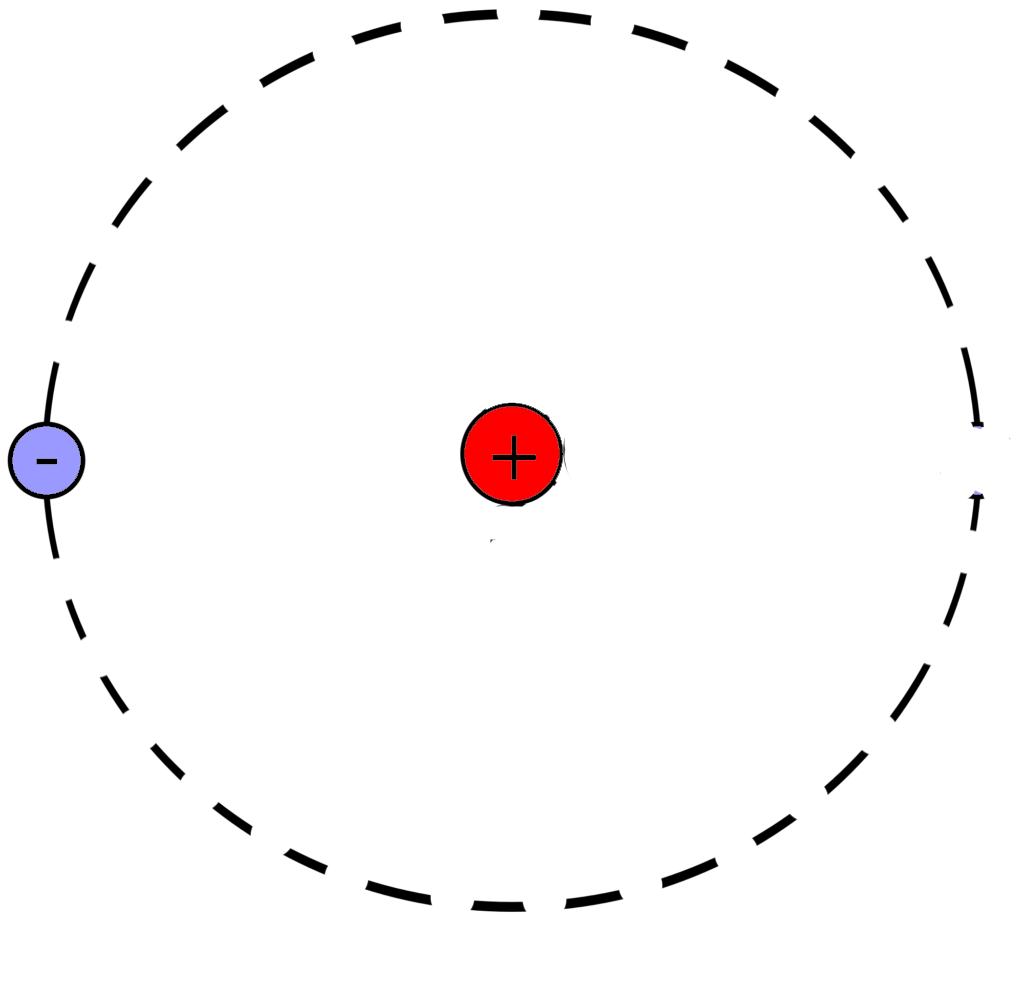
После чего начертим модель атома водорода
Порядковый номер атома водорода равен единице, значит атом имеет:
1 электрон
1 протон
Для нахождения количества нейтронов нужно из массы вычесть число протонов
Масса атома водорода равна единице
Количество нейтронов=1-1=0
В атоме водорода нет нейтронов
Модель атома водорода:
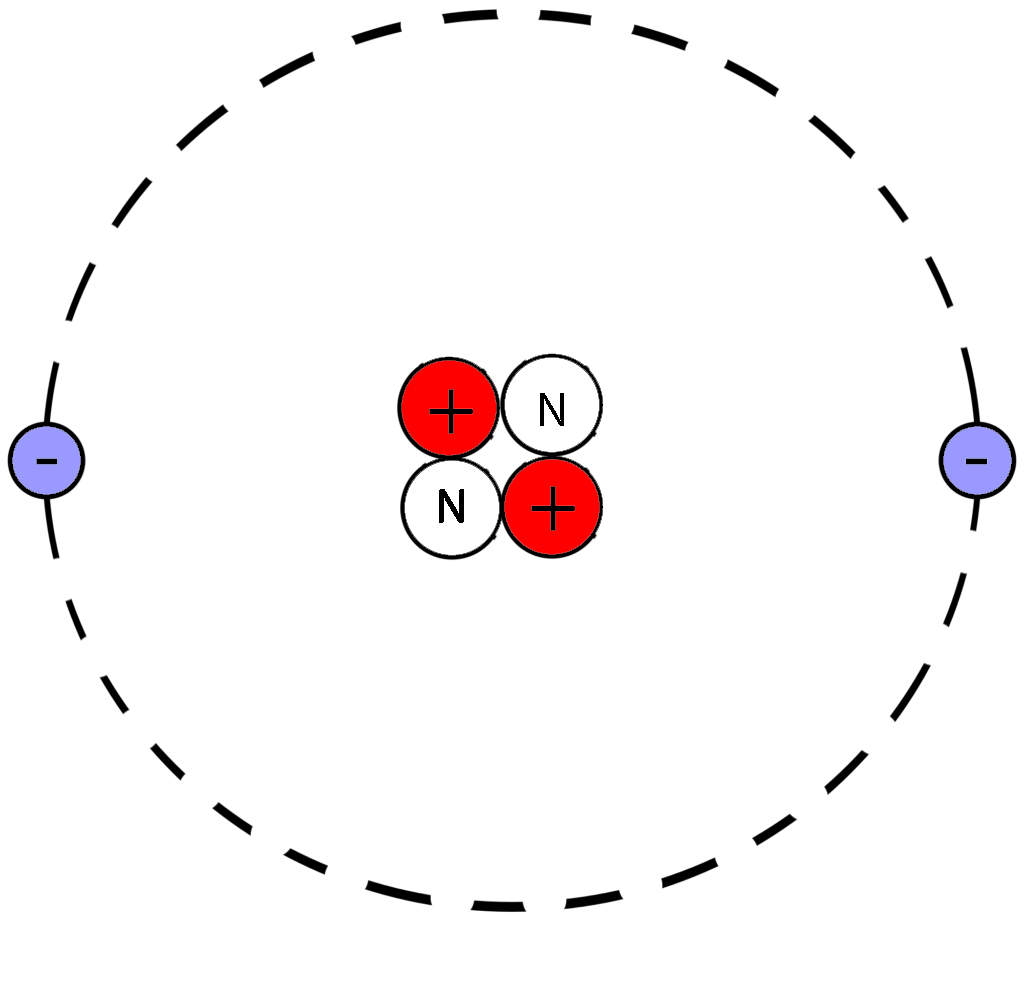
Рассмотрим фрагмент таблицы Менделеева и найдем количество протонов, нейтронов и электронов
в атоме гелия
После чего начертим модель атома гелия
Порядковый номер атома гелия равен 2, значит атом имеет:
2 электрона
2 протона
Для нахождения количества нейтронов нужно из массы вычесть число протонов
Масса атома гелия равна 4
Количество нейтронов=4-2=2
В атоме гелия 2 нейтрона
Модель атома гелия:
Задача 1.
С помощью фрагмента таблицы Менделеева найти количество протонов, нейтронов и электронов в атоме лития
Массу атома округлить до 7.
Показать ответ
Показать решение
Видеорешение
Задача 2.
С помощью фрагмента таблицы Менделеева найти количество протонов, нейтронов и электронов в атоме углерода.
Показать ответ
Показать решение
Видеорешение
Задача 3.
С помощью фрагмента таблицы Менделеева найти количество протонов, нейтронов и электронов в атоме азота.
Показать ответ
Показать решение
Видеорешение
Задача 4.
С помощью фрагмента таблицы Менделеева найти количество протонов, нейтронов и электронов в атоме кислорода.
Атомную массу округлить до 16.
Показать ответ
Показать решение
Видеорешение
Как мы видим в таблице Менделеева выше стоит порядковый номер, то есть заряд, который равен числу протонов
и электронов , а под ним расположена атомная масса.
Из каких-то непонятных соображений в ядерных реакциях или просто в одиночном обозначении элемента
сверху стоит масса, а снизу заряд(номер).
То есть все наоборот
( _{6}^{12}textrm{C} ;;;;;;;;; ) (12) это масса, (6) это заряд (номер)
( _{Z}^{M}textrm{C} ;;;;;;;;; ) (M) это масса, (Z) это заряд (номер)
Задача 5.
Найти количество протонов, нейтронов и электронов в атоме фтора
( _{9}^{19}textrm{F} )
Показать ответ
Показать решение
Видеорешение
Задача 6.
Найти количество протонов, нейтронов и электронов в атоме алюминия
( _{13}^{27}textrm{Al} )
Показать ответ
Показать решение
Видеорешение
Изотопы это атомы одного и того же химического элемента, они имеют одинаковый заряд,
но разное количество нейтронов
Изотопы кислорода:
( _{8}^{16}textrm{O} , ;;;; _{8}^{17}textrm{O} , ;;;; _{8}^{18}textrm{O} )
Строение атома алюминия

4.6
Средняя оценка: 4.6
Всего получено оценок: 482.
4.6
Средняя оценка: 4.6
Всего получено оценок: 482.
Алюминий (Al) – лёгкий металл, занимающий третье место по распространённости в земной коре среди химических элементов. Строение атома алюминия позволяет легко обрабатывать металл: он поддаётся литью, формовке, механическому воздействию.
Строение
Электронное строение атома элемента алюминия связано с его положением в периодической таблице Менделеева. Алюминий имеет 13 порядковый номер и находится в третьем периоде, в IIIa группе. Относительная атомная масса алюминия – 27. Электронная конфигурация атома алюминия – 1s22s22p63s23p1, модель распределения электронов – +13Al)2)8)3.
Атом элемента состоит из положительно заряженного ядра +13 (13 протонов и 14 нейронов) и трёх электронных оболочек с 13 электронами. На внешнем энергетическом уровне находится всего три электрона. В возбуждённом состоянии атом способен отдавать все три электрона, проявляя степень окисления +3, или образовывать три ковалентные связи. Поэтому алюминий имеет третью валентность.
В природе алюминий встречается только в составе соединений – глины, слюды, корунда. Металл ценился дороже золота до открытия промышленного способа его получения.
Свойства
Алюминий – серебристый металл, обладающий высокой электропроводностью и пластичностью. Элемент при комнатной температуре легко соединяется с кислородом, образуя на поверхности оксидную плёнку, защищающую металл от коррозии. Образование плёнки препятствует реакции с водой, концентрированными азотной и серной кислотами, поэтому алюминиевая тара подходит для перевозки этих кислот.
Для снятия оксидной плёнки используют соли аммония, горячие щёлочи, сплавы ртути. После разрушения оксидной плёнки алюминий вступает в реакцию со многими неметаллами и соединениями. Основные химические свойства элемента описаны в таблице.
|
Взаимодействие |
Ход реакции |
Пример |
|
С водой |
Только в условиях отсутствия оксидной плёнки. Образуется гидроксид алюминия |
2Al + 6H2O → 2Al(OH)3 + 3H2 |
|
С кислородом |
Образуется оксид алюминия |
4Al + 3O2 → 2Al2O3 + Q |
|
С галогенами |
При комнатной температуре. С йодом – в присутствии катализатора |
2Al + 3Cl2 → 2AlCl3 |
|
С серой |
При температуре выше 200°С, образуется сульфид алюминия |
2Al + 3S → Al2S3 |
|
С фосфором |
При температуре 500°С, образуется фосфид алюминия |
Al + P → AlP |
|
С азотом |
При температуре 800°С, образуется нитрид алюминия |
2Al + N2 → 2AlN |
|
С углеродом |
При температуре 2000°С, образуется карбид алюминия |
4Al + 3C → Al4C3 |
|
С кислотами |
При комнатной температуре реагирует с разбавленными кислотами, при нагревании – с концентрированными. Образуются соли |
– 2Al + 3H2SO4 → Al2(SO4)3 + 3H2; – 2Al + 6HCl → 2AlCl3 + 3H2; – Al + 6HNO3(конц.) → Al(NO3)3 + 3NO2 + 3H2O |
|
Со щелочами |
Реагируют растворы и сплавы |
– 2Al + 2NaOH + 10H2O → 2Na[Al(H2O)2(OH)4] + 3H2; – 2Al + 6KOH → 2KAlO2 + 2K2O + 3H2 |
|
С оксидами |
Вытесняет металлы |
2Al + Cr2O3 = 2Cr + Al2O3 |
Алюминий не взаимодействует с водородом.
Что мы узнали?
Атом алюминия включает 13 электронов. Схема строения алюминия – 1s22s22p63s23p1. На внешнем уровне находится три электрона, определяющие третью валентность элемента. Алюминий – лёгкий, плавкий металл, легко вступающий в реакцию с кислородом и образующий на поверхности оксидную плёнку. Благодаря плёнке металл не подвержен коррозии и не вступает в реакцию с концентрированными кислотами. При комнатной температуре алюминий реагирует с галогенами, при нагревании – с серой, фосфором, азотом, углеродом.
Тест по теме
Доска почёта

Чтобы попасть сюда — пройдите тест.
-
El’nore Christopher
5/5
-
Александр Котков
5/5
-
Александр Котков
5/5
Оценка доклада
4.6
Средняя оценка: 4.6
Всего получено оценок: 482.
А какая ваша оценка?
Один атом алюминия содержит 13 протонов и 14 нейтронов. Протоны — это положительно заряженные частицы в атоме, а нейтроны — это субатомные частицы, которые не имеют заряда.
Количество нейтронов в атоме можно определить, вычтя количество протонов в атоме из массового числа атома. В Периодической таблице элементов атомный вес элемента указан под этим элементом. Округление этого атомного веса до ближайшего целого числа дает массовое число элемента.
В случае алюминия массовое число равно 27. Количество нейтронов определяется путем вычитания количества протонов в элементе из массового числа элемента. В атоме алюминия 13 протонов, поэтому уравнение будет 27-13 = 14.
У некоторых атомов алюминия нет 14 нейтронов. Эти атомы называются изотопами. Al-26 — это изотоп алюминия с периодом полураспада 730 000 лет. У Al-28 период полураспада намного короче — 2,3 минуты.
Нейтральный атом алюминия также имеет 13 электронов. Электроны — это отрицательно заряженные частицы в атоме. У нейтрального атома нет чистого заряда, поэтому заряды протонов и электронов должны нейтрализовать друг друга. Алюминий имеет 14 положительно заряженных протонов и 14 отрицательно заряженных электронов, что дает ему нулевой общий заряд.