135
ЛЕКЦИЯ 12
ПРИМЕНЕНИЕ
ПЕРВОГО НАЧАЛА ТЕРМОДИНАМИКИ
К ИЗОПРОЦЕССАМ
12.1. Изопроцессы.
Работа при изопроцессах
Среди равновесных
процессов, происходящих с термодинамическими
системами, выделяют изопроцессы
– равновесные процессы, в которых один
из основных параметров поддерживается
постоянным.
1. Изохорный
процесс ().
1-3 – изохорное
охлаждение; 1-2 – изохорное нагревание.
При
газ не совершает работы:
.
Из первого начала
термодинамики
,
следовательно, первое начало термодинамики
при изохорном процессе:
.
Теплота, сообщенная
газу в изохорном процессе, идет на
изменение (увеличение) внутренней
энергии системы.
2. Изобарный
процесс ().
Из первого начала
термодинамики:
,
следовательно,
первое начало термодинамики при изобарном
процессе:
.
Работа при изобарном
процессе:

Если
К, то для 1 моль газа
,
т.е. R
численно равна работе изобарного
расширения 1 моль идеального газа при
нагревании на 1 К.
3. Изотермический
процесс ().
Первое начало
термодинамики:
.
При
,
,
следовательно,
.
Работа совершается за счет теплоты,
получаемой системой.
Работа изотермического
расширения:
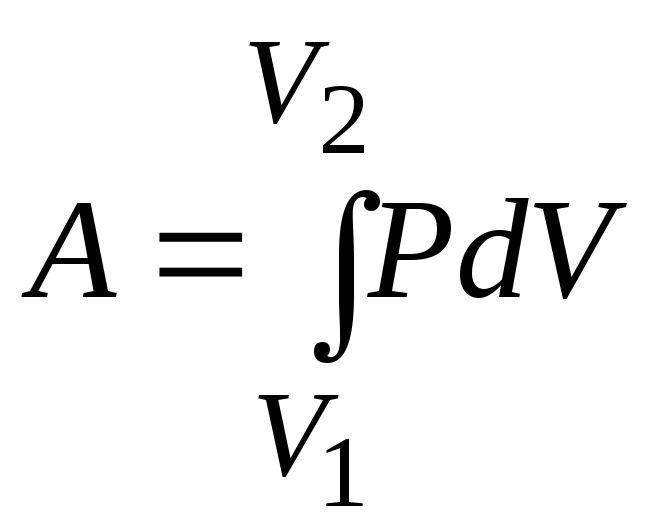
,
следовательно,


следовательно,
работа при изотермическом процессе:
.
Первое начало
термодинамики для изотермического
процесса:
.
Вывод:
все количество теплоты, сообщаемое
газу, расходуется на совершение им
работы против внешних сил.
Чтобы при расширении
газа его температура понижалась, к газу
в ходе изотермического процесса
необходимо подводить количество теплоты,
эквивалентное внешней работе расширения.
12.2. Адиабатный
процесс
К изопроцессам
можно отнести и адиабатный процесс –
процесс, при котором отсутствует
теплообмен с окружающей средой.
Пример:
сжатие и растяжение воздуха в звуковой
волне, работа двигателя внутреннего
сгорания.
полная
теплоизоляция.
Первое начало
термодинамики:
система совершает работу за счет
внутренней энергии системы.
;
(12.1)
Выражение
продифференцируем и получим:
.
(12.2)
Разделим (12.2) на
(12.1):
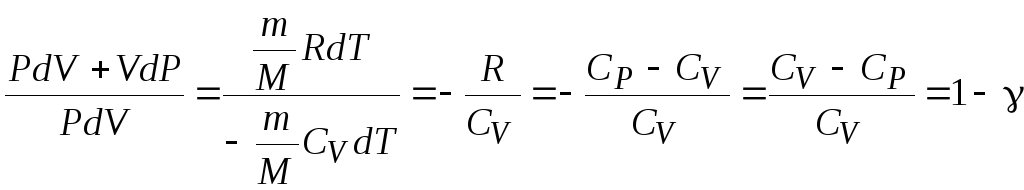
где
.
;
;


Уравнение Пуассона
уравнение
адиабатного процесса в координатах (Р,
V).
Запишем уравнение
Клапейрона-Менделеева и выразим из него
давление P:
,
откуда
‑ уравнение
Пуассона в координатах
(Т,
V).
Выразим из уравнения
Клапейрона-Менделеева объем:
,
откуда
уравнение
Пуассона в координатах
(Т,
Р).
Уравнения адиабатного
процесса:
;
;
,
где
показатель адиабаты.
График адиабаты
– график зависимости между параметрами
состояния идеального газа при
.
Адиабата
более крута, чем изотерма ().
Это объясняется тем, что при адиабатном
сжатии увеличение давления газа
обусловлено не только уменьшением его
объема, как при изотермическом сжатии,
но и повышением температуры, следовательно,
при адиабатном сжатии газ нагревается,
а при адиабатном расширении – охлаждается.
Работа газа в
адиабатном процессе.
.
Работа при адиабатном
процессе:

(12.3)
Вывод:
если газ адиабатически расширяется от
до
,
то его температура уменьшается от
до
.
Учтем:
;
(12.3)
;
(учли, что
)
Учтем:
.


Работа при
адиабатическом процессе расширения
меньше, чем при изотермическом расширении.
Это объясняется тем, что при адиабатном
расширении происходит охлаждение газа,
тогда как при изотермическом расширении
температура поддерживается постоянной
за счет притока извне эквивалентного
количества теплоты.
Вывод: рассматриваемые
изохорный, изобарный, изотермический
и адиабатный процессы имеют общую
особенность – они происходят при
постоянной теплоемкости.
уравнение
изохоры
уравнение
изобары
уравнение
изотермы
уравнение
адиабаты
Процесс, при котором
теплоемкость остается постоянной
называется политропным.
Уравнение политропы:
,
где
показатель политропы;
.
Вывод:
все рассмотренные процессы являются
частными случаями политропного процесса.
В координатах Р, V
политропа – график зависимости между
параметрами состояния при
.
Гипербола ()
занимает промежуточное положение между
изотермой и адиабатой (п
– показатель политропы
).
Контрольные
вопросы
-
Что такое
изопроцессы? Какие изопроцессы Вам
известны? -
Выведите формулы
для подсчета работы при различных
изопроцессах и покажите, как на их
графиках в осях р
,
V
изображается эта работа. -
Нарисуйте (на
плоскости р
,
V
) изотерму и адиабату. Объясните, почему
адиабата с ростом V
спадает круче, чем изотерма? -
Выведите уравнение
Пуассона. Что такое показатель адиабаты? -
За счет чего газ
при адиабатном расширении совершает
работу против внешних сил? Что происходит
с температурой адиабатно расширяющегося
идеального газа? -
Что называется
политропным процессом? -
Теплоемкость при
изотермическом процессе равна
.
Что это означает физически
Задачи
-
Масса 16г кислорода
находится при давлении 300 кПа и температуре
27 оС.
После нагревания при постоянном давлении
газ занял объем 10 литров. Найти количество
теплоты, полученное газом, изменение
внутренней энергии газа и работу,
совершенную газом при расширении.
[6142,5
Дж;
4387,5 Дж;
1755 Дж]. -
Двухатомному газу
сообщено количество теплоты 2,093 кДж.
Газ расширяется изобарически. Найти
работу расширения газа. [598 Дж]. -
Азот массой m=56
г, находящийся при нормальных условиях,
расширяется адиабатно, причем объем
газа увеличивается в два раза. Определите:
1) изменение внутренней энергии ΔU
газа; 2) работу расширения А
газа. [ΔU=—2,75
кДж;
А=2,75
кДж]
Соседние файлы в папке 432_lecfiz
- #
- #
- #
- #
- #
- #
- #
- #
- #
Для изотермического процесса характерен определенный процесс, который происходит с газовым веществом, который в свою очередь имеет неизменную массу и постоянную неизменяемую температуру вещества.
Изотермический процесс для температуры газа, основные формулы и величины
Формулы
Изотермический процесс характеризует состояние газа и данное состояние записывается следующими формулами:
[p_{1} V_{1}=v R T]
[p_{2} V_{2}=v R T]
Изотермический процесс для системы координат
Характерные изотермические процессы зачастую отражают на термодинамических графиках и диаграммах.
Если рассмотреть подробно график можно увидеть линию, именно ее и принято называть изотермой. Она непосредственно является основной характеристикой процесса.
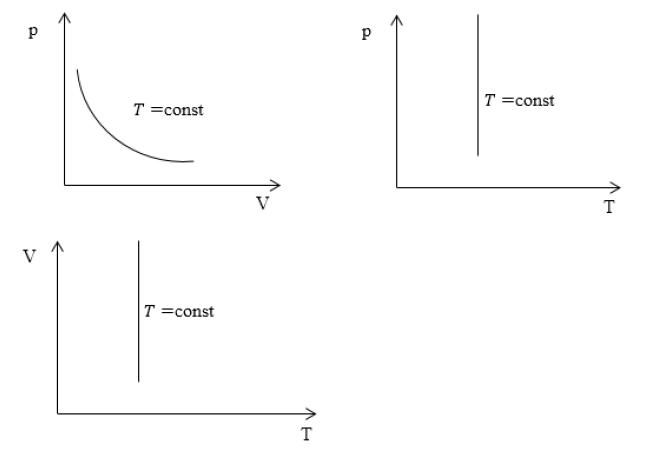
Изотермический процесс — закон Бойля-Мариотта
Разделим уравнение для второго состояния газа на выражение первого состояния и получим основное уравнение изотермического процесса.
[frac{p_{2} V_{2}}{p_{1} V_{1}}=1] или [p V=mathrm{const}] (постоянное значение)
Полученное уравнение и будет называться законом Бойля-Мариотта.
Данный процесс осуществляется с использованием тепловой энергии.
В случае, когда объем увеличивается, или отводится, для его уменьшения.
Составим первое значение термодинамики.
Затем постепенно получим уравнение для определения работы.
А также вычисления внутренней энергии и количества теплоты тела при изотермическом процессе.
[delta Q=d cup+d A=frac{i}{2} v R d T+p d V]
Температура является неизменной, поэтому, изменение значения внутренней энергии будет равняться нулевому значению. [(d cup=0)].
Из этого следует, что для изотермического процесса все подводимое тепло направлено на работу, которую совершает газ:
[ Delta Q=int_{V_{1}}^{V_{2}} d A ]
где:
- [delta Q] — тепло элементарного характера, которое подводится ко всей системе;
- dA — работа элементарного типа, совершаемая газом в изотермическом процессе;
- i — количество свободных степеней газовых молекул;
- R — газовое значение постоянной;
- d — значение молей для газа;
- V1— первоначальное значение объема газа;
- V2— окончательное значение объема газа.
[A=int_{V_{1}}^{V_{2}} p d V]
Давление газа, которое зависит от уравнения газа в идеальном состоянии.
[p V=v R T rightarrow p=frac{v R T}{V}]
Подставим вышеуказанное выражение в подынтегральное выражение:
[A=int_{V_{1}}^{V_{2}} frac{v R T}{V}=v R T int_{V_{1}}^{V_{2}} frac{d V}{V}=mathrm{u} R T ln left(frac{V_{2}}{V_{1}}right)]
Составленное уравнение необходимо определения значения работы, которую совершает газ в изотермическом процессе.
[ A=v R T ln left(frac{p_{1}}{p_{2}}right) ]
[ Delta Q=A ]
Нет времени решать самому?
Наши эксперты помогут!
Как найти изотермический процесс — примеры решения задач
Пример №1
Основное содержание задания: газ идеального состояния, имеет способность расширяется, имея постоянную температуру, от объема.
[V_{1}=0.2 mathrm{~m}^{3}]
[V_{2}=0.6 mathrm{~m}^{3}]
Известно сила давления во втором состоянии и оно равняется [p_{2}=1 cdot 10^{5} mathrm{Pi a}].
Определить:
- Величину изменения внутренней энергии газа;
- Значение работы, которую совершает газовое вещество в данном процессе;
- Какое необходимое количество теплоты получает газ в процессе работы.
Методика решения:
Внутренняя энергия газа неизменна, так как процесс который рассматривается в задаче, является изотермическим:
[Delta mathrm{U}=0]
Из основного закона термодинамики можно определить:
[Delta cup=A]
[A=v R T ln left(frac{V_{2}}{V_{1}}right)]
Составим и запишем уравнение, которое отражает окончательное (конечное) состояние газа:
[p_{2} V_{2}=v R T rightarrow T=frac{p_{2} V_{2}}{v R}]
Подставим в уравнение для температуры вышеизложенные формулы и получим решение:
[A=v R frac{p_{2} V_{2}}{v R} ln left(frac{V_{2}}{V_{1}}right)=p_{2} V_{2} ln left(frac{V_{2}}{V_{1}}right) .]
Следовательно, все величины расположены в международной системе единиц (СИ), можно провести вычисления и определить неизвестные значения:
[A=0.6 cdot 10^{5} ln left(frac{0.6}{0.2}right)=0.6 cdot 10^{5} cdot 1.1=6.6 cdot 10^{4} text { (Дж) }]
Ответ задачи:
- значение изменения внутренней энергии газа в рассматриваемой процессе равно нулевому значению.
- работа, которая совершается в процессе газовым веществом равняется [6,6 cdot 10^{4} text { Дж }].
- Необходимое количество тепловой энергии равно: [6,6 cdot 10^{4} text { Дж }].
Пример №2
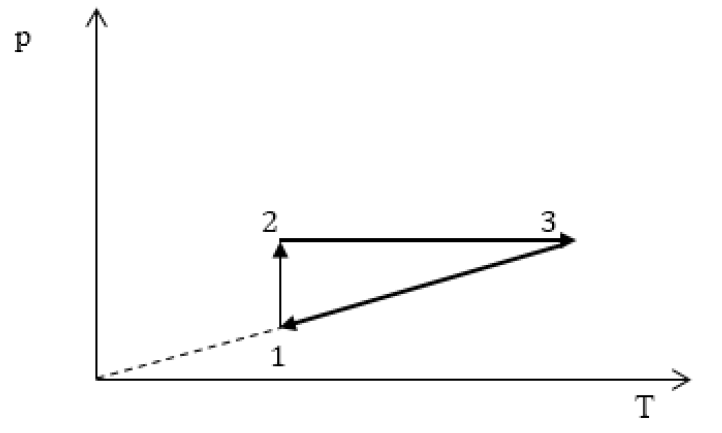
Задание: изображен график, где изменяется идеальное состояние массы газа равное m в координатных осях p (V).
Нужно перенесите данный процесс на координатные оси в p(T).
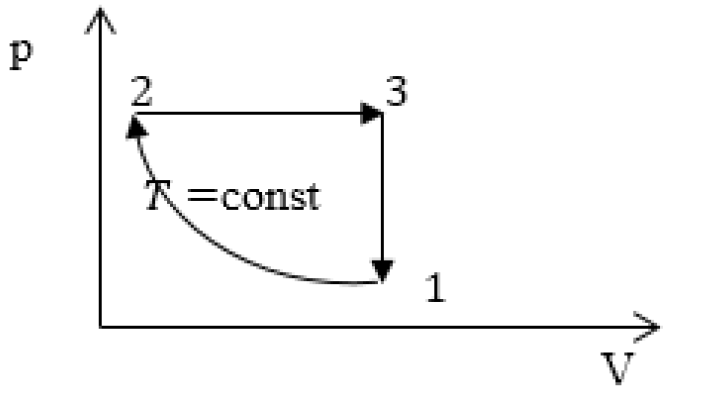
На данном графике изображен круговой процесс.
Где:
- Прямая 1-2 является изотермическим процессом с константой [(T=text { cons } t)]. Следовательно значение объема будет уменьшается [(mathrm{V} downarrow)], а давления соответственно расти [(p uparrow)].
- Прямая 2-3 отражает изобарический процесс [(p=text { const })]
const). Для данного процесса характерно увеличение объема [mathrm{V} uparrow] и применяя закон Гей-Люссака, увеличение [Т uparrow]
- Прямая (отрезок) 3-1 является изохорным процессом объем будет постоянной величиной [(mathrm{V}=text { const })], а [p downarrow],а исходя из закона Шарля [T downarrow].
Все перечисленные процессы изобразим на координатных осях p(T).
Как определить работу при изотермическом процессе
При изотермическом процессе, который протекает при постоянной температуре, газ выполняет работу за счет расширения. Расширение газа характеризуется его объемом, который изменяется в зависимости от изменения давления газа, обусловленного внешними воздействиями.
Вам понадобится
- — герметичный сосуд с поршнем;
- — весы;
- — термометр;
- — линейка.
Инструкция
Рассчитайте работу газа при постоянной температуре. Для этого определите, какой газ выполняет работу, и рассчитайте его молярную массу. С помощью периодической таблицы найдите молекулярную массу, которая численно равна молярной массе, измеренной в г/моль.
Найдите массу газа. Для этого откачайте воздух из герметичного сосуда и взвесьте его на весах. После этого закачайте газ, работа которого определяется, и снова взвесьте сосуд. Разность масс пустого и заполненного сосудов и будет равна массе газа. Измеряйте ее в граммах.
Измерьте при помощи термометра температуру газа. При изотермическом процессе она будет постоянна. Если измерение производится при комнатной температуре, достаточно измерить температуру окружающего воздуха. Измерения произведите в Кельвинах. Для этого к температуре, измеренной в градусах Цельсия, прибавьте число 273.
Определите начальный и конечный объем газа при выполнении работы. Для этого сосуд берите с подвижным поршнем, и, вычисляя уровень его подъема, рассчитайте первичный и вторичный объем геометрическими методами. Для этого используйте формулу для объема цилиндра V=π•R²•h, где π≈3,14, R – радиус цилиндра, h его высота.
Рассчитайте работу газа при изотермическом процессе. Для этого поделите массу газа m на его молярную массу M. Полеченный результат умножьте на универсальную газовую постоянную R=8,31 и значение температуры Т в Кельвинах. Полученный результат умножьте на натуральный логарифм из отношения конечного и начального объемов V2 и V1, A = m/M•R•T•ln(V2/V1).
В том случае, когда известно количество теплоты Q, которое получило тело при изотермическом процессе, используйте второе начало термодинамики Q = ∆U + A. Где A – работа газа, а ΔU – изменение его внутренней энергии. Поскольку изменение внутренней энергии зависит от температуры, а при изотермическом процессе она остается постоянной, то ΔU=0. В этом случае работа газа равна теплоте, переданной ему Q = A.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.






