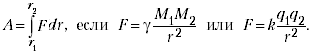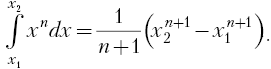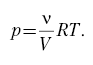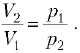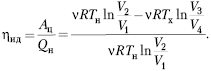Для
рассмотрения конкретных процессов
найдем в общем виде внешнюю работу,
совершаемую газом при изменении его
объема. Рассмотрим, например, газ,
находящийся под поршнем в цилиндрическом
сосуде (рис. 78). Если газ, расширяясь,
передвигает поршень на бесконечно малое
расстояние dl,
то
производит над ним работу
A=Fdl=pSdl=pdV,
где S
—
площадь поршня, Sdl=dV—
изменение объема системы. Таким
образом,
A=pdV.
(52.1)
Полную
работу A,
совершаемую газом при изменении его
объема от V1
до
V2,
найдем
91
интегрированием
формулы (52.1):
Результат
интегрирования определяется характером
зависимости между давлением и объемом
газа. Найденное для работы выражение
(52.2) справедливо при любых изменениях
объема твердых, жидких и газообразных
тел.
Произведенную
при том или ином процессе работу
можно изобразить графически с помощью
кривой в координатах р,
V.
Например,
изменение давления газа при его расширении
изобразится кривой на рис. 79. При
увеличении объема на dV
совершаемая
газом работа равна pdV,
т.
е. определяется площадью полоски с
основанием dV
на
рисунке. Поэтому полная работа, совершаемая
газом при расширении от объема V1
до
объема V2,
определяется
площадью, ограниченной осью абсцисс,
кривой p
= f(V) и
прямыми V1
и
V2.
Графически
можно изображать только равновесные
процессы —
процессы, состоящие из последовательности
равновесных состояний. Они протекают
так, что изменение термодинамических
параметров за конечный промежуток
времени бесконечно мало. Все реальные
процессы неравновесны (они протекают
с конечной скоростью), но в ряде случаев
неравновесностью реальных процессов
можно пренебречь (чем медленнее процесс
протекает, тем он ближе к равновесному).
В дальнейшем рассматриваемые процессы
будем считать равновесными.
§ 53. Теплоемкость
Удельная
теплоемкость вещества величина,
равная количеству теплоты, необходимому
для нагревания 1 кг вещества на 1 К:
Единица
удельной теплоемкости — джоуль на
килограмм-кельвин (Дж/(кг•К)).
Молярная
теплоемкость— величина,
равная количеству теплоты, необходимому
для нагревания 1 моля вещества на 1 К:
где v
= m/M
—
количество вещества, выражающее
число молей.
Единица
молярной теплоемкости — джоуль на
моль-кельвин (Дж/(моль•К)).
Удельная
теплоемкость с
связана
с молярной Сm
соотношением
Ст
= сМ, (53.2)
где М
— молярная
масса вещества.
Различают
теплоемкости при постоянном объеме
и постоянном давлении, если в процессе
нагревания вещества его объем или
давление поддерживается постоянным.
Запишем выражение
первого начала термодинамики (51.2) для
1 моля газа с учетом формул (52.1) и (53.1):
CmdT
= dUm
+ pdVm.
(53.3)
Если газ нагревается
при постоянном объеме, то работа внешних
сил равна нулю (см. (52.1)) и сообщаемая
газу извне теплота идет только на
увеличение его внутренней энергии:
т. е.
молярная теплоемкость газа при постоянном
объеме Сv
равна
изменению внутренней энергии 1 моля
газа при повышении его температуры
на 1 К. Согласно формуле (50.1),
92
тогда
Cv
= iR/2. (53.5)
Если газ нагревается
при постоянном давлении, то выражение
(53.3) можно записать в виде
Учитывая,
что dUm/dT
не зависит от вида процесса (внутренняя
энергия идеального газа не зависит ни
от р,
ни
от V,
а
определяется
лишь температурой Т)
и
всегда равна Сv
(см.
(53.4)); продифференцировав уравнение
Клапейрона — Менделеева pVm=RT
(42.4)
по T(p=const),
получим
Cp
= Cv
+ R. (53.6)
Выражение
(53.6) называется уравнением
Майера; оно
показывает, что Ср
всегда
больше Сv
на
величину молярной газовой постоянной.
Это объясняется тем, что при нагревании
газа при постоянном давлении требуется
еще дополнительное количество теплоты
на совершение работы расширения
газа, так как постоянство давления
обеспечивается увеличением объема
газа.
Использовав (53.5),
выражение (53.6) можно записать в виде
При
рассмотрении термодинамических процессов
важно знать характерное для каждого
газа отношение Ср
к Cv:
=Cp/Cv=(i+2)/i.
(53.8)
Из формул (53.5) и
(53.7) следует, что молярные теплоемкости
определяются лишь числом степеней
свободы и не зависят от температуры.
Это утверждение молекулярно-кинетической
теории справедливо в довольно широком
интервале температур лишь для одноатомных
газов. Уже у двухатомных газов число
степеней свободы, проявляющееся в
теплоемкости, зависит от температуры.
Молекула двухатомного газа обладает
тремя поступательными, двумя вращательными
и одной колебательной степенями свободы.
По
закону равномерного распределения
энергии по степеням свободы (см. § 50),
для комнатных температур Cv
= 7/2R.
Из
качественной экспериментальной
зависимости молярной теплоемкости Сv
водорода
(рис. 80) следует, что Cv
зависит
от температуры: при низкой температуре
(50
К) Cv=3/2R,
при
комнатной — Cv=5/2R
(вместо
расчетных 7/2R!)
и
очень высокой — Сv=7/2/R.
Это можно объяснить, предположив, что
при низких температурах наблюдается
только поступательное движение
молекул, при комнатных — добавляется
их вращение, а при высоких — к этим двум
видам движения добавляются еще
колебания молекул.
Расхождение
теории и эксперимента нетрудно объяснить.
Дело в том, что при вычислении теплоемкости
надо учитывать квантование энергии
вращения и колебаний молекул (возможны
не любые вращательные и колебательные
энергии, а лишь определенный дискретный
ряд значений энергий). Если энергия
теплового движения недостаточна,
например, для возбуждения колебаний,
то эти колебания не вносят своего
вклада в теплоемкость (соответствующая
степень свободы «замораживается» —
к ней неприменим закон равнораспределения
энергии). Этим объясняется, что
теплоемкость моля двухатомного газа —
водорода — при комнатной температуре
равна 5/2
R
вместо
7/2
R.
Аналогично
можно объяснить уменьшение теплоемкости
при низкой температуре («замораживаются»
вращательные степени сво-
93
боды) и увеличение
при высокой («возбуждаются»
колебательные степени свободы).
Соседние файлы в папке Трофимова
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Первый закон термодинамики
-
Темы кодификатора ЕГЭ: работа в термодинамике, первый закон термодинамики, адиабатный процесс.
-
Работа газа в изобарном процессе
-
Работа газа в произвольном процессе
-
Работа, совершаемая над газом
-
Применение первого закона термодинамики к изопроцессам
-
Адиабатный процесс
Автор статьи — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев
Темы кодификатора ЕГЭ: работа в термодинамике, первый закон термодинамики, адиабатный процесс.
Начнём с обсуждения работы газа.
Газ, находящийся в сосуде под поршнем, действует на поршень с силой , где
— давление газа,
— площадь поршня. Если при этом поршень перемещается, то газ совершает работу.
При расширении газа эта работа будет положительной (сила давления газа и перемещение поршня направлены в одну сторону). При сжатии работа газа отрицательна (сила давления газа и перемещение поршня направлены в противоположные стороны).
к оглавлению ▴
Работа газа в изобарном процессе
Предположим, что газ расширяется при постоянном давлении . Тогда сила
, с которой газ действует на поршень, также постоянна. Пусть поршень переместился на расстояние
(рис. 1).
Рис. 1.
Работа газа равна:
Но — изменение объёма газа. Поэтому для работы газа при изобарном расширении мы получаем формулу:
(1)
Если и
— начальный и конечный объём газа, то для работы газа имеем:
. Изобразив данный процесс на
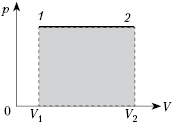
-диаграмме, мы видим, что работа газа равна площади прямоугольника под графиком нашего процесса (рис. 2).
Рис. 2. Работа газа как площадь
Пусть теперь газ изобарно сжимается от объёма до объёма
. С помощью аналогичных рассуждений приходим к формуле:
Но , и снова получается формула (1).
Работа газа опять-таки будет равна площади под графиком процесса на -диаграмме, но теперь со знаком минус.
Итак, формула выражает работу газа при постоянном давлении — как в процессе расширения газа, так и в процессе сжатия.
к оглавлению ▴
Работа газа в произвольном процессе
Геометрическая интерпретация работы газа (как площади под графиком процесса на -диаграмме) сохраняется и в общем случае неизобарного процесса.
Действительно, рассмотрим малое изменение объёма газа — настолько малое, что давление
будет оставаться приблизительно постоянным. Газ совершит малую работу
. Тогда работа
газа во всём процессе найдётся суммированием этих малых работ:
Но данный интеграл как раз и является площадью криволинейной трапеции (рис. 3):
Рис. 3. Работа газа как площадь
к оглавлению ▴
Работа, совершаемая над газом
Наряду с работой , которую совершает газ по передвижению поршня, рассматривают также работу
, которую поршень совершает над газом.
Если газ действует на поршень с силой , то по третьему закону Ньютона поршень действует на газ с силой
, равной силе
по модулю и противоположной по направлению:
(рис. 4).
Рис. 4. Внешняя сила , действующая на газ
Следовательно, работа поршня равна по модулю и противоположна по знаку работе газа:
Так, в процессе расширения газ совершает положительную работу ; при этом работа, совершаемая над газом, отрицательна
. Наоборот, при сжатии работа газа отрицательна
, а работа, совершаемая поршнем над газом, положительна
0 right )’ class=’tex’ alt=’left ( {A}’ > 0 right )’ />.
Будьте внимательны: если в задаче просят найти работу, совершённую над газом, то имеется в виду работа .
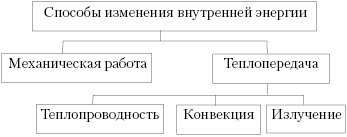
Как мы знаем, существует лишь два способа изменения внутренней энергии тела: теплопередача и совершение работы.
Опыт показывает, что эти способы независимы — в том смысле, что их результаты складываются. Если телу в процессе теплообмена передано количество теплоты , и если в то же время над телом совершена работа
, то изменение внутренней энергии тела будет равно:
(2)
Нас больше всего интересует случай, когда тело является газом. Тогда (где
, как всегда, есть работа самого газа). Формула (2) принимает вид:
, или
(3)
Соотношение (3) называется первым законом термодинамики. Смысл его прост: количество теплоты, переданное газу, идёт на изменение внутренней энергии газа и на совершение газом работы.
Напомним, что величина может быть и отрицательной: в таком случае тепло отводится от газа. Но первый закон термодинамики остаётся справедливым в любом случае. Он является одним из фундаментальных физических законов и находит подтверждение в многочисленных явлениях и экспериментах.
к оглавлению ▴
Применение первого закона термодинамики к изопроцессам
Напомним, что в изопроцессе остаётся неизменным значение некоторой величины, характеризующей состояние газа — температуры, объёма или давления. Для каждого вида изопроцессов запись первого закона термодинамики упрощается.
1. Изотермический процесс, .
Внутренняя энергия идеального газа зависит только от его температуры. Если температура газа не меняется, то не меняется и внутренняя энергия: . Тогда формула (3) даёт:
Всё подведённое к газу тепло идёт на совершение газом работы.
2. Изохорный процесс, .
Если объём газа остаётся постоянным, то поршень не перемещается, и потому работа газа равна нулю: . Тогда первый закон термодинамики даёт:
Всё тепло, переданное газу, идёт на изменение его внутренней энергии.
3. Изобарный процесс, .
Подведённое к газу тепло идёт как на изменение внутренней энергии, так и на совершение работы (для которой справедлива формула (1)). Имеем:
к оглавлению ▴
Адиабатный процесс
Процесс называется адиабатным, если он идёт без теплообмена с окружающими телами.
Адиабатный процесс совершается газом, находящимся в теплоизолированном сосуде. Такой сосуд препятствует всем видам теплопередачи: теплопроводности, конвекции, излучению. Пример теплоизолированного сосуда — термос.
Приблизительно адиабатным будет всякий процесс, протекающий достаточно быстро: в течение процесса теплообмен просто не успевает произойти.
При адиабатном процессе . Из первого закона термодинамики получаем:
, или
.
В процессе адиабатного расширения газ совершает положительную работу, поэтому (работа совершается за счёт убыли внутренней энергии). Следовательно, газ охлаждается. Если заставить газ совершить достаточно большую работу, охладить его можно весьма сильно. Именно на этом основаны методы сжижения газов.
Наоборот, в процессе адиабатного сжатия будет , поэтому
: газ нагревается. Адиабатное нагревание воздуха используется в дизельных двигателях для воспламенения топлива.
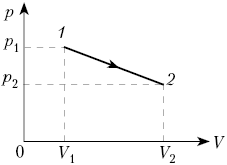
Кривая, изображающая ход адиабатного процесса, называется адиабатой. Интересно сравнить ход адиабаты и изотермы на -диаграмме (рис. 5).
Рис. 5. Сравнительный ход изотермы и адиабаты
В обоих процессах давление убывает с увеличением объёма, но в адиабатном процессе убывание идёт быстрее. Почему?
При изотермическом расширении давление падает потому, что уменьшается концентрация частиц газа, в результате чего удары частиц по стенкам сосуда становятся реже. Однако интенсивность этих ударов остаётся прежней: ведь температура газа не меняется — значит, не меняется и средняя кинетическая энергия его частиц.
А при адиабатном расширении, наряду с уменьшением концентрации частиц, падает также и температура газа. Удары частиц становятся не только более редкими, но и более слабыми. Вот почему адиабата убывает быстрее изотермы.
Благодарим за то, что пользуйтесь нашими статьями.
Информация на странице «Первый закон термодинамики» подготовлена нашими редакторами специально, чтобы помочь вам в освоении предмета и подготовке к ЕГЭ и ОГЭ.
Чтобы успешно сдать нужные и поступить в высшее учебное заведение или техникум нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими материалами из данного раздела.
Публикация обновлена:
08.05.2023
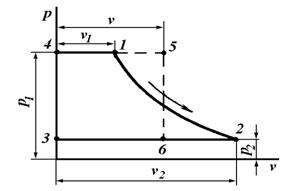
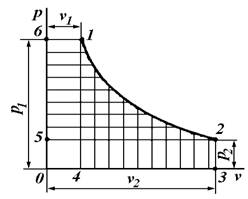
Кроме понятия «работа изменения объема», в термодинамических расчетах широко используют понятие «работа изменения давления».
Работой изменения давления называется работа перемещения жидкостей, газов и паров из области высокого давления () в область низкого давления (
). Ее значение определяют либо по формулам:
, (6.7)
, (6.8)
либо графически, пользуясь -диаграммой.
Здесь W – работа изменения давления; V – средний объем; w – удельная работа изменения давления; v – средний удельный объем.
Графически удельная работа изменения давления определяется площадью 1234 на -диаграмме (рис. 6.3), ограниченной осью ординат и двумя абсциссами , проведенными из крайних точек линии процесса.
В результате замены этой площади (пл.) равновеликой ей площадью прямоугольника 3456 высотой, равной разности , и основанием, равным среднему удельному объему газа (v) в процессе, устанавливаем, что
пл. 1234 = пл. 3456 = .
Работа изменения давления положительная, если >
, и отрицательная, если
<
.
Найдем связь между удельными работами изменения объема (l) и изменения давления (w).
Пусть на -диаграмме линия 1 – 2 изображает процесс произвольного состояния рабочего тела (рис. 6.4). В этом случае пл. 1234 (заштрихованная вертикальными линиями) графически изображает удельную работу изменения объема (l) ,а пл. 1256 (заштрихованная горизонтальными линиями) – удельную работу изменения давления (w).
Рис. 6.3. PV-диаграмма
Рис. 6.4. PV-диаграмма
Из рисунка 6.4 видно что
пл. 1234 + пл. 6140 – пл. 5032 = пл. 6125
или
,
откуда
. (6.9)
После подстановки удельной работы изменения объема, определенной по формуле (6.9), в уравнение первого начала термодинамики (6.2) имеем:
.
Сгруппируем слагаемые последнего выражения следующим образом:
. (6.10)
Введем обозначение:
.
Величина h называется удельной энтальпией, и поскольку ее определяют три параметра состояния, то и сама она является параметром состояния.
Подставив значения h в формулу (6.9) ,получим еще один вид уравнения первого начала термодинамики:
. (6.11)
Значения удельной энтальпии определяют по справочникам.
Физический смысл величины h можно выяснить путем исследования уравнения (6.11), записанного в дифференциальной форме:
.
При p = const имеем:
,
т.е. dh есть элементарное количество теплоты, подведенное к термодинамическому телу в процессе при постоянном давлении.
При изучении физики в восьмом классе мы говорили о том, что
изменить состояние термодинамической системы, то есть её внутреннюю энергию, можно
двумя способами: используя теплопередачу или совершая механическую работу.
Поговорим о последней более подробно.
Итак, когда мы изучали механику, мы с вами говорили о том,
что работа силы (то есть механическая работа) связана с превращением одного
вида энергии в другой, например, механической энергии во внутреннюю. При этом работу
силы мы рассматривали как меру изменения энергии физической системы.
А вот как определить работу в термодинамике, ведь при
рассмотрении термодинамических процессов механическое перемещение макротел в
целом не рассматривается?
Забавно, но работа в термодинамике определяется так же, как и
в механике, но она равна изменению не механической энергии тела, а изменению
его внутренней энергии.
Итак, давайте рассмотрим газ, находящийся в цилиндрическом
сосуде с площадью основания S, и закрытый
подвижным поршнем. Взаимодействие газа с поршнем, а также со стенками сосуда
можно характеризовать давлением, которое газ оказывает на них.
Начнём медленно нагревать газ так, чтобы его давление не
изменялось. Очевидно, что в этом случае газ будет изобарически расширяться, а
поршень начнёт перемещаться за счёт работы силы давления газа над внешними
телами.
Предположим, что поршень переместился на расстояние ∆l.
Так как в процессе расширения давление газа не изменялось, то и сила давления
газа на поршень оставалась неизменной:
F
= pS.
Поэтому работу этой силы мы можем найти как произведение
модуля силы на модуль перемещения и на косинус угла между направлением вектора
силы и вектора перемещения (в нашем примере правда, этот угол равен нулю):
Подставим в записанное уравнение выражение для силы давления:
А теперь давайте подумаем, что определяет произведение площади
основания сосуда (она же площадь основания поршня) и модуля перемещения поршня?..
Да, оно определяет приращение объёма:
Тогда работа газа при его изобарном расширении будет
определяться произведением давления газа на изменение его объёма:
Из этой формулы следует, что сила давления газа совершает
работу только в процессе изменения объёма газа.
А так как давление газа всегда величина положительная, то из
формулы также следует, что при расширении газ совершает положительную работу. При
сжатии же газа сила давления будет совершать отрицательную работу.
Процесс медленного изобарного сжатия газа можно
характеризовать и работой внешних сил над газом, которая отличается от работы
самого газа только знаком:
А теперь давайте запишем уравнение Клайперона — Менделеева
для двух состояний газа в цилиндре:
И вычтем из второго уравнение первое:
В левой части полученного равенства у нас стоит произведение
давления газа на изменение его объёма. А это, как мы с вами нашли ранее, есть не
что иное, как работа газа при изобарном процессе:
Теперь предположим, что в сосуде под поршнем находится один
моль идеального газа и в результате изобарного расширения его температура
изменилась на один кельвин. Тогда получим, что «А равно Эр»:
Отсюда вытекает физический смысл универсальной газовой
постоянной: она численно равна работе, совершаемой одним молем идеального
газа при его изобарном нагревании на один кельвин.
Работе газа при его изобарном расширении или сжатии можно
дать простое геометрическое токование. Для этого давайте построим график
зависимости давления газа от занимаемого им объёма. Очевидно, что графиком
является прямая линия, параллельная оси абсцисс.
А площадь прямоугольника, ограниченного графиком процесса,
осью V и прямыми, соответствующими значениям объёмов в начальном и
конечном состояниях газа, — это есть ничто иное, как работа газа.
Если процесс перехода газа из начального состояния в конечное
не является изобарным, то кривую зависимости давления газа от занимаемого им
объёма можно представить как ломаную, состоящую из большого числа изохор и
изобар. Работа на изохорных участках равна нулю, а суммарная работа на всех
изобарных участках будет равна площади заштрихованной фигуры.
А теперь для закрепления материала решим с вами несколько
классических задач. В первой задаче нам необходимо будет определить работу, совершаемую
силой давления идеального газа определённой массы при его изобарном нагревании от
290 К до 355 К, если давление газа и его начальный объём соответственно 200 кПа
и 0,1 м3.
Задача 2. Идеальный газ в количестве 3 молей находится
при температуре 350 К. После изохорного охлаждения, в результате которого
давление уменьшилось в два раза, газ испытывает изобарное расширение, причём в
конечном состоянии температура равна первоначальной. Изобразите графически эти
процессы в осях p, V и вычислите совершённую газом работу.
Спецвыпуск
Г. А.
Белуха
Работа газа в термодинамике
··· Орловский выпуск ···
Г.А.БЕЛУХА,
школа № 4, г. Ливны, Орловская обл.
Работа газа в термодинамике
Методические рекомендации по
изучению темы, 10-й класс
При изучении работы газа в
термодинамике учащиеся неизбежно сталкиваются с
трудностями, обусловленными слабыми навыками
вычисления работы переменной силы. Поэтому к
восприятию этой темы необходимо готовиться,
начиная уже с изучения работы в механике и решая
с этой целью задачи на работу переменной силы
путём суммирования элементарных работ на всём
пути с помощью интегрирования.
Например, при вычислениях работы силы
Архимеда, силы упругости, силы всемирного
тяготения и т.п. надо учиться суммировать
элементарные величины с помощью простейших
дифференциальных соотношений типа dA = Fds.
Опыт показывает, что старшеклассники легко
справляются с этой задачей, – дугу траектории, на
которой сила увеличивается или уменьшается,
нужно разбить на такие промежутки ds, на
которых силу F можно считать постоянной
величиной, а затем, зная зависимость F = F(s),
подставить её под знак интеграла. Например,
Работа этих сил вычисляется с помощью
простейшего табличного интеграла
Такая методика облегчает адаптацию
будущих студентов к восприятию курса физики в
вузе и устраняет методические сложности,
связанные с умением находить работу переменной
силы в термодинамике и др.
После того как учащиеся усвоили, что
такое внутренняя энергия и как найти её
изменение, целесообразно дать обобщающую схему:
Усвоив, что работа – это один из
способов изменения внутренней энергии,
десятиклассники легко рассчитывают работу газа
в изобарном процессе. На данном этапе необходимо
подчеркнуть, что сила давления газа на всём пути
не меняется, и по третьему закону Ньютона |F2| = |F1|,
знак работы находим из формулы A = Fs cos. Если
= 0°, то A > 0,
если = 180°,
то A < 0. На графике зависимости р(V)
работа численно равна площади под графиком.
Пусть газ расширяется или сжимается
изотермически. Например, газ сжимается под
поршнем, давление изменяется, и в любой момент
времени
При бесконечно малом перемещении
поршня на dl мы получим бесконечно малое
изменение объёма dV, а давление р можно
считать постоянным. По аналогии с нахождением
механической работы переменной силы, составим
простейшее дифференциальное соотношение dA = pdV,
тогда 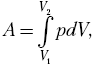
зависимость р (V), запишем 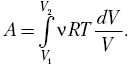
типа 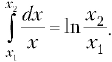
газа в этом случае отрицательна, т.к. = 180°:
т.к. V2 < V1.
Полученную формулу можно переписать,
используя соотношение
Для закрепления решим задачи.
1. Газ переходит из состояния 1
(объём V1, давление р1) в
состояние 2 (объём V2, давление р2)
в процессе, при котором его давление зависит от
объёма линейно. Найдите работу газа.
Решение. Построим примерный
график зависимости p от V. Работа равна
площади под графиком, т.е. площади трапеции:
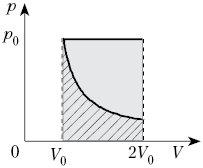
2. Один моль воздуха, находящийся при
нормальных условиях, расширяется от объёма V0
до 2V0 двумя способами – изотермически
и изобарно. Сравните работу, совершённую
воздухом в этих процессах.
Решение
При изобарном процессе Ap = р0V, но р0 =
RT0/V0,
V = V0,
следовательно, Ap = RT0.
При изотермическом процессе:
Сравним:
Изучив первый закон термодинамики и
его применение к изопроцессам и закрепив
решением задач тему о работе в термодинамике,
учащиеся подготовились к восприятию наиболее
сложной части термодинамики «Работа циклов и КПД
тепловых машин». Этот материал я излагаю в
следующей последовательности: работа циклов –
цикл Карно – КПД тепловых машин – круговые
процессы.
процессом (или циклом) называется
термодинамический процесс, в результате
которого тело, пройдя ряд состояний,
возвращается в исходное состояние. Если все
процессы в цикле равновесные, то цикл считается
равновесным. Его можно изобразить графически в
виде замкнутой кривой.
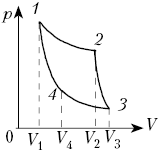
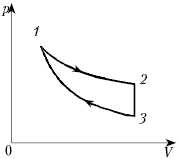
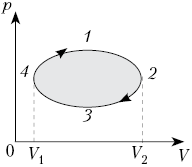
На рисунке показан график зависимости
давления p от объёма V (диаграмма p, V)
для некоторого цикла 1–2–3–4–1. На участках 1–2
и 4–1 газ расширяется и совершает
положительную работу А1, численно
равную площади фигуры V1412V2.
На участке 2–3–4 газ сжимается и совершает
работу А2, модуль которой равен
площади фигуры V2234V1. Полная
работа газ за цикл А = А1 + А2,
т.е. положительна и равна площади фигуры 12341.
Если равновесный цикл изображается
замкнутой кривой на р, V-диаграмме,
которая обходится по часовой стрелке, то работа
тела положительна, а цикл накзывается прямым.
Если замкнутая кривая на р, V-диаграмме
обходится против часовой стрелки, то газ
совершает отрицательную работу за цикл, а цикл
называется обратным. В любом случае модуль
работы газа за цикл равен площади фигуры,
ограниченной графиком цикла на р, V-диаграмме.
В круговом процессе рабочее тело
возвращается в исходное состояние, т.е. в
состояние с первоначальной внутренней энергией.
Это значит, что изменение внутренней энергии за
цикл равно нулю: U = 0.
Так как, по первому закону термодинамики, для
всего цикла Q = U + A, то Q = A.
Итак, алгебраическая сумма всех количеств
теплоты, полученных за цикл, равна работе тела за
цикл: Aц = Qн + Qх = Qн
– |Qх|.
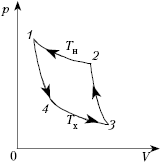
Рассмотрим один из круговых процессов
– цикл Карно. Он состоит из двух изотермических и
двух адиабатических процессов. Пусть рабочим
телом является идеальный газ. Тогда на участке 1–2
изотермического расширения, согласно первому
закону термодинамики, всё получаемое газом тепло
идёт на совершение положительной работы: Q12 = A12.
То есть нет никаких потерь тепла в окружающее
пространство и никакого изменения внутренней
энергии: U = 0,
т.к. T12 = const (потому что газ –
идеальный).
На участке 2–3 адиабатного
расширения газ совершает положительную работу
за счёт изменения внутренней энергии, т.к. Qад = 0
= U23 + Aг23
Aг23 = –
U23.
Здесь также нет потерь тепла, по определению
адиабатного процесса.
На участке 3–4 над газом
совершается положительная работа внешней силой,
но он не нагревается (изотермический процесс).
Благодаря достаточно медленно протекающему
процессу и хорошему контакту с холодильником газ
успевает отдавать получаемую за счёт работы
энергию в виде тепла холодильнику. Сам же газ
совершает при этом отрицательную работу: Q34 = Aг34
< 0.
На участке 4–1 газ адиабатно (без
теплообмена) сжимается до исходного состояния.
При этом он совершает отрицательную работу, а
внешние силы – положительную: 0 = U41 + Aг41
Aг41 = –
U41.
Таким образом, за цикл газ получает
тепло только на участке 1–2, изотермически
расширяясь:
Холодильнику тепло отдаётся только
при изотермическом сжатии газа на участке 3–4:
Согласно первому закону термодинамики
Aц = Qн – |Qx|;
поэтому
КПД машины, работающей по циклу Карно,
найдём по формуле
Согласно закону Бойля–Мариотта для
процессов 1–2 и 3–4, а также уравнению
Пуассона для процессов 2–3 и 4–1, легко
доказать, что
(Хорошо бы увидеть, как автор это
делает: ведь уравнение Пуассона для диабаты
идеального газа надо ещё получить. – Ред.)
После сокращений получим формулу КПД
тепловой машины, работающей по циклу Карно:
обратному циклу, методически правильно, как
показывает опыт, изучать на примере работы
обратного цикла Карно, т.к. он обратим и его можно
провести в обратном направлении: расширять газ
при понижении температуры от Tн до Tx
(процесс 1–4) и при низкой температуре Tx
(процесс 4–3), а затем сжимать (процессы 3–2
и 2–1). Теперь двигатель совершает работу,
чтобы привести в действие холодильную машину.
Рабочее тело отнимает количество теплоты Qx
у продуктов внутри при низкой температуре Tх,
а отдаёт количество теплоты Qн
окружающим телам, за пределами холодильника, при
более высокой температуре Tн. Таким
образом, машина, работающая по обратному циклу
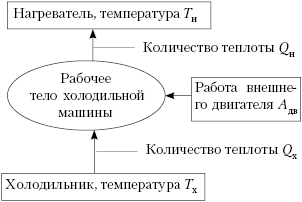
Карно, уже не тепловая, а идеальная холодильная.
Роль нагревателя (отдающего тепло) выполняет
тело с более низкой температурой. Но, сохранив
названия элементов, как в тепловой машине,
работающей по прямому циклу, мы можем
представить блок-схему холодильника в следующем
виде:
Обратим внимание, что тепло от
холодного тела переходит в холодильной машине к
телу с более высокой температурой не
самопроизвольно, а за счёт работы внешней силы.
Важнейшей характеристикой
холодильника является холодильный коэффициент , определяющий
эффективность работы холодильника и равный
отношению количества теплоты, отнятого от
холодильной камеры Qх к затраченной
энергии внешнего источника
За один обратный цикл рабочее тело
получает от холодильника количество теплоты Qх
и отдаёт в окружающее пространство количество
теплоты Qн, что больше Qх на
работу Aдв, совершаемую
электродвигателем над газом за цикл: |Qн| = |Qх| + Адв.
Энергия, затраченная двигателем
(электроэнергия в случае компрессорных
электрических холодильников), идёт на полезную
работу над газом, а также на потери при
нагревании обмоток двигателя электрическим
током QR и на трение в схеме Атр.
Если пренебречь потерями на трение и
джоулево тепло в обмотках двигателя, то
холодильный коэффициент
Учитывая, что в прямом цикле
после несложных преобразований
получим:
Последнее соотношение между
холодильным коэффициентом и КПД тепловой машины,
которая может работать и по обратному циклу,
показывает, что холодильный коэффициент может
быть больше единицы. В этом случае тепла
отнимается от холодильной камеры и возвращается
в комнату больше, чем для этого используется
энергии двигателем.
В случае идеальной тепловой машины,
работающей по обратному циклу Карно (идеального
холодильника), холодильный коэффициент имеет
максимальное значение:
В реальных холодильниках т.к. не вся получаемая
двигателем энергия идёт на работу над рабочим
телом, о чём написано выше.
Решим задачу:
• Оцените стоимость изготовления 1 кг
льда в домашнем холодильнике, если температура
испарения фреона –tх °С,
температура радиатора tн °С.
Стоимость одного киловатт-часа электроэнергии
равна Ц. Температура в комнате t.
Дано:
m, c, t, tн, tх,
, Ц.
____________
Д – ?
Решение
Стоимость Д изготовления льда равна
произведению работы электродвигателя на тариф Ц:
Д = ЦА.
Для превращения воды в лёд с
температурой 0 °С необходимо отвести от неё
количество теплоты Q = m(ct + ). Считаем
приближённо, что над фреоном совершается
обратный цикл Карно с изотермами при
температурах Tн и Tх.
Используем формулы для холодильного
коэффициента: по определению, = Q/A и для
идеального холодильника ид = Tх/(Tн – Tх).
Из условия следует, что
ид.
Решаем совместно три последних
уравнения:
Разбирая с учащимися эту задачу,
необходимо обратить внимание на то, что основная
работа холодильного устройства идёт не на
охлаждение продуктов, а на поддержание
температуры внутри холодильного шкафа путём
периодической откачки тепла, проникающего
сквозь стенки холодильника.
Для закрепления темы можно решить
задачу:
• КПД тепловой машины, работающей по
циклу, состоящему из изотермического процесса 1–2,
изохорического 2–3 и адиабатического 3–1,
равен , а
разность максимальной и минимальной температур
газа в цикле равна T. Найдите работу, совершённую
моль одноатомного
идеального газа в изотермическом процессе.
Решение
При решении задач, в которых
фигурирует КПД цикла, полезно предварительно
проанализировать все участки цикла, используя
первый закон термодинамики, и выявить участки,
где тело получает и отдаёт тепло. Проведём
мысленно ряд изотерм на р, V-диаграмме.
Тогда станет ясно, что максимальная температура
в цикле на изотерме, а минимальная – в т. 3.
Обозначим их через T1 и T3
соответственно.
На участке 1–2 изменение
внутренней энергии идеального газа U2 – U1 = 0.
По первому закону термодинамики, Q12 = (U2 – U1) + А12.
Так как на участке 1–2 газ расширялся, то
работа газа А12 > 0. Значит, и
подведённое к газу количество теплоты на этом
участке Q12 > 0, причём Q12 = А12.
На участке 2–3 работа газа равна
нулю. Поэтому Q23 = U3 – U2.
Воспользовавшись выражениями U2=
cVT1
и тем, что T1 – T3 = T, получим Q23 = –
cV
T < 0.
Это означает, что на участке 2–3 газ получает
отрицательное количество теплоты, т.е. отдаёт
тепло.
На участке 3–1 теплообмена нет,
т.е. Q31 = 0 и, по первому закону
термодинамики, 0 = (U1 – U3) + A31.
Тогда работа газа
A31 = U3 – U1 = cV(T3 –T1) = –
cV
T.
Итак, за цикл газ совершил работу A12 + А31 = А12 – cV
T и получил
тепло только на участке 1–2. КПД цикла
Так как то работа газа на изотерме равна
Геннадий Антонович Белуха –
заслуженный учитель РФ, педагогический стаж 20
лет, ежегодно его ученики занимают призовые
места на различных этапах всероссийской
олимпиады по физике. Хобби – компьютерная
техника.