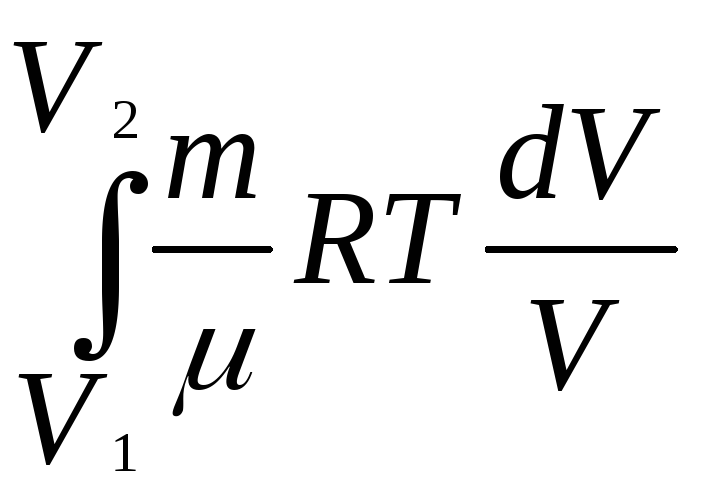Первый закон термодинамики
-
Темы кодификатора ЕГЭ: работа в термодинамике, первый закон термодинамики, адиабатный процесс.
-
Работа газа в изобарном процессе
-
Работа газа в произвольном процессе
-
Работа, совершаемая над газом
-
Применение первого закона термодинамики к изопроцессам
-
Адиабатный процесс
Автор статьи — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев
Темы кодификатора ЕГЭ: работа в термодинамике, первый закон термодинамики, адиабатный процесс.
Начнём с обсуждения работы газа.
Газ, находящийся в сосуде под поршнем, действует на поршень с силой , где
— давление газа,
— площадь поршня. Если при этом поршень перемещается, то газ совершает работу.
При расширении газа эта работа будет положительной (сила давления газа и перемещение поршня направлены в одну сторону). При сжатии работа газа отрицательна (сила давления газа и перемещение поршня направлены в противоположные стороны).
к оглавлению ▴
Работа газа в изобарном процессе
Предположим, что газ расширяется при постоянном давлении . Тогда сила
, с которой газ действует на поршень, также постоянна. Пусть поршень переместился на расстояние
(рис. 1).
Рис. 1.
Работа газа равна:
Но — изменение объёма газа. Поэтому для работы газа при изобарном расширении мы получаем формулу:
(1)
Если и
— начальный и конечный объём газа, то для работы газа имеем:
. Изобразив данный процесс на
-диаграмме, мы видим, что работа газа равна площади прямоугольника под графиком нашего процесса (рис. 2).
Рис. 2. Работа газа как площадь
Пусть теперь газ изобарно сжимается от объёма до объёма
. С помощью аналогичных рассуждений приходим к формуле:
Но , и снова получается формула (1).
Работа газа опять-таки будет равна площади под графиком процесса на -диаграмме, но теперь со знаком минус.
Итак, формула выражает работу газа при постоянном давлении — как в процессе расширения газа, так и в процессе сжатия.
к оглавлению ▴
Работа газа в произвольном процессе
Геометрическая интерпретация работы газа (как площади под графиком процесса на -диаграмме) сохраняется и в общем случае неизобарного процесса.
Действительно, рассмотрим малое изменение объёма газа — настолько малое, что давление
будет оставаться приблизительно постоянным. Газ совершит малую работу
. Тогда работа
газа во всём процессе найдётся суммированием этих малых работ:
Но данный интеграл как раз и является площадью криволинейной трапеции (рис. 3):
Рис. 3. Работа газа как площадь
к оглавлению ▴
Работа, совершаемая над газом
Наряду с работой , которую совершает газ по передвижению поршня, рассматривают также работу
, которую поршень совершает над газом.
Если газ действует на поршень с силой , то по третьему закону Ньютона поршень действует на газ с силой
, равной силе
по модулю и противоположной по направлению:
(рис. 4).
Рис. 4. Внешняя сила , действующая на газ
Следовательно, работа поршня равна по модулю и противоположна по знаку работе газа:
Так, в процессе расширения газ совершает положительную работу ; при этом работа, совершаемая над газом, отрицательна
. Наоборот, при сжатии работа газа отрицательна
, а работа, совершаемая поршнем над газом, положительна
0 right )’ class=’tex’ alt=’left ( {A}’ > 0 right )’ />.
Будьте внимательны: если в задаче просят найти работу, совершённую над газом, то имеется в виду работа .
Как мы знаем, существует лишь два способа изменения внутренней энергии тела: теплопередача и совершение работы.
Опыт показывает, что эти способы независимы — в том смысле, что их результаты складываются. Если телу в процессе теплообмена передано количество теплоты , и если в то же время над телом совершена работа
, то изменение внутренней энергии тела будет равно:
(2)
Нас больше всего интересует случай, когда тело является газом. Тогда (где
, как всегда, есть работа самого газа). Формула (2) принимает вид:
, или
(3)
Соотношение (3) называется первым законом термодинамики. Смысл его прост: количество теплоты, переданное газу, идёт на изменение внутренней энергии газа и на совершение газом работы.
Напомним, что величина может быть и отрицательной: в таком случае тепло отводится от газа. Но первый закон термодинамики остаётся справедливым в любом случае. Он является одним из фундаментальных физических законов и находит подтверждение в многочисленных явлениях и экспериментах.
к оглавлению ▴
Применение первого закона термодинамики к изопроцессам
Напомним, что в изопроцессе остаётся неизменным значение некоторой величины, характеризующей состояние газа — температуры, объёма или давления. Для каждого вида изопроцессов запись первого закона термодинамики упрощается.
1. Изотермический процесс, .
Внутренняя энергия идеального газа зависит только от его температуры. Если температура газа не меняется, то не меняется и внутренняя энергия: . Тогда формула (3) даёт:
Всё подведённое к газу тепло идёт на совершение газом работы.
2. Изохорный процесс, .
Если объём газа остаётся постоянным, то поршень не перемещается, и потому работа газа равна нулю: . Тогда первый закон термодинамики даёт:
Всё тепло, переданное газу, идёт на изменение его внутренней энергии.
3. Изобарный процесс, .
Подведённое к газу тепло идёт как на изменение внутренней энергии, так и на совершение работы (для которой справедлива формула (1)). Имеем:
к оглавлению ▴
Адиабатный процесс
Процесс называется адиабатным, если он идёт без теплообмена с окружающими телами.
Адиабатный процесс совершается газом, находящимся в теплоизолированном сосуде. Такой сосуд препятствует всем видам теплопередачи: теплопроводности, конвекции, излучению. Пример теплоизолированного сосуда — термос.
Приблизительно адиабатным будет всякий процесс, протекающий достаточно быстро: в течение процесса теплообмен просто не успевает произойти.
При адиабатном процессе . Из первого закона термодинамики получаем:
, или
.
В процессе адиабатного расширения газ совершает положительную работу, поэтому (работа совершается за счёт убыли внутренней энергии). Следовательно, газ охлаждается. Если заставить газ совершить достаточно большую работу, охладить его можно весьма сильно. Именно на этом основаны методы сжижения газов.
Наоборот, в процессе адиабатного сжатия будет , поэтому
: газ нагревается. Адиабатное нагревание воздуха используется в дизельных двигателях для воспламенения топлива.
Кривая, изображающая ход адиабатного процесса, называется адиабатой. Интересно сравнить ход адиабаты и изотермы на -диаграмме (рис. 5).
Рис. 5. Сравнительный ход изотермы и адиабаты
В обоих процессах давление убывает с увеличением объёма, но в адиабатном процессе убывание идёт быстрее. Почему?
При изотермическом расширении давление падает потому, что уменьшается концентрация частиц газа, в результате чего удары частиц по стенкам сосуда становятся реже. Однако интенсивность этих ударов остаётся прежней: ведь температура газа не меняется — значит, не меняется и средняя кинетическая энергия его частиц.
А при адиабатном расширении, наряду с уменьшением концентрации частиц, падает также и температура газа. Удары частиц становятся не только более редкими, но и более слабыми. Вот почему адиабата убывает быстрее изотермы.
Благодарим за то, что пользуйтесь нашими статьями.
Информация на странице «Первый закон термодинамики» подготовлена нашими редакторами специально, чтобы помочь вам в освоении предмета и подготовке к ЕГЭ и ОГЭ.
Чтобы успешно сдать нужные и поступить в высшее учебное заведение или техникум нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими материалами из данного раздела.
Публикация обновлена:
08.05.2023
-
Работа газа

-
Первый закон термодинамики
Существование
двух способов передачи энергии
термодинамической системе позволяет
проанализировать с энергетической
точки зрения равновесный процесс
перехода системы из какого-либо начального
состояния 1 в другое состояние 2.
Изменение внутренней энергии системы
U1-2
= U2—
U1
в
таком процессе равно сумме работы A’1-2
совершаемой над системой внешними
силами и теплоты Q1-2
сообщенной системе:
U1-2
=
A’1-2
+ Q1-2
(2. 3)
Работа
A’1-2
численно равна и противоположна по
знаку работе A1-2,
совершаемой самой системой против
внешних сил в том же процессе перехода:
A’1-2
= — A1-2.
Поэтому
выражение (2.6) можно переписать иначе:
Q1-2
= U1-2
+
A1-2
(2. 3)
Первое
начало термодинамики: теплота, сообщаемая
системе, расходуется на изменение
внутренней энергии системы и на совершение
системой работы против внешних сил.
Q
= dU + A (2.
3)
dU
– внутренняя энергия, является полным
дифференциалом.
Q
и A
не являются полными дифференциалами.
Q1-2
=
(2.3)
.
Исторически
установление первого начала термодинамики
было связано с неудачами создания
вечного двигателя первого рода (перпетуум
мобиле), в котором машина совершала бы
работу не получая извне тепла и не
затрачивая при этом никакого вида
энергии. Первый закон термодинамики
говорит о невозможности построения
такого двигателя.
Q1-2
= U1-2
+
A1-2
-
Применение первого начала термодинамики к изопроцессам.
-
Изобарный процесс.
-
р
= const
A
=
= p(V2—V1)
= pV
,
где
р – давление газа, V
– изменение его объема.
Т.к.
PV1
=
RT1;
PV2
=RT2,
то
V2—V1
=
(T2
– T1)
и
А
=
R(T2
– T1);
(2.3)
Таким
образом, получаем, что универсальная
газовая постоянная R
равна работе, которую совершает моль
идеального газа при повышении его
температуры на один Кельвин при
постоянном давлении.
Учитывая
выражение (2.10), уравнение первого начала
термодинамики (2.8) можно записать
следующим образом
Q
= dU + pdV. (2. 3)
-
Изохорный процесс
V
= const,
следовательно, dV
= 0
А
= pV
= 0
Q
= U.
Q
= U
=
R
T (2.3)
-
Изотермический процесс
Т
= const,
U
= 0
внутренняя энергия идеального газа не
изменяется, и
Q
= А
A
=
=
=
RTln
(2.3)
Для
того, чтобы температура газа при
расширении не уменьшалась, к газу в
течение изотермического процесса
необходимо подводить количество теплоты,
эквивалентное внешней работе расширения,
т.е. А = Q.
Практически
, чем медленнее протекает процесс, тем
с большей точностью его можно считать
изотермическим.
Г
работа при изотермическом процессе
численно равна площади заштрихованной
проекции на рис.
Сравнивая
площади фигур под участками изотермы
и изобары можно сделать вывод, что
расширение газа от объема V1
до объема V2
при одинаковом начальном значении
давления газа сопровождается в случае
изобарного расширения совершением
большей работы.
-
Теплоемкость газов
Теплоемкостью
С
какого-либо тела называется отношение
бесконечно малого количества теплоты
dQ,
полученного телом, к соответствующему
приращению dT
его температуры:
Cтела
= (2.3)
Эта
величина измеряется в джоулях на кельвин
(Дж/К).
Когда
масса тела равна единице, теплоемкость
называется удельной. Её обозначают
малой буквой с. Она измеряется в джоулях
на килограмм.кельвин
(Дж/кг.К).Между
теплоемкостью моля вещества и удельной
теплоемкостью того же вещества
существует соотношение
(2.3)
Используя
формулы (2.12) и (2.15), можно записать
(2.
3)
Особое
значение имеют теплоемкости при
постоянном объеме СV
и
постоянном давлении Ср.
Если объем остается постоянным, то dV
= 0 и согласно первому началу термодинамики
(2.12) вся теплота идет на приращение
внутренней энергии тела
Q
= dU (2. 3)
Из
этого равенства вытекает, что теплоемкость
моля идеального газа при постоянном
объеме равна
(2.
3)
Отсюда
dU
= CVdT,
а внутренняя энергия одного моля
идеального газа равна
U
= CVT
(2. 3)
Внутренняя
энергия произвольной массы газа т
определяется по формуле
(2.
3)
Учитывая,
что для 1 моля идеального газа
U
=
RT,
и
считая число степеней свободы i
неизменным, для молярной теплоемкости
при постоянном объеме получаем
Cv
=
=
(2.3)
Удельная
теплоемкость при постоянном объеме
сv
=
= (2.3)
Для
произвольной массы газа справедливо
соотношение:
Q
= dU =
RdT;
(2.3)
Если
нагревание газа происходит при постоянном
давлении, то газ будет расширяться,
совершая над внешними силами положительную
работу. Поэтому теплоемкость при
постоянном давлении должна быть больше,
чем теплоемкость при постоянном
объеме.
Если
1 молю газа при изобарном
процессе
сообщается количество теплоты Q
то введя понятие молярной теплоемкости
при постоянном давлении Ср
=
можно записать
Q
= CpdT;
где
Cp –
молярная теплоемкость при постоянном
давлении.
Т.к.
в соответствии с первым началом
термодинамики
Q
= A
+ dU = RdT +
RdT
=
=(R
+
R)dT
= (R + СV)dT,
то
Ср
== R +СV.
(2. 3)
Это
соотношение называется уравнением
Майера:
Выражение
для Ср
можно также записать в виде:
Ср
= R +
R
=
.
(2. 3)
Удельную
теплоемкость при постоянном давлении
сp
определим, разделив выражения (2.26) на
:
сp
=
(2.3)
При
изобарном сообщении газу массой m
количества теплоты Q
его внутренняя энергия возрастает на
величину U
=
CVT,
а количество теплоты, переданное газу
при изобарном процессе, Q=
CpT.
Обозначив
отношение теплоемкостей
буквой,
получим

Очевидно,
1
и зависит только от сорта газа (числа
степеней свободы).
Из
формул (2.22) и (2.26) следует, что молярные
теплоемкости определяются лишь
числом степеней свободы и не зависят
от температуры. Это утверждение
справедливо в довольно широком
интервале температур лишь для одноатомных
газов только с поступательными степенями
свободы. У двухатомных газов число
степеней свободы, проявляющееся в
теплоемкости, зависит от температуры.
Молекула двухатомного газа обладает
тремя поступательными, степенями
свободы: поступательными (3), вращательными
(2) и колебательными (2).
Таким
образом, суммарное число степеней
свободы достигает 7 и для молярной
теплоемкости при постоянном объеме мы
должны получить: СV
=
.
Из
экспериментальной зависимости молярной
теплоемкости водорода следует, что СV
зависит от температуры: при низкой
температуре (
50 K)
СV
=
, при
комнатной СV
=
и очень
высокой — СV
=.
Расхождение
теории и эксперимента объясняется тем,
что при вычислении теплоемкости надо
учитывать квантование энергии вращения
и колебаний молекул (возможны не любые
вращательные и колебательные энергии,
а лишь определенный дискретный ряд
значений энергий). Если энергия теплового
движения недостаточна, например, для
возбуждения колебаний, то эти колебания
не вносят своего вклада в теплоемкость
(соответствующая степень свободы
«замораживается» — к ней неприменим
закон равномерного распределения
энергии). Этим объясняется
последовательное (при определенных
температурах) возбуждение степеней
свободы, поглощающих тепловую энергию,
и приведенная на рис. 13 зависимость CV
= f(T).
Соседние файлы в папке Элитная физика
- #
- #
- #
- #
- #
- #
- #
30.03.201517.41 Кб25таблица вариантов.xls
- #
Как найти работу газа
Работа газа осуществляется при изменении его объема. Именно при изменении объема газа приходят в движение узлы тепловых двигателей, будь то двигатель внутреннего сгорания или пуля в стволе ружья. При различных процессах работа газа вычисляется по-разному.

Вам понадобится
- — манометр;
- — термометр.
Инструкция
Если работа газа осуществляется при изобарном процессе (при постоянном давлении), то для того чтобы найти работу газа с помощью манометра, измерьте давление газа. После этого замерьте его объем перед выполнением работы и после. Найдите изменение объема газа, отняв от конечного значения начальное. После этого найдите произведение давления газа на изменение его объема. Это и будет работа газа при постоянном давлении A=p•ΔV.
Для идеального газа вычислить работу при постоянном давлении можно, применив уравнение Клапейрона-Менделеева. Найдите работу газа, умножив его массу на число 8,31 (универсальную газовую постоянную) и изменение температуры при выполнении работы. Результат поделите на молярную массу газа A=m•R•ΔT/M. При расчетах учитывайте то, что если работа выполняется газом (он расширяется), то она положительна. Если же работа выполняется над газом (его сжимают сторонние силы), то работа отрицательна.
Если работа выполняет при изотермическом расширении (когда температура постоянна), узнайте изменение объема газа и значение его температуры. Для того чтобы найти работу газа, умножьте его массу на число 8,31 (универсальную газовую постоянную) и температуру при выполнении работы. Результат поделите на молярную массу газа. Получившееся число умножьте на логарифм натуральный из отношения конечного и начального объемов газа A=m•R•T•ln(V2/V1)/M.
В общем случае, чтобы найти работу газа возьмите интеграл из функции давления по объему. Границы интеграла – от начального до конечного объема ∫pdV. Если есть график газового процесса в координатах (V,p), как правило, он представляет собой прямую линию, найдите площадь трапеции ограниченной по бокам линиями перпендикулярными оси Vв точках V1 и V2, снизу осью V, а сверху графиком функции. В более сложных случаях ищется площадь криволинейной трапеции.
Полезный совет
Если объем газа не изменяется, работа им не выполняется.
Источники:
- как изменяется объем газа
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.