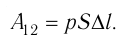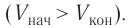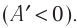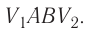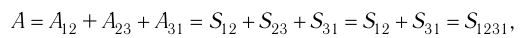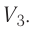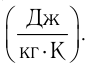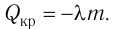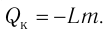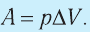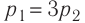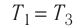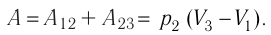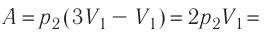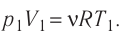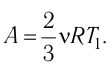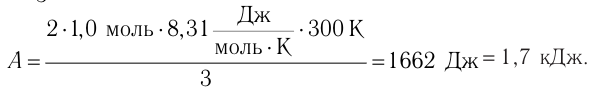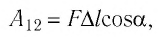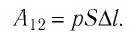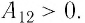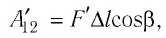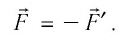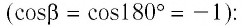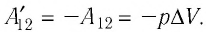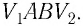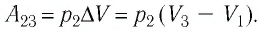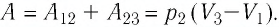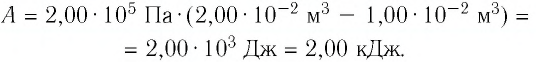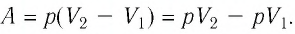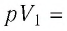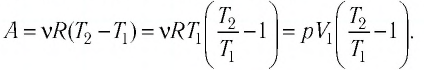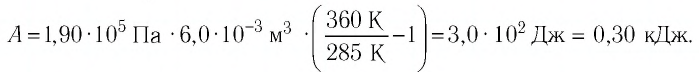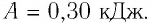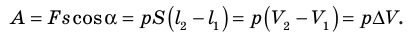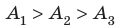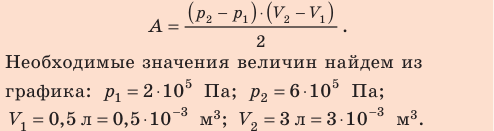Как найти работу газа
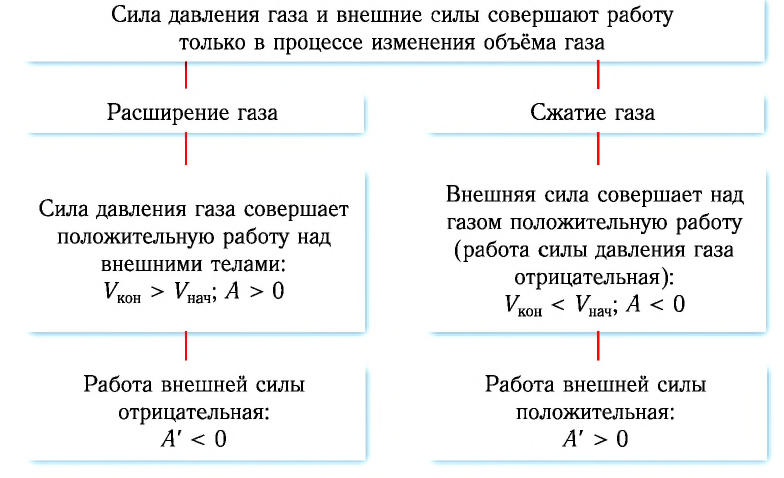
Работа газа осуществляется при изменении его объема. Именно при изменении объема газа приходят в движение узлы тепловых двигателей, будь то двигатель внутреннего сгорания или пуля в стволе ружья. При различных процессах работа газа вычисляется по-разному.

Вам понадобится
- — манометр;
- — термометр.
Инструкция
Если работа газа осуществляется при изобарном процессе (при постоянном давлении), то для того чтобы найти работу газа с помощью манометра, измерьте давление газа. После этого замерьте его объем перед выполнением работы и после. Найдите изменение объема газа, отняв от конечного значения начальное. После этого найдите произведение давления газа на изменение его объема. Это и будет работа газа при постоянном давлении A=p•ΔV.
Для идеального газа вычислить работу при постоянном давлении можно, применив уравнение Клапейрона-Менделеева. Найдите работу газа, умножив его массу на число 8,31 (универсальную газовую постоянную) и изменение температуры при выполнении работы. Результат поделите на молярную массу газа A=m•R•ΔT/M. При расчетах учитывайте то, что если работа выполняется газом (он расширяется), то она положительна. Если же работа выполняется над газом (его сжимают сторонние силы), то работа отрицательна.
Если работа выполняет при изотермическом расширении (когда температура постоянна), узнайте изменение объема газа и значение его температуры. Для того чтобы найти работу газа, умножьте его массу на число 8,31 (универсальную газовую постоянную) и температуру при выполнении работы. Результат поделите на молярную массу газа. Получившееся число умножьте на логарифм натуральный из отношения конечного и начального объемов газа A=m•R•T•ln(V2/V1)/M.
В общем случае, чтобы найти работу газа возьмите интеграл из функции давления по объему. Границы интеграла – от начального до конечного объема ∫pdV. Если есть график газового процесса в координатах (V,p), как правило, он представляет собой прямую линию, найдите площадь трапеции ограниченной по бокам линиями перпендикулярными оси Vв точках V1 и V2, снизу осью V, а сверху графиком функции. В более сложных случаях ищется площадь криволинейной трапеции.
Полезный совет
Если объем газа не изменяется, работа им не выполняется.
Источники:
- как изменяется объем газа
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Первый закон термодинамики
-
Темы кодификатора ЕГЭ: работа в термодинамике, первый закон термодинамики, адиабатный процесс.
-
Работа газа в изобарном процессе
-
Работа газа в произвольном процессе
-
Работа, совершаемая над газом
-
Применение первого закона термодинамики к изопроцессам
-
Адиабатный процесс
Автор статьи — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев
Темы кодификатора ЕГЭ: работа в термодинамике, первый закон термодинамики, адиабатный процесс.
Начнём с обсуждения работы газа.
Газ, находящийся в сосуде под поршнем, действует на поршень с силой , где
— давление газа,
— площадь поршня. Если при этом поршень перемещается, то газ совершает работу.
При расширении газа эта работа будет положительной (сила давления газа и перемещение поршня направлены в одну сторону). При сжатии работа газа отрицательна (сила давления газа и перемещение поршня направлены в противоположные стороны).
к оглавлению ▴
Работа газа в изобарном процессе
Предположим, что газ расширяется при постоянном давлении . Тогда сила
, с которой газ действует на поршень, также постоянна. Пусть поршень переместился на расстояние
(рис. 1).
Рис. 1.
Работа газа равна:
Но — изменение объёма газа. Поэтому для работы газа при изобарном расширении мы получаем формулу:
(1)
Если и
— начальный и конечный объём газа, то для работы газа имеем:
. Изобразив данный процесс на
-диаграмме, мы видим, что работа газа равна площади прямоугольника под графиком нашего процесса (рис. 2).
Рис. 2. Работа газа как площадь
Пусть теперь газ изобарно сжимается от объёма до объёма
. С помощью аналогичных рассуждений приходим к формуле:
Но , и снова получается формула (1).
Работа газа опять-таки будет равна площади под графиком процесса на -диаграмме, но теперь со знаком минус.
Итак, формула выражает работу газа при постоянном давлении — как в процессе расширения газа, так и в процессе сжатия.
к оглавлению ▴
Работа газа в произвольном процессе
Геометрическая интерпретация работы газа (как площади под графиком процесса на -диаграмме) сохраняется и в общем случае неизобарного процесса.
Действительно, рассмотрим малое изменение объёма газа — настолько малое, что давление
будет оставаться приблизительно постоянным. Газ совершит малую работу
. Тогда работа
газа во всём процессе найдётся суммированием этих малых работ:
Но данный интеграл как раз и является площадью криволинейной трапеции (рис. 3):
Рис. 3. Работа газа как площадь
к оглавлению ▴
Работа, совершаемая над газом
Наряду с работой , которую совершает газ по передвижению поршня, рассматривают также работу
, которую поршень совершает над газом.
Если газ действует на поршень с силой , то по третьему закону Ньютона поршень действует на газ с силой
, равной силе
по модулю и противоположной по направлению:
(рис. 4).
Рис. 4. Внешняя сила , действующая на газ
Следовательно, работа поршня равна по модулю и противоположна по знаку работе газа:
Так, в процессе расширения газ совершает положительную работу ; при этом работа, совершаемая над газом, отрицательна
. Наоборот, при сжатии работа газа отрицательна
, а работа, совершаемая поршнем над газом, положительна
0 right )’ class=’tex’ alt=’left ( {A}’ > 0 right )’ />.
Будьте внимательны: если в задаче просят найти работу, совершённую над газом, то имеется в виду работа .
Как мы знаем, существует лишь два способа изменения внутренней энергии тела: теплопередача и совершение работы.
Опыт показывает, что эти способы независимы — в том смысле, что их результаты складываются. Если телу в процессе теплообмена передано количество теплоты , и если в то же время над телом совершена работа
, то изменение внутренней энергии тела будет равно:
(2)
Нас больше всего интересует случай, когда тело является газом. Тогда (где
, как всегда, есть работа самого газа). Формула (2) принимает вид:
, или
(3)
Соотношение (3) называется первым законом термодинамики. Смысл его прост: количество теплоты, переданное газу, идёт на изменение внутренней энергии газа и на совершение газом работы.
Напомним, что величина может быть и отрицательной: в таком случае тепло отводится от газа. Но первый закон термодинамики остаётся справедливым в любом случае. Он является одним из фундаментальных физических законов и находит подтверждение в многочисленных явлениях и экспериментах.
к оглавлению ▴
Применение первого закона термодинамики к изопроцессам
Напомним, что в изопроцессе остаётся неизменным значение некоторой величины, характеризующей состояние газа — температуры, объёма или давления. Для каждого вида изопроцессов запись первого закона термодинамики упрощается.
1. Изотермический процесс, .
Внутренняя энергия идеального газа зависит только от его температуры. Если температура газа не меняется, то не меняется и внутренняя энергия: . Тогда формула (3) даёт:
Всё подведённое к газу тепло идёт на совершение газом работы.
2. Изохорный процесс, .
Если объём газа остаётся постоянным, то поршень не перемещается, и потому работа газа равна нулю: . Тогда первый закон термодинамики даёт:
Всё тепло, переданное газу, идёт на изменение его внутренней энергии.
3. Изобарный процесс, .
Подведённое к газу тепло идёт как на изменение внутренней энергии, так и на совершение работы (для которой справедлива формула (1)). Имеем:
к оглавлению ▴
Адиабатный процесс
Процесс называется адиабатным, если он идёт без теплообмена с окружающими телами.
Адиабатный процесс совершается газом, находящимся в теплоизолированном сосуде. Такой сосуд препятствует всем видам теплопередачи: теплопроводности, конвекции, излучению. Пример теплоизолированного сосуда — термос.
Приблизительно адиабатным будет всякий процесс, протекающий достаточно быстро: в течение процесса теплообмен просто не успевает произойти.
При адиабатном процессе . Из первого закона термодинамики получаем:
, или
.
В процессе адиабатного расширения газ совершает положительную работу, поэтому (работа совершается за счёт убыли внутренней энергии). Следовательно, газ охлаждается. Если заставить газ совершить достаточно большую работу, охладить его можно весьма сильно. Именно на этом основаны методы сжижения газов.
Наоборот, в процессе адиабатного сжатия будет , поэтому
: газ нагревается. Адиабатное нагревание воздуха используется в дизельных двигателях для воспламенения топлива.
Кривая, изображающая ход адиабатного процесса, называется адиабатой. Интересно сравнить ход адиабаты и изотермы на -диаграмме (рис. 5).
Рис. 5. Сравнительный ход изотермы и адиабаты
В обоих процессах давление убывает с увеличением объёма, но в адиабатном процессе убывание идёт быстрее. Почему?
При изотермическом расширении давление падает потому, что уменьшается концентрация частиц газа, в результате чего удары частиц по стенкам сосуда становятся реже. Однако интенсивность этих ударов остаётся прежней: ведь температура газа не меняется — значит, не меняется и средняя кинетическая энергия его частиц.
А при адиабатном расширении, наряду с уменьшением концентрации частиц, падает также и температура газа. Удары частиц становятся не только более редкими, но и более слабыми. Вот почему адиабата убывает быстрее изотермы.
Благодарим за то, что пользуйтесь нашими статьями.
Информация на странице «Первый закон термодинамики» подготовлена нашими редакторами специально, чтобы помочь вам в освоении предмета и подготовке к ЕГЭ и ОГЭ.
Чтобы успешно сдать нужные и поступить в высшее учебное заведение или техникум нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими материалами из данного раздела.
Публикация обновлена:
08.05.2023
Работа идеального газа
равна
.
При расширении работа газа
положительна, при сжатии – отрицательна.
Чтобы получить функцию
давления в зависимости от объема, надо
использовать совместно с уравнением
процесса уравнение Менделеева-Клапейрона
4-1. В воздушном шарике
находится одноатомный идеальный газ.
Газ расширяется от объема
до объема
,
при этом его давление меняется по закону
а)
;
б)
;
в)
;
г)
.
Найти работу (в МДж),
совершенную газом в этом процессе.
p0
= 105
Па;
=
1 м3;
=2
м3.
Ответы: а) 0,15 МДж; б) 0,233 МДж;
в) 0,375 МДж; г) 0,62 МДж
4-2. В воздушном шарике
находится один моль одноатомного
идеального газа. Газ расширяется от
объема
до объема
,
при этом его температура меняется по
закону
а)
;
б)
;
в)
;
г)
Найти работу (в кДж),
совершенную газом в этом процессе.
Универсальная газовая постоянная
.
T0
= 300 K;
=
1 м3;
=2
м3.
Ответы: а) 26,1 кДж; б) 45,2 кДж;
в) 79,4 кДж; г) 141 кДж
4-3. В воздушном шарике
находится один моль одноатомного
идеального газа. Газ расширяется от
объема
до объема
,
при этом его объем меняется по закону
а)
;
б)
;
в)
;
г)
Найти работу (в кДж),
совершенную газом в этом процессе.
Универсальная газовая постоянная
.
= 300 K;
=
1 м3;
=2
м3.
Ответы: а) 3,74 кДж; б) 5,82 кДж;
в) 9,35 кДж; г) 15,5 кДж
4-4. В воздушном шарике
находится один моль одноатомного
идеального газа. Газ расширяется от
объема
до объема
,
при этом его давление меняется по закону
.
Найти работу (в МДж), совершенную газом
в этом процессе. Универсальная газовая
постоянная
.
= 300 K;
= 105
Па;
=
1 м3;
=2
м3.
Ответ: 6,02 МДж
4-5. В воздушном шарике
находится один моль одноатомного
идеального газа. Газ расширяется от
объема
до объема
,
при этом его температура меняется по
закону
.
Найти работу (в МДж), совершенную газом
в этом процессе. Универсальная газовая
постоянная
.
= 300 K;
= 105
Па;
=
1 м3;
=2
м3.
Ответ: 6,02 МДж
4
-6э.
Идеальный газ совершает циклический
процесс 1-2-3-1, как показано на рисунке,
где процессы 2-3 — изохорический, а 3-1 —
изотермический. Площадь
фигуры 1-2-3 равна 10 Дж, а площадь
фигуры 1-3-В-А равна 15 Дж.
В процессе 3-1 газ отдал
окружающей среде тепло…
Ответ: 15 Дж
5. Теплоемкость.
Теплоемкость
газа равна
– теплота, необходимая для нагревания
тела (газа) на один Кельвин.
Зная теплоемкость, можно
определить теплоту, переданную газу
при нагревании:
Если задана зависимость
теплоемкости от температуры в виде
графика, то теплота есть площадь
под кривой
.
Изменение
внутренней энергии
идеального газа равна
,
где
– число степеней свободы молекулы. При
не очень высокой и не очень низкой
температуре (когда возбуждены вращательные
степени свободы, но не возбуждены
колебательные степени свободы) i
= 3 для одноатомного
газа, i
=5 для двухатомного
газа, i
= 6 для трех- и
(более)-атомного газа.
Первое начало термодинамики:
теплота, переданная газу
от нагревателя, идет на увеличение
внутренней энергии газа и на совершение
эти газом работы. Если внутренняя энергия
газа при этом уменьшается, то
.
Политропический процесс
– процесс с постоянной теплоемкостью.
5-1. Теплоемкость газа зависит
от температуры по закону
а)
;
б)
;
в)
;
г)
.
Найти тепло, полученное
газом, если его температура увеличилась
с
до
.
=1
Дж/К;
=300
К;
.
Ответы: а) 450 Дж; б) 1125 Дж; в)
3150 Дж; г) 9,56 кДж
5-2. Теплоемкость газа зависит
от температуры по закону
а)
;
б)
;
в)
;
г)
При изменении температуры
газа от
до
им была совершена работа А.
Найти изменение внутренней энергии
газа.
=1
Дж/К;
=300
К;
;
А =
100 Дж.
Ответы: а) 600 Дж; б) 1760 Дж; в)
5,39 кДж; г) 16,9 кДж
5-3. Теплоемкость одного моля
идеального одноатомного
газа зависит от температуры по закону
а)
;
б)
.
Найти работу, совершенную
газом, при изменении температуры газа
от
до
.
Универсальная газовая постоянная R
= 8,3 Дж/мольК;
=1
Дж/К;
=300
К;
.
Ответы: а) –3285 Дж; б) –2334 Дж
5-4. Теплоемкость одного моля
идеального двухатомного
газа зависит от температуры по закону
а)
;
б) .
Найти работу, совершенную
газом, при изменении температуры газа
от
до
.
Универсальная газовая постоянная R
= 8,3 Дж/моль×К;
=1
Дж/К;
=300
К;
.
Ответы: а) – 5775 Дж; б) – 4824
Дж
5-5. Теплоемкость одного моля
идеального трехатомного
газа зависит от температуры по закону
а)
;
б)
Найти работу, совершенную
газом, при изменении температуры газа
от
до
.
Универсальная газовая постоянная R
= 8,3 Дж/моль×К;
=1
Дж/К;
=300
К;
.
Ответы: а) – 7020 Дж; б) – 6069
Дж
5-6. Один моль идеального а)
одноатомного; б) двухатомного; в)
трехатомного газа совершает политропический
процесс. При этом его температура
увеличивается от
до
,
и газ совершает работу А.
Найти теплоемкость газа. Универсальная
газовая постоянная
.
=300
К;
;
А =
100 Дж.
Ответы: а) 12,8 Дж/К; б) 21,1 Дж/К;
в) 25,3 Дж/К
5-7. Один моль идеального а)
одноатомного; б) двухатомного ; в)
трехатомного газа совершает политропический
процесс с теплоемкостью С.
При этом его температура увеличивается
на
,
и газ совершает работу А.
Найти
.
Универсальная газовая постоянная
.
С = 30
Дж/К; А
= 100 Дж.
Ответы: а) 5,7 К; б) 10,8 К; в) 19,7
К
5-8. Один моль идеального а)
одноатомного; б) двухатомного; в)
трехатомного газа совершает политропический
процесс с теплоемкостью С.
При этом его температура увеличивается
на
,
и газ совершает работу А.
Найти А.
Универсальная газовая постоянная
.
С = 30
Дж/К;
= 10 К.
Ответы: а) 175 Дж; б) 92,3 Дж; в)
50,7 Дж
5
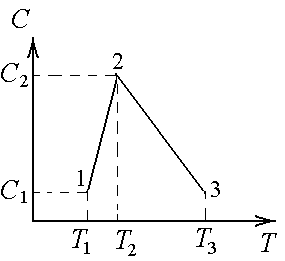
-9.
Идеальный газ совершает процесс 1–2–3.
Его теплоемкость зависит от температуры,
как показано на графике.
T1
= 600 К; T2
= 900 К; Т3
= 1800 К.
С1
= 1 Дж/К; С2
= 5 Дж/К.
Найти
а) тепло, полученное газом
в этом процессе.
б) Во сколько раз тепло,
полученное на участке 2–3 больше тепла,
полученного на участке 1–2.
в) На сколько джоулей тепло,
полученное на участке 2–3 больше тепла,
полученного на участке 1–2.
Ответы: а) 3600 Дж; б) в 3 раза; в) 1800 Дж

5-10э.
Молярные теплоемкости азота в процессах
и
равны
и
соответственно. Их отношение
равно: а)
б)
в)
г)
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Стенки сосуда, в котором находится газ, подвергаются беспрестанной хаотичной «бомбардировке» молекулами, из которых он состоит. Скорости молекул велики, время соударения мало, молекул много, так что эта «молекулярная барабанная дробь» воспринимается стенкой как постоянное давление. Обусловленная давлением сила направлена по нормали к поверхности вовне, а величина силы, действующей на маленький элемент стенки площадью δSδS есть p⋅δSpcdot δS, где рр – давление газа. Далее мы рассматриваем квазистационарные («медленные») процессы, при которых давление р и температура ТТ одинаковы во всех точках сосуда, содержащего газ.
Квазистационарные процессы
Пусть вся поверхность сосуда, занимаемого газом, или её часть под действием давления газа — или внешних сил — перемешается (деформируется). Выбрав очень маленькие элементы поверхности δS, настолько маленькие, что их можно рассматривать как материальные точки, сосчитаем для каждого из них работу «местной силы давления»:
δА=(р⋅δS)⋅δх⋅cosα=p⋅δS⋅δn=p⋅δVδА = (р cdot δS)cdot δх cdot cosα = p cdot δS cdot δn = p cdotδV,
где δхδх – путь, пройденный элементом поверхности,
αα — угол между направлением перемещения элемента и направлением нормали к нему,
δnδn – смещение элемента δSδS вдоль нормали, направленной вовне,
δVδV – приращение объёма сосуда в месте расположения элемента δSδS;
δVδV – положительно, если объём увеличивается.
Выполнив суммирование по всем элементарным площадкам, получаем, что при очень маленьком изменении объёма газа dVdV, при котором давление почти постоянно, элементарная работа сил давления газа или кратко – элементарная работа газа dАdА есть произведение давления газа рр на изменение dVdV его объёма.
Первое начало
Основным энергетическим соотношением термодинамики является Квазистационарные процессы, которое выражается формулой Q=A+ΔUQ = A + ΔU со следующим правилом знаков:
- если газ получает тепло или теплоту – так в термодинамике называется переданная энергия — то её величина QQ положительна;
- QQ отрицательна, если газ отдаёт теплоту. АА – это результирующая работа газа при переходе из начального состояния в конечное, она является суммой элементарных работ, подсчитанных так, как описано выше;
- ΔUΔU – разность внутренних энергий газа в конечном и начальном состояниях, т.е. ΔU=νсvΔTΔU = νсvΔT (описание обозначений – в конце статьи).
Изопроцессы
А вот теперь рассмотрим несколько типовых процессов в газах и определим для них величину работы.
Когда объём газа не меняется – а это изохорический процесс – то на всех его этапах dV=0dV = 0, dА=0dА = 0, следовательно, и результирующая работа газа равна нулю.
Когда давление газа неизменно – а это изобарический процесс – то при сложении элементарных работ постоянное давление можно вынести за скобку, а в скобке в итоге окажется разность конечного и начального объёмов газа, следовательно результирующая работа А=р(Vк−Vн)А = р(V_к — V_н).
Когда температура газа постоянна – а это изотермический процесс – то производя сложение элементарных работ и выразив давление согласно уравнению Менделеева-Клапейрона, получим следующую формулу для результирующей работы: А=∑dАi=∑pidVi=νRT∑dVi/Vi=νRTln(Vк/Vн)А = ∑dА_i = ∑p_idV_i = νRT∑dV_i/V_i = νRTln(V_к/V_н), воспользовавшись помощью математики при подсчёте суммы.
Когда процесс происходит в теплоизолированном сосуде – а это адиабатный процесс, при котором Q=0Q = 0 – в таком случае, согласно первому началу термодинамики, работа А=−ΔU=−νсvΔT=νсv(Tн–Тк)А = — ΔU = — νсvΔT = νсv(T_н – Т_к).
Таким образом, резюмируем
- адиабатный процесс: А=νсv(Tн–Тк)А = νсv(T_н – Т_к);
- изобарический процесс: А=р(Vк−Vн)А = р(V_к — V_н);
- изотермический процесс: А=νRTln(Vк/Vн)А = νRTln(V_к /V_н);
- изохорический процесс: А=0А = 0,
где VV – объём газа, рр – давление, ТТ – температура, νν – число молей, сvсv – молярная теплоёмкость при постоянном объёме, RR — универсальная газовая постоянная, индексы нн и кк указывают на начальное и конечное состояния.
Содержание:
Работа в термодинамике:
В 9 классе вы узнали, что работа силы (механическая работа) связана с превращением одного вида энергии в другой, например, механической энергии во внутреннюю. Работу силы рассматривают как меру изменения энергии физической системы. А как определить работу в термодинамике? Как может быть выражена эта работа через макроскопические параметры — давление и об1
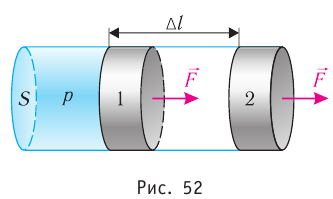
Рассмотрим газ, находящийся в цилиндрическом сосуде с площадью основания S, закрытом подвижным поршнем (рис. 52).
Взаимодействие газа с поршнем, а также со стенками сосуда можно характеризовать давлением р, которое газ оказывает на них. Допустим, что в результате изобарного расширения газа поршень переместился из положения 1 в положение 2 на расстояние
Модуль силы давления газа, действующей на поршень, F = pS. Эта сила совершает работу по перемещению поршня
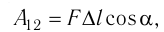
где а — угол между направлениями силы и перемещения. В рассматриваемом примере а = 0, тогда
Произведение 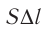
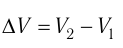
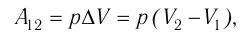
где 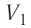
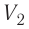
Так как давление р газа всегда величина положительная, из формулы (10.2) следует, что, если газ расширяется 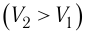
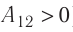
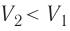
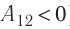
Процесс медленного изобарного сжатия газа из состояния 2 с начальным объёмом 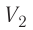
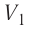
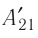
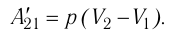
Из сравнения равенств (10.2) и (10.3) вытекает соотношение между работой 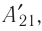
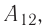
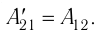
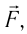
направление, противоположное силе давления 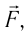
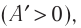
Если газ расширяется 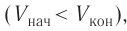
Геометрическое толкование работы
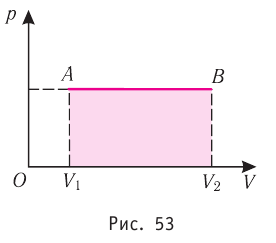
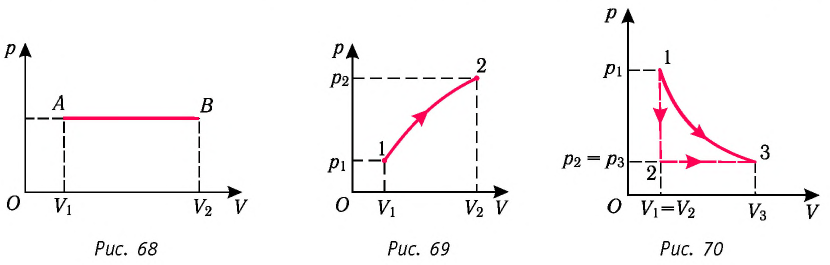
Построим график зависимости давления газа от его объёма при р = const. Как видно из рисунка 53, при изобарном расширении газа работа, совершённая силой давления газа, численно равна площади прямоугольника
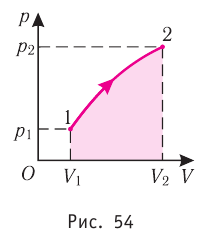
Если процесс перехода газа из начального состояния в конечное не является изобарным, то работа, совершённая силой давления газа при изменении его объёма от 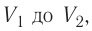
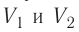
Процесс, при котором термодинамическая система, прошедшая некоторую последовательность состояний, снова возвращается в исходное состояние, называют циклическим процессом или циклом (рис. 55). Работа, совершаемая системой при циклическом процессе, или работа цикла, равна площади фигуры, ограниченной линиями, которые изображают цикл:
где
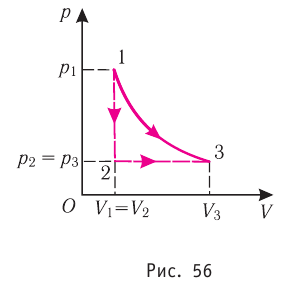
Если «кривая расширения» (изобара
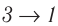
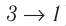
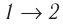
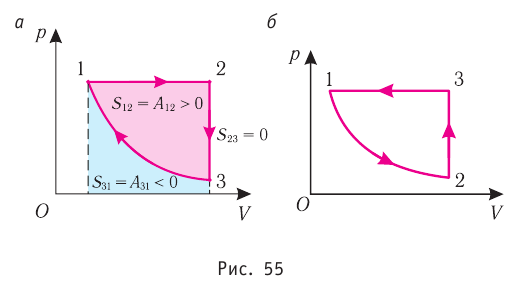
Из рисунка 56 видно, что численное значение работы цикла определяется не только начальным и конечным состояниями системы, но и видом процесса. Например, газ из состояния 1 можно перевести в состояние 3 либо в результате изотермического расширения, либо сначала изохорно понизив его давление до значения 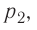
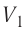
Как видно из рисунка 56, в первом случае работа, совершённая силами давления газа, больше, чем во втором. Следовательно, работа, совершаемая при переходе термодинамической системы из одного состояния в другое, зависит не только от начального и конечного состояний системы, но и от вида процесса.
Количество теплоты и удельная теплоёмкость
Итак, существуют два способа передачи энергии от одного тела к другому. Первый характеризуется передачей энергии в процессе механического взаимодействия тел — механическая энергия одного тела переходит в энергию хаотического движения частиц вещества другого тела или, наоборот, убыль энергии хаотического движения частиц вещества одного тела сказывается на увеличении механической энергии другого тела. Такую форму передачи энергии в термодинамике (как и в механике) называют работой. Так, например, в рассмотренной нами ранее термодинамической системе (газ в цилиндрическом сосуде под поршнем) расширение газа приводит к перемещению поршня. При этом убыль внутренней энергии газа равна работе, совершённой силой давления газа, под действием которой поршень переместился.
Второй способ передачи энергии осуществляется при непосредственном обмене энергией между хаотически движущимися частицами взаимодействующих тел. За счёт переданной при этом энергии увеличивается внутренняя энергия одного тела и уменьшается внутренняя энергия другого. Если, например, привести в соприкосновение два тела с разными температурами, то частицы более нагретого тела будут передавать часть своей энергии частицам более холодного тела. В результате внутренняя энергия первого тела уменьшается, а второго тела увеличивается. Процесс передачи энергии от одного тела к другому без совершения работы называют теплопередачей. Как вы уже знаете, существуют три вида теплопередачи: теплопроводность, конвекция и излучение.
Количественной мерой энергии, переданной телу в процессе теплопередачи, является количество теплоты Q. В СИ единицей количества теплоты является джоуль (Дж). Иногда для измерения количества теплоты используют внесистемную единицу — калорию (1 кал = 4,19Дж).
Если процесс теплопередачи не сопровождается изменением агрегатного состояния вещества, то
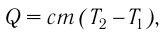
где m — масса тела, 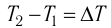
теплоемкость измеряют в джоулях, деленных на килограмм, кельвин
Физическая величина, равная произведению массы тела на удельную теплоёмкость вещества, носит название теплоёмкости тела. Обозначают теплоёмкость тела С и измеряют в джоулях на кельвин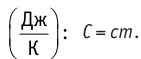
Удельная теплота плавления
Физическую величину, численно равную количеству теплоты, необходимому для превращения кристаллического вещества массой 1 кг, взятого при температуре плавления, в жидкость той же температуры, называют удельной теплотой плавления 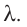
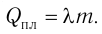
Удельная теплота парообразования
Физическую величину, численно равную количеству теплоты, которое необходимо передать жидкости массой 1 кг, находящейся при температуре кипения, для превращения её при постоянной температуре в пар, называют удельной теплотой парообразования L. Количество теплоты, необходимое для превращения жидкости массой m, предварительно нагретой до температуры кипения, в пар, определяют по формуле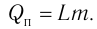
Удельная теплота сгорания топлива
Физическую величину, численно равную количеству теплоты, выделяющемуся при полном сгорании топлива массой 1 кг, называют удельной теплотой сгорания топлива q. Количество теплоты, выделившееся при полном сгорании некоторой массы m топлива, определяют по формуле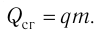
Отметим, что в результате теплопередачи могут изменяться как обе составляющие внутренней энергии тела, так и одна из них. При нагревании (охлаждении) изменяются кинетическая энергия хаотического движения частиц, которые составляют тело, и потенциальная энергия их взаимодействия. При плавлении (кристаллизации), кипении (конденсации) изменяется только потенциальная энергия взаимодействия частиц вещества.
При совершении работы также может изменяться как кинетическая, так и потенциальная энергия частиц вещества. Следовательно, как при теплопередаче, так и при совершении работы происходит изменение кинетической и потенциальной энергий частиц вещества, что приводит к изменению внутренней энергии тела.
1. Работу газа при изобарном процессе выражают через макроскопические параметры термодинамической системы:
2. Работа газа численно равна площади фигуры, ограниченной графиком зависимости давления от объёма, осью OV и прямыми, соответствующими значениям объёмов
3. Работа, совершаемая при переходе системы из одного состояния в другое, зависит не только от начального и конечного состояний, но и от вида процесса.
4. Процесс передачи энергии от одного тела к другому без совершения работы называют теплопередачей.
Пример №1
Определите работу, совершаемую силой давления идеального газа определённой массы при изобарном повышении его температуры от 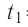
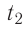
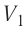
Дано:
Пример №2
Состояние идеального газа, взятого в количестве v=l,0 моль при температуре 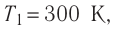
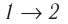
Дано:
v = 1,0 моль
А — ?
Решение. Работа Л газа в ходе всего процесса равна сумме работ на участках 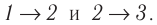
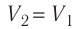
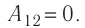
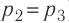
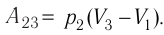
Так как по условию 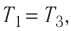
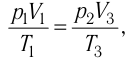
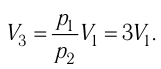
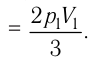
Тогда
Ответ: А = 1,7 кДж.
Работа в термодинамике
В 9-м классе вы узнали, что передача энергии путём совершения работы происходит в процессе силового взаимодействия тел. То есть работа, совершённая над рассматриваемым телом, есть не что иное, как работа сил, приложенных к этому телу со стороны всех остальных (внешних) тел, с которыми оно взаимодействует. Работа, совершённая над телом, может непосредственно изменить любой вид энергии этого тела, например внутреннюю энергию, поэтому работу силы рассматривают как меру изменения энергии физической системы.
Одним из способов изменения внутренней энергии термодинамической системы является совершение работы. Этот способ характеризуется передачей энергии в процессе механического взаимодействия тел. При этом механическая энергия одного тела переходит во внутреннюю энергию другого тела или, наоборот, убыль внутренней энергии одного тела сказывается на увеличении механической энергии другого тела.
Таким образом, при совершении работы происходит превращение энергии из одной формы в другую.
Поскольку для описания термодинамических систем используют макропараметры (давление, объём, температура), то работу в термодинамике необходимо выражать, применяя эти параметры.
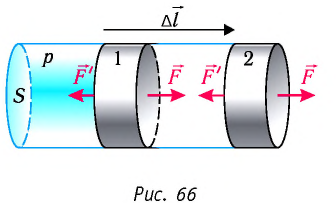
Рассмотрим газ в цилиндре, закрытом поршнем, площадь которого S (рис. 66). Давление газа в цилиндре 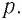
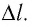
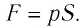
где 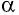
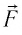
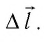
Произведение 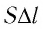
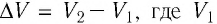
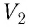
Таким образом, работа силы давления газа при его изобарном расширении:
Так как давление р газа — величина положительная, то из формулы (12.1) следует, что
При изобарном расширении газа из состояния 1 в состояние 2 работа силы 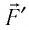
где 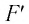
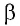
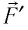
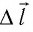
Перемещение 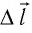
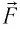
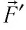
Следовательно, работы 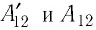
Таким образом, можно сделать следующие выводы.
Геометрическое толкование работы:
Работу газа можно определить графически. Изобразим график зависимости давления газа от его объёма при 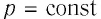
Если процесс перехода газа из начального состояния в конечное не является изобарным (рис. 69), то работа силы давления газа при изменении объёма от 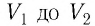
Работу газа определяют не только начальное и конечное состояния системы, но и вид процесса. Например, газ из состояния 1 можно перевести в состояние 3 либо в результате изотермического расширения (рис. 70), либо сначала изохорно понизив его давление до значения 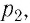
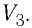
Следовательно, работа, совершаемая термодинамическом системой при переходе из одного состояния в другое, зависит не только от начального и конечного состояний системы, но и от вида процесса.
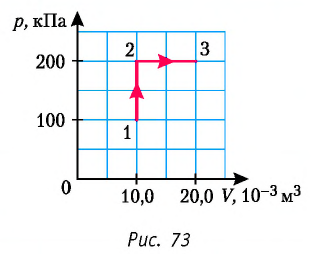
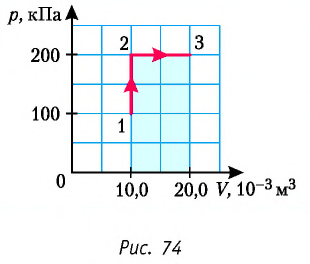
Пример №3
Определите работу, совершаемую силой давления идеального газа определённой 200 массы при переходе из состояния 1 в состояние 3 (рис. 73).
Решение. 1 способ. Работа А газа в ходе всего процесса равна сумме работ на участках 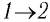
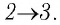
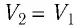
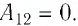
Тогда при переходе из состояния 1 в состояние 3 работа
2 способ. Работа газа численно равна площади заштрихованной фигуры, ограниченной графиком зависимости давления от объёма, осью OV и прямыми, соответствующими значениям объёма 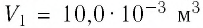
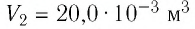
Ответ:
Пример №4
Определите работу, совершаемую силой давления идеального газа определённой массы при изобарном повышении его температуры от 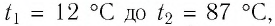
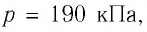
Решение. Сила давления газа совершает положительную работу, поскольку при изобарном нагревании увеличивается его объём. Поэтому
Согласно уравнению Клапейрона—Менделеева,
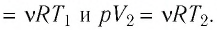
Ответ:
Как определить работу в термодинамике
В конце XVIII в. английский физик Бенджамин Томпсон (граф Румфорд) исследовал тепло, выделяющееся при сверлении бронзовых пушек. Румфорд успевал вскипятить поставленные на пушки котлы с водой за счет тепла, которое выделялось, пока лошади приводили в движение очень тупое сверло. В данном случае энергия механического движения сверла превращалась в энергию хаотического движения молекул бронзы и воды. А можно ли сделать наоборот?
Почему при изменении объема газа изменяется его внутренняя энергия
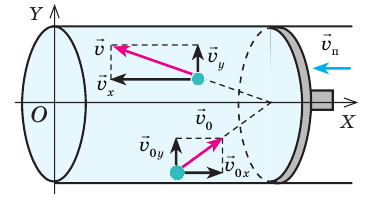
Внутренняя энергия газа может изменяться, если действующие на него внешние силы совершают работу (положительную или отрицательную). Например, если газ сжимают (газ совершает отрицательную работу) (рис. 37.1) и он при этом не отдает энергию окружающей среде, то скорость движения молекул газа, а соответственно, и внутренняя энергия, и температура газа увеличиваются. И наоборот: если газ расширяется (то есть совершает положительную работу), то скорость движения молекул, температура и внутренняя энергия газа уменьшаются.
Рис. 37.1. При сжатии газа скорость его молекул после столкновения с поршнем увеличивается (v > 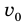
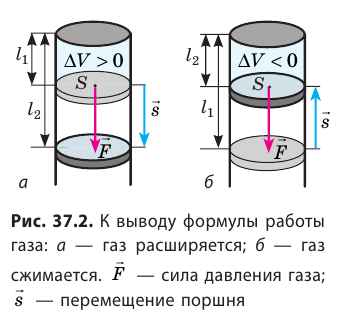
Как вычислить работу газа
Вычислим работу, которую совершает сила давления газа при изменении его объема от 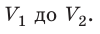
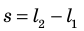
Таким образом, работа газа при его изобарном расширении равна:
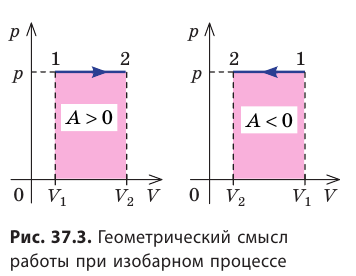
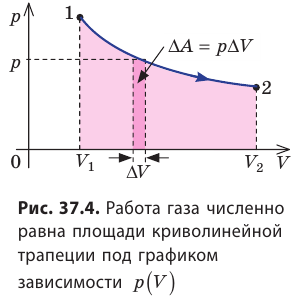
Работе газа при изобарном расширении (или сжатии) можно дать простое геометрическое толкование: работа газа численно равна площади прямоугольника под графиком зависимости p(V) (рис. 37.3).
Пусть некоторый газ переходит из состояния 1 в состояние 2 (рис. 37.4). Если изменение объема газа (∆V) достаточно мало, то давление газа можно считать неизменным. Тогда работа газа численно равна площади выделенной на рисунке полосы. Полная работа при изменении объема от 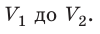
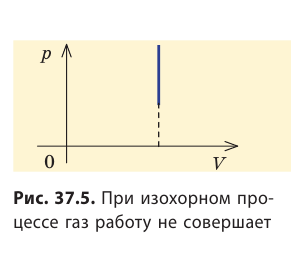
Очевидно, что при изохорном процессе (V = const) площадь фигуры под графиком зависимости p (V) равна нулю (рис. 37.5), — газ работу не совершает (A = 0) . Работа газа зависит от того, каким образом происходил переход газа из начального состояния в конечное (рис. 37.6).
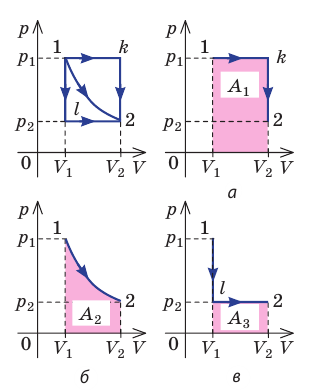
Рис. 37.6. три пути перехода газа из состояния 1 в состояние 2: а — газ изобарно расширяется (участок 1k), затем изохорно охла ждается (участок k2); б — газ изотермически расширяется; в — газ изохорно охлаждается (участок 1l), затем изобарно расширяется (участок l2). сравнив площади фигур под графиками, видим, что:
Пример №5
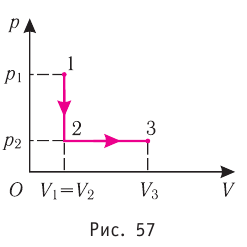
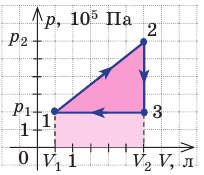
На рисунке графически изображен циклический процесс, совершаемый идеальным газом. Определите работу газа за цикл.
Решение:
Полная работа за цикл равна сумме работ, совершенных газом в ходе каждого процесса цикла. Работа газа в ходе процесса 1–2 численно равна площади трапеции, основания которой равны 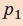
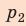
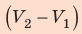
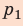
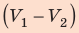
Выводы:
- При отсутствии теплообмена с окружающей средой, если над газом совершают работу, внутренняя энергия газа увеличивается; если газ сам совершает работу, его внутренняя энергия уменьшается.
- Если объем газа увеличивается, то газ совершает положительную работу. Если объем газа уменьшается, то работа газа отрицательна.
- Работа газа численно равна площади фигуры под графиком зависимости p (V). При изобарном процессе работу газа можно определить по формуле A=p∆V, при изохорном процессе работа газа равна нулю: A = 0.
- Первый закон термодинамики
- Второй закон термодинамики
- Тепловые двигатели и их КПД
- Тепловое состояние тел
- Термодинамика — основные понятия, формулы и определения
- Необратимость тепловых процессов
- Адиабатический процесс
- Молекулярно-кинетическая теория