Определите работу испарения 3 моль метанола при нормальной температуре кипения. [c.48]
Определите работу испарения. 5 моль бензола при нормальной температзфе кипения. [c.6]
Вычислить работу испарения моля воды при переходе ее в пар при 100 «С и нормальном давлении. Определить также количество тепло гы, сообшаемое при эгом воле. [c.34]
Если пар следует законам идеального газа, то внешняя работа испарения равна Гкип. [c.187]
Работа переноса моля вещества из одного растворителя в другой через газообразную фазу будет слагаться из 1) работы испарения одного моля хлористого водорода при постоянном давлении из неводного растворителя (эта работа равна RT) 2) максимальной изотермической работы изменения давления от давления НС1 над неводным растворителем (р ) до давления над вторым растворителем, например водой р 3) работы переноса одного моля вещества в воду при постоянном давлении р , равной RT. Так как работы первая и третья равны и противоположны по знаку, то суммарная работа определяется работой второго процесса [c.64]
Значения энтальпии Нт определяются вполне аналогичными выражениями, в которых вместо v содержатся соответствующие им значения С . Кроме того, теплота испарения исп в выражении Ut представляет собой внутреннюю теплоту испарения, а в выражении Яг —общую теплоту испарения, т. е. включает в последнем случае и внешнюю работу испарения pAV. Строго говоря, подобное различие относится также к теплотам плавления л и полиморфного превращения п. Однако в этих случаях внешняя работа процесса pAV очень мала и указанное различие можно обычно не учитывать. [c.204]
Теплота испарения, точнее — общая теплота испарения жидкости, слагается из двух составляющих 1) энергии, затрачиваемой на преодоление сил межмолекулярного притяжения в жидкости (включая и ассоциацию), называемой внутренней теплотой испарения, и 2) энергии, расходуемой на преодоление внешнего давления при выделении пара, называемой внешней теплотой (или работой) испарения и равной рДи. Внешняя теплота всегда бывает значительно меньше внутренней. В дальнейшем мы будем рассматривать только общую теплоту испарения, называя ее для краткости теплотой испарения. [c.171]
Аналогично найдем работу испарения вещества D и превращения его в газообразное состояние р/. [c.158]
Обозначим через г радиус сферической поверхности раздела фаз (радиус капли), через ро — давление насыщенного пара над плоской (г = чз), а через р — над выпуклой поверхностью. Перенесем некоторое количество жидкости dm с плоской поверхности жидкости в каплю радиуса г путем обратимого изотермического испарения при давлении ро, обратимого сжатия пара ОТ ДО В после 3 уюШ ей обратимой изотермической конденсации при р. Поскольку работа испарения и работа конденсации в этих условиях равны и противоположны по знаку, то общая работа переноса dW , совершаемая над системой, оказывается работой сжатия пара [c.193]
Под давлением р сконденсируем По молей пара в раствор. Работа конденсации +А =щЯТ, т. е. равна по величине, но противоположна по знаку работе испарения А . [c.191]
Еще точнее силы взаимодействия отражены величиной работы испарения или сублимации твердого тела. Укажем, что упругость насыщенного пара марганца весьма велика и температура его кипения составляет всего 2146°С, что значительно ниже температуры кипения его электронных аналогов Тс 3927°С Ке 5760°С. [c.323]
Как отмечено выше, в начальный период сушки работа испарения воды, связанной крайне слабо физико-механически [8], т. е. воды поверхностного смачивания и заключенной в макропорах (/ >10 см), не принимается во внимание, потому что энергия, взятая для этого из окружающей среды, не вызывает заметных энергетических изменений в структуре рассматриваемого тела, а используется только для изменения агрегатного состояния воды. [c.235]
Работа переноса моля вещества из одного растворителя в другой через газообразную фазу будет слагаться из 1) работы испарения одного моля хлористого водорода при постоянном давлении из растворителя М эта работа равна RT 2) максимальной изотермической работы изменения давления от давления НС1 над растворителем до давления [c.146]
Работа по первому пути определяется алгебраической суммой работ испарения п молекул растворителя М. Эта работа Лисп равна работе конденсации, взятой с обратным знаком работы реакции присоединения Лпр [c.485]
Известно, что молекулы каждого вещества находятся в постоянном движении и интенсивность этого движения зависит от температуры. Отсюда произведение энтропии на абсолютную температуру ( Т8 ) отражает то минимальное количество энергии, которое необходимо для теплового движения молекул при данной температуре. Само собою разумеется, что для практических целей важно уметь рассчитывать энтропию. Обычно вычисляется только разность энтропии при различных состояниях одного тела или системы тел. Так, при изотермическом процессе испарения воды или другой жидкости работа испарения связана с поглощением тепла извне ( 0), причем температура Т остается постоянной. Тогда отношение теплового прироста к абсолютной температуре и является приростом энтропии системы. Откуда [c.20]
На этом принципе построены квартирные и другие холодильники. Сжиженный газ (сернистый ангидрид, фреон и др.), испаряясь в испарителе, использует большое количество тепла, поглощаемого из камеры холодильника. Температура в последнем значительно понижается. Пары газа из испарителя засасываются в компрессор, в нем под влиянием высокого давления сжижаются и в жидком виде поступают в испаритель, где снова происходит испарение. Работа испарения связана при этом с поглощением тепла из камеры холодильника и т. д. [c.20]
Метод Улиха также хорошо применим к вычислению зависимости упругости насыш,енного пара жидкостей от температуры. Для этого надо в (255) лишь заменить Л — — ДФ т- на RT nP, где Р—упругое 1ь насыщенного пара при Т, так как полезная работа испарения 1 моля жидкого или твердого вещества до [c.399]
Таким образом вычисление работы реакции между газами Л сводится к вычислению работы А реакции между конденсированными веществами и двух работ испарения. [c.222]
Существуют соответствующие формулы определения как полной теплоты испарения, так и всей работы испарения [3]. Например, теплота испарения может быть определена по формуле Трутона [c.330]
Многие авторы подчеркивали, что во избежание испарения жидкости калориметрический сосуд должен быть герметичным. Однако в некоторых работах термохимической лаборатории МГУ удалось и в негерметичных калориметрах получить высокую воспроизводимость результатов опытов, несмотря на значительные колебания влажности окружающего калориметрическую установку воздуха. В этих работах испарение воды уменьшалось нанесением на ее поверхность нескольких (10— 20) капель трансформаторного или вазелинового масла герметизировалось только [c.23]
Значения энтальпии HJ определяются вполне аналогичными выражениями, в которых вместо Су содержатся соответствующие им значения Ср. Кроме того, теплота испарения 1 сп. в выражении представляет собой внутреннюю теплоту испарения, а в выражении Н /—общую теплоту испарения, т. е. включает в последнем случае и внешнюю работу испарения рй . Строго говоря, [c.185]
Испарим это количество чистого растворителя при давлении насыщенного пара р , расширим пар до давления насыщенного пара над раствором р и сконденсируем в раствор при этом давлении. Работы испарения и конденсации при постоянном давлении, равные [c.361]
Произведем теперь перенос такого же количества жидкости из капли с радиусом Г1 в каплю с радиусом Гг путем изотермического обратимого испарения ее из первой капли, обратимого сжатия пара от давления р1 до давления рг (давлений насыщенных паров этих капель) и обратимой изотермической конденсации его при этом давлении. Работа испарения и ра бота конденсации в этих процессах равны между собой по абсолютной величине и противоположны по знаку. Поэтому общая работа Лг всего переноса определяется только работой сжатия пара, т. е. [c.497]
Такова максимальная работа рассматриваемой нами реакции в газовой фазе. Для подведения баланса всего процесса, т. е. для вычисления сродства реакции, протекающей в конденсированных фазах, помимо рассмотренной нами работы процесса, идущего между парами вещества, необходимо подсчитать еще работы испарения и конденсации (пп. 1 и 3). [c.209]
СМ. [43]). Находящаяся на поверхности шарообразная молекула, согласно Стефану, находится как раз наполовину в жидкости, а наполовину в пространстве, занимаемом паром. Работа, необходимая для того, чтобы поместить молекулу на поверхность (а это и есть молекулярная поверхностная энергия), должна, следовательно, составлять половину той работы, которая нУЖна для перевода молекулы в газовую фазу (а это есть молекулярная теплота испарения). Это соотношение всегда соблюдается лишь грубо и даже для шаровидных частиц не является очень точным. Например, при точке кипения (т. е. в соответственном состоянии) соотношение молярной поверхностной энергии к молярной теплоте испарения равно для четыреххлористого углерода 0,452, для ртути 0,636. Еще хуже совпадение при других температурах, например для четыреххлористого углерода при комнатной температуре 0,34. Для спиртов или кислот требуемое теорией Стефана соотношение не осуществляется даже приблизительно. Например, для этилового спирта при точке кипения оно равно 0,186 [44]. Это и не удивительно, так как сильно схематизированный способ рассмотрения и должен оказаться совершенно непригодным, если на поверхности раздела находятся ориентированные молекулы, направленный нарУЖУ конец которых обладает иными силами притяжения, чем направленный внутрь жидкости. Работа, которую нужно в подобных случаях совершить для вывода молекулы на поверхность раздела, меньше, чем половина работы испарения, так как в первом случае не требуется разделять группы соседних молекУЛ, удерживаемых вместе значительными силами притяжения, в то время как при испарении эти значительные силы притяжения необходимо преодолеть. У алифатических спиртов и кислот различия между силами притяжения, действующими на противоположных концах молекУЛ, особенно велики вследствие возможности образования водородных мостиков между ДВУМЯ гидроксилами. Если, кроме того, появляется еще как характерная особенность строения прямая цепь, то склонность к ориентированию на поверхности в результате возможности параллельного расположения цепей 1ю схеме [c.276]
Впервые правильная и научно обоснованная оценка роли отдельных факторов в испарении с поверхности речных бассейнов была сделана Э. М. Ольдекопом в его работе Испарение с поверхности речных бассейнов (1911 г.). Ольдекоп исходил при этом из следующих положений. При малых количествах осадков они полностью испаряются. По мере увеличения количества осадков величина испарения возрастает. Но это увеличение испарения продол- [c.272]
Работа по первому пути определяется алгебраической суммой работ испарения п молекул растворителя М, эта работа Л сп равна работе конденсации, взятой с обратным знаком сп = —работе реакции присоединения Л р с и работе конденсации молекул НАМ , равной кнам [c.260]
Эта работа может быть получена, если принять изотермическое испарение жидкости из капли г и последующий перевод пара в каплю сжатием от давления р1 до давления рг- Напомним, что давления и р отвечают кривизне /»I и Г2. Работа испарения и работа конденсации во внимание не принимаются, так как они равны по абсолютному значению и взаимопогашаются. Тогда результирующая работа равна работе изотермического сжатия [c.210]
Н а g g е n га а с h е г J. Е. Теплота и внешняя работа испарения двадцати двух углеводородов. Ind. Eng. hem., 948, 40, № 3, 436—437. [c.60]
В этой связи следует отметить, что Хоар и Пернелл [ИЗ] предложили определять скрытую работу испарения на основе температурной зависимости характеристик удерживания, например [c.52]
Найдем максимальные работы испарения ям и on. При испарении 1 моля под постоянным давлением насыщенного пара Р совершается работа RT образования одного моля газа при Я= onst. Дальнейшее расширение от Р до р дает работу [c.365]
Можно было бы привести и другие примеры, включающие различные типы необратимых изменений, например, расширение газа без совершения полезной работы, смешение двух газов, химическая реакция без совершения электрической работы, испарение перегретой жидкости, растворение твердого тела в жидкости, но нет необходимости далее разбирать специальные случаи, так как наши рассуждения можно обобщить для приложения к любому необратимому процессу. Из рассмотрения необратимых процессов в гл. 1 очевидно, что где бы ни происходил такой процесс, отдельная система , участвующая в нем, может быть полностью возвращена к своему исходному состоянию только при исполь еании работы, получаемой от, некотарой внешней системы. [c.126]
Гидравлические масла группы HL применяют в системах, подвергающихся термическим воздействиям, или там, где ожидается длительный срок службы залитого масла. В таких случаях добавляют присадки, защищающие от коррозии. Если помимо вышеперечисленных свойств требуются также противоизносные характеристики (особенно для насосов), применяют гидравлические масла типа HLP согласно DIN 51 524, ч. 2 (см. табл. 99). Хорошая деэмульгируемость требуется для гидравлических масел обеих категорий, так как,если масло во время работы контактирует с большим объемом воды (например, в случае повреждений), вода должна легко отделяться от масла. В малогабаритных системах (станках, строительном оборудовании) небольшие количества конденсирующейся воды или СОЖ на водной основе, попавшие в масло из-за утечек, эмульгируются маслом и не образуют больших водных пузырей. Небольшие количества воды, попадающей в систему, как правило, не вредят ее работе и легко удаляются во время работы испарением из масляного бака. В некоторых случаях требуются гидравлические масла группы HLP (модифицированные), содержащие моющие присадки они обозначаются (не в соответствии со стандартом) как масла HLPD . Когда такие масла недоступны, вместо них применяют моторные масла группы HD, особенно для передвижных гидравлических систем в дорожно-строительной технике и т. д. В большинстве [c.335]
Теплота испарения 1исп в выражении Ит представляет собой внутреннюю теплоту испарения, а в выражении Нт — общую теплоту испарения, т. е. включает в последнем случае и внешнюю работу испарения рАУ Строго говоря, подобное различие относится также к теплотам плавления 1 л и полиморфного превращения п. Однако в этих случаях внешняя работа процесса рДУ очень, мала и указанное различие можно обычно не учитывать. [c.270]
И а g g е U ш а с h е г J. Е, Теплота и внешняя работа испарения этилбензола от О до 140°. J. Ат. hem. See., 1947, 69, № 3, 707—708. [c.451]
Аналогичные результаты полученк В. Р. Левиным [20] и Е. Р. Терещенко [21]. Основная часть бензина испаряется из масла в первые 10—15 мин работы испарение оставшегося бензина несколько замедляется, однако через 40—50 мин работы на номинальном режиме бензин практически полностью удаляется из системы смазки. [c.219]
Краткий курс физической химии Изд5 (1978) — [
c.171
]
Краткий курс физической химии Издание 3 (1963) — [
c.155
]
ИСПАРЕНИЕ, переход вещества из жидкого состояния в газообразное (парообразное). Испарение происходит со всякой свободной поверхности жидкости. Механизм испарения с точки зрения молекулярно-кинетической теории заключается в следующем. Молекулы жидкости, находящиеся вблизи от ее поверхности и обладающие в данный момент большой скоростью в направлении, образующем достаточно большой угол с поверхностью, вылетают в пространство над жидкостью, освобождаясь от притяжения остальных молекул жидкости; таким образом они становятся свободными молекулами пара. На преодоление сил сцепления жидкости и сопротивления внешнего давления для каждой испаряющейся молекулы требуется затрата энергии (тепловой).
Количество тепла ϱ, затрачиваемого на испарение при данной температуре одной весовой единицы жидкости, называется скрытой теплотой испарения:
где ϱi — внутренняя скрытая теплота испарения, расходуемая на внутреннюю работу разъединения молекул, а ϱв — внешняя скрытая теплота испарения, затрачиваемая на внешнюю работу расширения вещества от удельного объема s жидкости до удельного объема σ пара. Теплота испарения mϱ, отнесенная к граммолекуле жидкости, называется молекулярной теплотой испарения. Соответственно употребляются mϱi и mϱв. В технике полной теплотой испарения λ называется количество тепла в Cal, затрачиваемое на 1 кг жидкости для нагревания от 0° до данной температуры t и на превращение ее при этой температуре в пар:
где q — количество тепла, затрачиваемое на нагревание жидкости.
Теплотой пара называется сумма
где С — теплоемкость жидкости. Теплота пара определяет избыток энергии пара над энергией жидкости при 0°.
Внешняя скрытая теплота испарения при постоянном давлении р
где А — термический эквивалент работы. Полная теплота испарения
Для воды от 0 до 100° можно пользоваться формулой:
Для других жидкостей:
С повышением температуры скрытая теплота испарения уменьшается и при критической температуре ϱ = 0. Величина ϱв с возрастанием температуры сначала постепенно увеличивается и достигает своего максимума обычно при 0,7 абсолютной критической температуры, а затем убывает и при критической температуре ϱв = 0, как и ϱi = 0.
Самый простой случай испарения — с поверхности неподвижной жидкости в покоящийся воздух (статическое испарение). На практике мы сталкиваемся с этим случаем при хранении жидкостей (в частности жидкого топлива), в поверхностных увлажнителях, в мокрых производствах и т. д. В природе к этому случаю надо отнести испарение из водоемов в безветреную погоду. Основной закон для статического испарения дан Дальтоном: количество Q испаряемой в единицу времени жидкости пропорционально площади s испаряющей поверхности, обратно пропорционально давлению воздуха р и прямо пропорционально разности давления насыщенного пара ps при данной температуре и давления паров в воздухе p = ϕps (ϕ — отношение данного давления пара к ps):
Опыты Стефана и Винкельмана показали, что закон Дальтона является лишь первым, грубым приближением; однако, для случая испарения воды из водоемов поправки оказываются незначительными. Под скоростью испарения понимают объем паров Vz, испаряющихся с 1 см2 площади свободной поверхности жидкости в 1 сек. Для жидкостей, налитых в открытые цилиндрические сосуды, Стефан и Винкельман нашли, что
где h — «путь диффузии» паров, равный расстоянию от поверхности жидкости до свободного края цилиндра, kt — коэффициент диффузии паров. Если испарение идет в свободную от паров атмосферу, то ϕps = 0. Для изменения коэффициента диффузии с температурой Винкельман дает следующую формулу:
где k0 — коэффициент диффузии при 0°, Т — абсолютная температура, m — постоянная величина, определяемая из опытов. Для диффузии водяного пара в воздух k = 0,2162 см2/сек и m = 1,774. Коэффициент диффузии и скорость испарения зависят от внешнего давления:
Таким образом
(формула для испарения в покоящийся воздух или газ). Далее, испарение связано и с формой поверхности жидкости, и с формой сосуда, внутри которого оно происходит. В средних частях поверхности испарения происходит иначе, чем у краев. Неста Томас и Фергюсон нашли для массы Q воды, испаряющейся в 1 сек., формулу:
где а — радиус круглой поверхности, k = 0,05+0,025e-4a и n = 2,0—0,60е-2a. В 1926 г. В. Шулейкиным разработана кинетическая теория испарения. Он расчленяет весь процесс испарения на три части: 1) вылетание молекул из жидкости — свободное испарение, 2) обратное поглощение части вылетевших молекул жидкостью (при ударах о ее поверхность) и 3) распространение (диффузию) остальных молекул в окружающей покоящейся газовой среде.
Для скорости испарения с безграничной плоской поверхности теория приводит к формуле:
где ϕps — давление паров в сечении, находящемся над поверхностью жидкости на высоте h, ξ — среднее число ударов молекул пара о поверхность жидкости, приходящихся на поглощение жидкостью одной молекулы пара, v0 — скорость свободного статического испарения, равная 
В случае статического испарения с поверхности круга конечных размеров, объем испаряющейся жидкости со всей поверхности равен:
где а — радиус круга и γ — удельный объем жидкости. Чтобы оценить статическое испарение, необходимо знать для паров данной жидкости коэффициент диффузии и его изменение с температурой и другими факторами, молекулярный вес, кривую упругости насыщенных паров и скрытую теплоту испарения.
Явление испарения значительно осложняется, как только от статических условий мы переходим к динамическим. При самом слабом движении воздуха количество испаряющейся жидкости значительно возрастает, т. к. увеличивается коэффициент диффузии:
где k0 — коэффициент диффузии в отсутствии движения воздуха, W — скорость воздуха вдоль испаряющей поверхности в см/сек. Случаи испарения в динамических условиях наиболее часто встречаются как в природе (т. к. обычно имеется или движение воздуха мимо испаряющей поверхности — ветер или, наоборот, движение самой испаряющей поверхности в воздухе — капли дождя), так и в технике, где особенно распространен случай испарения жидкости, разбрызгиваемой в струе воздуха (двигатели внутреннего сгорания, работающие на карбюрируемом топливе, испарение при пульверизации, и т. д.). Если рассматривать испарение капли не слишком малого радиуса а с точки зрения кинетической теории испарения, то для скорости испарения с поверхности капли получим:
где
a v0 — скорость испарения с безграничной плоской поверхности.
Самым сложным, а вместе с тем и имеющим наибольшее значение в технике является случай испарения при карбюрации. Основные процессы здесь следующие: воздух просасывается через карбюратор; создающимся разрежением в струю этого воздуха засасывается из жиклера жидкое топливо, при выходе из жиклера струя топлива разбивается на капли, несущиеся в потоке; вместе с тем начинается испарение с капель в воздух и диффузия в последнем молекул образовавшихся паров топлива. Значительная часть капель, как показали опыты в Научном автомоторном институте (НАМИ), вскоре оседает на стенке трубопровода и образует пленку жидкого топлива, движущуюся по трубе значительно медленнее (раз в 60) воздуха. С поверхности этой пленки тоже происходит испарение топлива в воздух. В результате испарения с поверхности капель и с пленки жидкого топлива и диффузии молекул пара, в струе воздуха происходит смешение паров топлива с воздухом, и образуется горючая рабочая смесь.
Попытка дать теорию динамического испарения принадлежит Кляфтену. Им построена теория испарения с капель, прямолинейно движущихся в потоке воздуха и равномерно в нем распределенных. Кляфтен исходил из основного уравнения классической теории диффузии газов (в полярных координатах):
где a — радиус капли, Z — время, ps — давление насыщенных паров, k — коэффициент диффузии. Интегрирование этого уравнения дает:
где
a0 — радиус капли в момент начала испарения, n — коэффициент смешения, т. е. отношение веса воздуха к весу жидкости и паров, n’ – коэффициент смешения для случая, когда насыщение наступает при Z = ∞. Теория Кляфтена очень несовершенна, так как не учитывает целого ряда очень важных факторов (упругости насыщенных паров около капель в зависимости от формы и размеров поверхности последних, неоднородности распыления, наличия вихревых движений воздуха, испарения с пленки и т. д.). Вследствие этого время полного испарения капель, по теории Кляфтена, получается слишком малым, что не согласуется с данными, полученными из моторной практики. Таким образом, полной теории динамического испарения пока еще нет, и оценку испарению приходится давать, лишь основываясь на сравнительных опытных данных.
Для измерения испарения с покоящейся жидкости служат особые приборы, называемые испарителями, или эвапорометрами. Самый простой и наиболее распространенный из них — испаритель Вильда (фиг. 1).
На чашку неравноплечных весов наливается жидкость (слой толщиной 20 мм). При испарении чашка делается легче, и уравновешивающий ее груз опускается. Стрелка показывает, сколько жидкости испарилось. Очень распространен для воды испаритель Лермантова (фиг. 2), состоящий из двух соединенных друг с другом сосудов А и В.
В испаритель наливают воду, пока не заполнится весь нижний сосуд (воздух из него выходит через трубку Д). Затем мехами через трубку Д нагнетают в нижний сосуд воздух, этим подымают воду в верхний сосуд и закрывают соединительную трубку пробкой С. Вода испаряется в течение определенного времени из верхнего сосуда. Чтобы узнать, сколько испарилось воды, открывают пробку С, спускают воду в нижний сосуд и приливают мензуркой дополнительно новую воду, пока в нижнем сосуде не будет достигнут прежний уровень. В лабораторных условиях скорость статического испарения можно измерять или в открытых цилиндрах, по понижению свободного уровня жидкости (метод Винкельмана), или в закрытых цилиндрах по парциальному давлению паров. Для измерения испарения в условиях, возможно близких к тем, какие имеются во всасывающих трубопроводах мотора (динамическое испарение), НАМИ осуществлена следующая установка (фиг. 3).
Жидкое топливо через карбюратор К подается в трубу Т, через которую просасывается с помощью компрессора воздух (со скоростью до 40 м/сек). Часть топлива, образующая пленку на стенках трубопровода, в конце последнего улавливается захватными кольцами и стекает в собирательный сосуд С1. Оставшиеся неиспаренные капли падают на рупорный экран Рэ и стекают в собирательный сосуд С2. Т. о. оказывается возможным уловить всю неиспарившуюся в трубе часть топлива, а отсюда узнать и количество испарившегося топлива.
Во всех случаях испарения жидкость может испариться нацело лишь в количестве, которое соответствует давлению насыщения. Упругость насыщенного пара является важнейшим фактором для процесса испарения. Чем больше упругость насыщенных паров при данной температуре, тем больше для насыщения требуется вещества, тем большее количество жидкости может испариться. Упругость насыщенных паров равняется атмосферному давлению при температуре кипения. Отсюда, чем ниже температура кипения данной жидкости, тем последняя более «летуча», тем сильнее она испаряется.
Если обратимся к сложным жидкостям, являющимся смесями из целого ряда компонентов (а таковы все наши жидкие топлива — бензины, керосины, нефть, технические или моторные бензолы и т. д.), то они выкипают уже не при одной температуре, а по фракциям. Так, в техническом бензоле, представляющем смесь бензола, толуола, ксилола и сольвентнафта, должна была бы сначала, около 80° выкипать бензольная фракция, затем, около 110° — толуольная, около 130° — ксилольная и т. д. На самом же деле кипение начинается действительно около 80°, но жидкость при дальнейшем подогреве продолжает все время нагреваться, и кипение идет непрерывно до тех пор, пока все, даже трудно испаряющиеся фракции не улетят. Для характеристики таких сложных жидкостей служит т. н. кривая разгонки (фиг. 4), дающая % по отношению к первоначальному весу (в технике. часто к объему) испарившейся части жидкости до данной температуре.
Законы испарения смесей очень сложны и до сего времени не выяснены.
Источник: Мартенс. Техническая энциклопедия. Том 9 — 1929 г.
Парообразование, которое происходит только со свободной поверхности жидкости, граничащей о газообразной средой или с вакуумом, называется испарением.
Рассмотрим процесс испарения с точки зрения молекулярно-кинетической теории. Как известно, потенциальная энергия молекул жидкости при увеличении расстояния между ними должна возрастать. Следовательно, чтобы покинуть жидкость, молекула должна выполнить работу за счет уменьшения своей кинетической энергии. Среди хаотически движущихся молекул жидкости в ее поверхностном слое всегда найдутся такие молекулы, которые стремятся вылететь из жидкости. Когда такая молекула выходит за поверхностный слой, то возникает сила, втягивающая молекулу обратно в жидкость (рис. 7.1). Поэтому вылетают из жидкости только те молекулы, у которых кинетическая энергия больше работы, необходимой для преодоления противодействия молекулярных сил в слое толщиной rm, где rm — радиус молекулярного действия.
Покинувшие жидкость молекулы совместно составляют пар над ее поверхностью. Так как из жидкости вылетают молекулы с достаточно большой кинетической энергией, а остаются в ней молекулы с меньшей кинетической энергией, то среднее значение энергии Епост Для молекул, остающихся в жидкости, в процессе испарения уменьшается, т. е. жидкость при испарении охлаждается. Этим объясняется ощущение холода при выходе из воды после купанья, охлаждение руки, смоченной эфиром, и т. п.
Некоторые молекулы пара при хаотическом движении над поверхностью жидкости залетают обратно в жидкость. Это означает, что наряду с испарением жидкости всегда происходит и конденсация ее паров. Так как молекулы пара, залетающие в жидкость, частично передают свою кинетическую энергию молекулам жидкости, то при этом происходит возрастание Eпост У молекул жидкости, т. е. увеличение внутренней энергии жидкости (нагревание жидкости).
Итак, на поверхности жидкости одновременно происходит испарение и конденсация. Когда преобладает процесс испарения, жидкость охлаждается, а когда преобладает конденсация, жидкость нагревается.
Поскольку силы молекулярного взаимодействия зависят от природы молекул, скорость испарения зависит от рода жидкости. Эту зависимость легко обнаружить на опыте. Если в одинаковые открытые сосуды налить равные объемы разных жидкостей, то через некоторое время будет видно, что быстрота испарения этих жидкостей разная. Оказывается, что эфир испаряется быстрее спирта, а спирт — быстрее воды.
Опыт показывает, что скорость испарения жидкости зависит от площади ее свободной поверхности. Чем больше эта площадь, тем быстрее испаряется жидкость. (Приведите примеры, подтверждающие эту зависимость, и объясните ее.)
Испарение происходит при любой температуре. Поэтому над свободной поверхностью жидкости всегда находится пар этой жидкости.
Легко заметить, что с повышением температуры скорость испарения жидкости возрастает. Например, горячая вода испаряется быстрее холодной. Объясняется это тем, что при повышении температуры увеличивается средняя кинетическая энергия молекул жидкости и становится больше таких молекул, которые могут преодолеть противодействие поверхностного слоя жидкости и вылететь за его пределы.
Как было отмечено выше, наряду с испарением жидкости всегда происходит и конденсация ее паров, которая уменьшает скорость испарения. При увеличении плотности молекул пара над поверхностью жидкости конденсация пара возрастает и испарение замедляется. Следовательно, чем меньше плотность пара жидкости над ее поверхностью, тем больше скорость испарения. Поэтому откачка паров с поверхности ускоряет ее испарение.
Отметим еще, что охлаждение жидкости в процессе ее испарения не всегда заметно. Объясняется это тем, что между жидкостью и окружающими телами существует теплообмен, который компенсирует потери ее энергии, уменьшая охлаждение жидкости. Однако при большой скорости испарения температура жидкости может заметно понизиться.
Сергей Сергеевич Соев
Эксперт по предмету «Физика»
Задать вопрос автору статьи
Что такое испарение
Определение
Испарением называется процесс парообразования, который происходит со свободной поверхности жидкости.
Испарение происходит при любой температуре и происходит интенсивнее с увеличением температуры. В результате испарения происходит охлаждение жидкости, так как испарение можно объяснить тем, что молекулы, обладающие наибольшей кинетической энергией, вылетают с поверхностного слоя жидкости, преодолевая силы притяжения соседних молекул. Скорость испарения зависит от внешнего давления и движения газообразной фазы над свободной поверхностью жидкости. С повышением температуры плотность, следовательно, давление насыщенного пара над жидкостью увеличиваются. При увеличении плотности паров, поверхностное натяжение жидкости уменьшается, следовательно, скрытая теплота парообразования с повышением температуры уменьшается. При критической температуре (${ T}_k$) плотность насыщенных паров равна плотности жидкости, различие между этими фазами вещества исчезает. Получается, что при критической температуре поверхностное натяжение и скрытая теплота парообразования равны нулю. Пар, строго говоря, газом не является. У паров близких к насыщению давление незначительно изменяется в зависимости от объема. Газовые законы, могут приближенно применяться к ненасыщенным парам.
Что такое кипение
Сдай на права пока
учишься в ВУЗе
Вся теория в удобном приложении. Выбери инструктора и начни заниматься!
Получить скидку 3 000 ₽
Определение
Процесс интенсивного испарения жидкости не только с ее свободной поверхности, но и по всему объему жидкости внутрь образующихся в процессе пузырьков пара называют кипением.
Давление p внутри пузырька пара определяют в соответствии со следующим выражением:
[p=p_0+rho gh+p_{R }left(1right),]
где $p_0$- внешнее давление, $rho gh$- давление слоев жидкости, которые расположены выше, $p_{R }=frac{2sigma}{r}$ — дополнительное давление, которое вызвано с кривизной пузырька, $r$- радиус пузырька, $h$ — расстояние от центра пузырька до поверхности жидкости, $rho $ — плотность жидкости, $ sigma $ — поверхностное натяжение жидкости.
Кипение начинается тогда, когда давление (упругость) насыщенного пара внутри пузырька ($p_p$) больше чем давление в правой части формулы (1). Если жидкость имеет центры парообразования, то кипение жидкости начинается при более низких температурах. Если $rho ghll p_0$, то можно считать, что кипение начинается при $p_papprox p_0$. Температуру жидкости, при которой давление ее насыщенного пара равно внешнему давлению, называют температурой (точкой) кипения (${ T}_k$). Строго говоря, кипение на различных уровнях жидкости происходит при различных температурах, нет какой то одной определенной температуры. Определенную температуру имеет насыщенный пар, который находится над поверхностью кипящей жидкости. Его температура не зависит от того как происходит кипение в глубине жидкости, и определяется только внешним давлением. Именно температура такого пара имеется в виду, когда говорят о температуре кипения.
Если кипение происходит при постоянном давлении ($p_0$), то температура кипения постоянна. Тепло, подводимое к системе, в таком случае расходуется только на парообразование.
Что такое конденсация
«Испарение и конденсация» 👇
Определение
Процесс, обратный испарению, называют конденсацией.
При конденсации тепло выделяется. Кипение жидкости, конденсация пара — фазовые переходы первого рода. Напомним, что фазовым переходом первого рода называют переход, который сопровождается скачкообразным изменением внутренней энергии и плотности вещества. При фазовых переходах первого рода, к которым относятся испарение и конденсация, термодинамический потенциал (Ф) системы не изменяется.
Количество теплоты, которое необходимо израсходовать при парообразовании единицы массы жидкости при температуре равной ${ T}_k$, называют удельной теплотой парообразования (или скрытой теплотой кипения) ($r_k$). Удельную теплоту парообразования можно найти из уравнения Клайперона — Клаузиуса:
[r_k=left(v_p-v_jright)T_kfrac{dp}{dT_k}left(2right),]
где $v_p,v_j$ — удельные объемы пара и жидкости при температуре кипения $T_k$. Соответственно, зависимость температуры кипения от давления в процессе испарения определяется как:
[frac{dT_k}{dp}=frac{left(v_p-v_jright)T_k}{r_k} left(3right).]
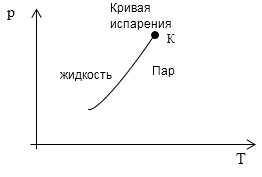
Так как $v_p>v_j$ и $r_k>0$, то $frac{dT_k}{dp}>0. $ На рис 1. представлена кривая фазового равновесия процесса парообразования. Она заканчивается в критической точке К. Следствием обрыва кривой испарения в точке К является непрерывность жидкого и газообразного состояния вещества. Температура кипения растет при увеличении давления.
Рис. 1
Пример 1
Задание: Определите молярную теплоту испарения жидкости при температуре T и давлении p насыщенных паров, если жидкость и ее пар подчиняются уравнению Ван-дер-Ваальса. Коэффициенты в уравнении Ван-дер-Ваальса равны a и b, $Tll T_k$.
Решение:
Теплота парообразования, исходя из первого начала термодинамики, может быть вычислена как:
[r_p=U_p-U_j+pleft(V_p-V_jright)left(1.1right),]
где $U_j-$ внутренняя энергия жидкости, $U_p$ внутренняя энергия пара, $V_j,V_p$ объемы жидкости и пара соответственно, $pleft(V_p-V_jright)- работа, совершаемая при испарении$ против сил внешнего давления p. Разность внутренних энергий по уравнению Ван-дер-Ваальса равна:
[U_p-U_j=frac{a}{V_j}-frac{a}{V_p}left(1.2right).]
используем уравнение Ван-дер-Ваальса для одного моля вещества:
[left(p+frac{a}{V^2}right)left(V-bright)=RTto p=frac{RT}{left(V-bright)}-frac{a}{V^2} left(1.3right).]
Получаем:
[r_p=frac{a}{V_j}-frac{a}{V_p}+pleft(V_p-V_jright)=V_pleft{frac{RT}{V_p-b}-frac{2a}{V^2_p}right}-V_j left{frac{RT}{V_j-b}-frac{2a}{V^2_j}right} (1.4).]
Ответ: Молярная теплота испарения жидкости при заданных условиях равна: $r_p=V_pleft{frac{RT}{V_p-b}-frac{2a}{V^2_p}right}-V_j left{frac{RT}{V_j-b}-frac{2a}{V^2_j}right}$.
Пример 2
Задание: Два килограмма воды взяли при температуре 00C при атмосферном давлении нагрели и превратили в пар полностью. Найдите изменение энтропии, если считать процесс обратимым.
Решение:
В качестве основы для решения задачи возьмем определение энтропии для обратимого процесса:
[triangle S=int{frac{delta Q}{T}}=triangle S_{nagr}+triangle S_p (2.1),]
где $triangle S_{nagr}$ изменение энтропии при нагревании воды от нуля по Цельсию до температуры кипения, то есть от $T_1=273 K до T_2=373 K$. $triangle S_p- $изменение энтропии при парообразовании. Найдем изменение энтропии при нагревании воды:
[triangle S_{nagr}=intlimits^{T_2}_{T_1}{frac{delta Q}{T}}=intlimits^{T_2}_{T_1}{frac{cmdT}{T}}=cmintlimits^{T_2}_{T_1}{frac{dT}{T}}=cmlnleft(frac{T_2}{T_1}right)left(2.2right),]
где $c$ удельная теплоемкость воды равна $c=4,2 {cdot 10}^3frac{Дж}{кгК}$
Процесс парообразования при температуре кипения идет без изменения температуры, поэтому выражение для изменения энтропии в этом процессе будет иметь вид:
[triangle S_p=frac{1}{T_2}int{delta Q}=frac{1}{T_2}triangle Q=frac{r_pm}{T_2}left(2.3right),]
где $r_p$- удельная теплота парообразования из справочных материалов равна для воды $r_p=22,6cdot {10}^5frac{Дж}{кг}$.
Окончательно выражение для изменения энтропии имеем в виде:
[triangle S=cmlnleft(frac{T_2}{T_1}right)+frac{r_pm}{T_2} left(2.4right).]
Все данные переведены в СИ, проведем расчет:
[triangle S=4,2 {cdot 10}^3cdot 2{ln left(frac{373}{273}right) }+frac{22,6cdot {10}^5cdot 2}{373}=14,6{cdot 10}^3frac{Дж}{К}.]
Ответ: Изменение энтропии в заданном процессе равно $1,46{cdot 10}^4frac{Дж}{К}$.
Находи статьи и создавай свой список литературы по ГОСТу
Поиск по теме
Скорость испарения
воды со свободной поверхности
W/(F)
= c (H-h) /B, (8.10)
где W — количество
испарений влаги, кг
— продолжительность
испарения, ч;
F — поверхность
испарения, м2
;
с — коэффициент
испарения;
H — давление пара
в пограничном слое испаряющейся
жидкости равняется парциальному
давлению насыщенного пара, Па;
h — парциальное
давление в окружающей воздушной среде,
Па;
В — общее
барометрическое давление, Па.
Коэффициент
испарения воды
с =
а,
(8.11)
где a — коэффициент;
— массовая
скорость воздуха, кг/(м2
с).
Обобщенное
уравнение скорости испарения жидкости
со свободной поверхности, предложенное
А.В.Лыковым:
(8.12)
коэффициент
испарения
с = k Ren,
(8.13)
Re =
/
— критерий Рейнольдса;
— скорость
движения воздуха, м/с;
— размер поверхности
испарения по направлению потока
воздуха, м;
— кинематическая
вязкость воздуха, м2
/с;
М- молекулярная
масса испраяющейся жидкости, кг/кМоль
(МH О =
18,016 кг/ кМоль);
L — ширина поверхности
испарения в направлении, перпендикулярном
направлению движения воздуха, м;
R — газовая
постоянная: R =8,3144 Дж/(Моль.
К);
D — коэффициент
диффузии для системы воздух — водяной
пар, м2 /ч;
D =
0,0754
/B ,
(8.14)
B0
— давление
при нормальных условиях, равное 0,1013
МПа;
Tп
— температура
нагрева воздушной смеси в пограничном
слое, К;
Tп
=0,5 (Tп.ж.+
Tc),
(8.15)
Tп.ж.
— температура
поверхности жидкости (принимается
температура жидкости), К;
Tc
— температура
окружающего воздуха, К.
Для решения формулы
сначала находят число Re, а затем с:
Re =200
20000, c= 0,5 Re0,58
;
Re= 20000200000
; с=0,85
Re0,76
.
8.2. Расчет продолжительности сушки
Г.К. Филоненко
разработал метод приведенной скорости
для расчета продолжительности сушки.
На основе анализа данных экспериментального
исследования он позволяет установить
связь между скоростью сушки и
влагосодержанием материала, исключить
влияние параметров сушильного агента.
Зависимость метода приведенной скорости
сушки только от физико-химических
свойств материала и энергии связи
влаги с материалом позволяет использовать
уравнение продолжительности сушки,
полученное в результате исследования
процесса сушки на опытных стендах,
в инженерных расчетах сушильных
установок любой производительности.
Продолжительность
сушки
в (мин)

(8.16)
Показатель степени
m является постоянной величиной для
данного материала, не зависит от формы
и размера частиц, влагосодержания,
способа и параметров процесса сушки.
Он характеризует энергию связи влаги
с материалом, физико-химические свойства
материала. При испарении свободной
воды в периоде постоянной скорости
сушки m=0.
m = 0,5 для рыбы, m
= 1 для кальмара.
При известных
значениях показателя степени m
уравнения (35) имеют вид: при m=0,5
=
,
(8.17)
при m=1
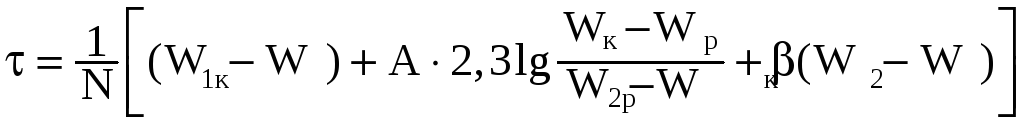
(8.18)
В уравнениях 14.8
и 14.9 N — скорость постоянного периода
сушки, % /мин.
W1,
Wк,W2,Wр
—
влагосодержание материала начальное,
критическое, конечное и равновесное,
%;
A и
— массообменные коэффициенты, определяющие
перемещение влаги внутри материала.
Величины этих
коэффициентов для данного материала
зависят как от размера и формы частиц
т.е. от длины пути перемещения влаги
внутри частицы, так и от фазового
состояния перемещаемой влаги, т.е. от
температуры и потенциала сушки воздуха.
Коэффициенты A и
можно рассчитать по уравнениям
А= с — dEср
, (8.19)
= еЕср —
f, (8.20)
В этих уравнениях
Еср —
среднеинтегральное значение потенциала
сушки воздуха: Eср
=(tc
— tм
)ср.
Критическое
влагосодержание материала Wк
рассчитывают
по уравнению
Wк
= k — eEср
,
(8.21)
Скорость постоянного
периода сушки
N = a
+ bEcр (F/Мс),
(8.22)
где
— массовая скорость воздуха, кг/(м2с);
при сушке в
неподвижном слое нужно подставить
,
F/Мс
— величина,
обратная удельная нагрузке материала,
м2/кг.
Значения коэффициентов
c,d,e,f.
Таблица 5
|
Материал |
Размеры, |
с |
d |
e |
f |
|
кальмар |
8x8x8 |
700 |
4,83 |
0,0191 |
2,2 |
|
рыба |
20х20х20 |
305 |
2,28 |
0,126 |
16,55 |
Значения коэффициентов
k и l.
Таблица 6
|
Материал |
Размеры, |
Коэффициент |
|
|
k |
l |
||
|
Кальмар |
8Х8Х8 |
250 |
1,1 |
|
Рыба |
20Х20Х20 |
730 |
5 |
Значения равновесного
влагосодержания Wр
в уравнениях
следует принимать в зависимости от
температуры сушильного агента: при
100С
и выше Wр
=0; при 90С
— Wр =
1; при 80С
— Wp=3;
при 60-70С-Wр=5.
Полученные
зависимости позволяют относительно
быстро и достаточно точно рассчитать
продолжительность сушки пищевых
материалов.
Для расчета
периода прогрева материала вводится
понятие условного влагосодержания
Wу,
которое больше начального W1
, если
начальная температура материала to
меньше
температуры материала t1
в период
постоянной скорости сушки. За счет
тепла, затраченного на подогрев
материала от t0
до t1
, можно
было бы понизить влагосодержание
материала от Wу
до W1
:
Mc
, (8.23)
Wу
= W1+(100
cс.в. +
W1)(
(8.24)
где
— коэффициент, зависящий от вида и
теплопроводности материала (для рыбы
= 0,60).
Величины
коэффициентов a и b
Таблица 7
|
Материал |
Размеры, |
Коэффициент |
|
|
a |
b |
||
|
кальмар |
8Х8Х8 |
5,4 |
0,54 |
|
рыба |
20Х20Х20 |
8,2 |
0,174 |
Задание № 11
11.1. Рассчитать
продолжительность сушки кальмара,
если его начальная влажность 72%, а
конечная — 24 %. Удельная нагрузка
составляет 6 кг/м2
, а процесс
осуществляется воздухом с температурой
90С.
11.2. Рассчитать
продолжительность сушки рыбы, если ее
начальная влажность 78%, а конечная — 18%.
Удельная нагрузка составляет 7 кг/м2
, а процесс
осуществляется воздухом
с температурой 80С.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #