Молекулярная физика Основные формулы
1. Основы молекулярно-кинетической теории. Газовые законы
1.1 Количество вещества
m — масса;
μ — молярная масса вещества;
N — число молекул;
NA = 6,02·1023 моль-1 — число Авогадро
1.2 Основное уравнение молекулярно-кинетической теории идеального газа
p — давление идеального газа;
m — масса одной молекулы;
n = N/V — концентрация молекул;
V — объем газа;
N — число молекул;

1.3 Средняя квадратичная скорость молекул идеального газа
k = 1,38·10-23 Дж/К — постоянная Больцмана;
R = kNA = 8,31 Дж/(моль·К) — универсальная газовая постоянная;
T = t+273 — абсолютная температура;
t — температура по шкале Цельсия.
1.4 Средняя кинетическая энергия молекулы одноатомного газа
1.5 Давление идеального газа
n — концентрация молекул;
k — постоянная Больцмана;
T — абсолютная температура.
1.6 Закон Бойля-Мариотта
p — давление;
V — объем газа.
1.7 Закон Шарля
p0 — давление газа при 0 °С;
α = 1/273 °C-1 — температурный коэффициент давления.
1.8 Закон Гей-Люссака
V0 — объем газа при 0 °С.
1.9 Уравнение Менделеева-Клапейрона
1.10 Объединенный закон газового состояния (уравнение Клапейрона)
1.11 Закон Дальтона
pi — парциальное давление i-й компоненты смеси газов.
2. Основы термодинамики
2.1 Внутренняя энергия идеального одноатомного газа
ν — количество вещества;
R = 8,31 Дж/(моль·К) — универсальная газовая постоянная;
T — абсолютная температура.
2.2 Элементарная работа, совершаемая газом,
при изменении объема на бесконечно малую величину dV
p — давление газа.
При изменении объема от V1 до V2
2.3 Первый закон термодинамики
ΔQ — количество подведенной теплоты;
ΔA — работа, совершаемая веществом;
ΔU — изменение внутренней энергии вещества.
2.4 Теплоемкость идеального газа
ΔQ — количество переданной системе теплоты на участке процесса;
ΔT — изменение температуры на этом участке процесса.
Молекулярная физика
Основные понятия
Количество вещества измеряется в молях (n).
n — число молей
1 моль равен количеству вещества системы, содержащей столько же частиц, сколько атомов содержится в 0,012 кг углерода 
NA=6,022 1023 1/моль.
1 моль любого газа при нормальных условиях занимает объем
V=2,24 10-2 м3.
М – молярная масса (масса моля) – величина, равная отношению массы вещества m к количеству вещества n:
mo – масса одной молекулы, m – масса взятого количества вещества

Идеальный газ. Основное уравнение молекулярно-кинетической теории.
Основным уравнением молекулярно-кинетической теории газа является уравнение:

р – давление газа на стенки сосуда,
n – концентрация молекул,

Давление газа р можно определить по формулам:


Т – абсолютная температура,
K=1,38 10-23 Дж/К – постоянная Больцмана.

где 
Т=373+to С, to С – температура по Цельсию.
Например, t=27o С, Т=273+27=300 К.
Смесь газов
Если в объеме V находится не один газ, а смесь газов, то давление газа р определяется законом Дальтона: смесь газов оказывает на стенки давление, равное сумме давлений каждого из газов, взятых в отдельности:


n — число молей смеси,

Уравнение Клапейрона-Менделеева, изопроцессы.
Состояние идеального газа характеризуют давлением р, объемом V, температурой Т.
[p]=Паскаль (Па), [V]=м3, [T]=Кельвин (К).
Уравнение состояния идеального газа:


Если масса m постоянная, то различные процессы, происходящие в газах, можно описать законами, вытекающими из уравнения Менделеева-Клапейрона.
1. Если m=const, T=const – изотермический процесс.
Уравнение процесса:
График процесса:
2. Если m=const, V=const – изохорический процесс.
Уравнение процесса: 
График процесса:
3. Если m=const, p=const – изобарический процесс.
Уравнение процесса:
График процесса:
4. Адиабатический процесс – процесс, протекающий без теплообмена с окружающей средой. Это очень быстрый процесс расширения или сжатия газа.
Насыщенный пар, влажность.
Абсолютная влажность – давление р водяного пара, содержащегося в воздухе при данной температуре.
Относительная влажность – отношение давления р водяного пара, содержащегося в воздухе при данной температуре, к давлению ро насыщенного водяного пара при той же температуре:
рo – табличное значение.
Точка росы – температура, при которой находящийся в воздухе водяной пар становится насыщенным.
Термодинамика
Термодинамика изучает наиболее общие закономерности превращения энергии, но не рассматривает молекулярного строения вещества.
Всякая физическая система, состоящая из огромного числа частиц – атомов, молекул, ионов и электронов, которые совершают беспорядочное тепловое движение и при взаимодействии между собой обмениваются энергией, называется термодинамической системой. Такими системами являются газы, жидкости и твердые тела.
Внутренняя энергия.
Термодинамическая система обладает внутренней энергией U. При переходе термодинамической системы из одного состояния в другое происходит изменение ее внутренней энергии.
Изменение внутренней энергии идеального газа равно изменению кинетической энергии теплового движения его частиц.
Изменение внутренней энергии DU при переходе системы из одного состояния в другое не зависит от процесса, по которому совершался переход.
Для одноатомного газа:


Изменение внутренней энергии системы может происходить за счет двух различных процессов: совершения над системой работы А/ и передачи ей теплоты Q.
Работа в термодинамике.
Работа зависит от процесса, по которому совершался переход системы из одного состояния в другое. При изобарическом процессе (p=const, m=const): 


Работа, совершаемая над системой внешними силами, и работа, совершаемая системой против внешних сил, равны по величине и противоположны по знаку: 
Первый закон термодинамики.
Закон сохранения энергии в термодинамике называют: первый закон термодинамики.
Первый закон термодинамики:
А/ — работа, совершенная над системой внешними силами,
А – работа, совершенная системой,



Первый закон термодинамики формулируется следующим образом: Количество теплоты (Q), сообщенное системе, идет на приращение внутренней энергии системы и на совершение системой работы над внешними телами.
Применим первый закон термодинамики к различным изопроцессам.
а) Изотермический процесс (T=const, m=const).
Так как 


б) Изохорический процесс (V=const, m=const).
Так как объем не изменяется, то работа системы равна 0 (А=0) и 
в) Изобарический процесс (p=const, m=const).
г) Адиабатический процесс (m=const, Q=0).

КПД тепловой машины.
Тепловой машиной называется периодически действующий двигатель, совершающий работу за счет получаемого извне количества теплоты. Тепловая машина должна состоять из трех частей: 1) рабочего тела – газа (или пара), при расширении которого совершается работа; 2) нагревателя – тела, у которого за счет теплообмена рабочее тело получает количество теплоты Q1; 3) холодильника (окружающей среды), отбирающего у газа количество теплоты Q2.
Нагреватель периодически повышает температуру газа до Т1, а холодильник понижает до Т2.
Отношение полезной работы А, выполненной машиной, к количеству теплоты, полученной от нагревателя, называется коэффициентом полезного действия машины h:
Коэффициент полезного действия идеальной тепловой машины:
Т1 – температура нагревателя,
Т2 – температура холодильника.

ТЕСТОВЫЕ ЗАДАНИЯ
- Какое число молекул содержит 1 моль кислорода?
- Получите из уравнения Менделеева-Клапейрона уравнение изобарического процесса.
- По графикам изопроцессов в координатных осях V-T постройте графики тех же процессов в координатных осях p-V.
- Определите температуру в состоянии В, если в состоянии А Т=200 К.
- Два сосуда объемами V1 и V2 заполнены идеальным газом при давлении р1 и р2. Какое установится давление в сосудах, если их соединить между собой? Температура не изменяется.
- Докажите, что удельная теплоемкость газа при постоянном давлении больше, чем при постоянном объеме.
- Идеальному газа передается количество теплоты таким образом, что в любой момент времени переданное количество теплоты Q равно работе А, совершенной газом. Какой процесс осуществлен?
- Идеальный газ переходит из состояния М в состояние N тремя различными способами, представленными на диаграмме p-V. В каком случае работе будет минимальной?
- Идеальному газу передано количество теплоты 5 Дж и внешние силы совершили над ним работу 8 Дж. Как изменится внутренняя энергия газа?
- Каково максимально возможное КПД тепловой машины, использующей нагреватель с температурой 427о С и холодильник с температурой 27о С.
Ответы и решения
- Моль любого вещества содержит одинаковое число молекул, равное числу Авогадро:
- Запишем уравнение Менделеева-Клапейрона для двух состояний с p=const и m=const, т.к. процесс перехода из одного состояния в другое изобарический:
(1)
(2) Разделим (1) на (2), получаем:
— уравнение изобатического процесса.
-
- Для определения температуры применим уравнение Менделеева-Клапейрона. Из графика: для состояния А —
, для состояния В —
.
, из первого уравнения —
, тогда —
.
- Давление смеси
. Запишем уравнение изотермического процесса:
,
— давление газов после расширения.
- Для решения задачи запишем первое начало термодинамики. Для изобарического процесса:
. Для изохорического процесса:
. Т.к.
Ср – удельная теплоемкость при постоянном давлении, СV – теплоемкость при постоянном объеме. Т.к. ,
, т.е.
— первое начало термодинамики. По условию Q=А, т.е. дельта U=0, значит, процесс протекает при постоянной температуре (процесс изотермический).
- А1 – численно равна площади фигуры А1В ,
. Т.к.
меньше остальных площадей, то работа А1 минимальна.
- Q=5 Дж, А/ =8 Дж – работу совершают внешние силы. Первое начало термодинамики запишем так:
.
10.
Сила, перемещающая тело, совершает работу. Работа – это разность энергии тела в начале процесса и в его конце. А мощность – это работа за одну секунду. Коэффициент полезного действия (КПД) – это дробное число. Максимальный КПД равен единице, однако, часто, КПД меньше единицы.
Работы силы, формула
Сила, приложенная к телу и перемещающая его, совершает работу (рис. 1).
Рис. 1. Сила перемещает тело и совершает работу
Работа силы — это скалярное произведение вектора силы на вектор перемещения.
Работу, совершаемую силой, можно посчитать, используя векторный или скалярный вид записи такой формулы:
Векторный вид записи
[ large boxed{ A = left( vec{F} , vec{S} right) }]
Для решения задач правую часть этой формулы удобно записывать в скалярном виде:
[ large boxed{ A = left| vec{F} right| cdot left| vec{S} right| cdot cos(alpha) }]
( F left( H right) ) – сила, перемещающая тело;
( S left( text{м} right) ) – перемещение тела под действием силы;
( alpha ) – угол между вектором силы и вектором перемещения тела;
Работу обозначают символом (A) и измеряют в Джоулях. Работа – это скалярная величина.
В случае, когда сила постоянная, формула позволяет рассчитать работу, совершенную силой за полное время ее действия.
Если сила изменяется со временем, то в каждый конкретный момент времени будем получать мгновенную работу. Эти, мгновенные значения для разных моментов времени будут различаться.
Рассмотрим несколько случаев, следующих из формулы:
- Когда угол между силой и перемещением острый, работа силы положительная;
- А если угол тупой — работа отрицательная, так как косинус тупого угла отрицательный;
- Если же угол прямой – работа равна нулю. Сила, перпендикулярная перемещению, работу не совершает!
Работа — разность кинетической энергии
Работу можно рассчитать еще одним способом — измеряя кинетическую энергию тела в начале и в конце процесса движения. Рассмотрим такой пример. Пусть автомобиль, движется по горизонтальной прямой и, при этом увеличивает свою скорость (рис. 2). Масса автомобиля 1000 кг. В начале его скорость равнялась 1 м/с. После разгона скорость автомобиля равна 10 метрам в секунду. Найдем работу, которую пришлось проделать, чтобы ускорить этот автомобиль.
Рис. 2. Автомобиль движется прямолинейно и увеличивает свою скорость
Для этого посчитаем энергию движения автомобиля в начале и в конце разгона.
( E_{k1} left(text{Дж} right) ) – начальная кинетическая энергия машины;
( E_{k2} left(text{Дж} right) ) – конечная кинетическая энергия машины;
( m left( text{кг}right) ) – масса автомобиля;
( displaystyle v left( frac{text{м}}{c}right) ) – скорость, с которой машина движется.
Кинетическую энергию будем вычислять, используя формулу:
[ large E_{k} = m cdot frac{v^{2}}{2} ]
[ large E_{k1} = 1000 cdot frac{1^{2}}{2} = 500 left(text{Дж} right) ]
[ large E_{k2} = 1000 cdot frac{10^{2}}{2} = 50000 left(text{Дж} right) ]
Теперь найдем разницу кинетической энергии в конце и вначале разгона.
[ large boxed{ A = Delta E_{k} }]
[ large Delta E_{k} = E_{k2} — E_{k1} ]
[ large Delta E_{k} = 50000 – 500 = 49500 left(text{Дж} right) ]
Значит, работа, которую потребовалось совершить, чтобы разогнать машину массой 1000 кг от скорости 1 м/с до скорости 10 м/с, равняется 49500 Джоулям.
Примечание: Работа – это разность энергии в конце процесса и в его начале. Можно находить разность кинетической энергии, а можно — разность энергии потенциальной.
[ large boxed{ A = Delta E }]
Работа силы тяжести — разность потенциальной энергии
Рассмотрим теперь следующий пример. Яблоко массой 0,2 кг упало на садовый стол с ветки, находящейся на высоте 3 метра от поверхности земли. Столешница располагается на высоте 1 метр от поверхности (рис. 3). Найдем работу силы тяжести в этом процессе.
Рис. 3. На рисунке указано начальное 1 положение тела (яблока) и его конечное 2 положение, отмечены высоты для подсчета работы по вертикальному перемещению тела
Посчитаем потенциальную энергию яблока до его падения и энергию яблока на столешнице.
( E_{p1} left(text{Дж} right) ) – начальная потенциальная энергия яблока;
( E_{p2} left(text{Дж} right) ) – конечная потенциальная энергия яблока;
Примечание: Работу можно рассчитать через разность потенциальной энергии тела.
Потенциальную энергию будем вычислять, используя формулу:
[ large E_{p} = m cdot g cdot h]
( m left( text{кг}right) ) – масса яблока;
Величина ( displaystyle g approx 10 left(frac{text{м}}{c^{2}} right) ) – ускорение свободного падения.
( h left( text{м}right) ) – высота, на которой находится яблоко относительно поверхности земли.
Начальная высота яблока над поверхностью земли равна 3 метрам
[ large E_{p2} = 0,2 cdot 10 cdot 3 = 6 left(text{Дж} right) ]
Потенциальная энергия яблока на столе
[ large E_{p1} = 0,2 cdot 10 cdot 1 = 2 left(text{Дж} right) ]
Теперь найдем разницу потенциальной энергии яблока в конце падения и перед его началом.
[ large Delta E_{p} = E_{p2} — E_{p1} ]
[ large Delta E_{p} = 2 – 6 = — 4 left(text{Дж} right) ]
Важно помнить: Когда тело падает на землю, его потенциальная энергия уменьшается. Сила тяжести при этом совершает положительную работу!
Чтобы работа получилась положительной, в правой части формулы перед ( Delta E_{p}) дополнительно допишем знак «минус».
[ large boxed{ A = — Delta E_{p} }]
Значит, работа, которую потребовалось совершить силе тяжести, чтобы яблоко массой 0,2 кг упало с высоты 3 м на высоту 1 метр, равняется 4 Джоулям.
Примечания:
- Если тело падает на землю, работа силы тяжести положительна;
- Когда мы поднимаем тело над землей, мы совершаем работу против силы тяжести. Наша работа при этом положительна, а работа силы тяжести будет отрицательной;
- Сила тяжести относится к консервативным силам. Для консервативных сил перед разностью потенциальной энергии мы дописываем знак «минус»;
- Работа силы тяжести не зависит от траектории, по которой двигалось тело;
- Работа для силы (displaystyle F_{text{тяж}}) зависит только от разности высот, в которых тело находилось в конечный и начальный моменты времени.
Рисунок 4 иллюстрирует факт, что для силы (displaystyle F_{text{тяж}}) работа зависит только от разности высот и не зависит от траектории, по которой тело двигалось.
Рис. 4. Разность высот между начальным и конечным положением тела во всех случаях на рисунке одинакова, поэтому, работа силы тяжести для представленных случаев будет одинаковой
Мощность
В механике мощность часто обозначают символами N или P и измеряют в Ваттах в честь шотландского изобретателя Джеймса Уатта.
Примечание: Символ (vec{N}) используется для обозначения силы реакции опоры — она измеряется в Ньютонах и является векторной величиной. Чтобы не возникло путаницы, мощность вместо N будем обозначать символом P. Символ P – первая буква в английском слове power – мощность.
Мощность – это работа, совершенная за одну секунду (энергия, затраченная за 1 сек).
Расчет работы осуществляем, используя любую из формул:
[ large A = Delta E_{k} ]
[ large A = Delta E_{p} ]
[ large A = F cdot S cdot cos(alpha) ]
Разделив эту работу на время, в течение которого она совершалась, получим мощность.
[ large boxed{ P = frac{A}{Delta t} }]
Если работа совершалась равными частями за одинаковые интервалы времени – мощность будет постоянной величиной.
Мощность переменная, когда в некоторые интервалы времени совершалось больше работы.
Еще одна формула для расчета мощности
Есть еще один способ расчета мощности, когда сила перемещает тело и при этом скорость тела не меняется:
[ large P = left( vec{F} , vec{v} right) ]
Формулу можно записать в скалярном виде:
[ large P = left| vec{F} right| cdot left| vec{v} right| cdot cos(alpha) ]
( F left( H right) ) – сила, перемещающая тело;
( displaystyle v left( frac{text{м}}{c} right) ) – скорость тела;
( alpha ) – угол между вектором силы и вектором скорости тела;
Когда векторы (vec{F}) и (vec{v}) параллельны, запись формулы упрощается:
[ large boxed{ P = F cdot v }]
Примечание: Такую формулу для расчета мощности можно получить из выражения для работы силы, разделив обе части этого выражения на время, в течение которого работа совершалась (а если точнее, найдя производную обеих частей уравнения).
КПД
КПД – коэффициент полезного действия. Обычно обозначают греческим символом (eta) «эта». Единиц измерения не имеет, выражается либо десятичной дробью, либо в процентах.
Примечания:
- Процент – это дробь, у которой в знаменателе число 100.
- КПД — это либо правильная дробь, или дробь, равная единице.
Вычисляют коэффициент (eta) для какого-либо устройства, механизма или процесса.
[ large boxed{ eta = frac{ A_{text{полезная}}}{ A_{text{вся}}} }]
(eta) – КПД;
( large A_{text{полезная}} left(text{Дж} right)) – полезная работа;
(large A_{text{вся}} left(text{Дж} right)) – вся затраченная для выполнения работы энергия;
Примечание: КПД часто меньше единицы, так как всегда есть потери энергии. Коэффициент полезного действия не может быть больше единицы, так как это противоречит закону сохранения энергии.
[ large boxed{ eta leq 1 }]
Величина (eta) является дробной величиной. Если числитель и знаменатель дроби разделить на одно и то же число, полученная дробь будет равна исходной. Используя этот факт, можно вычислять КПД, используя мощности:
[ large boxed{ eta = frac{ P_{text{полезная}}}{ P_{text{вся затраченная}}} }]
Выводы
- Сила, приложенная к телу и перемещающая его, совершает работу;
- Когда угол между силой и перемещением острый, работа силы положительная, а если угол тупой — работа отрицательная; Если же угол прямой – работа равна нулю. Сила, перпендикулярная перемещению, работу не совершает!
- Работу можно вычислить, измеряя кинетическую энергию тела в начале и в конце его движения;
- Вычислить работу можно через разность потенциальной энергии тела в начальной и в конечной высотах над землей;
- Когда тело падает на землю, его потенциальная энергия уменьшается. Сила тяжести при этом совершает положительную работу!
- Мы совершаем работу против силы тяжести, когда поднимаем тело над землей. При этом наша работа положительная, а работа силы тяжести — отрицательная;
- Сила тяжести — это консервативная сила. Поэтому, работа силы (displaystyle F_{text{тяж}}) не зависит от траектории, по которой двигалось тело, а зависит только от разности высот, в которых тело находилось в конечный и начальный моменты времени;
- Мощность – это работа, совершенная за одну секунду, или затраченная за 1 сек. энергия;
- Коэффициент полезного действия обозначают греческим символом (eta) «эта», единиц измерения не имеет, выражается либо десятичной дробью, либо в процентах;
- КПД — это либо правильная дробь, или дробь, равная единице.
- Можно вычислять КПД, подставляя в формулу работу, или мощности
Элементарная работа термодинамической
системы над внешней средой может быть
вычислена так:
-
,
где
—
нормаль элементарной (бесконечно малой)
площадки, P — давление
и dV — бесконечно малое приращение
объёма.
Работа в термодинамическом процессе
,
таким образом, выражается так:
-
.
Величина работы зависит от пути, по
которому термодинамическая система
переходит из состояния 1 в состояние 2,
и не является функцией
состояния системы. Такие величины
называют функциями
процесса.
Работа,
совершенная идеальным газом в
изотермическом процессе, равна
,
где
—
число частиц газа,
—
температура,
и
—
объём газа в начале и конце процесса,
—
постоянная
Больцмана .
В твёрдом теле и большинстве жидкостей
изотермические процессы очень мало
изменяют объём тела, если только не
происходит фазовый
переход.
Первый закон термодинамики для
изотермического процесса записывается
в виде:
-
Теплота. Теплоёмкость. Общее выражение для теплоёмкости. Теплоёмкость иг в изопроцессах.
ТЕПЛОТА, кинетическая часть
внутренней энергии вещества, определяемая
интенсивным хаотическим движением
молекул и атомов, из которых это вещество
состоит. Мерой интенсивности движения
молекул является температура. Количество
теплоты, которым обладает тело при
данной температуре, зависит от его
массы; например, при одной и той же
температуре в большой чашке с водой
заключается больше теплоты, чем в
маленькой, а в ведре с холодной водой
его может быть больше, чем в чашке с
горячей водой (хотя температура воды в
ведре и ниже).
Теплоёмкость тела (обозначается
C) — физическая величина,
определяющая отношение бесконечно
малого количества теплоты ΔQ,
полученного телом, к соответствующему
приращению его температуры ΔT:
Единица измерения теплоёмкости в системе
СИ — Дж/К.
Удельной теплоемкостью называется
количество теплоты, которое необходимо
для нагревания единичного количества
вещества. Количество вещества может
быть измерено в килограммах, кубических
метрах и молях. В зависимости от того,
к какой количественной единице относится
теплоемкость, различают массовую,
объемную и мольную теплоемкость.
Массовая теплоемкость (С) – это количество
теплоты, которую необходимо подвести
к единице массы тела (обычно 1 кг), чтобы
нагреть его на 1 С, измеряется в джоулях
на килограмм на кельвин (Дж/кг К).
Объемная теплоемкость (С′) – это
количество теплоты, которую необходимо
подвести к 1 м3 вещества, чтобы нагреть
его на 1 С, измеряется в джоулях на
кубический метр на кельвин (Дж/м3·К).
Мольная теплоемкость (Сμ)
– это количество теплоты, которую
необходимо подвести к 1 молю вещества,
чтобы нагреть его на 1 С, измеряется в
джоулях на моль на кельвин (Дж/моль·К).
Если же говорить про теплоёмкость
произвольной системы, то ее уместно
формулировать в терминах термодинамических
потенциалов — теплоёмкость есть
отношение малого приращения количества
теплоты Q к малому изменению
температуры T:
Понятие теплоёмкости определено как
для веществ в различных агрегатных
состояниях (твёрдых тел, жидкостей,
газов), так и для ансамблей частиц и
квазичастиц (в физике металлов, например,
говорят о теплоёмкости электронного
газа). Если речь идёт не о каком-либо
теле, а о некотором веществе как таковом,
то различают удельную теплоёмкость —
теплоёмкость единицы массы этого
вещества и молярную — теплоёмкость
одного моля его.
Для примера, в молекулярно-кинетической
теории газов показывается, что молярная
теплоёмкость идеального газа с i
степенями свободы при постоянном объеме
равна:
R = 8.31 Дж/(моль К) —
универсальная газовая постоянная.
А при постоянном давлении
Удельные теплоёмкости многих веществ
приведены в справочниках обычно для
процесса при постоянном давлении. К
примеру, удельная теплоемкость жидкой
воды при нормальных условиях — 4200 Дж/(кг
К). Льда — 2100 Дж/(кг К)
Теплоёмкость идеального газа
Теплоемкость идеального газа — это
отношение тепла, сообщенного газу, к
изменению температуры δТ,
которое при этом произошло.
Теплоемкость идеального газа в
изопроцессах
Адиабатический
В адиабатическом процессе теплообмена
с окружающей средой не происходит, т.е.
δQ=0. Следовательно,
теплоемкость идеального газа в
адиабатическом процессе также равна
нулю: Садиаб=0.
Изотермический
В изотермическом процессе постоянна
температура, т.е. dT = 0.
Следовательно, теплоемкость идеального
газа стремится к бесконечности:
Изохорический
В изохорическом процессе постоянен
объем, т.е. δV = 0. Элементарная
работа газа равна произведению изменения
объема на давление, при котором происходит
изменение (δA = δVP).
Первое Начало Термодинамики для
изохорического процесса имеет вид:
dU = δQ = CVΔT
А для идеального газа
Таким образом,
где i — число степеней свободы частиц
газа.
Изобарический
В изобарическом процессе (P
= const):
δQ = dU + PdV
= νCVΔT + νRΔT
= ν(CV + R)ΔT
= νCPΔT
CP=δQ/νΔT=CV+R=(1+i/2)*R
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Работа в термодинамике.
В термодинамике работа — это взаимодействие системы с внешними объектами, в результате чего изменяются параметры системы
Рассмотрим цилиндр с идеальным газом, который находится под подвижным поршнем. Пусть внешняя сила, действующая на поршень, перемещает его из состояния 1 в состояние 2
Работа силы равна . Со стороны газа на поршень действуют сила, равная произведению давлению газа на поршень и площадь сечения поршня
. Подставив вторую формулу в первую, получим
.
Знак «-» в формуле означает, что при уменьшении объема (как в нашем примере, ) работа внешних сил положительная. И наоборот, когда газ расширяется, работа внешней силы, удерживающей поршень, отрицательная.
Графическое определение работы
Строим график процесса p(V). Определяем на графике точки, которые соответствуют состоянию системы в 1 и 2 состояниях. Площадь фигуры под графиком — есть термодинамическая работа самой системы. Внешняя работа над системой равна работе системы, но с противоположным знаком
Работа термодинамической системы при изобарном процессе
Работа термодинамической системы при изотермическом процессе
При изохорном процессе объем не изменяется, работа равна нулю A=0.







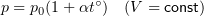

























 (1)
(1)  (2) Разделим (1) на (2), получаем:
(2) Разделим (1) на (2), получаем:
 — уравнение изобатического процесса.
— уравнение изобатического процесса.
 , для состояния В —
, для состояния В — .
.  , из первого уравнения —
, из первого уравнения — , тогда —
, тогда — .
.

 — давление газов после расширения.
— давление газов после расширения.
 . Т.к.
. Т.к.  Ср – удельная теплоемкость при постоянном давлении, СV – теплоемкость при постоянном объеме. Т.к. ,
Ср – удельная теплоемкость при постоянном давлении, СV – теплоемкость при постоянном объеме. Т.к. ,

 , т.е.
, т.е. 
 — первое начало термодинамики. По условию Q=А, т.е. дельта U=0, значит, процесс протекает при постоянной температуре (процесс изотермический).
— первое начало термодинамики. По условию Q=А, т.е. дельта U=0, значит, процесс протекает при постоянной температуре (процесс изотермический). . Т.к.
. Т.к. меньше остальных площадей, то работа А1 минимальна.
меньше остальных площадей, то работа А1 минимальна.

 .
.



