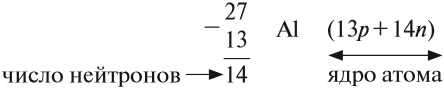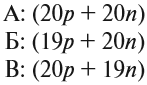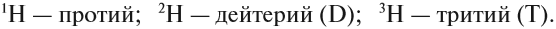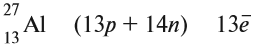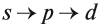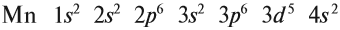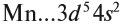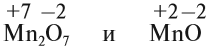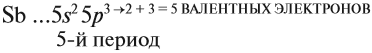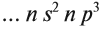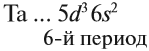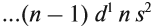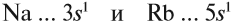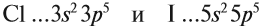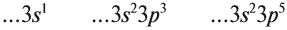Загрузить PDF
Загрузить PDF
Электронная конфигурация атома — это численное представление его электронных орбиталей. Электронные орбитали — это области различной формы, расположенные вокруг атомного ядра, в которых математически вероятно нахождение электрона. Электронная конфигурация помогает быстро и с легкостью сказать читателю, сколько электронных орбиталей есть у атома, а также определить количество электронов, находящихся на каждой орбитали. Прочитав эту статью, вы освоите метод составления электронных конфигураций.
-
1
Найдите атомный номер вашего атома. Каждый атом имеет определенное число электронов, связанных с ним. Найдите символ вашего атома в таблице Менделеева. Атомный номер — это целое положительное число, начинающееся от 1 (у водорода) и возрастающее на единицу у каждого последующего атома. Атомный номер — это число протонов в атоме, и, следовательно, это еще и число электронов атома с нулевым зарядом.
-
2
Определите заряд атома. Нейтральные атомы будут иметь столько же электронов, сколько показано в таблице Менделеева. Однако заряженные атомы будут иметь большее или меньшее число электронов — в зависимости от величины их заряда. Если вы работаете с заряженным атомом, добавляйте или вычитайте электроны следующим образом: добавляйте один электрон на каждый отрицательный заряд и вычитайте один на каждый положительный.
- Например, атом натрия с зарядом -1 будет иметь дополнительный электрон в добавок к своему базовому атомному числу 11. Иначе говоря, в сумме у атома будет 12 электронов.
- Если речь идет об атоме натрия с зарядом +1, от базового атомного числа 11 нужно отнять один электрон. Таким образом, у атома будет 10 электронов.
-
3
Запомните базовый список орбиталей. По мере того, как у атома увеличивается число электронов, они заполняют различные подуровни электронной оболочки атома согласно определенной последовательности. Каждый подуровень электронной оболочки, будучи заполненным, содержит четное число электронов. Имеются следующие подуровни:
- s-подуровень (любое число в электронной конфигурации, которое стоит перед буквой «s») содержит единственную орбиталь, и, согласно Принципу Паули, одна орбиталь может содержать максимум 2 электрона, следовательно, на каждом s-подуровне электронной оболочки может находиться 2 электрона.
- p-подуровень содержит 3 орбитали, и поэтому может содержать максимум 6 электронов.
- d-подуровень содержит 5 орбиталей, поэтому в нем может быть до 10 электронов.
- f-подуровень содержит 7 орбиталей, поэтому в нем может быть до 14 электронов.
- g-, h-, i- и k-подуровни являются теоретическими. Атомы, содержащие электроны в этих орбиталях, неизвестны. g-подуровень содержит 9 орбиталей, поэтому теоретически в нем может быть 18 электронов. В h-подуровне может быть 11 орбиталей и максимум 22 электрона; в i-подуровне —13 орбиталей и максимум 26 электронов; в k-подуровне — 15 орбиталей и максимум 30 электронов.
- Запомните порядок орбиталей с помощью мнемонического приема:[1]
Sober Physicists Don’t Find Giraffes Hiding In Kitchens (трезвые физики не находят жирафов, скрывающихся на кухнях).
-
4
Разберитесь в записи электронной конфигурации. Электронные конфигурации записываются для того, чтобы четко отразить количество электронов на каждой орбитали. Орбитали записываются последовательно, причем количество атомов в каждой орбитали записывается как верхний индекс справа от названия орбитали. Завершенная электронная конфигурация имеет вид последовательности обозначений подуровней и верхних индексов.
- Вот, например, простейшая электронная конфигурация: 1s2 2s2 2p6. Эта конфигурация показывает, что на подуровне 1s имеется два электрона, два электрона — на подуровне 2s и шесть электронов на подуровне 2p. 2 + 2 + 6 = 10 электронов в сумме. Это электронная конфигурация нейтрального атома неона (атомный номер неона — 10).
-
5
Запомните порядок орбиталей. Имейте в виду, что электронные орбитали нумеруются в порядке возрастания номера электронной оболочки, но располагаются по возрастанию энергии. Например, заполненная орбиталь 4s2 имеет меньшую энергию (или менее подвижна), чем частично заполненная или заполненная 3d10, поэтому сначала записывается орбиталь 4s. Как только вы будете знать порядок орбиталей, вы сможете с легкостью заполнять их в соответствии с количеством электронов в атоме. Порядок заполнения орбиталей следующий: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p.
- Электронная конфигурация атома, в котором заполнены все орбитали, будет иметь следующий вид: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d107p6
- Обратите внимание, что приведенная выше запись, когда заполнены все орбитали, является электронной конфигурацией элемента Uuo (унуноктия) 118, атома периодической системы с самым большим номером. Поэтому данная электронная конфигурация содержит все известные в наше время электронные подуровни нейтрально заряженного атома.
-
6
Заполняйте орбитали согласно количеству электронов в вашем атоме. Например, если мы хотим записать электронную конфигурацию нейтрального атома кальция, мы должны начать с поиска его атомного номера в таблице Менделеева. Его атомный номер — 20, поэтому мы напишем конфигурацию атома с 20 электронами согласно приведенному выше порядку.
- Заполняйте орбитали согласно приведенному выше порядку, пока не достигнете двадцатого электрона. На первой 1s орбитали будут находится два электрона, на 2s орбитали — также два, на 2p — шесть, на 3s — два, на 3p — 6, и на 4s — 2 (2 + 2 + 6 +2 +6 + 2 = 20.) Иными словами, электронная конфигурация кальция имеет вид: 1s2 2s2 2p6 3s2 3p6 4s2.
- Обратите внимание: орбитали располагаются в порядке возрастания энергии. Например, когда вы уже готовы перейти на 4-й энергетический уровень, то сначала записывайте 4s орбиталь, а затем 3d. После четвертого энергетического уровня вы переходите на пятый, на котором повторяется такой же порядок. Это происходит только после третьего энергетического уровня.
-
7
Используйте таблицу Менделеева как визуальную подсказку. Вы, вероятно, уже заметили, что форма периодической системы соответствует порядку электронных подуровней в электронных конфигурациях. Например, атомы во второй колонке слева всегда заканчиваются на «s2«, а атомы на правом краю тонкой средней части оканчиваются на «d10» и т.д. Используйте периодическую систему как визуальное руководство к написанию конфигураций — как порядок, согласно которому вы добавляете к орбиталям соответствует вашему положению в таблице. Смотрите ниже:
- В частности, две самые левые колонки содержат атомы, чьи электронные конфигурации заканчиваются s-орбиталями, в правом блоке таблицы представлены атомы, чьи конфигурации заканчиваются p-орбиталями, а в нижней части атомы заканчиваются f-орбиталями.
- Например, когда вы записываете электронную конфигурацию хлора, размышляйте следующим образом: «Этот атом расположен в третьем ряду (или «периоде») таблицы Менделеева. Также он располагается в пятой группе орбитального блока p периодической системы. Поэтому, его электронная конфигурация будет заканчиваться на …3p5
- Обратите внимание: элементы в области орбиталей d и f таблицы характеризуются энергетическими уровнями, которые не соответствуют периоду, в котором они расположены. Например, первый ряд блока элементов с d-орбиталями соответствует 3d орбиталям, хотя и располагается в 4 периоде, а первый ряд элементов с f-орбиталями соответствует орбитали 4f, несмотря на то, что он находится в 6 периоде.
-
8
Выучите сокращения написания длинных электронных конфигураций. Атомы на правом краю периодической системы называются благородными газами. Эти элементы химически очень устойчивы. Чтобы сократить процесс написания длинных электронных конфигураций, просто записывайте в квадратных скобках химический символ ближайшего благородного газа с меньшим по сравнению с вашим атомом числом электронов, а затем продолжайте писать электронную конфигурацию последующих орбитальных уровней. Смотрите ниже:
- Чтобы понять эту концепцию, полезно будет написать пример конфигурации. Давайте напишем конфигурацию цинка (атомный номер 30), используя сокращение, включающее благородный газ. Полная конфигурация цинка выглядит так: 1s2 2s2 2p6 3s2 3p6 4s2 3d10. Однако мы видим, что 1s2 2s2 2p6 3s2 3p6 — это электронная конфигурация аргона, благородного газа. Просто замените часть записи электронной конфигурации цинка химическим символом аргона в квадратных скобках ([Ar].)
- Итак, электронная конфигурация цинка, записанная в сокращенном виде, имеет вид: [Ar]4s2 3d10.
- Учтите, если вы пишете электронную конфигурацию благородного газа, скажем, аргона, писать [Ar] нельзя! Нужно использовать сокращение благородного газа, стоящего перед этим элементом; для аргона это будет неон ([Ne]).
Реклама
-
1
Освойте периодическую таблицу ADOMAH. Данный метод записи электронной конфигурации не требует запоминания, однако требует наличия переделанной периодической таблицы, поскольку в традиционной таблице Менделеева, начиная с четвертого периода, номер периода не соответствует электронной оболочке. Найдите периодическую таблицу ADOMAH — особый тип периодической таблицы, разработанный ученым Валерием Циммерманом. Ее легко найти посредством короткого поиска в интернете.[2]
- В периодической таблице ADOMAH горизонтальные ряды представляют группы элементов, такие как галогены, инертные газы, щелочные металлы, щелочноземельные металлы и т.д. Вертикальные колонки соответствуют электронным уровням, а так называемые «каскады» (диагональные линии, соединяющие блоки s,p,d и f) соответствуют периодам.
- Гелий перемещен к водороду, поскольку оба этих элемента характеризуются орбиталью 1s. Блоки периодов (s,p,d и f) показаны с правой стороны, а номера уровней приведены в основании. Элементы представлены в прямоугольниках, пронумерованных от 1 до 120. Эти номера являются обычными атомными номерами, которые представляют общее количество электронов в нейтральном атоме.
-
2
Найдите ваш атом в таблице ADOMAH. Чтобы записать электронную конфигурацию элемента, найдите его символ в периодической таблице ADOMAH и вычеркните все элементы с большим атомным номером. Например, если вам нужно записать электронную конфигурацию эрбия (68), вычеркните все элементы от 69 до 120.
- Обратите внимание на номера от 1 до 8 в основании таблицы. Это номера электронных уровней, или номера колонок. Игнорируйте колонки, которые содержат только вычеркнутые элементы. Для эрбия остаются колонки с номерами 1,2,3,4,5 и 6.
-
3
Посчитайте орбитальные подуровни до вашего элемента. Смотря на символы блоков, приведенные справа от таблицы (s, p, d, and f), и на номера колонок, показанные в основании, игнорируйте диагональные линии между блоками и разбейте колонки на блоки-колонки, перечислив их по порядку снизу вверх. И снова игнорируйте блоки, в которых вычеркнуты все элементы. Запишите блоки-колонки, начиная от номера колонки, за которым следует символ блока, таким образом: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 6s (для эрбия).
- Обратите внимание: Приведенная выше электронная конфигурация Er записана в порядке возрастания номера электронного подуровня. Ее можно также записать в порядке заполнения орбиталей. Для этого следуйте по каскадам снизу вверх, а не по колонкам, когда вы записываете блоки-колонки: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f12.
-
4
Посчитайте электроны для каждого электронного подуровня. Подсчитайте элементы, в каждом блоке-колонке которые не были вычеркнуты, прикрепляя по одному электрону от каждого элемента, и запишите их количество рядом с символом блока для каждого блока-колонки таким образом: 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f12 5s2 5p6 6s2. В нашем примере это электронная конфигурация эрбия.
-
5
Учитывайте неправильные электронные конфигурации. Существует восемнадцать типичных исключений, относящихся к электронным конфигурациям атомов в состоянии с наименьшей энергией, также называемом основным энергетическим состоянием. Они не подчиняются общему правилу только по последним двум-трем положениям, занимаемым электронами. При этом действительная электронная конфигурация предполагает нахождение электронов в состоянии с более низкой энергией в сравнении со стандартной конфигурацией атома. К атомам-исключениям относятся:
- Cr (…, 3d5, 4s1); Cu (…, 3d10, 4s1); Nb (…, 4d4, 5s1); Mo (…, 4d5, 5s1); Ru (…, 4d7, 5s1); Rh (…, 4d8, 5s1); Pd (…, 4d10, 5s0); Ag (…, 4d10, 5s1); La (…, 5d1, 6s2); Ce (…, 4f1, 5d1, 6s2); Gd (…, 4f7, 5d1, 6s2); Au (…, 5d10, 6s1); Ac (…, 6d1, 7s2); Th (…, 6d2, 7s2); Pa (…, 5f2, 6d1, 7s2); U (…, 5f3, 6d1, 7s2); Np (…, 5f4, 6d1, 7s2) и Cm (…, 5f7, 6d1, 7s2).
Реклама
Советы
- Чтобы найти атомный номер атома, когда он записан в форме электронной конфигурации, просто сложите все числа, которые идут за буквами (s, p, d, и f). Это работает только для нейтральных атомов, если вы имеете дело с ионом, то ничего не получится — вам придется добавить или вычесть количество дополнительных или потерянных электронов.
- Число, идущее за буквой — это верхний индекс, не сделайте ошибку в контрольной.
- «Стабильности полузаполненного» подуровня не существует. Это упрощение. Любая стабильность, которая относится к «наполовину заполненным» подуровням, имеет место из-за того, что каждая орбиталь занята одним электроном, поэтому минимизируется отталкивание между электронами.
- Каждый атом стремится к стабильному состоянию, а самые стабильные конфигурации имеют заполненные подуровни s и p (s2 и p6). Такая конфигурация есть у благородных газов, поэтому они редко вступают в реакции и в таблице Менделеева расположены справа. Поэтому, если конфигурация заканчивается на 3p4, то для достижения стабильного состояния ей необходимо два электрона (чтобы потерять шесть, включая электроны s-подуровня, потребуется больше энергии, поэтому потерять четыре легче). А если конфигурация оканчивается на 4d3, то для достижения стабильного состояния ей необходимо потерять три электрона. Кроме того, полузаполненные подуровни (s1, p3, d5..) являются более стабильными, чем, например, p4 или p2; однако s2 и p6 будут еще более устойчивыми.
- Когда вы имеете дело с ионом, это значит, что количество протонов не равно количеству электронов. Заряд атома в этом случае будет изображен сверху справа (как правило) от химического символа. Поэтому атом сурьмы с зарядом +2 имеет электронную конфигурацию 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p1. Обратите внимание, что 5p3 изменилось на 5p1. Будьте внимательны, когда конфигурация нейтрального атома заканчивается на подуровни, отличные от s и p. Когда вы забираете электроны, вы можете забрать их только с валентных орбиталей (s и p орбиталей). Поэтому, если конфигурация заканчивается на 4s2 3d7 и атом получает заряд +2, то конфигурация будет заканчиваться 4s0 3d7. Обратите внимание, что 3d7 не меняется, вместо этого теряются электроны s-орбитали.
- Существуют условия, когда электрон вынужден «перейти на более высокий энергетический уровень». Когда подуровню не хватает одного электрона до половинной или полной заполненности, заберите один электрон из ближайшего s или p- подуровня и переместите его на тот подуровень, которому необходим электрон.
- Имеется два варианта записи электронной конфигурации. Их можно записывать в порядке возрастания номеров энергетических уровней или в порядке заполнения электронных орбиталей, как было показано выше для эрбия.
- Также вы можете записывать электронную конфигурацию элемента, записав лишь валентную конфигурацию, которая представляет собой последний s и p подуровень. Таким образом, валентная конфигурация сурьмы будет иметь вид 5s2 5p3.
- Ионы не то же самое. С ними гораздо сложнее. Пропустите два уровня и действуйте по той же схеме в зависимости от того, где вы начали, и от того, насколько велико количество электронов.
Реклама
Об этой статье
Эту страницу просматривали 482 905 раз.
Была ли эта статья полезной?
Электронная конфигурация атома
Электронная конфигурация атома — это формула, показывающая расположение электронов в атоме по уровням и
подуровням. После изучения статьи Вы узнаете, где и как располагаются электроны, познакомитесь с квантовыми числами и
сможете построить электронную конфигурацию атома по его номеру, в конце статьи приведена таблица элементов.
Для чего изучать электронную конфигурацию элементов?
Атомы как конструктор: есть определённое количество деталей, они отличаются друг от друга, но две детали
одного типа абсолютно одинаковы. Но этот конструктор куда интереснее, чем пластмассовый и вот почему.
Конфигурация меняется в зависимости от того, кто есть рядом. Например, кислород рядом с водородом может
превратиться в воду, рядом с натрием в газ, а находясь рядом с железом вовсе превращает его в ржавчину.
Что бы ответить на вопрос почему так происходит и предугадать поведение атома рядом с другим необходимо
изучить электронную конфигурацию, о чём и пойдёт речь ниже.
Сколько электронов в атоме?
Атом состоит из ядра и вращающихся вокруг него электронов, ядро состоит из протонов и нейтронов. В нейтральном
состоянии у каждого атома количество электронов равно количеству протонов в его ядре. Количество
протонов обозначили порядковым номером элемента, например, сера, имеет 16 протонов — 16й элемент периодической
системы. Золото имеет 79 протонов — 79й элемент таблицы Менделеева. Соответственно, в сере в нейтральном
состоянии 16 электронов, а в золоте 79 электронов.
Где искать электрон?
Наблюдая поведение электрона были выведены определённые закономерности, они описываются
квантовыми числами, всего их четыре:
- Главное квантовое число
- Орбитальное квантовое число
- Магнитное квантовое число
- Спиновое квантовое число
Орбиталь
Далее, вместо слова орбита, мы будем использовать термин «орбиталь», орбиталь — это волновая функция электрона,
грубо — это область, в которой электрон проводит 90% времени.
N — уровень
L — оболочка
Ml — номер орбитали
Ms — первый или второй электрон на орбитали
Орбитальное квантовое число l
В результате исследования электронного облака, обнаружили, что в зависимости от уровня энергии,
облако принимает четыре основных формы: шар, гантели и другие две, более сложные.
В порядке возрастания энергии, эти формы называются s-,p-,d- и f-оболочкой.
На каждой из таких оболочек может располагаться 1 (на s), 3 (на p), 5 (на d) и 7 (на f)
орбиталей. Орбитальное квантовое число — это оболочка, на которой находятся
орбитали. Орбитальное квантовое число для s,p,d и f-орбиталей соответственно
принимает значения 0,1,2 или 3.
На s-оболочке одна орбиталь (L=0) — два электрона
На p-оболочке три орбитали (L=1) — шесть электронов
На d-оболочке пять орбиталей (L=2) — десять электронов
На f-оболочке семь орбиталей (L=3) — четырнадцать электронов
Магнитное квантовое число ml
На p-оболочке находится три орбитали, они обозначаются цифрами
от -L, до +L, то есть, для p-оболочки (L=1) существуют орбитали «-1», «0» и «1».
Магнитное квантовое число обозначается буквой ml.
Внутри оболочки электронам легче
располагаться на разных орбиталях, поэтому первые электроны заполняют по одному на каждую
орбиталь, а затем уже к каждому присоединяется его пара.
Рассмотрим d-оболочку:
d-оболочке соответствует значение L=2, то есть пять орбиталей (-2,-1,0,1 и 2), первые пять
электронов заполняют оболочку принимая значения Ml=-2,Ml=-1,Ml=0,
Ml=1,Ml=2.
Спиновое квантовое число ms
Спин — это направление вращения электрона вокруг своей оси, направлений два, поэтому спиновое квантовое число
имеет два значения: +1/2 и -1/2. На одном энергетическом подуровне могут находиться два электрона только с
противоположными спинами. Спиновое квантовое число обозначается ms
Главное квантовое число n
Главное квантовое число — это уровень энергии, на данный момент известны семь энергетических уровней,
каждый обозначается арабской цифрой: 1,2,3,…7. Количество оболочек на каждом уровне равно номеру уровня:
на первом уровне одна оболочка, на втором две и т.д.
Номер электрона
Итак, любой электрон можно описать четырьмя квантовыми числами, комбинация из этих чисел уникальна для каждой
позиции электрона, возьмём первый электрон, самый низкий энергетический уровень это N=1, на первом уровне
распологается одна оболочка, первая оболочка на любом уровне имеет форму шара (s-оболочка), т.е. L=0,
магнитное квантовое число может принять только одно значение, Ml=0 и спин будет равен +1/2.
Если мы возьмём пятый электрон (в каком бы атоме он не был), то главные квантовые числа для него будут:
N=2, L=1, M=-1, спин 1/2.
Энергетические уровни с подуровнями для наглядности изображены ниже, сверху вниз расположены уровни
и цветом разделены подуровни:
| 1 | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 2 | |||||||||||||||||||
| 3 | |||||||||||||||||||
| 4 | |||||||||||||||||||
| 5 | |||||||||||||||||||
| 6 | |||||||||||||||||||
| 7 | |||||||||||||||||||
| 8 | |||||||||||||||||||
| Таблица 1. Распределение электронов по энергетическим уровням |
Здесь, сверху-вниз показаны энергетические уровни (1-7), слева-направо разделены по группам электронные
подуровни (s,p,d,f), в каждой ячейке располагаются по два электрона в противоположных направлениях. Общий
принцип распределения электронов такой, что энергетические подуровни заполняются в порядке суммы главного
и орбитального квантовых чисел, то есть: 1S, 2S, 2P, 3S, 3P, 4S, 3D и так далее, если сумма одинакова, то
сначала заполняется уровень с меньшим главным квантовым числом N.
У некоторых элементов имеются отклонения в формировании электронной конфигурации, а именно у
24Cr,
29Cu,
41Nb,
42Mo,
44Ru,
45Rh,
46Pd,
47Ag,
78Pt,
79Au
Элементы
Проверьте себя, составьте электронную конфигурацию для элементов #4, #11 и #23, затем проверьте себя по таблице ниже.
| № | Элемент | Название | Электронная конфигурация | Энергетических уровней |
|---|---|---|---|---|
| 1 | H | водород | 1s 1 | 1 |
| 2 | He | гелий | 1s 2 | 1 |
| 3 | Li | литий | 1s 22s 1 | 2 |
| 4 | Be | бериллий | 1s 22s 2 | 2 |
| 5 | B | бор | 1s 22s 22p 1 | 2 |
| 6 | C | углерод | 1s 22s 22p 2 | 2 |
| 7 | N | азот | 1s 22s 22p 3 | 2 |
| 8 | O | кислород | 1s 22s 22p 4 | 2 |
| 9 | F | фтор | 1s 22s 22p 5 | 2 |
| 10 | Ne | неон | 1s 22s 22p 6 | 2 |
| 11 | Na | натрий | 1s 22s 22p 63s 1 | 3 |
| 12 | Mg | магний | 1s 22s 22p 63s 2 | 3 |
| 13 | Al | алюминий | 1s 22s 22p 63s 23p1 | 3 |
| 14 | Si | кремний | 1s 22s 22p 63s 23p2 | 3 |
| 15 | P | фосфор | 1s 22s 22p 63s 23p3 | 3 |
| 16 | S | сера | 1s 22s 22p 63s 23p4 | 3 |
| 17 | Cl | хлор | 1s 22s 22p 63s 23p5 | 3 |
| 18 | Ar | аргон | 1s 22s 22p 63s 23p6 | 3 |
| 19 | K | калий | 1s 22s 22p 63s 23p64s 1 | 4 |
| 20 | Ca | кальций | 1s 22s 22p 63s 23p64s 2 | 4 |
| 21 | Sc | скандий | 1s 22s 22p 63s 23p64s 23d1 | 4 |
| 22 | Ti | титан | 1s 22s 22p 63s 23p64s 23d2 | 4 |
| 23 | V | ванадий | 1s 22s 22p 63s 23p64s 23d3 | 4 |
| 24 | Cr | хром | 1s 22s 22p 63s 23p64s 13d5 | 4 |
| 25 | Mn | марганец | 1s 22s 22p 63s 23p64s 23d5 | 4 |
| 26 | Fe | железо | 1s 22s 22p 63s 23p64s 23d6 | 4 |
| 27 | Co | кобальт | 1s 22s 22p 63s 23p64s 23d7 | 4 |
| 28 | Ni | никель | 1s 22s 22p 63s 23p64s 23d8 | 4 |
| 29 | Cu | медь | 1s 22s 22p 63s 23p64s 13d10 | 4 |
| 30 | Zn | цинк | 1s 22s 22p 63s 23p64s 23d10 | 4 |
| 31 | Ga | галлий | 1s 22s 22p 63s 23p64s 23d104p1 | 4 |
| 32 | Ge | германий | 1s 22s 22p 63s 23p64s 23d104p2 | 4 |
| 33 | As | мышьяк | 1s 22s 22p 63s 23p64s 23d104p3 | 4 |
| 34 | Se | селен | 1s 22s 22p 63s 23p64s 23d104p4 | 4 |
| 35 | Br | бром | 1s 22s 22p 63s 23p64s 23d104p5 | 4 |
| 36 | Kr | криптон | 1s 22s 22p 63s 23p64s 23d104p6 | 4 |
| 37 | Rb | рубидий | 1s 22s 22p 63s 23p64s 23d104p65s1 | 5 |
| 38 | Sr | стронций | 1s 22s 22p 63s 23p64s 23d104p65s2 | 5 |
| 39 | Y | иттрий | 1s 22s 22p 63s 23p64s 23d104p65s24d1 | 5 |
| 40 | Zr | цирконий | 1s 22s 22p 63s 23p64s 23d104p65s24d2 | 5 |
| 41 | Nb | ниобий | 1s 22s 22p 63s 23p64s 23d104p65s14d4 | 5 |
| 42 | Mo | молибден | 1s 22s 22p 63s 23p64s 23d104p65s14d5 | 5 |
| 43 | Tc | технеций | 1s 22s 22p 63s 23p64s 23d104p65s24d5 | 5 |
| 44 | Ru | рутений | 1s 22s 22p 63s 23p64s 23d104p65s14d7 | 5 |
| 45 | Rh | родий | 1s 22s 22p 63s 23p64s 23d104p65s14d8 | 5 |
| 46 | Pd | палладий | 1s 22s 22p 63s 23p64s 23d104p64d10 | 5 |
| 47 | Ag | серебро | 1s 22s 22p 63s 23p64s 23d104p65s14d10 | 5 |
| 48 | Cd | кадмий | 1s 22s 22p 63s 23p64s 23d104p65s24d10 | 5 |
| 49 | In | индий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p1 | 5 |
| 50 | Sn | олово | 1s 22s 22p 63s 23p64s 23d104p65s24d105p2 | 5 |
| 51 | Sb | сурьма | 1s 22s 22p 63s 23p64s 23d104p65s24d105p3 | 5 |
| 52 | Te | теллур | 1s 22s 22p 63s 23p64s 23d104p65s24d105p4 | 5 |
| 53 | I | йод | 1s 22s 22p 63s 23p64s 23d104p65s24d105p5 | 5 |
| 54 | Xe | ксенон | 1s 22s 22p 63s 23p64s 23d104p65s24d105p6 | 5 |
| 55 | Cs | цезий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s1 | 6 |
| 56 | Ba | барий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s2 | 6 |
| 57 | La | лантан | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s25d1 | 6 |
| 58 | Ce | церий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f2 | 6 |
| 59 | Pr | празеодим | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f3 | 6 |
| 60 | Nd | неодим | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f4 | 6 |
| 61 | Pm | прометий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f5 | 6 |
| 62 | Sm | самарий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f6 | 6 |
| 63 | Eu | европий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f7 | 6 |
| 64 | Gd | гадолиний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f75d1 | 6 |
| 65 | Tb | тербий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f9 | 6 |
| 66 | Dy | диспрозий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f10 | 6 |
| 67 | Ho | гольмий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f11 | 6 |
| 68 | Er | эрбий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f12 | 6 |
| 68 | Tm | тулий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f13 | 6 |
| 70 | Yb | иттербий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f14 | 6 |
| 71 | Lu | лютеций | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d1 | 6 |
| 72 | Hf | гафний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d2 | 6 |
| 73 | Ta | тантал | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d3 | 6 |
| 74 | W | вольфрам | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d4 | 6 |
| 75 | Re | рений | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d5 | 6 |
| 76 | Os | осмий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d6 | 6 |
| 77 | Ir | иридий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d7 | 6 |
| 78 | Pt | платина | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s14f145d9 | 6 |
| 79 | Au | золото | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s14f145d10 | 6 |
| 80 | Hg | ртуть | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d10 | 6 |
| 81 | Tl | таллий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p1 | 6 |
| 82 | Pb | свинец | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p2 | 6 |
| 83 | Bi | висмут | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p3 | 6 |
| 84 | Po | полоний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p4 | 6 |
| 85 | At | астат | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p5 | 6 |
| 86 | Rn | радон | 1s 22s 22p 63s 23p64s 23d104p65s14d105p66s24f145d106p6 | 6 |
| 87 | Fr | франций | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s1 | 7 |
| 88 | Ra | радий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s2 | 7 |
| 89 | Ac | актиний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s26d1 | 7 |
| 90 | Th | торий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s26d25f0 | 7 |
| 91 | Pa | протактиний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f26d1 | 7 |
| 92 | U | уран | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f36d1 | 7 |
| 93 | Np | нептуний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f46d1 | 7 |
| 94 | Pu | плутоний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f56d1 | 7 |
| 95 | Am | америций | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f7 | 7 |
| 96 | Cm | кюрий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f76d1 | 7 |
| 97 | Bk | берклий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f86d1 | 7 |
| 98 | Cf | калифорний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f10 | 7 |
| 99 | Es | эйнштейний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f11 | 7 |
| 100 | Fm | фермий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f12 | 7 |
| 101 | Md | менделеевий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f13 | 7 |
| 102 | No | нобелий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f14 | 7 |
| 103 | Lr | лоуренсий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d1 | 7 |
| 104 | Rf | резерфордий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d2 | 7 |
| 105 | Db | дубний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d3 | 7 |
| 106 | Sg | сиборгий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d4 | 7 |
| 107 | Bh | борий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d5 | 7 |
| 108 | Hs | хассий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d6 | 7 |
| 109 | Mt | мейтнерий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d7 | 7 |
| 110 | Ds | дармштадтий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d8 | 7 |
| 111 | Rg | рентгений | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d9 | 7 |
| 112 | Cn | коперниций | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d10 | 7 |
| 113 | Nh | нихоний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d107p1 | 7 |
| 114 | Fl | флеровий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d107p2 | 7 |
| 115 | Mc | московий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d107p3 | 7 |
| 116 | Lv | ливерморий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d107p4 | 7 |
| 117 | Ts | теннесcин | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d107p5 | 7 |
| 118 | Og | оганесон | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d107p6 | 7 |
| Таблица 2. Электронная конфигурация атомов |
Если Вы хотите узнать, как составить электронную конфигурацию, обратитесь к статье
«как написать электронную конфигурацию»
Квантовые числа электронов в атомах
Атомно-молекулярное учение
Мы приступаем к изучению химии — мира молекул и атомов. В этой статье мы рассмотрим базисные понятия и разберемся с электронными
формулами элементов.
Атом (греч. а — отриц. частица + tomos — отдел, греч. atomos — неделимый) — электронейтральная частица вещества микроскопических
размеров и массы, состоящая из положительно заряженного ядра (протонов) и отрицательно заряженных электронов (электронные орбитали).
Описываемая модель атома называется «планетарной» и была предложена в 1913 году великими физиками: Нильсом Бором и Эрнестом Резерфордом

Протон (греч. protos — первый) — положительно заряженная (+1) элементарная частица, вместе с нейтронами образует ядра атомов
элементов. Нейтрон (лат. neuter — ни тот, ни другой) — нейтральная (0) элементарная частица, присутствующая в ядрах всех
химических элементов, кроме водорода.
Электрон (греч. elektron — янтарь) — стабильная элементарная частица с отрицательным электрическим зарядом (-1), заряд атома —
порядковый номер в таблице Менделеева — равен числу электронов (и, соответственно, протонов).
Запомните, что в невозбужденном состоянии атом содержит одинаковое число электронов и протонов. Так у кальция (порядковый номер 20)
в ядре находится 20 протонов, а вокруг ядра на электронных орбиталях 20 электронов.

Я еще раз подчеркну эту важную деталь. На данном этапе будет отлично, если вы запомните простое правило:
порядковый номер элемента = числу электронов. Это наиболее важно для практического применения и изучения следующей темы.
Электронная конфигурация атома
Электроны атома находятся в непрерывном движении вокруг ядра. Энергия электронов отличается друг от друга, в соответствии с этим
электроны занимают различные энергетические уровни.
Энергетические уровни подразделяются на несколько подуровней:
- Первый уровень
- Второй уровень
- Третий уровень
- Четвертый уровень
Состоит из s-подуровня: одной «1s» ячейки, в которой помещаются 2 электрона (заполненный электронами — 1s2)
Состоит из s-подуровня: одной «s» ячейки (2s2) и p-подуровня: трех «p» ячеек (2p6), на которых
помещается 6 электронов
Состоит из s-подуровня: одной «s» ячейки (3s2), p-подуровня: трех «p» ячеек (3p6) и d-подуровня:
пяти «d» ячеек (3d10), в которых помещается 10 электронов
Состоит из s-подуровня: одной «s» ячейки (4s2), p-подуровня: трех «p» ячеек (4p6), d-подуровня:
пяти «d» ячеек (4d10) и f-подуровня: семи «f» ячеек (4f14), на которых помещается 14
электронов

Зная теорию об энергетических уровнях и порядковый номер элемента из таблицы Менделеева, вы должны расположить определенное число
электронов, начиная от уровня с наименьшей энергией и заканчивая к уровнем с наибольшей. Чуть ниже вы увидите несколько примеров, а
также узнаете об исключении, которое только подтверждает данные правила.
Подуровни: «s», «p» и «d», которые мы только что обсудили, имеют в определенную конфигурацию в пространстве. По этим подуровням, или
атомным орбиталям, движутся электроны, создавая определенный «рисунок».
S-орбиталь похожа на сферу, p-орбиталь напоминает песочные часы, d-орбиталь — клеверный лист.

Правила заполнения электронных орбиталей и примеры
Существует ряд правил, которые применяют при составлении электронных конфигураций атомов:
- Сперва следует заполнить орбитали с наименьшей энергией, и только после переходить к энергетически более высоким
- На орбитали (в одной «ячейке») не может располагаться более двух электронов
- Орбитали заполняются электронами так: сначала в каждую ячейку помещают по одному электрону, после чего орбитали дополняются
еще одним электроном с противоположным направлением - Порядок заполнения орбиталей: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s
Должно быть, вы обратили внимание на некоторое несоответствие: после 3p подуровня следует переход к 4s, хотя логично было
бы заполнить до конца 4s подуровень. Однако природа распорядилась иначе.
Запомните, что, только заполнив 4s подуровень двумя электронами, можно переходить к 3d подуровню.
Без практики теория мертва, так что приступает к тренировке. Нам нужно составить электронную конфигурацию атомов углерода и
серы. Для начала определим их порядковый номер, который подскажет нам число их электронов. У углерода — 6, у серы — 16.
Теперь мы располагаем указанное количество электронов на энергетических уровнях, руководствуясь правилами заполнения.

Обращаю ваше особе внимание: на 2p-подуровне углерода мы расположили 2 электрона в разные ячейки, следуя одному из правил.
А на 3p-подуровне у серы электронов оказалось много, поэтому сначала мы расположили 3 электрона по отдельным ячейкам, а оставшимся
одним электроном дополнили первую ячейку.
Таким образом, электронные конфигурации наших элементов:
- Углерод — 1s22s22p2
- Серы — 1s22s22p63s23p4
Внешний уровень и валентные электроны
Количество электронов на внешнем (валентном) уровне — это число электронов на наивысшем энергетическом уровне, которого достигает элемент. Такие электроны называются валентными: они могут быть спаренными или неспаренными. Иногда
для наглядного представления конфигурацию внешнего уровня записывают отдельно:
- Углерод — 2s22p2 (4 валентных электрона)
- Сера -3s23p4 (6 валентных электронов)
Неспаренные валентные электроны способны к образованию химической связи. Их число соответствует количеству связей, которые данный атом может образовать с другими атомами. Таким образом неспаренные валентные электроны тесно связаны с валентностью — способностью атомов образовывать определенное число химических связей.

- Углерод — 2s22p2 (2 неспаренных валентных электрона)
- Сера -3s23p4 (2 неспаренных валентных электрона)
Тренировка
Потренируйтесь и сами составьте электронную конфигурацию для магния и скандия. Определите число электронов на внешнем (валентном) уровне и число неспаренных
электронов. Ниже будет дано наглядное объяснение этой задаче.

Запишем получившиеся электронные конфигурации магния и скандия:
- Магний — 1s22s22p63s2
- Скандий — 1s22s22p63s23p64s23d1
В целом несложная и интересная тема электронных конфигураций отягощена небольшим исключением — провалом электрона, которое только подтверждает общее
правило: любая система стремится занять наименее энергозатратное состояние.
Провал электрона
Провалом электрона называют переход электрона с внешнего, более высокого энергетического уровня, на предвнешний, энергетически более
низкий. Это связано с большей энергетической устойчивостью получающихся при этом электронных конфигураций.
Подобное явление характерно лишь для некоторых элементов: медь, хром, серебро, золото, молибден. Для примера выберем хром, и рассмотрим
две электронных конфигурации: первую «неправильную» (сделаем вид, будто мы не знаем про провал электрона) и вторую правильную, написанную
с учетом провала электрона.
Теперь вы понимаете, что кроется под явлением провала электрона. Запишите электронные конфигурации хрома и меди самостоятельно еще раз и
сверьте с представленными ниже.

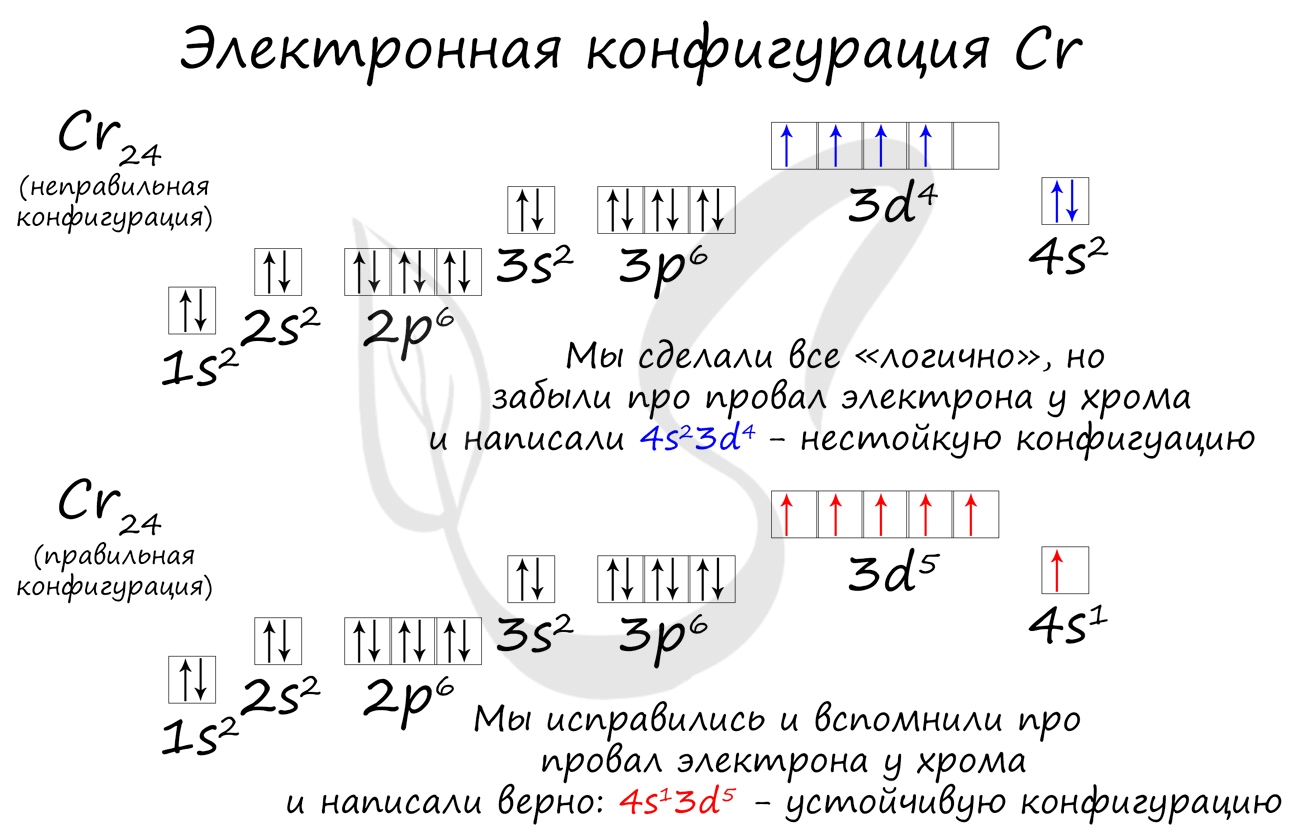
Основное и возбужденное состояние атома
Основное и возбужденное состояние атома отражаются на электронных конфигурациях. Возбужденное состояние связано с движением электронов
относительно атомных ядер. Говоря проще: при возбуждении пары электронов распариваются и занимают новые ячейки.
Возбужденное состояние является для атома нестабильным, поэтому долгое время в нем он пребывать не может. У некоторых атомов: азота,
кислорода , фтора — возбужденное состояние невозможно, так как отсутствуют свободные орбитали («ячейки») — электронам некуда перескакивать, к тому
же d-орбиталь у них отсутствует (они во втором периоде).
У серы возможно возбужденное состояние, так как она имеет свободную d-орбиталь, куда могут перескочить электроны. Четвертый энергетический
уровень отсутствует, поэтому, минуя 4s-подуровень, заполняем распаренными электронами 3d-подуровень.
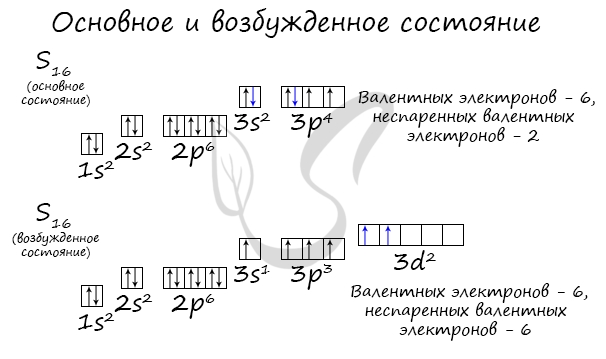
По мере изучения основ общей химии мы еще не раз вернемся к этой теме, однако хорошо, если вы уже сейчас запомните, что возбужденное состояние
связано с распаривание электронных пар.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Вспомните:
- что такое атом;
- из чего состоит атом;
- изменяется ли атом в химических реакциях?
АТОМ — это электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов.
Число электронов в ходе химических процессов может изменяться, но заряд ядра всегда остается неизменным. Зная распределение электронов в атоме (строение атома), можно предсказать многие свойства данного химического элемента, а также простых и сложных веществ, в состав которых этот элемент входит.
Содержание
- Структура Периодической системы Менделеева
- Ядро атома. Изотопы
- Распределение электронов в поле ядра атома
- Строение атома и свойства элементов
- Выводы
Структура Периодической системы Менделеева
Строение атома, т. е. состав ядра, распределение электронов вокруг ядра, несложно определить по положению элемента в Периодической системе. В Периодической системе Менделеева химические элементы располагаются в определённой последовательности. Эта последовательность тесно связана со строением атома этих элементов. Каждому химическому элементу в системе присвоен порядковый номер, кроме того, для него можно указать:
- номер периода;
- номер группы;
- вид подгруппы.
Зная точный «адрес» химического элемента, т. е. его группу, подгруппу и номер периода, можно однозначно определить строение его атома.
Период — это горизонтальный ряд химических элементов. В современной Периодической системе семь периодов. Первые три — малые, так как они содержат 2 или 8 элементов:
- 1-й период — Н, Не — 2 элемента;
- 2-й период — Li…Nе — 8 элементов;
- 3-й период — Na…Аr — 8 элементов.
Остальные периоды — большие. Каждый из них содержит 2–3 ряда элементов:
- 4-й период (2 ряда) — К…Кr — 18 элементов;
- 6-й период (3 ряда) — Сs…Rn — 32 элемента. В этот период входит ряд лантаноидов.
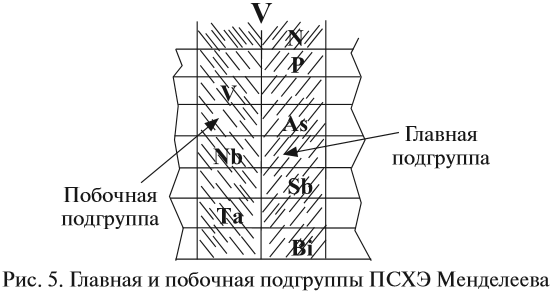
Группа — вертикальный ряд химических элементов. Всего групп восемь. Каждая группа состоит из двух подгрупп: главной подгруппы и побочной подгруппы (см. рис. 5).
Главную подгруппу (подгруппу А) образуют химические элементы малых периодов и больших периодов. На рисунке 5 показано, что главную подгруппу пятой группы составляют элементы малых периодов (N, P) и больших периодов (As, Sb, Bi).
Побочную подгруппу (подгруппу Б) образуют химические элементы только больших периодов. В нашем случае это V, Nb, Ta.
Визуально эти подгруппы различить легко: главная подгруппа «высокая», начинается с первого или второго периода. Побочная подгруппа — «низкая», начинается с 4-го периода.
Итак, каждый химический элемент Периодической системы имеет свой адрес:
- период;
- группу;
- подгруппу;
- порядковый номер.
Например, ванадий (V) — это химический элемент 4-го периода, V группы, побочной подгруппы, порядковый номер 23.
Задание 3.1. Укажите период, группу и подгруппу для химических элементов с порядковыми номерами 8, 26, 31, 35, 54.
Задание 3.2. Укажите порядковый номер и название химического элемента, если известно, что он находится:
- в 4-м периоде, VI группе, побочной подгруппе;
- в 5-м периоде, IV группе, главной подгруппе.
Каким образом можно связать эти сведения об элементе со строением его атома?
Ядро атома. Изотопы
Атом состоит из ядра, которое имеет положительный заряд, и электронов, которые имеют отрицательный заряд. В целом атом электронейтрален.
Положительный заряд ядра атома равен порядковому номеру химического элемента.
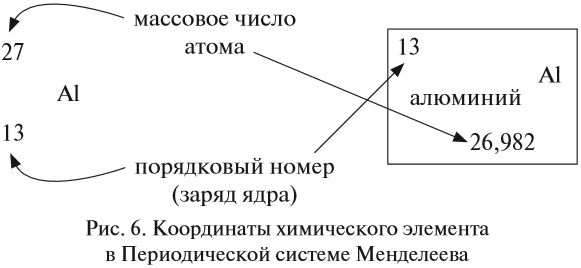
Ядро атома — сложная частица. В ней сосредоточена почти вся масса атома. Поскольку химический элемент — совокупность атомов с одинаковым зарядом ядра, то около символа элемента указывают (рис. 6).
По этим данным можно определить состав ядра. Ядро состоит из протонов и нейтронов.
- Протон (р) имеет массу, равную 1 (1,0073 а. е. м.) и заряд, равный +1.
- Нейтрон (n) заряда не имеет (нейтрален), а масса его приблизительно равна массе протона (1,0087 а. е. м.).
Какие частицы определяют заряд ядра? Протоны! Причём число протонов равно (по величине) заряду ядра атома, т. е. порядковому номеру:
Число нейтронов определяют по разности между величинами: «масса ядра» и «порядковый номер».
Задание 3.3. Определите состав ядер атомов, если химический элемент находится в:
- 3-м периоде, VII группе, главной подгруппе;
- 4-м периоде, IV группе, побочной подгруппе;
- 5-м периоде, I группе, главной подгруппе.
Обратите внимание, что при определении массового числа ядра атома приходится округлять атомную массу, указанную в Периодической системе! Почему? Ведь массы протона и нейтрона практически целочисленны, а массой электронов можно пренебречь.
Для того,чтобы ответить на этот вопрос, нужно понять:
- Что происходит с атомом в ходе химических процессов;
- Что такое «химический элемент».
В химических процессах обязательно изменяется распределение электронов вокруг ядра или даже изменяется их число. В последнем случае атом отдаёт или принимает электроны и превращается в заряженную частицу — ион. Но в химических реакциях никогда не меняется состав ядра атома, его заряд. Поэтому заряд ядра атома является своеобразным «паспортом» химического элемента.
Химический элемент — совокупность атомов или ионов с одинаковым зарядом ядра.
Для того чтобы разобраться, попробуйте определить, какие из ядер, состав которых указан ниже, принадлежат одному и тому же химическому элементу:
Атомам одного химического элемента принадлежат ядра А и В, так как они содержат одинаковое число протонов, т. е. заряд этих ядер одинаковый. Но ведь у них разная масса! Исследования показывают, что масса атома не оказывает существенного влияния на его химические свойства. Поэтому атомы одного и того же химического элемента (одинаковое число протонов), но с разной массой (разное число нейтронов) являются ИЗОТОПАМИ* этого элемента.
* Слово «изотоп» означает по смыслу «одно место», т. е. все изотопы данного химического элемента находятся в одной клетке ПСХЭ.
В таблице Менделеева указана средняя атомная масса всех природных изотопов данного элемента (Аr). Изотопы и их химические соединения отличаются друг от друга по физическим свойствам, но химические свойства у изотопов одного химического элемента одинаковы. Так, изотоп углерода-14 (14С) имеет такие же химические свойства, как и углерод-12 (12С), который входит в ткани любого живого организма, отличаясь от него только радиоактивностью. Поэтому изотопы применяют для диагностики и лечения различных заболеваний, для научных исследований.
Элемент «водород» встречается в природе в виде трёх изотопов:
Химический элемент «кислород» также представлен тремя природными изотопами:
Задание 3.4. Укажите состав ядер этих изотопов водорода и кислорода.
Если разные вещества содержат атомы одного и того же химического элемента, это не означает, что эти вещества имеют одни те же свойства. Например, химический элемент «хлор» в виде атомарного хлора Cl• разрушает метан, а также атмосферный озон. Тот же элемент в виде молекулярного хлора Cl2 ядовит, активно реагирует с водой, многими металлами, а ионы хлора (химический элемент — тот же!) в составе NaCl химически инертен, а с биологической точки зрения не только безвреден, но и полезен для нас. Эти ионы являются макроэлементами нашей пищи, которые входят в состав крови, желудочного сока. Суточная потребность — до 6 граммов.
Но вернемся к описанию строения атома.
Распределение электронов в поле ядра атома
Как известно, ядро атома в химических процессах не меняется. А что меняется? Общее число электронов и распределение электронов. Общее число электронов определить несложно: оно равно порядковому номеру, т. е. заряду ядра атома:
Электроны имеют отрицательный заряд –1, а масса их ничтожна: 1/1840 от массы протона.
Отрицательно заряженные электроны отталкиваются и поэтому находятся на разных расстояниях от ядра. При этом электроны, имеющие приблизительно равный запас энергии, образуют энергетический уровень.
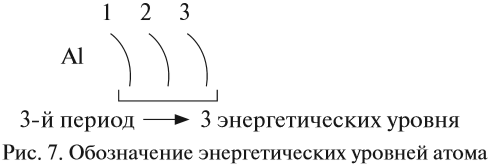
Число энергетических уровней в атоме равно номеру периода, в котором находится химический элемент. Энергетические уровни условно обозначают так (рис. 7).
Задание 3.5. Определите число энергетических уровней в атомах кислорода, магния, кальция, свинца.
На каждом энергетическом уровне может находиться ограниченное число электронов:
- на первом энергетическом уровне не более 2 электронов;
- на втором энергетическом уровне не более 8 электронов;
- на третьем энергетическом уровне не более 18 электронов.
ЗАПОМНИТЕ ЭТИ ЧИСЛА!
Они показывают, что, например, на втором энергетическом уровне может находиться 2 или 5 или 7 электронов, но не может быть 9 или 12 электронов.
Важно знать, что, независимо от номера энергетического уровня, на внешнем (последнем) уровне не может быть больше восьми электронов. Внешний восьмиэлектронный энергетический уровень является наиболее устойчивым и называется завершённым. Такие энергетические уровни имеются у самых неактивных элементов — благородных газов.
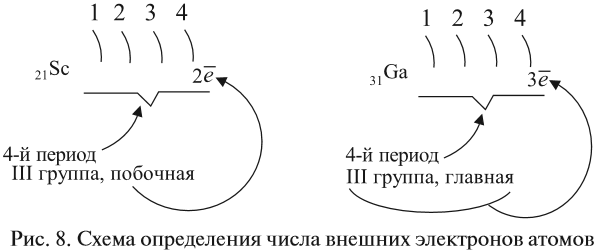
Как определить число электронов на внешнем уровне остальных атомов? Для этого существует простое правило – число внешних электронов равно:
- для элементов главных подгрупп — номеру группы;
- для элементов побочных подгрупп — оно не может быть больше двух (рис. 8).
Например:
Задание 3.6. Укажите число внешних электронов для химических элементов с порядковыми номерами 15, 25, 30, 53.
Задание 3.7. Найдите в Периодической системе химические элементы, в атомах которых имеется завершённый внешний уровень.
Очень важно правильно определять число внешних электронов, так как именно с ними связаны важнейшие свойства атома. Так, в химических реакциях атомы стремятся «приобрести» устойчивый, завершённый внешний уровень (8ē). Для этого атомы, на внешнем уровне которых мало электронов, «предпочитают» их отдать.
Химические элементы, атомы которых способны только отдавать электроны, относятся к МЕТАЛЛАМ. Очевидно, что на внешнем уровне атома металла должно быть мало электронов: 1, 2, 3.
Если на внешнем энергетическом уровне атома много электронов, то такие атомы стремятся принять электроны до завершения внешнего энергетического уровня, т. е. до восьми электронов. Такие элементы относятся к НЕМЕТАЛЛАМ.
Вопрос. К каким элементам (металлам или неметаллам) относятся химические элементы побочных подгрупп? Почему?
Металлы и неметаллы главных подгрупп в таблице Менделеева отделяет линия, которую можно провести от бора к астату. Выше этой линии (и на линии) располагаются неметаллы, ниже — металлы.
Задание 3.8. Определить, к металлам или неметаллам относятся: фосфор, ванадий, кобальт, селен, висмут. Вывод сделайте, определив положение элемента в Периодической системе химических элементов и число электронов на внешнем уровне.
Для того чтобы составить распределение электрона по остальным уровням и подуровням, следует воспользоваться следующим АЛГОРИТМОМ:
- Определить общее число электронов в атоме (по порядковому номеру).
- Определить число энергетических уровней (по номеру периода).
- Определить число внешних электронов (по виду подгруппы и номеру группы).
- Указать число электронов на всех уровнях, кроме предпоследнего.
- Рассчитать число электронов на предпоследнем уровне.
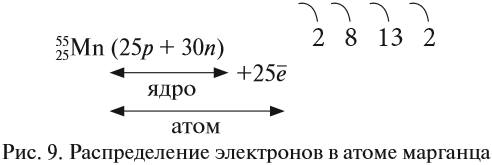
Например, согласно пунктам 1…4 для атома марганца определено:
Получили распределение электронов в атоме марганца (рис. 9):
Задание 3.9. Отработайте алгоритм, составив схемы строения атомов для элементов № 16, 26, 33, 37. Укажите: металлы это или неметаллы? Ответ поясните.
Составляя вышеприведенные схемы строения атома, мы не учитывали, что электроны в атоме занимают не только определённые уровни, но и определённые подуровни каждого уровня. Вид подуровня обозначается латинской буквой: s, p, d.
Число возможных подуровней равно номеру уровня, т. е.
- первый уровень состоит из одного s-подуровня;
- второй уровень состоит из двух подуровней: s и р и т. д.
На каждом подуровне может находиться строго ограниченное число электронов:
- на s-подуровне — не больше 2ē;
- на р-подуровне — не больше 6ē;
- на d-подуровне — не больше 10ē.
Подуровни одного уровня заполняются в строго определённом порядке:
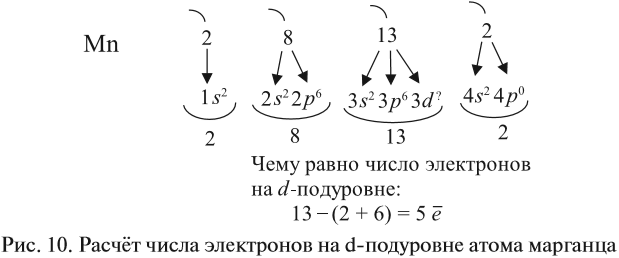
Таким образом, р-подуровнь не может начать заполняться, если не заполнен s-подуровень данного энергетического уровня и т. д. Исходя из этого правила, несложно составить электронную конфигурацию атома марганца (рис. 10).
В целом электронная конфигурация атома марганца выглядит так:
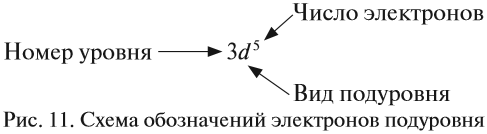
Здесь и далее приняты обозначения (рис. 11).
Задание 3.10. Составьте электронные конфигурации атомов для химических элементов № 16, 26, 33, 37.
Для чего необходимо составлять электронные конфигурации атомов? Для того чтобы определять свойства этих химических элементов!
Для этого следует помнить: в химических процессах участвуют только валентные электроны.
Валентные электроны находятся на внешнем энергетическом уровне и незавершённом d-подуровне предвнешнего уровня.
Определим число валентных электронов для марганца:
или сокращённо:
Строение атома и свойства элементов
Мы получили краткую электронную формулу атома марганца, которая отражает распределение его валентных электронов. Что можно определить по этой формуле?
1. Какие свойства — металла или неметалла — преобладают у этого элемента? Ответ: марганец — металл, так как на внешнем (четвёртом) уровне 2 электрона.
2. Какой процесс характерен для металла? Ответ: всегда только отдача электронов.
3. Какие электроны и сколько их будет отдавать атом марганца? Ответы:
- два внешних электрона (они дальше всех от ядра и слабее притягиваются им);
- семь (2+5) валентных электронов (так как в этом случае на третьем уровне атома останется восемь электронов, т. е. образуется завершённый уже внешний уровень).
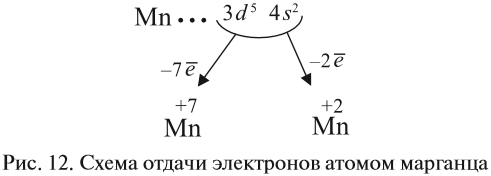
Все эти рассуждения и заключения можно отразить при помощи схемы (рис. 12).
Полученные условные заряды атома называются степенью окисления.
Рассматривая строение атомов кислорода и водорода и рассуждая аналогично, можно показать, что типичными степенями окисления для кислорода является –2, а для водорода +1.
Вопрос. С каким из этих химических элементов может образовывать соединения марганец, если учесть полученные выше степени окисления его?
Только с кислородом, так как его атом имеет противоположную по заряду (знаку) степень окисления. В этом случае несложно составить формулы соответствующих оксидов марганца (здесь степени окисления соответствуют валентностям этих химических элементов):
Строение атома марганца подсказывает, что большей степени окисления, чем +7, у марганца быть не может, так как в этом случае пришлось бы затрагивать устойчивый, теперь уже завершённый предвнешний уровень. Поэтому степень окисления +7 является высшей, а соответствующий оксид Мn2О7 — высшим оксидом марганца.
Для закрепления всех этих понятий рассмотрим строение атома теллура и некоторые его свойства (см. рис. 13). Этот рисунок показывает, что теллур относится к неметаллам, так как, во-первых, у него на внешнем уровне шесть электронов и, во-вторых, его символ находится в главной подгруппе выше линии В — At. Поэтому его атом может и принимать (до завершения внешнего уровня, и отдавать электроны. В результате, в отличие от металлов, неметалл теллур может проявлять низшую степень окисления (–2) и образовывать летучие водородные соединения с водородом (Н2Те). Высшая степень окисления атома теллура (+6), как и у металлов соответствует номеру группы и, находясь в этой степени окисления, теллур образует высший оксид ТеО3.
Задание 3.11. Изобразить электронные конфигурации атомов Nа, Rb, Сl, I, Si, Sn. Определить свойства этих химических элементов, формулы их простейших соединений (с кислородом и с водородом).
Сделаем выводы.
- В химических реакциях участвуют только валентные электроны, которые могут находиться только на последних двух уровнях.
- Атомы металлов могут только отдавать эти электроны (все или несколько), принимая положительные степени окисления.
- Атомы неметаллов могут принимать (недостающие до восьми) электроны, получая при этом отрицательные степени окисления, и отдавать валентные электроны (все или несколько), принимая при этом положительные степени окисления.
Возникает вопрос: как составить краткую электронную формулу (распределение валентных электронов), сразу, не составляя длинных электронных конфигураций? Для этого нужно помнить несколько простых правил.
1. Номер периода соответствует числу энергетических уровней у атомов химических элементов этого периода.
2. Номер группы, как правило, совпадает с числом валентных электронов, (исключение составляют только подгруппы меди и железа).
3. Подгруппа (главная или побочная) включает химические элементы, у которых имеется одинаковое распределение валентных электронов, причём в атомах элементов главной и побочной подгруппы электроны распределяются по-разному.
3.1. У элементов главных подгрупп все валентные электроны находятся на внешнем уровне, например:
V группа, главная → 5 валентных электронов
Поэтому для всех химических элементов главной подгруппы пятой группы (пять валентных электронов) распределение этих электронов следующее:
3.2. У элементов побочных подгрупп число внешних электронов не превышает двух, например:
5 валентных электронов ← V группа, побочная → 2 электрона на внешнем уровне*.
* За счёт «провала электрона» число внешних электронов может быть меньше. Но число валентных электронов при этом не меняется, поэтому свойства элемента будут такими же. Эти случаи рассмотрены в Самоучителе второго уровня, часть 1.
Для большинства химических элементов побочных подгрупп, у которых на внешнем энергетическом уровне два электрона, остальные (N – 2) валентные электроны будут находиться на d-подуровне предвнешнего уровня (N – номер группы), например:
Вопрос. Для элементов какой группы составлена такая запись?
Задание 3.12. Составьте краткие электронные формулы для атомов химических элементов № 35 и 42, а затем составьте распределение электронов в этих атомах по алгоритму. Убедитесь, что ваше «предсказание» сбылось.
Сравним теперь свойства химических элементов одной подгруппы, например:
Что общего в строении атомов этих элементов? На внешнем уровне каждого атома по одному электрону — это активные металлы. Металлическая активность связана со способностью отдавать электроны: чем легче отдает электроны атом, тем сильнее выражены его металлические свойства.
Что удерживает электроны в атоме? Притяжение их к ядру. Чем ближе электроны к ядру, тем сильнее они притягиваются ядром атома, тем труднее их «оторвать».
Исходя из этого, сделаем вывод: какой элемент — Nа или Rb — легче отдает внешний электрон? Какой из них является более активным металлом? Очевидно, рубидий, так как его валентные электроны находятся дальше от ядра (и слабее удерживаются ядром).
Вывод. В главных подгруппах сверху вниз металлические свойства усиливаются, так как возрастает радиус атома и валентные электроны слабее притягиваются к ядру.
Сравним свойства:
Оба химических элемента — неметаллы, так как до завершения внешнего уровня не хватает одного электрона, и эти атомы будут активно притягивать недостающий электрон. При этом, чем сильнее притягивает атом неметалла недостающий электрон, тем сильнее проявляются его неметаллические свойства (способность принимать электроны).
За счёт чего происходит притяжение электрона? За счёт положительного заряда ядра атома. Но в таком случае чем ближе электрон к ядру, тем сильнее их взаимное притяжение, тем активнее неметалл.
Сделаем вывод, у какого элемента сильнее выражены неметаллические свойства: у хлора или у йода? Очевидно, у хлора, так как его валентные электроны ближе к ядру.
Вывод. Активность неметаллов в подгруппах сверху вниз убывает, так как возрастает радиус атома и все труднее притянуть недостающие электроны.
Сравним свойства кремния и олова:
На внешнем уровне обоих атомов по четыре электрона. Тем не менее эти элементы в Периодической системе находятся по разные стороны от линии, соединяющей бор и астат (см. правило в уроке 2.1.). Поэтому:
- у кремния, символ которого находится выше линии В–At, сильнее проявляются неметаллические свойства;
- у олова, символ которого находится ниже линии В–At, сильнее проявляются металлические свойства;
Почему? Потому что в атоме олова четыре валентных электрона находятся так далеко от ядра, что присоединение недостающих четырех электронов затруднено, в то время как отдача электронов с пятого энергетического уровня происходит достаточно легко. Для кремния возможны оба процесса, причём первый (приём электронов) — преобладает.
Выводы:
- чем меньше электронов в атоме и чем дальше они от ядра, тем сильнее проявляются металлические свойства;
- чем больше внешних электронов в атоме, чем ближе они к ядру, тем сильнее проявляются неметаллические свойства.
Сравним строение атомов и свойства химических элементов одного периода:
Вопрос. О каком периоде и каких элементах идёт речь?
Видно, что металлические свойства убывают, так как увеличивается число внешних электронов, а неметаллические свойства — возрастают. Если речь идёт о большом периоде, где большинство элементов имеет 2 электрона на внешнем уровне (элементы побочных подгрупп), то в этом случае главной причиной убывания металлических свойств в периоде является уменьшение радиуса атома. Дело в том, что за счёт увеличения заряда ядра в периоде увеличивается сила притяжения электронов к нему и уменьшается радиус атома:
Сравните: r (Ca) = 0,197 нм и r (Zn) = 0,139 нм
Вопрос. Какой из металлов более активен?
Основываясь на этих и других выводах, сформулированных в этой главе, можно для любого химического элемента Периодической системы составить алгоритм описания свойств химического элемента по его положению в Периодической системе.
1. Составить схему строения атома, т. е. определить состав ядра, распределение электронов по энергетическим уровням и подуровням:
- определить общее число электронов в атоме (по порядковому номеру);
- определить число энергетических уровней (по номеру периода);
- определить число внешних электронов (по виду подгруппы и номеру группы);
- указать число электронов на всех энергетических уровнях, кроме предпоследнего;
- рассчитать число электронов на предпоследнем уровне.
2. Определить число валентных электронов и число внешних электронов.
3. Определить, какие свойства — металла или неметалла — сильнее проявляются у данного химического элемента (по положению в ПСХЭ).
4. Определить число отдаваемых (принимаемых) электронов.
5. Определить высшую и низшую степени окисления химического элемента.
6. Составить для этих степеней окисления химические формулы простейших соединений с кислородом и водородом.
7. Определить характер оксида (см. урок 2.1.) и составить уравнения его реакции с водой.
8. Для указанных (пункт 6) веществ составить уравнения характерных реакций (см. урок 2).
Задание 3.13. Составить по данной схеме описания атомов серы, селена, кальция и стронция и свойства этих химических элементов. Какие общие свойства имеют их оксиды? Гидроксиды?
Если вы выполнили упражнения 3.11 и 3.12, то легко заметить, что не только атомы элементов одной подгруппы, но и их соединения имеют общие свойства и похожий состав. Это отражено в Периодическом законе Менделеева: Свойства химических элементов, а также свойства простых и сложных веществ, образованных ими, находятся в периодической зависимости от ЗАРЯДА ЯДЕР ИХ АТОМОВ.
Физический смысл Периодического закона ясен: свойства химических элементов периодически повторяются потому, что периодически повторяются конфигурации валентных электронов (распределение электронов внешнего и предпоследнего уровней).
Так, у химических элементов одной и той же подгруппы одинаковое распределение валентных электронов и, значит, похожие свойства.
Выводы
Строение атома связано с положением элемента в Периодической системе. Зная строение атома, можно предсказать свойства элемента и его соединений. Эти свойства находятся в периодической зависимости от заряда ядер атомов элементов, в соответствии с Периодическим законом Менделеева.
Download Article
Download Article
An atom’s electron configuration is a numeric representation of its electron orbitals. Electron orbitals are differently-shaped regions around an atom’s nucleus where electrons are mathematically likely to be located. An electron configuration can quickly and simply tell a reader how many electron orbitals an atom has as well as the number of electrons populating each of its orbitals. Once you understand the basic principles behind electron configuration, you will be able to write your own configurations and tackle those chemistry tests with confidence.
-
1
What is an electron configuration? An electron configuration shows the distribution of electrons of an atom or a molecule. There is a specific notation that can quickly show you where the electrons are likely to be located, so knowing this notation is an essential part of knowing electron configurations. Reading these notations can tell you what element you’re referring to and how many electrons it has.[1]
- The structure of the periodic table is based on electron configuration.
- For example, the notation for Phosphorus (P) is
.
-
2
What are electron shells? The area that surrounds the nucleus of an atom, or the area where the electrons orbit, is called an electron shell. There are usually around 3 electron shells per atom, and the arrangement of these shells is called the electron configuration. All electrons in the same shell must have the same energy.[2]
- Electron shells are also sometimes referred to as energy levels.
Advertisement
-
3
What is an atomic orbital? As an atom gains electrons, they fill different orbitals sets according to a specific order. Each set of orbitals, when full, contains an even number of electrons. The orbital sets are:[3]
- The s orbital set (any number in the electron configuration followed by an «s») contains a single orbital, and by Pauli’s Exclusion Principle, a single orbital can hold a maximum of 2 electrons, so each s orbital set can hold 2 electrons.
- The p orbital set contains 3 orbitals, and thus can hold a total of 6 electrons.
- The d orbital set contains 5 orbitals, so it can hold 10 electrons.
- The f orbital set contains 7 orbitals, so it can hold 14 electrons.
- The g, h, i and k orbital sets are theoretical. No known atoms have electrons in any of these orbitals. The g set has 9 orbitals, so it could theoretically contain 18 electrons. The h set would have 11 orbitals and a maximum of 22 electrons, the i set would have 13 orbitals and a maximum of 26 electrons, and the k set would have 15 orbitals and a maximum of 30 electrons.
- Remember the order of the letters with this mnemonic: Sober Physicists Don’t Find Giraffes Hiding In Kitchens.
-
4
What are overlap orbitals? Sometimes, electrons occupy a shared orbital space. Take the Dihydrogen molecule, or H2. The 2 electrons must stay close to each other in order to stay attracted to each other and connect. Since they’re so close, they will occupy the same orbital space, thus sharing the orbital, or overlapping it.[4]
- In your notation, you’d simply change the row number to 1 less than it actually is. For example, the electron configuration for germanium (Ge) is
Even though you go all the way to row 4, there is still a “3d” in the middle there because of overlap.[5]
- In your notation, you’d simply change the row number to 1 less than it actually is. For example, the electron configuration for germanium (Ge) is
-
5
How do you use an electron configuration table? If you’re having trouble visualising your notation, it can be useful to use an electron configuration table so you can actually see what you’re writing. Set up a basic table with the energy levels going down the y-axis and the orbital type going across the x-axis. From there, you can draw your notation in the corresponding spaces as they go down the y-axis and across the x-axis. Then, you can follow the line to get your notation.[6]
- For example, if you were writing out the configuration for beryllium, you’d start up at the 1s, then loop back around to the 2s. Since beryllium only has 4 electrons, you’d stop after that, and get your notion of
- For example, if you were writing out the configuration for beryllium, you’d start up at the 1s, then loop back around to the 2s. Since beryllium only has 4 electrons, you’d stop after that, and get your notion of
Advertisement
-
1
Find your atom’s atomic number. Each atom has a specific number of electrons associated with it. Locate your atom’s chemical symbol on the periodic table. The atomic number is a positive integer beginning at 1 (for hydrogen) and increasing by 1 for each subsequent atom. The atom’s atomic number is the number of protons of the atom—thus, it is also the number of electrons in an atom with 0 charge.[7]
- Since the periodic table is based on electron configuration, you can use it to determine the element’s configuration notation.
-
2
Determine the charge of the atom. Uncharged atoms will have exactly the number of electrons as is represented on the periodic table. However, charged atoms (ions) will have a higher or lower number of electrons based on the magnitude of their charge. If you’re working with a charged atom, add or subtract electrons accordingly: add 1 electron for each negative charge and subtract 1 for each positive charge.[8]
- For instance, a sodium atom with a +1 charge would have an electron taken away from its basic atomic number of 11. So, the sodium atom would have 10 electrons in total.
- A sodium atom with a -1 charge would have 1 electron added to its basic atomic number of 11. The sodium atom would then have a total of 12 electrons.
-
3
Understand electron configuration notation. Electron configurations are written so as to clearly display the number of electrons in the atom as well as the number of electrons in each orbital. Each orbital is written in sequence, with the number of electrons in each orbital written in superscript to the right of the orbital name. The final electron configuration is a single string of orbital names and superscripts.[9]
- For example, here is a simple electron configuration: 1s2 2s2 2p6. This configuration shows that there are 2 electrons in the 1s orbital set, 2 electrons in the 2s orbital set, and 6 electrons in the 2p orbital set. 2 + 2 + 6 = 10 electrons total. This electron configuration is for an uncharged neon atom (neon’s atomic number is 10.)
-
4
Memorize the order of the orbitals. Note that orbital sets are numbered by electron shell, but ordered in terms of energy. For instance, a filled 4s2 is lower energy (or less potentially volatile) than a partially-filled or filled 3d10, so the 4s shell is listed first. Once you know the order of orbitals, you can simply fill them according to the number of electrons in the atom. The order for filling orbitals is as follows: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p, 8s.[10]
- An electron configuration for an atom with every orbital completely filled would be written: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d107p6
- Note that the above list, if all the shells were filled, would be the electron configuration for Og (Oganesson), 118, the highest-numbered atom on the periodic table—so this electron configuration contains every currently known electron shell for a neutrally charged atom.
-
5
Fill in the orbitals according to the number of electrons in your atom. For instance, if we want to write an electron configuration for an uncharged calcium atom, we’ll begin by finding its atomic number on the periodic table. Its atomic number is 20, so we’ll write a configuration for an atom with 20 electrons according to the order above.[11]
- Fill up orbitals according to the order above until you reach 20 total electrons. The 1s orbital gets 2 electrons, the 2s gets 2, the 2p gets 6, the 3s gets 2, the 3p gets 6, and the 4s gets 2 (2 + 2 + 6 +2 +6 + 2 = 20.) Thus, the electron configuration for calcium is: 1s2 2s2 2p6 3s2 3p6 4s2.
- Note: Energy level changes as you go up. For example, when you are about to go up to the 4th energy level, it becomes 4s first, then 3d. After the 4th energy level, you’ll move onto the 5th where it follows the order once again (5s, then 4d). This only happens after the 3rd energy level.
-
6
Use the periodic table as a visual shortcut. You may have already noticed that the shape of the periodic table corresponds to the order of orbital sets in electron configurations. For example, atoms in the second column from the left always end in «s2«, atoms at the far right of the skinny middle portion always end in «d10,» etc. Use the periodic table as a visual guide to write configurations – the order that you add electrons to orbitals corresponds to your position in the table.[12]
- Specifically, the 2 leftmost columns represent atoms whose electron configurations end in s orbitals, the right block of the table represents atoms whose configurations end in p orbitals, the middle portion, atoms that end in d orbital, and the bottom portion, atoms that end in f orbitals.
- For example, when writing an electron configuration for Chlorine, think: «This atom is in third row (or «period») of the periodic table. It’s also in the fifth column of the periodic table’s p orbital block. Thus, its electron configuration will end …3p5
- Caution: the d and f orbital regions of the table correspond to energy levels that are different from the period they’re located in. For instance, the first row of the d orbital block corresponds to the 3d orbital even though it’s in period 4, while the first row of the f orbital corresponds to the 4f orbital even though it’s in period 6.
-
7
Learn shorthand for writing long electron configurations. The atoms along the right edge of the periodic table are called noble gases. These elements are very chemically stable. To shorten the process of writing a long electron configuration, simply write the chemical symbol of the nearest chemical gas with fewer electrons than your atom in brackets, then continue with the electron configuration for the following orbital sets.[13]
- To understand this concept, it’s useful to write an example configuration. Let’s write a configuration for zinc (atomic number 30) using noble gas shorthand. Zinc’s full electron configuration is: 1s2 2s2 2p6 3s2 3p6 4s2 3d10. However, notice that 1s2 2s2 2p6 3s2 3p6 is the configuration for Argon, a noble gas. Just replace this portion of zinc’s electron notation with Argon’s chemical symbol in brackets ([Ar].)
- So, zinc’s electron configuration written in shorthand is [Ar]4s2 3d10.
- Note that if you are doing noble gas notation for, say, argon, you cannot write [Ar]! You have to use the noble gas that comes before that element; for argon, that would be neon ([Ne]).
Advertisement
-
1
Understand the ADOMAH Periodic Table. This method of writing electron configurations doesn’t require memorization. However, it does require a rearranged periodic table, because in a traditional periodic table, beginning with 4th row, period numbers do not correspond to the electron shells. Find an ADOMAH Periodic Table, a special type of periodic table designed by scientist Valery Tsimmerman. It’s easily found via a quick online search.
- In the ADOMAH Periodic Table, horizontal rows represent groups of elements, such as halogens, inert gases, alkali metals, alkaline earths, etc. Vertical columns correspond to electron shells and so called “cascades” (diagonal lines connecting s,p,d and f blocks) correspond to periods.
- Helium is moved next to Hydrogen, since both of them are characterized by the 1s orbital. Blocks of periods (s,p,d and f) are shown on the right side and shell numbers are shown at the base. Elements are presented in rectangular boxes that are numbered from 1 to 120. These numbers are normal atomic numbers that represent total number of electrons in a neutral atom.
-
2
Find your atom in the ADOMAH table. To write electron configuration of an element, locate its symbol in ADOMAH Periodic Table and cross out all elements that have higher atomic numbers. For example, if you need to write electron configuration of Erbium (68), cross out elements 69 through 120.
- Notice numbers 1 through 8 at the base of the table. These are electron shell numbers, or column numbers. Ignore columns which contain only crossed out elements. For Erbium, remaining columns are 1,2,3,4,5 and 6.
-
3
Count orbital sets up to your atom. Looking at the block symbols shown on the right side of the table (s, p, d, and f) and at the column numbers shown at the base and ignoring diagonal lines between the blocks, break up columns into column-blocks and list them in order from the bottom up. Again, ignore column blocks where all elements are crossed out. Write down the column-blocks beginning with the column number followed by the block symbol, like this: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 6s (in case of Erbium).
- Note: The above electron configuration of Er is written in the order of ascending shell numbers. It could also be written in the order of orbital filling. Just follow cascades from top to bottom instead of columns when you write down the column-blocks: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f12.
-
4
Count electrons for each orbital set. Count elements that were not crossed out in each block-column, assigning 1 electron per element, and write down their quantity next to the block symbols for each block-column, like this: 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f12 5s2 5p6 6s2. In our example, this is the electron configuration of Erbium.
-
5
Know irregular electron configurations. There are eighteen common exceptions to electron configurations for atoms in the lowest energy state, also called the ground state. They deviate from the general rule only by last 2 to 3 electron positions. In these cases, the actual electron configuration keeps the electrons in a lower-energy state than in a standard configuration for the atom. The irregular atoms are:
- Cr (…, 3d5, 4s1); Cu (…, 3d10, 4s1); Nb (…, 4d4, 5s1); Mo (…, 4d5, 5s1); Ru (…, 4d7, 5s1); Rh (…, 4d8, 5s1); Pd (…, 4d10, 5s0); Ag (…, 4d10, 5s1); La (…, 5d1, 6s2); Ce (…, 4f1, 5d1, 6s2); Gd (…, 4f7, 5d1, 6s2); Au (…, 5d10, 6s1); Ac (…, 6d1, 7s2); Th (…, 6d2, 7s2); Pa (…, 5f2, 6d1, 7s2); U (…, 5f3, 6d1, 7s2); Np (…, 5f4, 6d1, 7s2) and Cm (…, 5f7, 6d1, 7s2).
Advertisement
-
1
Notating cations: When you’re dealing with cations, it’s very similar to neutral atoms in a grounded state. Start by removing electrons in the outermost p orbital, then the s orbital, then the d orbital.[14]
-
2
Notating anions: When you notate an anion, you have to use the Aufbau Principle, which states that electrons fill the lowest available energy levels first before moving onto higher ones. So, you’d add electrons to the outermost energy level (or the lowest), before moving inwards to add more.[15]
-
3
Chromium and Copper: As with every rule, there are exceptions. Although most elements follow the Aufbau Principle, these elements do not. Instead of going to the lowest energy state, these electrons are added to the level that will make them the most stable. It may be helpful to memorize the notation for these 2 elements, since they defy the rule.[16]
Advertisement
Add New Question
-
Question
In some elements, I have seen beside the electronic configuration, it is written [He], [Ne], etc. What is that supposed to be?
This answer was written by one of our trained team of researchers who validated it for accuracy and comprehensiveness.
wikiHow Staff Editor
Staff Answer
It’s a shorthand notation for the noble gas that comes before the element. It’s basically a way of skipping a step when you write out your notation so you don’t have to spend as much time on it.
-
Question
What is an electron configuration?
An electron configuration is the arrangement of electron of an atom or a molecule in an atomic or molecular orbital.
-
Question
What is the electron configuration of CH4?
CH4 isn’t an atom, but a composite substance. You can only tell the electron configuration of an atom.
See more answers
Ask a Question
200 characters left
Include your email address to get a message when this question is answered.
Submit
Advertisement
-
You can also write an element’s electron configuration by just writing the valence configuration, which is the last s and p orbital set. So, the valence configuration of an antimony atom would be 5s2 5p3.
-
There are also many electron figuration calculators you can use for free online by typing in the element name. However, they won’t usually show their work.
Advertisement
About This Article
Article SummaryX
If you need to write the electron configurations for atoms of any element, find the atom’s atomic number. If you’re working with a charged atom, add one electron for each negative charge and subtract one for each positive charge. Write the electron configuration to display the number of electrons in the atom, divided into orbital sets. The orbital sets go in a predetermined order and have a set number of electrons per set, so fill in the orbitals according to the number of electrons in your atom. If you want to learn how to find an electron configuration using an ADOMAH periodic table, keep reading!
Did this summary help you?
Thanks to all authors for creating a page that has been read 2,695,817 times.