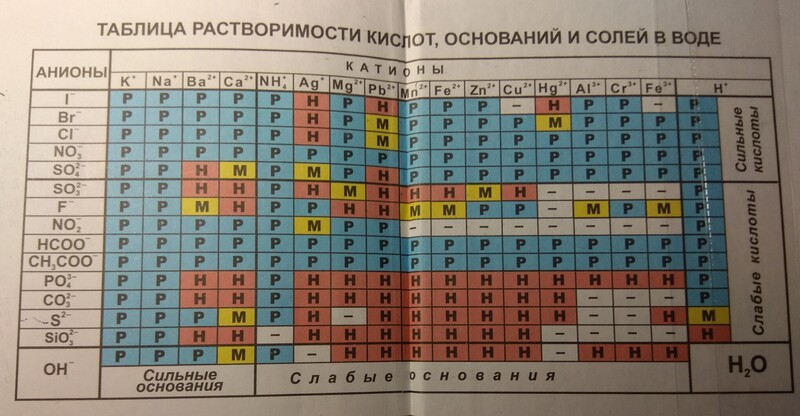
Таблица растворимости солей, кислот и оснований
Растворимость – это способность одного вещества взаимодействовать с другими веществами, образуя при этом однородные растворы.
На сегодняшний день существует таблица способная помочь в определении растворимости химического соединения.
Чтобы пользоваться таблицей не обязательно иметь специальных навыков. Для определения растворимости какого-либо химического вещества, достаточно в таблице провести перпендикуляр от выбранного вещества начиная от крайней левой колонки до химического вещества в верхней колонке. Точка пересечения и укажет нам насколько растворимы выбранные вещества.
Рассмотрим на примере, как пользоваться таблицей растворимости солей, кислот и оснований:
В левой колонке выберем вещество Ba2+, проводим линию до 3-й колонки с веществом F—, на пересечении видим символы «РК». Это означает, что соединение нерастворимо в воде и растворяется только в сильных неорганических кислотах.
Таблица условных обозначений
| Р | растворимо в воде (больше 1 грамма вещества на 100 грамм воды) |
| М | малорастворимо в воде (от 0,001 грамма до 1 грамма вещества в 100 граммах воды) |
| Н | нерастворимо в воде, но хорошо растворимо в слабых кислотах (меньше 0,001 грамма до 1 грамма вещества в 100 граммах воды) |
| РК | нерастворимо в воде, но растворимо в сильных неорганических кислотах |
| НК | химическое вещество не растворимо ни в воде, ни в любых кислотах |
| Г | химическое вещество подвергается гидролизу |
| — | данные о растворимости химического вещества отсутствуют |
Таблица растворимости солей, кислот и оснований по химии
| Катионы |
Анионы | ||||||||||
| OH— | F— | Cl— | Br— | I— | S2- | NO3— | CO32- | SiO32- | SO42- | PO43- | |
| H+ | Р | Р | Р | Р | Р | М | Р | — | Н | Р | Р |
| Na+ | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р |
| K+ | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р |
| NH4+ | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р |
| Mg2+ | Н | РК | Р | Р | Р | М | Р | Н | РК | Р | РК |
| Ca2+ | М | НК | Р | Р | Р | М | Р | Н | РК | М | РК |
| Sr2+ | М | НК | Р | Р | Р | Р | Р | Н | РК | РК | РК |
| Ba2+ | Р | РК | Р | Р | Р | Р | Р | Н | РК | НК | РК |
| Sn2+ | Н | Р | Р | Р | М | РК | Р | Н | Н | Р | Н |
| Pb2+ | Н | Н | М | М | М | РК | Р | Н | Н | Н | Н |
| Al3+ | Н | М | Р | Р | Р | Г | Р | Г | НК | Р | РК |
| Cr3+ | Н | Р | Р | Р | Р | Г | Р | Г | Н | Р | РК |
| Mn2+ | Н | Р | Р | Р | Р | Н | Р | Н | Н | Р | Н |
| Fe2+ | Н | М | Р | Р | Р | Н | Р | Н | Н | Р | Н |
| Fe3+ | Н | Р | Р | Р | — | — | Р | Г | Н | Р | РК |
| Co2+ | Н | М | Р | Р | Р | Н | Р | Н | Н | Р | Н |
| Ni2+ | Н | М | Р | Р | Р | РК | Р | Н | Н | Р | Н |
| Cu2+ | Н | М | Р | Р | — | Н | Р | Н | Н | Р | Н |
| Zn2+ | Н | М | Р | Р | Р | РК | Р | Н | Н | Р | Н |
| Cd2+ | Н | Р | Р | Р | Р | РК | Р | Н | Н | Р | Н |
| Hg2+ | Н | Р | Р | М | НК | НК | Р | Н | Н | Р | Н |
| Hg22+ | Н | Р | НК | НК | НК | РК | Р | Н | Н | М | Н |
| Ag+ | Н | Р | НК | НК | НК | НК | Р | Н | Н | М | Н |
Загрузить PDF
Загрузить PDF
Понятие растворимости используется в химии для описания свойств твердого вещества, которое смешивается с жидкостью и растворяется в ней. Полностью растворимы лишь ионные (заряженные) соединения. Для практических нужд достаточно помнить несколько правил или уметь найти их, чтобы при случае воспользоваться ими и узнать, растворятся или нет те или иные ионные вещества в воде. Фактически, в любом случае растворяется некоторое количество атомов, даже если изменения не заметны, поэтому для проведения точных экспериментов иногда требуется вычислить это количество.
-
1
Узнайте больше об ионных соединениях. В нормальном состоянии каждый атом имеет определенное число электронов, но иногда он может захватить дополнительный электрон или потерять свой.[1]
В результате образуется ион, который имеет электрический заряд. Если ион с отрицательным зарядом (дополнительным электроном) встречает ион с положительным зарядом (без электрона), они связываются вместе, подобно противоположным полюсам двух магнитов. В результате образуется ионное соединение.- Ионы с отрицательным зарядом называются анионами, а ионы с положительным зарядом — катионами.
- В нормальном состоянии количество электронов в атоме равно числу протонов, в результате чего атом электрически нейтрален.
-
2
Узнайте больше о растворимости. Молекулы воды (H2O) обладают своеобразной структурой, что делает их похожими на магнит: с одного конца они имеют положительный, а со второго — отрицательный заряд. При помещении в воду ионного соединения эти водяные «магниты» собираются вокруг его молекул и стремятся оттянуть положительные и отрицательные ионы друг от друга. Молекулы некоторых ионных соединений не очень прочны, и такие вещества растворимы в воде, так как молекулы воды оттягивают ионы друг от друга и растворяют их. В других соединениях ионы связаны крепче, и они нерастворимы, поскольку молекулы воды не в состоянии растащить ионы в стороны.[2]
- В молекулах некоторых соединений внутренние связи сравнимы по силе с действием молекул воды. Такие соединения называют слабо растворимыми, поскольку значительная часть их молекул диссоциирует, хотя другие остаются не растворенными.
-
3
Изучите правила растворимости. Поскольку взаимодействие между атомами описывается довольно сложными законами, не всегда можно сразу сказать, какие вещества растворяются, а какие нет. Найдите один из ионов соединения в приведенном ниже описании того, как обычно ведут себя различные вещества. После этого обратите внимание на второй ион и проверьте, не относится ли данное вещество к исключениям из-за необычного взаимодействия ионов.
- Предположим, вы имеете дело с хлоридом стронция (SrCl2). Найдите в перечисленных ниже шагах (они выделены жирным шрифтом) ионы Sr и Cl. Cl обычно растворим; после этого загляните в приведенные ниже исключения. Ионы Sr там не упомянуты, так что соединение SrCl должно растворяться в воде.
- Ниже соответствующих правил приведены наиболее распространенные исключения. Существуют и другие исключения, однако вы вряд ли столкнетесь с ними на уроках химии или в лаборатории.
-
4
Соединения растворимы, если в их состав входят ионы щелочных металлов, то есть Li+, Na+, K+, Rb+ и Cs+. Это элементы группы IA таблицы Менделеева: литий, натрий, калий, рубидий и цезий. Почти все простые соединения этих элементов растворимы.
- Исключение: соединение Li3PO4 нерастворимо.
-
5
Соединения ионов NO3—, C2H3O2—, NO2—, ClO3— и ClO4— растворимы. Их называют соответственно ионами нитратов, ацетатов, нитритов, хлоратов и перхлоратов. Ион ацетата часто обозначают аббревиатурой OAс.[3]
- Исключения: Ag(OAc) (ацетат серебра) и Hg(OAc)2 (ацетат ртути) нерастворимы.
- AgNO2— и KClO4— лишь слабо растворимы.
-
6
Соединения ионов Cl—, Br— и I— обычно растворимы. Ионы хлора, брома и йода образуют соответственно хлориды, бориды и йодиды, которые называют солями галогенов. Эти соли почти всегда растворимы.
- Исключение: если вторым ионом в паре является ион серебра Ag+, ртути Hg22+ или свинца Pb2+, соль нерастворима. Это же верно и для менее распространенных галогенов с ионами меди Cu+ и таллия Tl+.
-
7
Соединения иона SO42- (сульфаты) обычно растворимы. Как правило, сульфаты растворяются в воде, однако существует несколько исключений.
- Исключения: нерастворимы сульфаты следующих ионов: стронция Sr2+, бария Ba2+, свинца Pb2+, серебра Ag+, кальция Ca2+, радия Ra2+ и двухвалентного серебра Hg22+. Учтите, что сульфат серебра и сульфат кальция все же немного растворяются в воде, и иногда их считают слегка растворимыми веществами.
-
8
Соединения OH— и S2- нерастворимы в воде. Это соответственно ионы гидроксида и сульфида.
- Исключения: помните о щелочных металлах (группа IA) и о том, что почти все их соединения растворимы? Так вот, ионы Li+, Na+, K+, Rb+ и Cs+ образуют растворимые гидроксиды и сульфиды. Кроме того, растворимы соли кальция Ca2+, стронция Sr2+ и бария Ba2+ (группа IIA). Учтите, что значительная часть молекул гидроксидов этих элементов все же не растворяется, поэтому иногда их считают слабо растворимыми.
-
9
Соединения ионов CO32- и PO43- нерастворимы. Эти ионы образуют карбонаты и фосфаты, которые обычно не растворяются в воде.
- Исключения: данные ионы образуют растворимые соединения с ионами щелочных металлов: Li+, Na+, K+, Rb+ и Cs+, а также с аммонием NH4+.
Реклама
-
1
Найдите произведение растворимости Ksp (это постоянная величина). Каждое соединение имеет свою константу Ksp. Ее значения для различных веществ приведены в справочниках и на сайте (на английском языке). Значения произведения растворимости определяются экспериментально и они могут значительно отличаться друг от друга в различных источниках, поэтому лучше пользоваться таблицей для Ksp в вашем учебнике химии, если такая таблица там есть. Если не указано другого, в большинстве таблиц приводится произведение растворимости при температуре 25ºC.
- К примеру, если вы растворяете иодид свинца PbI2, найдите для него произведение растворимости. На сайте bilbo.chm.uri.edu указано значение 7,1×10–9.
-
2
Запишите химическое уравнение. Сначала определите, на какие ионы распадется молекула вещества при растворении. Затем запишите уравнение с Ksp с одной стороны и соответствующими ионами с другой.
- В нашем примере молекула PbI2 расщепляется на ион Pb2+ и два иона I—. При этом достаточно установить заряд лишь одного иона, так как в целом раствор будет нейтральным.
- Запишите уравнение: 7,1×10–9 = [Pb2+][I—]2.
-
3
Преобразуйте уравнение так, чтобы решить его. Перепишите уравнение в простом алгебраическом виде. Используйте при этом то, что вам известно о количестве молекул и ионов. Подставьте вместо числа атомов растворяемого соединения неизвестную величину х и выразите количество ионов через х.
- В нашем примере необходимо переписать следующее уравнение: 7,1×10–9 = [Pb2+][I—]2.
- Поскольку в соединение входит лишь один атом свинца (Pb), число растворенных молекул будет равняться количеству свободных ионов свинца. Таким образом, мы можем приравнять [Pb2+] и x.
- Поскольку на каждый ион свинца приходится два иона йода (I), число атомов йода следует приравнять 2x.
- В результате получается уравнение 7,1×10–9 = (x)(2x)2.
-
4
При необходимости учтите общие ионы. Пропустите данный шаг, если вещество растворяется в чистой воде. Однако если вы используете раствор, который уже содержит один или более интересующих вас ионов (общих ионов), растворимость может значительно снизиться.[4]
Эффект общих ионов особенно заметен для слабо растворимых веществ, и в подобных случаях можно предполагать, что подавляющее большинство растворенных ионов уже присутствовали в растворе ранее. Перепишите уравнение и учтите в нем известные молярные концентрации (молей на литр, или M) уже растворенных ионов. Откорректируйте неизвестные величины х для этих ионов.[5]
- Например, если иодид свинца уже присутствует в растворе с концентрацией 0,2M, следует переписать уравнение следующим образом: 7,1×10–9 = (0,2M+x)(2x)2. Поскольку величина 0,2M намного больше x, можно записать уравнение в виде 7,1×10–9 = (0,2M)(2x)2.
-
5
Решите уравнение. Найдите величину x, чтобы узнать, насколько растворимо данное соединение. Ввиду определения произведения растворимости ответ будет выражен в молях растворенного вещества на литр воды. Для вычисления конечного результата может понадобиться калькулятор.
- Для растворения в чистой воде, то есть при отсутствии общих ионов, находим:
- 7,1×10–9 = (x)(2x)2
- 7,1×10–9 = (x)(4x2)
- 7,1×10–9 = 4x3
- (7,1×10–9)/4 = x3
- x = ∛((7,1×10–9)/4)
- x = 1,2 x 10-3 молей на литр воды. Это очень малое количество, поэтому данное вещество практически нерастворимо.
Реклама
Что вам понадобится
- Таблица произведений растворимости (Ksp) различных соединений.
Советы
- Если имеются экспериментальные данные о растворимости соединения, можно использовать то же уравнение для того, чтобы вычислить произведение растворимости Ksp для данного вещества.[6]
Реклама
Предупреждения
- Несмотря на отсутствие общепринятого согласия насчет терминов, химики согласны относительно большинства веществ. Разногласия могут возникнуть лишь в случае немногих соединений, для которых в различных таблицах приведены разные значения.
- В некоторых довольно старых справочниках соединение NH4OH отнесено к растворимым. Это неверно: хотя и можно выявить ионы NH4+ и OH— в малых количествах, их нельзя выделить, чтобы получить соединение.[7]
Реклама
Об этой статье
Эту страницу просматривали 31 420 раз.
Была ли эта статья полезной?
Растворимость (Р, χ или ks) – это характеристика насыщенного раствора, которая показывает, какая масса растворенного вещества может максимально раствориться в 100 г растворителя. Размерность растворимости — г/ 100 г воды. Поскольку мы определяем массу соли, которая приходится на 100 г воды, в формулу растворимости добавляем множитель 100:
здесь mр.в. – масса растворенного вещества, г
mр-ля – масса растворителя, г
Иногда используют обозначение коэффициент растворимости kS.
Задачи на растворимость, как правило, вызывают сложности, так как эта физическая величина для школьников не очень привычна.
Растворимость веществ в различных растворителях меняется в широких пределах.
В таблице приведена растворимость некоторых веществ в воде при 20oС:
|
Вещество |
Растворимость, г на 100 г H2O |
Вещество |
Растворимость, г на 100 г H2O |
|
NH4NO3 |
177 |
H3BO3 |
6 |
|
NaCl |
36 |
CaCO3 |
0,0006 |
|
NaHCO3 |
10 |
AgI |
0,0000002 |
От чего же зависит растворимость веществ? От ряда факторов: от природы растворенного вещества и растворителя, от температуры и давления. В справочных таблицах предлагается вещества делят на хорошо растворимые, малорастворимые и нерастворимые. Такое деление очень условное, поскольку абсолютно нерастворимых веществ нет. Даже серебро и золото растворимы в воде, однако их растворимость настолько мала, что можно пренебречь ей.
Зависимость растворимости от природы растворенного вещества и растворителя*
Растворимость твердых веществ в жидкостях зависит от структуры твердого вещества (от типа кристаллической решетки твердого вещества). Например, вещества с металлическими кристаллическими решетками (железо, медь и др.) очень мало растворимы в воде. Вещества с ионной кристаллической решеткой, как правило, хорошо растворимы в воде.
Есть замечательное правило: “подобное хорошо растворяется в подобном”. Вещества с ионным или полярным типом связи хорошо растворяются в полярных растворителях. Например, соли хорошо растворимы в воде. В то же время неполярные вещества, как правило, хорошо растворяются в неполярных растворителях.
Большинство солей щелочных металлов и аммония хорошо растворимы в воде. Хорошо растворимы почти все нитраты, нитриты и многие галогениды (кроме галогенидов серебра, ртути, свинца и таллия) и сульфаты (кроме сульфатов щелочноземельных металлов, серебра и свинца). Для переходных металлов характерна небольшая растворимость их сульфидов, фосфатов, карбонатов и некоторых других солей.
Растворимость газов в жидкостях также зависит от их природы. Например, в 100 объемах воды при 20oС растворяется 2 объема водорода, 3 объема кислорода. В тех же условиях в 1 объеме Н2О растворяется 700 объемов аммиака.
Влияние температуры на растворимость газов, твердых веществ и жидкостей*
Растворение газов в воде вследствие гидратации молекул растворяемого газа сопровождается выделением теплоты. Поэтому при повышении температуры растворимость газов понижается.
Температура различным образом влияет на растворимость твердых веществ в воде. В большинстве случаев растворимость твердых веществ возрастает с повышением температуры. Например, растворимость нитрата натрия NaNO3 и нитрата калия КNO3 при нагревании увеличивается (процесс растворения протекает с поглощением теплоты). Растворимость NaCl при увеличении температуры возрастает незначительно, что связано с почти нулевым тепловым эффектом растворения поваренной соли.
Влияние давления на растворимость газов, твердых веществ и жидкостей*
На растворимость твердых и жидких веществ в жидкостях давление практически не оказывает влияния, так как изменение объема при растворении невелико. При растворении газообразных веществ в жидкости происходит уменьшение объема системы, поэтому повышение давления приводит к увеличению растворимости газов. В общем виде зависимость растворимости газов от давления подчиняется закону У. Генри (Англия, 1803 г.): растворимость газа при постоянной температуре прямо пропорциональна его давлению над жидкостью.
Закон Генри справедлив лишь при небольших давлениях для газов, растворимость которых сравнительно невелика и при условии отсутствия химического взаимодействия между молекулами растворяемого газа и растворителем.
Влияние посторонних веществ на растворимость*
В присутствии в воде других веществ (солей, кислот и щелочей) растворимость газов уменьшается. Растворимость газообразного хлора в насыщенном водном растворе поваренной соли в 10 раз меньше. Чем в чистой воде.
Эффект понижения растворимости в присутствии солей называется высаливанием. Понижение растворимости обусловлено гидратацией солей, что вызывает уменьшение числа свободных молекул воды. Молекулы воды, связанные с ионами электролита, уже не являются растворителем для других веществ.
Примеры задач на растворимость
Задача 1. Массовая доля вещества в насыщенном растворе равна 24% при некоторой температуре. Определите коэффициент растворимости этого вещества при данной температуре.
Решение:
Для определения растворимости вещества примем массу раствора равной 100 г. Тогда масса соли равна:
mр.в. = mр-ра⋅ωр.в. = 100⋅0,24 = 24 г
Масса воды равна:
mводы = mр-ра – mр.в. = 100 — 24 = 76 г
Определяем растворимость:
χ = mр.в./mр-ля⋅100 = 24/76⋅100 = 31,6 г вещества на 100 г воды.
Ответ: χ = 31,6 г
Еще несколько аналогичных задач:
2. Массовая доля соли в насыщенном растворе при некоторой температуре равна 28,5%. Определите коэффициент растворимости вещества при этой температуре.
3. Определите коэффициент растворимости нитрата калия при некоторой температуре, если массовая доля соли при этой температуре равна 0,48.
4. Какая масса воды и соли потребуется для приготовления 500г насыщенного при некоторой температуре раствора нитрата калия, если его коэффициент растворимости при этой температуре равен 63,9г соли в 100г воды?
Ответ: 194,95 г
5. Коэффициент растворимости хлорида натрия при некоторой температуре составляет 36г соли в 100г воды. Определите молярную концентрацию насыщенного раствора этой соли, если плотность раствора 1,2 г/мл.
Ответ: 5,49М
6. Какая масса соли и 5% раствора её потребуется для приготовления 450г насыщенного при некоторой температуре раствора сульфата калия, если его коэффициент растворимости при этой температуре равен 439г/1000г воды?
7. Какая масса нитрата бария выделится из раствора, насыщенного при 100ºС и охлаждённого до 0ºС, если во взятом растворе было 150мл воды? Коэффициент растворимости нитрата бария при температурах 0ºС и 100ºС равен соответственно 50г и 342г в 100г воды.
8. Коэффициент растворимости хлорида калия при 90ºС равен 500г/л воды. Сколько граммов этого вещества можно растворить в 500г воды при 90ºС и какова его массовая доля в насыщенном растворе при этой температуре?
9. В 500г воды растворено при нагревании 300г хлорида аммония. Какая масса хлорида аммония выделится из раствора при его охлаждении до 50ºС, если коэффициент растворимости соли при этой температуре равен 50г/л воды?
* Материалы портала onx.distant.ru
Таблица растворимости
Скачать изображение
Растворимость — это свойство вещества растворяться в воде или другом растворителе. В воде могут растворяться и
твёрдые и жидкие и газообразные вещества. По растворимости все вещества делятся на три группы:
- хорошо растворимые
- мало растворимые
- нерастворимые
Абсолютно нерастворимых веществ несуществует, поэтому название нерастворимые условно и нужно читать
«практически нерастворимые».
Растворимость веществ зависит от температуры зависит от температуры и давления, так, например, вещество KNO3
(нитрат калия) при температуре +20°C имеет растворимость 31,6 г / 100 г воды, а при температуре +100°C — 245 г / 100 г воды.
Нерастворимые вещества
Твёрдые
- Стекло
- Сера
- Золото
Жидкие
- Бензин
- Растительное масло
Малорастворимые вещества
Твёрдые
- Алебастр
- Сульфат свинца
Жидкие
- Диэтиловый эфир
- Бензол
Газообразные
- Метан
- Азот
- Кислород
Растворимые вещества
Твёрдые
- Соль
- Медный купорос
Газообразные
- Хлороводород
- Аммиак
|
Катионы Анионы |
OH— | F— | Cl— | Br— | I— | S2- | NO3— | CO32- | SiO32- | SO42- | PO43- |
| H+ | Р | Р | Р | Р | Р | М | Р | — | Н | Р | Р |
| Na+ | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р |
| K+ | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р |
| NH4+ | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р |
| Mg2+ | Н | РК | Р | Р | Р | М | Р | Н | РК | Р | РК |
| Ca2+ | М | НК | Р | Р | Р | М | Р | Н | РК | М | РК |
| Sr2+ | М | НК | Р | Р | Р | Р | Р | Н | РК | РК | РК |
| Ba2+ | Р | РК | Р | Р | Р | Р | Р | Н | РК | НК | РК |
| Sn2+ | Н | Р | Р | Р | М | РК | Р | Н | Н | Р | Н |
| Pb2+ | Н | Н | М | М | М | РК | Р | Н | Н | Н | Н |
| Al3+ | Н | М | Р | Р | Р | Г | Р | Г | НК | Р | РК |
| Cr3+ | Н | Р | Р | Р | Р | Г | Р | Г | Н | Р | РК |
| Mn2+ | Н | Р | Р | Р | Р | Н | Р | Н | Н | Р | Н |
| Fe2+ | Н | М | Р | Р | Р | Н | Р | Н | Н | Р | Н |
| Fe3+ | Н | Р | Р | Р | — | — | Р | Г | Н | Р | РК |
| Co2+ | Н | М | Р | Р | Р | Н | Р | Н | Н | Р | Н |
| Ni2+ | Н | М | Р | Р | Р | РК | Р | Н | Н | Р | Н |
| Cu2+ | Н | М | Р | Р | — | Н | Р | Г | Н | Р | Н |
| Zn2+ | Н | М | Р | Р | Р | РК | Р | Н | Н | Р | Н |
| Cd2+ | Н | Р | Р | Р | Р | РК | Р | Н | Н | Р | Н |
| Hg2+ | Н | Р | Р | М | НК | НК | Р | Н | Н | Р | Н |
| Hg22+ | Н | Р | НК | НК | НК | РК | Р | Н | Н | М | Н |
| Ag+ | Н | Р | НК | НК | НК | НК | Р | Н | Н | М | Н |
|
Катионы Анионы |
OH— | F— | Cl— | Br— | I— | S2- | NO3— | CO32- | SiO32- | SO42- | PO43- |
Таблица 1. Растворимость веществ
|
Список растворимости элементов
Скачать статью в формате PDF.















