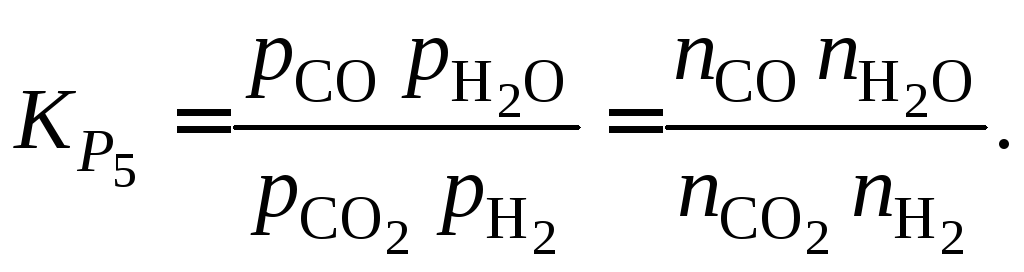Рекомендуемые сообщения
Решение задач по фото за 30 минут! Мы онлайн – кликай!
-
- Поделиться
при 63 градусах по Цельсию Кр=1,27 для реакции N2O4(г)—>2NO2(г)
определить равновесные парциальные давления газов,если общее давление в состоянии равновесия было 1 атм
Ссылка на комментарий
—>
-
- Поделиться
при 63 градусах по Цельсию Кр=1,27 для реакции N2O4(г)—>2NO2(г)
определить равновесные парциальные давления газов,если общее давление в состоянии равновесия было 1 атм
Запиши закон действующих масс для твоей реакции, обозначь парциальное давление NO2 через х и реши квадратное уравнение. Вот вроде и вся задача.
Ссылка на комментарий
- Автор
-
- Поделиться
Запиши закон действующих масс для твоей реакции, обозначь парциальное давление NO2 через х и реши квадратное уравнение. Вот вроде и вся задача.
а подробнее можно?
Ссылка на комментарий
-
- Поделиться
Kр=p2(NO2)/p(N2O4). Пусть парциальное давление NO2 будет х. Так в состоянии равновесия общее давление 1 атм, то парциальное давление N2O4 будет 1-х. Получаем квадратное уравнение: х2/(1-х)=1,27. Решаем квадратное уравнение как в школе и получаем ответ
Ссылка на комментарий
- Автор
-
- Поделиться
Kр=p2(NO2)/p(N2O4). Пусть парциальное давление NO2 будет х. Так в состоянии равновесия общее давление 1 атм, то парциальное давление N2O4 будет 1-х. Получаем квадратное уравнение: х2/(1-х)=1,27. Решаем квадратное уравнение как в школе и получаем ответ
так вывести его в квадратное не пойму как,помоги уж до конца,спасибо)
Ссылка на комментарий
-
- Поделиться
так вывести его в квадратное не пойму как,помоги уж до конца,спасибо)
x2+1.27x-1.27=0. Решать само уравнение не буду!!!!! В 9 классе это проходят. Открываешь книгу по математике за 9 класс ну или хотя бы в интернете смотришь и сам решаешь
Ссылка на комментарий
- Автор
-
- Поделиться
x2+1.27x-1.27=0. Решать само уравнение не буду!!!!! В 9 классе это проходят. Открываешь книгу по математике за 9 класс ну или хотя бы в интернете смотришь и сам решаешь
спасибо!!!!!!!!!!!попробую сам)))))))
Ссылка на комментарий
- Автор
-
- Поделиться
спасибо!!!!!!!!!!!попробую сам)))))))
квадратное уравнение подразумевает 2 ответа,а какой в решение задачи вставлять?
Ссылка на комментарий
- Автор
-
- Поделиться
x2+1.27x-1.27=0. Решать само уравнение не буду!!!!! В 9 классе это проходят. Открываешь книгу по математике за 9 класс ну или хотя бы в интернете смотришь и сам решаешь
квадратное уравнение подразумевает 2 ответа,а какой в решение задачи вставлять?
Ссылка на комментарий
-
- Поделиться
квадратное уравнение подразумевает 2 ответа,а какой в решение задачи вставлять?
А ты подумай, может ли быть парциальное давление отрицательной величиной?
Ссылка на комментарий
Для публикации сообщений создайте учётную запись или авторизуйтесь
Вы должны быть пользователем, чтобы оставить комментарий
Войти
Уже есть аккаунт? Войти в систему.
Войти
Материалы из методички: Сборник задач по теоретическим основам химии для студентов заочно-дистанционного отделения / Барботина Н.Н., К.К. Власенко, Щербаков В.В. – М.: РХТУ им. Д.И. Менделеева, 2007. -155 с.
Понятие химического равновесия
Признаки химического равновесия
Принцип Ле Шателье
Влияние температуры на химическое равновесие
Влияние давления на химическое равновесие
Влияние концентрации на химическое равновесие
Константа химического равновесия
Примеры решения задач
Задачи для самостоятельного решения
Понятие химического равновесия
Равновесным считается состояние системы, которое остается неизменным, причем это состояние не обусловлено действием каких-либо внешних сил. Состояние системы реагирующих веществ, при котором скорость прямой реакции становится равной скорости обратной реакции, называется химическим равновесием. Такое равновесие называется еще подвижным или динамическим равновесием.
Признаки химического равновесия
- Состояние системы остается неизменным во времени при сохранении внешних условий.
- Равновесие является динамическим, то есть обусловлено протеканием прямой и обратной реакции с одинаковыми скоростями.
- Любое внешнее воздействие вызывает изменение в равновесии системы; если внешнее воздействие снимается, то система снова возвращается в исходное состояние.
- К состоянию равновесия можно подойти с двух сторон – как со стороны исходных веществ, так и со стороны продуктов реакции.
- В состоянии равновесия энергия Гиббса достигает своего минимального значения.
Принцип Ле Шателье
Влияние изменения внешних условий на положение равновесия определяется принципом Ле Шателье (принципом подвижного равновесия):
Если на систему, находящуюся в состоянии равновесия, производить какое–либо внешнее воздействие, то в системе усилится то из направлений процесса, которое ослабляет эффект этого воздействия, и положение равновесия сместится в том же направлении.
Принцип Ле Шателье применим не только к химическим процессам, но и к физическим, таким как кипение, кристаллизация, растворение и т. д.
Рассмотрим влияние различных факторов на химическое равновесие на примере реакции окисления NO:
2NO(г) + O2(г) → 2NO2(г); ΔHо298 = — 113,4 кДж/моль.
Влияние температуры на химическое равновесие
При повышении температуры равновесие сдвигается в сторону эндотермической реакции, при понижении температуры – в сторону экзотермической реакции.
Степень смещения равновесия определяется абсолютной величиной теплового эффекта: чем больше по абсолютной величине энтальпия реакции ΔH, тем значительнее влияние температуры на состояние равновесия.
В рассматриваемой реакции синтеза оксида азота (IV) повышение температуры сместит равновесие в сторону исходных веществ.
Влияние давления на химическое равновесие
Сжатие смещает равновесие в направлении процесса, который сопровождается уменьшением объема газообразных веществ, а понижение давления сдвигает равновесие в противоположную сторону.
В рассматриваемом примере в левой части уравнения находится три объема, а в правой – два. Так как увеличение давления благоприятствует процессу, протекающему с уменьшением объема, то при повышении давления равновесие сместится вправо, т.е. в сторону продукта реакции – NO2. Уменьшение давления сместит равновесие в обратную сторону. Следует обратить внимание на то, что, если в уравнении обратимой реакции число молекул газообразных веществ в правой и левой частях равны, то изменение давления не оказывает влияния на положение равновесия.
Влияние концентрации на химическое равновесие
Для рассматриваемой реакции введение в равновесную систему дополнительных количеств NO или O2 вызывает смещение равновесия в том направлении, при котором концентрация этих веществ уменьшается, следовательно, происходит сдвиг равновесия в сторону образования NO2. Увеличение концентрации NO2 смещает равновесие в сторону исходных веществ.
Катализатор одинаково ускоряет как прямую, так и обратную реакции и поэтому не влияет на смещение химического равновесия.
При введении в равновесную систему (при Р = const) инертного газа концентрации реагентов (парциальные давления) уменьшаются. Поскольку рассматриваемый процесс окисления NO идет с уменьшением объема, то при добавлении инертного газа равновесие сместится в сторону исходных веществ.
Константа химического равновесия
Для химической реакции:
2NO(г) + O2(г) → 2NO2(г)
константа химической реакции Кс есть отношение:
Кс = [NO2]2/([NO]2 · [O2]) (1)
В этом уравнении в квадратных скобках – концентрации реагирующих веществ, которые устанавливаются при химическом равновесии, т.е. равновесные концентрации веществ.
Константа химического равновесия связана с изменением энергии Гиббса уравнением:
ΔGTо = – RTlnK (2)
Примеры решения задач
Задача 1. При некоторой температуре равновесные концентрации в системе 2CO (г) + O2 (г)→2CO2 (г) составляли: [CO] = 0,2 моль/л, [O2] = 0,32 моль/л, [CO2] = 0,16 моль/л. Определите константу равновесия при этой температуре и исходные концентрации CO и O2, если исходная смесь не содержала СО2.
Решение.
2CO(г) + O2(г) →2CO2(г)
|
Вещество |
CO | O2 | CO2 |
| Сисходн, моль/л | 0,36 | 0,40 | 0 |
| Спрореагир,моль/л | 0,16 | 0,08 | 0,16 |
| Сравн, моль/л | 0,2 | 0,32 | 0,16 |
Во второй строке под Спрореагир понимается концентрация прореагировавших исходных веществ и концентрация образующегося CO2, причем, Сисходн= Спрореагир + Сравн.
Задача 2. Используя справочные данные, рассчитайте константу равновесия процесса
3 H2 (г) + N2 (г) →2 NH3 (г) при 298 К.
Решение.
ΔG298о = 2·(- 16,71) кДж = -33,42·103 Дж.
ΔGTо = — RTlnK.
lnK = 33,42·103/(8,314× 298) = 13,489. K = 7,21× 105.
Задача 3. Определите равновесную концентрацию HI в системе
H2(г) + I2(г) →2HI(г),
если при некоторой температуре константа равновесия равна 4, а исходные концентрации H2 , I2 и HI равны, соответственно, 1, 2 и 0 моль/л.
Решение. Пусть к некоторому моменту времени прореагировало x моль/л H2.
| Вещество | H2 | I2 | HI |
| сисходн., моль/л | 1 | 2 | 0 |
| спрореагир., моль/л | x | x | 2x |
| cравн., моль/л | 1-x | 2-x | 2x |
Тогда, К = (2х)2/((1-х)(2-х))
Решая это уравнение, получаем x = 0,67.
Значит, равновесная концентрация HI равна 2× 0,67 = 1,34 моль/л.
Задача 4. Используя справочные данные, определите температуру, при которой константа равновесия процесса: H2(г) + HCOH(г) →CH3OH(г) становится равной 1. Принять, что ΔНоТ » ΔНо298, а ΔSоT » ΔSо298.
Решение.
Если К = 1, то ΔGоT = — RTlnK = 0;
ΔGоT = ΔНо298 — ТΔ Sо298 .
ΔНо298 = -202 – (- 115,9) = -86,1 кДж = — 86,1× 103 Дж;
ΔSо298 = 239,7 – 218,7 – 130,52 = -109,52 Дж/К;
0 = — 86100 — Т·(-109,52)
Т = 786,15К
Задача 5. Для реакции SO2(Г) + Cl2(Г) →SO2Cl2(Г) при некоторой температуре константа равновесия равна 4. Определите равновесную концентрацию SO2Cl2, если исходные концентрации SO2, Cl2 и SO2Cl2 равны 2, 2 и 1 моль/л соответственно.
Решение. Пусть к некоторому моменту времени прореагировало x моль/л SO2.
SO2(г) + Cl2(г) →SO2Cl2(г)
| Вещество | SO2 | Cl2 | SO2Cl2 |
| cисходн., моль/л | 2 | 2 | 1 |
| cпрореагир., моль/л | x | x | х |
| cравн., моль/л | 2-x | 2-x | x + 1 |
Тогда получаем:
(х + 1)/(2 — х)2 = 4
Решая это уравнение, находим: x1 = 3 и x2 = 1,25. Но x1 = 3 не удовлетворяет условию задачи.
Следовательно, [SO2Cl2] = 1,25 + 1 = 2,25 моль/л.
Задачи для самостоятельного решения
1. В какой из приведенных реакций повышение давления сместит равновесие вправо? Ответ обоснуйте.
1) 2 NH3 (г) → 3H2 (г) + N2 (г)
2) ZnCO3 (к) → ZnO(к) + CO2 (г)
3) 2HBr (г) → H2 (г) + Br2 (ж)
4) CO2 (г) + C (графит) →2CO (г)
|
Так как увеличение давления благоприятствует процессу, протекающему с уменьшением количества |
2. При некоторой температуре равновесные концентрации в системе:
2HBr (г) →H2 (г) + Br2 (г)
составляли: [HBr] = 0,3 моль/л, [H2] = 0,6 моль/л, [Br2] = 0,6 моль/л. Определите константу равновесия и исходную концентрацию HBr.
3. Для реакции H2(г) + S(г) →H2S(г) при некоторой температуре константа равновесия равна 2. Определите равновесные концентрации H2 и S, если исходные концентрации H2, S и H2S равны, соответственно, 2, 3 и 0 моль/л.
4. Используя справочные данные, вычислите температуру, при которой константа равновесия процесса
CO2(г) + C(графит) →2CO(г)
становится равной 1. Примите, что ΔНоТ≈ΔНо298, а ΔSоT≈ΔSо298
5. Используя справочные данные, рассчитайте константу равновесия процесса:
С2Н4(г) →С2Н2(г) + Н2(г) при 298 К
6. Для реакции 2С3Н8(г) → н-С5Н12(г)+СН4(г) при температуре 1000 К константа равновесия равна 4. Определите равновесную концентрацию н-пентана, если исходная концентрация пропана равна 5 моль/л.
7. При температуре 500 К константа равновесия процесса:
СО2(г) + 3Н2(г) → СН3ОН(г) + Н2О(г)
равна 3,4·10-5. Вычислите Δ Gо500.
8. При температуре 800 К константа равновесия процесса н-С6Н14(г)+ 2С3Н6(г)+Н2(г) равна 8,71. Определите ΔGоf,800(С3Н6(г)), если ΔGоf,800(н-С6Н14(г)) = 305,77 кДж/моль.
9. Для реакции СО(г) + Cl2(г) →СO2Cl2(г) при некоторой температуре равновесная концентрация СO2Cl2(г) равна 1,2 моль/л. Определите константу равновесия данного процесса, если исходные концентрации СО(г) и Cl2(г) равны соответственно 2,0 и 1,8 моль/л.
10. При некоторой температуре равновесные концентрации в системе 2SО2(г) + О2(г) →2SO3(г) составляли: [SО2 ]=0,10 моль/л, [О2]=0,16 моль/л, [SО3]=0,08 моль/л. Вычислите константу равновесия и исходные концентрации SО2 и О2.
|
К=4,0; исходная концентрация SО2 составляет 0,18 моль/л; |
Р
Рис. 1.5. Схема
сложного
Равновесия в системе с – н – о
ешение.В общем случае при горении
метана образуется сложная газовая
смесь, содержащая все реагенты реакций
(1)–(12) и азот воздуха. При пиролизе
метана или при распаде СО в системе
может появиться твердый углерод. В этом
случае устанавливается сложное равновесие
(рис. 1.5) как сочетание
частных равновесий.
В данной задаче будем считать,
что по кинетическим
причинам образование твердого углерода
заторможено. Равновесия с участием
Стврассматривать не будем.
Данная система С – Н – О – Nявляется 4 компонентной ()
и однофазной (n =
1), значит, пятивариантной ().
Для анализа необходимо знание пяти
независимых параметров. ВыбираемР,Т,,
,
Тогданеизвестными
оказываются
равновесныедавления
.
Система уравнений связи:





Можно заметить, что возможна запись
констант равновесия других 3 реакций.
Однако следует проверить: действительно
ли выбранные реакции независимы.
Исходное состояние смеси удобно записать
в виде:
.
Тогда концентрационные параметры:



1.3.2. Упрощения расчетов равновесного состава газовой фазы
Часто содержания компонентов в газовых
фазах металлургических систем – величины
разного порядка. При температурах
пирометаллургических процессов
и
весьма
малы. Тогда в системе С – Н – О
расчет основан на реакциях (5) и (10). Эти
реакции являются регулирующими состав
в газовых атмосферах при использовании
природного газа или увлажненного дутья
в доменной печи, углеводородного топлива
и других углеродсодержащих материалов
в конвертере и других
металлургических агрегатах и системах.
Р
Рис.
1.6. Равновесные отношения pCO/pCO2
и pH2/pH2O
в газовой смеси
CO –
CO2
–
H2
–
H2O
при различных
температурах
еакция (5), называемая реакцией
водяного газа, определяет соотношение
между углеродсодержащими газами СО – СО2и водородсодержащими Н2 – Н2О
в равновесных сложных газовых смесях.
При этом из выражения константы равновесия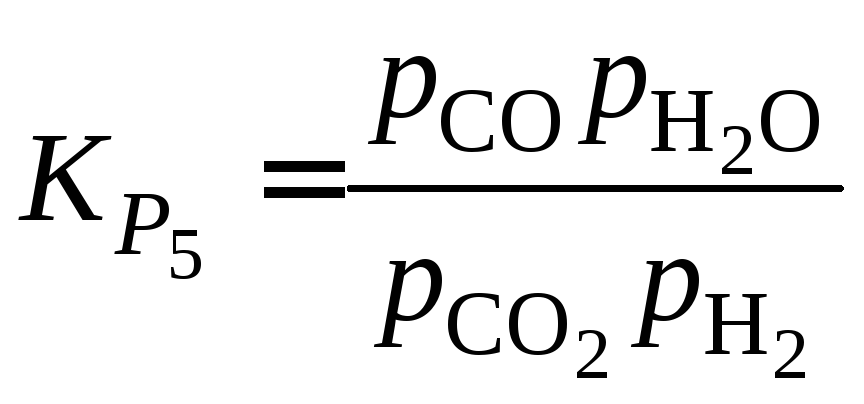
(при введении обозначений
и
).
Функциюможно представить графически (рис. 1.6).
Для расчетаприменяют уравнение
,
полученное из выражения
при подстановке в него зависимости
(см. пример 1.4).
Следует отметить,
что представленные
простейшие изотермические зависимости
дают строгую связь отношений
и
,
но указывают и на неопределенность
равновесных составов газовых смесей.
Из графика при заданной температуре
и значенииможно определить равновесное сx
отношение
и наоборот. Зная состав газовой атмосферы
металлургического агрегата или
системы, можно на основе графика решить
вопрос о равновесности газовой фазы и
спрогнозировать протекание процессов
изменения ее состава и свойств.
Если одно из отношений при определенной
температуре на графике не соответствует
другому, то смесь неравновесна. Ее
следует рассматривать как исходную,
и выполнить расчет
равновесного состава сложного газа.
Все точки на изотермической прямой
соответствуют состояниям системы
с одним и тем же значением.
Это означает, что различные по составу
двухкомпонентные смеси характеризуются
одинаковым сродством к кислороду и
одинаковыми окислительно-восстановительными
свойствами. При 1093 К, как было
отмечено в примере
1.1,
сродство к кислороду у водорода и СО
одинаково, и это проявляется
на графике равенством отношений (),
так как
при 1093 К.
При всех других температурах равноценные
по окислительно-восстановительным
свойствам смеси имеют разные составы.
Например, из графика следует, что
смеси Н2– Н2О с
отношением
при 1400
К соответствует смесь СО – СО2с отношением
.
Пример 1.8. Привести методику расчета
состава равновесной газовой фазы,
образующейся из смеси СО2и Н2в отношении 3:1 при 1400 К. Определить
равновесное давление кислорода.
Решение.
Записываем уравнение реакции водяного
газа (5) и вводим обозначения, характеризующие
исходное и равновесное состояния
газовой фазы:
исходный состав, моль 3 1
– –
равновесный состав, моль 3 – x
1 –x x x

Отсюда получаем
квадратное уравнение
.
Константу равновесия=2,417
при 1400 Квычисляем
из выражения .Подставляя
в уравнение(1.12),
находим х =
0,858. Равновесный состав газа, мол. (об.)
%:
.
Равновесное давление кислорода находим
из выражений для константы равновесия
и
реакции (1):
,
где константа равновесия
при 1400 К.
Тогда

Вычисленное значение
подтверждает весьма низкие содержания
молекулярного кислорода в высокотемпературной
газовой фазе системы
.
Пример 1.9.Рассчитать состав
равновесной газовой фазы, образующейся
из смеси природного
газа и воздуха, подаваемой в нагревательную
печь в соотношении 1:5. Температура печи
поддерживается постоянной и равной
1600 К. ДавлениеР=1 атм. Вычислить
равновесные давления кислорода и метана
в газовой смеси.
Исходный состав
природного газа: 83 об. % СН4;
16 об. % С2Н6;
1 об. % N2.
Состав воздуха: 21 об. % О2;
79 об. % N2.
Решение.
Считаем, что содержания СН4,
С2Н6и О2в равновесной
смеси ничтожно малы. АзотN2не реагирует, и его количество в
равновесной и исходной смесях одно и
то же.
Тогда равновесие
определяется реакцией водяного газа
(5). При указанных упрощениях необходимо
вычислить 4 неизвестные величины,
определяющие содержание компонентов,
указанных в уравнении(5).
Выражаем константу равновесия через
количество молей реагентов
Записываем еще три необходимые уравнения
на основе материального баланса по
каждому элементу в газовой фазе:
«Штрих» относится к исходному составу
газовой смеси.
В расчете на 1 моль природного газа
исходная смесь содержит:
моль;
моль;
моль;
3,96 моль.
Тогда
(1.13)
(1.14)
.(1.15)
Из выражения
(см. пример 1.8) для
К

Решение системы 4
уравнений (1.13–1.16) возможно на ЭВМ. Можно
также после преобразований получить и
решить квадратное уравнение:

из которого
моль.
Количества остальных реагентов из
уравнений (1.13–1.16):;
;
моль.
С учетоммоль мольные доли
газов равновесной смеси равны:
и соответствуют мольному (объемному)
составу (%) смеси:
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
§3. Состояние термодинамического равновесия
Пусть в сосуде объёма VV находится некоторое количество газа, состоящего из нейтральных молекул. Допустим также, что нам известен химический состав данного газа (например, азот N2mathrm N_2 или углекислый газ CO2mathrm{CO}_2).
Равновесное состояние любого тела в термодинамике определяется некоторым (небольшим) количеством физических величин, полностью характеризующих это состояние. Эти величины принято называть параметрами состояния, или просто параметрами. Например, для описания состояния газа в сосуде используют давление газа, занимаемый им объём и его температуру.
Состоянием термодинамического равновесия системы (в том числе и газа) называется состояние, характеризуемое тем, что в нём все макроскопические процессы прекращаются, а давление и температура принимают значения, постоянные по всему объёму системы.
Если давление газа в любой точке сосуда принимает одно и то же значение, то в сосуде не происходит движения отдельных частей газа, т. е. имеет место механическое равновесие. Это верно для сосудов обычных размеров, если пренебречь незначительным изменением давления с высотой, возникающим под действием силы тяжести.
Если температура газа во всём объёме одинакова, то не происходит теплопередачи от одной части газа к другой, т. е. наступает тепловое равновесие.
Как показывает опыт, в состоянии теплового равновесия три параметра состояния газа (давление, температура и объём) не являются независимыми друг от друга. Если некоторое количество газа заключено в сосуде определённого объёма при определённой температуре, то газ имеет и вполне определённое давление. При изменении температуры газа или его объёма давление газа также изменяется, принимая новое, вполне определённое значение. Эта связь между тремя параметрами (объёмом VV, давлением pp, и температурой TT) не зависит от того, каким способом были достигнуты два параметра. Такую связь между параметрами газа в самом общем виде для постоянной массы газа называют уравнением состояния газа. Конкретный вид уравнения состояния получают на основании данных опытов, в которых устанавливаются закономерности поведения газа при изменении какого-либо параметра состояния.