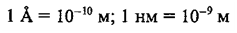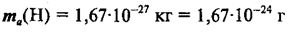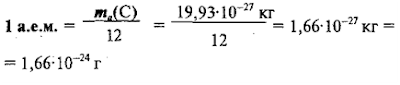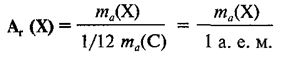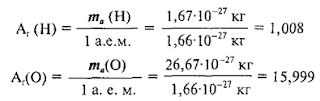Одной из важных постоянных атомной физики является постоянная Авогадро (см. том I, § 242) — число структурных элементов (атомов, молекул, ионов и т. п.) в моле вещества. Зная постоянную Авогадро, можно найти величины, характеризующие отдельный атом: массу и размеры атома, заряд иона и т. п.
Существует ряд способов измерения постоянной Авогадро. В них используются физические явления различного рода. К числу таких явлений относятся броуновское движение частиц, взвешенных в жидкости или газе (см. том I, §219), радиоактивность (см. гл. XXII), рассеяние света в газах и др. Наиболее точным методом определения этой постоянной является метод, основанный на дифракции рентгеновского излучения.
Из оптики (см. гл. XVII) мы знаем, что рентгеновское излучение представляет собой электромагнитные волны, отличающиеся от видимого света значительно меньшей длиной волны. Волновая природа рентгеновского излучения была установлена впервые в опытах по дифракции на кристаллах. Эти опыты одновременно подтвердили справедливость представления о кристаллах как о совокупности правильно расположенных атомов, образующих пространственную решетку (см. том I, §266).
Пучок рентгеновских лучей, падающих на кристалл, рассеивается по преимуществу в некоторых избранных направлениях (см. § 154). Углы рассеяния определяются длиной волны рентгеновского излучения и расстоянием между соседними атомами в кристалле. Если одна из этих величин известна, то, измерив углы рассеяния, можно определить вторую.
Длину волны рентгеновского излучения измеряют с большой точностью по дифракции на обыкновенной штриховой решетке, подобной решеткам, применяемыми оптике (см. §§ 135 и 138). Зная же длину волны рентгеновского излучения, мы можем определить межатомное расстояние в кристалле. В кристаллах типа каменной соли
атомы расположены по вершинам куба со стороной, равной кратчайшему межатомному расстоянию
. Объем кристалла, приходящийся на один атом, составляет
, на одну молекулу
. Пусть объем кристаллического вещества, количество которого равно 1 молю, есть
. Тогда постоянную Авогадро можно найти по формуле
Все разнообразные способы измерения постоянной Авогадро приводят к одному и тому же значению. По современным измерениям значение это равно
Согласие различных способов определения постоянной Авогадро (равно как и согласие различных способов измерения масс, размеров и скоростей атомов) является убедительным доказательством справедливости атомистической теории вещества.
Обратим внимание на резкое различие сжимаемости газов, с одной стороны, и жидкостей и твердых тел, с другой стороны.
Согласно закону Бойля — Мариотта (см. том I, §226) для уменьшения объема газа на
достаточно на
увеличить давление. В твердых же телах и жидкостях уменьшение объема на
требует увеличения давления в десятки и сотни раз (исходное давление предполагается атмосферным). Это различие объясняется тем, что молекулы газов находятся на расстояниях, которые во много раз превосходят размеры молекул. Их сближению препятствует тепловое движение. Силы же взаимодействия между молекулами газа, находящимися на больших расстояниях друг от друга, настолько слабы, что их можно не учитывать. Наоборот, в жидкостях и в твердых телах атомы (или молекулы) можно рассматривать как расположенные почти «вплотную». При сближении атомов (молекул) возникают огромные силы отталкивания, которые и затрудняют уменьшение объема этих тел.
Таким образом, среднее расстояние между центрами соседних атомов твердого или жидкого тела можно приближенно считать линейным размером атома. Зная постоянную Авогадро, легко вычислить это расстояние.
Моль вещества содержит
атомов и занимает объем
, где
— плотность вещества,
— его молярная масса. Придадим молю вещества форму куба. На ребре куба уложится
атомов; длина ребра будет равна корню кубическому из объема куба, т. е.
. Поделив длину ребра на число атомов на нем, получим среднее расстояние между центрами соседних атомов, которое мы принимаем за приближенный размер атома. Это расстояние
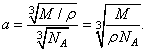
Для жидкого водорода (при температуре
), подставляя
и
, находим
Для других элементов расчет дает сходные значения. Мы можем заключить, что линейные размеры всех атомов близки к
.
Зная постоянную Авогадро, можно также определить массу атома:
.
Эта формула дает нам среднее значение массы атома. Вопрос о том, одинаковы ли все атомы данного элемента по массе или нет, должен быть решен опытом (см. § 195).
Легчайшим из атомов является атом водорода, относительная атомная масса которого равна
и, следовательно,
. Разделив это значение
на
получим массу атома водорода:
УЧЕБНАЯ КНИГА ПО ХИМИИ
ДЛЯ УЧИТЕЛЕЙ СРЕДНИХ ШКОЛ,
СТУДЕНТОВ ПЕДАГОГИЧЕСКИХ ВУЗОВ И ШКОЛЬНИКОВ 9–10
КЛАССОВ,
РЕШИВШИХ ПОСВЯТИТЬ СЕБЯ ХИМИИ И ЕСТЕСТВОЗНАНИЮ
УЧЕБНИКЗАДАЧНИК
ЛАБОРАТОРНЫЙ ПРАКТИКУМ
НАУЧНЫЕ РАССКАЗЫ ДЛЯ ЧТЕНИЯ
Продолжение. См. № 4–14, 16–28, 30–34, 37–44, 47,
48/2002;
1, 2, 3,
4, 5, 6, 7, 8, 9, 10, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22/2003
§ 5.3 Вещество
в кристаллическом состоянии
(продолжение)
ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ
1. Определение межъядерного расстояния в
кристаллическом железе.
В этой экспериментальной работе вы
познакомитесь с определением плотности металла
– очень важной характеристикой, благодаря
которой можно судить, например, о составе и
времени изготовления металлического изделия.
Когда и от кого пошло восклицание «Эврика!»?
Древнегреческий ученый Архимед родился в
Сиракузах (остров Сицилия) около 287 г. до н. э. и был
убит римским солдатом при взятии города во время
2-й Пунической войны. Последние слова Архимеда:
«Не трогай мои чертежи». Архимеду приписывают
фразу: «Дай мне, где стать, и я сдвину Землю».
Архимед нашел решение задачи об определении
количества золота и серебра в жертвенной короне
сиракузского правителя Гиерона, когда принимал
ванну. Он побежал нагим домой с криком «Эврика!»,
что значит «Нашел!». Попытайтесь в самом общем
виде рассказать, как Архимед доказал, что в
короне было больше серебра, чем требовалось.
Вам предстоит настоящее научное
исследование!
Работу выполняют небольшой группой – 2–4
человека. Внимательно прочитайте описание
работы, составьте подробный план эксперимента
(имея в наличии образец металла и мерную посуду) и
предварительно распределите обязанности (кто
что будет делать).
Эксперимент заключается в определении плотности
металла, позволяющей, воспользовавшись числом
Авогадро, рассчитать межъядерное расстояние, т.
е. расстояние между ядрами атомов в кристалле или
молекуле. Это расстояние и является одной из
постоянных характеристик данного вещества.
Размеры атомов и молекул выражают разными
единицами: сантиметрами (см), нанометрами
(1 нм = 1•10–9 м) и пикометрами (1 пм = 1•10–12
м). Раньше широко использовали внесистемную
единицу длины – ангстрем
Возьмите кусок металла (железа, меди, алюминия,
свинца), например, железный шарик от большого
подшипника. Можно воспользоваться толстым
железным гвоздем, предварительно отпилив его
шляпку и острие, чтобы получился цилиндр.
Определите взвешиванием массу взятого металла.
Определите объем измеренной массы того же
металла. Если имеющийся металл имеет форму
правильной геометрической фигуры – куба, шара,
цилиндра или другой, измерьте ее размеры
линейкой или штангенциркулем. Воспользовавшись
математическими познаниями, рассчитайте объем
заготовки.
Вы можете взять большую автомобильную гайку
или винт, кусок свинцовой оплетки от кабеля.
Необязательно брать металл в виде одного куска,
можно взять горсть гвоздей, мелких шариков, дроби
и т. п. Если вы имеете кусок металла неправильной
формы или мелкие куски (шарики, винтики, гайки,
гвозди, скрепки и т.п., изготовленные из одного
металла, а не сплава), вам следует самим
предложить способ определения объема металла
известной массы (вы уже успели взвесить горсть
или кучку кусочков металла, ничего не потеряв?).
Можно поступить так. Заполните измерительный
цилиндр примерно наполовину водой и запишите ее
объем (точнее!). Поместите кусочки металла в
цилиндр с водой, чтобы вода покрывала металл, и
запишите полученный объем воды и металла. Чему
равен объем металла? Может случиться, что воды
окажется меньше и она не покроет весь металл. Как
поступить тогда? Подумайте.
В другой измерительный цилиндр налейте точно
известный объем воды и вылейте в цилиндр с
металлом столько воды, чтобы она покрывала
металл. Запишите положения уровней воды в обоих
цилиндрах. Теперь вы можете рассчитать объем
воды в цилиндре с металлом и объем, занимаемый
водой и металлом. Найдите объем металла и, зная
его массу, определите его плотность.
Далее рассчитайте объем, который приходился бы
на число Авогадро атомов металла. Определите
объем, приходящийся на один атом, и вычислите
межъядерное расстояние, приравняв его к длине
ребра куба, заключающего внутри себя атом.
Имейте в виду, что этот метод определения
межъядерных расстояний приближенный. Тем не
менее вычисленные этим методом межъядерные
расстояния в кристаллах металлов хорошо
совпадают с полученными другими методами.
Вместо железа можно взять другие металлы – медь,
свинец, даже золото и серебро.
Как определить размеры одного атома, например,
железа? Вам известно, что 1 моль Fe имеет массу
55,845 г.; плотность железа была определена ранее
экспериментально. (По справочным данным
кристаллическое железо имеет плотность= 7,87 г/см3). Вычислим
объем 1 моль железа:55,845 (г)/7,87 (г/см3) = 7,1 см3.
Определим объем, приходящийся на долю одного
атома в кристаллической структуре железа. Для
этого разделим объем 1 моль атомов (мольный объем)
на число Авогадро атомов:7,1 (см3)/6,02•1023 = 1,18•10–23 см3.
Будем считать, что атом представляет собой шар,
вписанный в куб. Приравняем длину ребра куба, т. е.
диаметр атома, к корню кубическому из
полученного объема:
Таким образом, диаметр атома железа в кристалле
приближенно равен 0,000000023 см. Это и есть
межъядерное расстояние. Полученное число – не
диаметр изолированного атома, т. к. электронные
оболочки атомов представляют собой нечто
похожее на облака с сильно размытыми краями. В
строгой научной литературе по химии и физике не
пользуются выражениями «диаметр атома» или
«радиус атома», а применяют термин «межъядерное
расстояние» и обозначение l («эль»). Почему
диаметр атома железа D и его межъядерное
расстояние l равны, вам станет ясно из рис. 5.6.
По справочным данным радиус атома железа равен
124,1 пм = 1,24•10–8 см, поэтому межъядерное
расстояние равно 2,48•10–8 см.
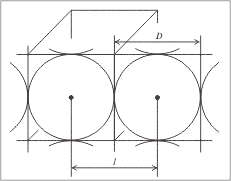 |
Рис. 5.6.
|
Выразите межъядерное расстояние в
кристаллическом железе в различных единицах
измерения.
2. Изучение межъядерных расстояний других
элементов
Проследим изменение межъядерных расстояний на
примере элементов 4-го периода, находящихся в
кристаллическом состоянии (при обычной
температуре):
| Элемент | Радиус, см | Межъядерное расстояние, см |
|
|---|---|---|---|
| Калий | К | 2,27•10–8 | 4,54•10–8 |
| Кальций | Са | 1,97•10–8 | 3,94•10–8 |
| Скандий | Sc | 1,61•10–8 | 3,22•10–8 |
| Титан | Ti | 1,44•10–8 | 2,88•10–8 |
| Ванадий | V | 1,32•10–8 | 2,64•10–8 |
| Хром | Cr | 1,24•10–8 | 2,48•10–8 |
| Марганец | Mn | 1,24•10–8 | 2,48•10–8 |
| Железо | Fe | 1,24•10–8 | 2,48•10–8 |
| Кобальт | Co | 1,25•10–8 | 2,50•10–8 |
| Никель | Ni | 1,24•10–8 | 2,48•10–8 |
| Медь | Cu | 1,28•10–8 | 2,56•10–8 |
| Цинк | Zn | 1,33•10–8 | 2,66•10–8 |
| Галлий | Ga | 1,22•10–8 | 2,44•10–8 |
| Германий | Ge | 1,23•10–8 | 2,46•10–8 |
| Мышьяк | As | 1,25•10–8 | 2,50•10–8 |
| Селен | Se | 2,15•10–8 | 4,30•10–8 |
Нарисуйте график изменения
межъядерных расстояний при переходе от калия к
селену. Если вам удастся объяснить ход изменения
межъядерных расстояний, то вы поймете некоторые
особенности построения периодической таблицы
элементов Д.И.Менделеева.
Если вам в будущем придется приготовлять сплавы
различных металлов, то сведения по радиусам
атомов помогут вам предсказать свойства сплавов.
Сплавы металлов – твердые системы, образованные
из двух и более металлов (а также металлов и
неметаллов). Сплавы обладают лучшими свойствами
по сравнению с составляющими их металлами. Одна
из классификаций сплавов основана на числе фаз,
составляющих сплав. Если в сплаве только одна
фаза, то это однофазная система, или твердый
раствор одного металла в другом.
Несколько слов скажем о твердых растворах.
Полная взаимная растворимость металлов в любых
соотношениях наблюдается редко. Такое может быть
у компонентов, близких по свойствам. Например,
золото и серебро могут растворяться друг в друге
в любых соотношениях, т. к. они находятся в одной
подгруппе и размеры их атомов близки (1,442•10–8
и 1,444•10–8 см соответственно).
Твердый раствор – фаза
переменного состава, в которой атомы различных
элементов размещены в общей кристаллической
решетке. Различают твердые растворы замещения
и внедрения.
Твердый раствор замещения образуется при
расположении атомов растворяемого металла в
заселяемых местах (узлах) решетки растворяющего
металла. Радиусы атомов в таких растворах
отличаются друг от друга не более чем на 15% (для
сплавов железа – не более чем на 8%). Предскажите,
какие твердые растворы могут быть образованы
приведенными выше металлами. Другое важное
требование для образования твердых растворов
замещения – металлы должны быть
электрохимически подобны, т. е. находиться не
слишком далеко друг от друга в ряду напряжений
(точнее, в ряду электродных потенциалов).
Твердый раствор внедрения образуется в
результате того, что атомы растворяемого металла
размещаются в пустотах между заселяемыми
местами (узлами) кристаллической решетки. Размер
атомов растворяемого металла не должен быть
больше чем на 63% размера атома растворяющего
металла.
О.С.ЗАЙЦЕВ
Размер атома определяется радиусом его внешней электронной оболочки. Размеры всех атомов ~ 10‑10 м. А размер ядра на 5 порядков меньше, всего — 10-15 м. Наглядно это можно представить так: если атом увеличить до размеров 20-этажного дома, то ядро атома будет выглядеть как миллиметровая пылинка в центральной комнате этого дома. Однако трудно вообразить дом, масса которого практически полностью сосредоточена в этой пылинке. А атом именно таков.
Атомы очень маленькие и очень легкие. Атом во столько раз легче яблока, во сколько раз яблоко легче земного шара. Если мир «потяжелеет» так, что атом станет весить как капля воды, то люди в таком мире станут тяжелыми, как планеты: дети — как Меркурий и Марс, а взрослые — как Венера и Земля.
Рассмотреть атом нельзя даже с помощью микроскопа. Лучшие оптические микроскопы позволяют различить детали объекта, если расстояние между ними ~0,2 мкм. В электронном микроскопе это расстояние удалось уменьшить до ~2-3 Å. Различить и сфотографировать отдельные атомы впервые удалось с помощью ионного проектора. Но никто не видел, как устроен атом внутри. Все данные о строении атомов получены из опытов по рассеянию частиц.
Масса атомного ядра в несколько тысяч раз больше массы его электронной оболочки. Это связано с тем, что ядра атомов состоят из очень тяжелых, по сравнению с электроном, частиц — протонов p и нейтронов n. Их массы почти одинаковы и примерно в 2000 раз больше массы электрона. При этом протон — положительно заряженная частица, а нейтрон — нейтральная. Заряд протона по величине равен заряду электрона. Число протонов в ядре равно числу электронов в оболочке, это и обеспечивает электрическую нейтральность атома. Число нейтронов может быть различным, в ядре атома легкого водорода нейтронов нет совсем, а в ядре атома углерода их может быть и 6, и 7, и 8.
Масса электрона me ≈ 0,91 • 10-30 кг, масса протона mp ≈ 1,673 • 10-27 кг = 1836 me, масса нейтрона mn = 1,675 • 10‑27кг ≈ 1840 me.
Масса атома меньше суммы масс ядра и электронов на величину Δm, называемую дефектом масс, который возникает из-за кулоновского взаимодействия ядра и электронов. Дефект масс у атомов (в отличие от ядер) очень мал, и, хотя он увеличивается с ростом Z, ни у одного атома не превышает массы электрона. Материал с сайта http://worldofschool.ru
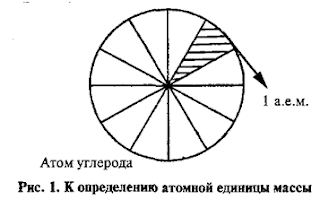
Конечно, атом нельзя положить на весы и взвесить, он слишком мал. Массы атомов сначала определили химики. Причем измерили они их в относительных единицах, приняв за единицу массу атома водорода и воспользовавшись законом Дальтона, согласно которому химические вещества образуются при соединении атомов химических элементов в строго определенной пропорции. И сейчас массы атомов чаще всего измеряют в относительных единицах, но в качестве атомной единицы массы (а. е. м.) используют 1/12 массы атома углерода C12,1 а. е. м. = 1,66057 • 10-27 кг.
2.2. Размеры атомов. Абсолютные и
относительные атомные массы
Атомы
различных элементов имеют разные размеры и разные массы. Так как атомы имеют
форму шара, их размеры характеризуются диаметром
или радиусом.
Для выражения
малых величин часто используются единицы длины, которые называются ангстренами и нанометрами (нм):
Массы
атомов также являются очень малыми величинами. Массы атомов, которые выражены в
обычных единицах массы (кг или г), называются абсолютными атомными массами и обозначаются символом mа.
Самую
маленькую массу имеет атом водорода:
Абсолютные
массы атомов углерода и кислорода имеют следующие значения:
Использовать
такие малые величины очень неудобно. Поэтому в химии вместо абсолютных атомных
масс обычно используются относительные
атомные массы.
За
единицу атомных масс принимается 1/12 часть абсолютной массы атома углерода С. Если представить атом углерода в виде шарика
и мысленно разделить его на 12 равных частей, то масса одной части и есть атомная единица массы.
Абсолютной
единицей массы (а.е.м.) – это 1/12 часть абсолютной массы атома углерода.
Зная
абсолютную массу атома углерода, можно выразить а.е.м. в кг
или г:
Относительная
атомная масса элемента – это число, которое показывает, во сколько раз
абсолютная масса атома данного элемента больше 1/12 части абсолютной массы
атома углерода, т.е. атомной единицы массы.
Относительная
атомная масса обозначается символом Аr
( индекс «r» — первая буква англ.слова – относительный).
Относительная
атомная масса элемента Х равна:
Рассчитаем,
например, относительные атомные массы водорода и кислорода:
Таким
образом, масса атома водорода приблизительно равна массе 1/12 части атома
углерода, а масса атома кислорода приблизительно в 16 раз больше массы 1/12
части атома углерода.
Обратите
внимание,
что относительные атомные массы элементов, как и любые относительные величины,
являются безразмерными.
Обычно
используют приблизительные значения относительных атомных масс.
УПРАЖНЕНИЯ
1.
Определите
массу одного атома кальция.
Решение: Атомная масса кальция составляет Аr (Са)=40
г/моль. Масса одного атома кальция окажется равной:
m(Ca)= Аr(Ca) :
NA =40 : 6,02·1023 = 6,64·10-23 г.
____________________________________________________________
2.
Определите
массу одной молекулы серной кислоты.
Решение: Молярная масса серной кислоты равна Мr
(H2SO4) = 98. Масса одной молекулы m(H2SO4)
равна:
m(H2SO4) = Мr(H2SO4)
: NA = 98:6,02·1023 = 16,28·10-23 г.
___________________________________________________________
3.
Относительная
молярная масса серной кислоты:
Мr(H2SO4)
= 2Ar(H) + Ar(S) + 4Ar(O) = 2·1
+ 32 + 4·16 = 98.
Решение: Величины абсолютных масс атомов и молекул
находятся делением массы 1 моль вещества на число Авогадро.
________________________________________________________________
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
1.
Чем
характеризуются размеры атомов.
2.
Какие единицы
длины используются для выражения диаметров или радиусов атомов.
3.
Что называется
абсолютной атомной массой.
4.
Какие атомные
массы обычно используют в химии.
5.
Что принимают
за единицу атомных масс.
6.
Что такое
относительная атомная масса химического элемента. Каким символом она
обозначается.
7.
Диаметр атома
хлора равен 1,8 * 10-8см. Выразите его в ангстремах и нанометрах.
8.
Сколько
ангстремов и нанометров в а) 1 м; б) 1
см.
9.
Рассчитайте,
сколько атомных единиц массы в: а) 1 кг;
б) 1 г.
10.
Используя
относительные атомные массы элементов (см. табл.), рассчитайте, во сколько раз
масса атома меди больше массы а) атома серы;
б) атома кислорода; в) атома
водорода.
|
1. В каких единицах не может выражаться масса атомов и молекул: |
|
|
а) г |
б) а.е.м. |
|
в) кг |
г) моль |
|
2. Чему равна масса атома фтора: |
|
|
а) 19 |
б) 19 а.е.м. |
|
в) 19 г |
г) 19 кг |
|
3. Масса молекулы фосфора при некоторых условиях |
|
|
а) 2 |
б) 4 |
|
в) 3 |
г) 8 |
|
4. В результате протекания любой химической реакции |
|
|
а) число молекул |
б) число атомов |
|
в) нет верного ответа |
г) природа веществ |
|
5. Относительная атомная масса элемента: |
|
|
а) единица измерения – г/моль |
б) равна отношению массы атома к 1 |
|
в) единица измерения — моль |
г) равна отношению массы атома к массе |
|
6. Атом какого |
|
|
а) серы |
б) кислорода |
|
в) азота |
г) неона |
|
7. Масса молекулы О3 равна: |
|
|
а) 16 а.е.м. |
б) 32 а.е.м. |
|
в) 48 |
г) 7,97*10-23 г |
|
8. Что означает запись 4CO2: |
|
|
а) |
б) восемь молекул кислорода |
|
в) |
г) |
|
9. Сколько атомов серы в 5Na2S2O3: |
|
|
а) 15 |
б) 10 |
|
в) 5 |
г) 7 |
|
10. Относительная атомная |
|
|
а) 32 |
б) 16 |
|
в) 32 г/моль |
г) 16 |
Ответы:
|
1 |
г |
|
2 |
б |
|
3 |
а |
|
4 |
б |
|
5 |
б |
|
6 |
б |
|
7 |
г |
|
8 |
а |
|
9 |
б |
|
10 |
а |
Как найти радиус атома
Атом представляет собою ту мельчайшую частицу вещества, которая является носителем его химических свойств. В упрощенном виде его можно представить как микроскопическую модель Солнечной системы, где роль Солнца исполняет атомное ядро, состоящее из протонов и нейтронов (за исключением водорода, ядром которого является один-единственный протон), а роль планет – электроны, вращающиеся вокруг этого ядра. То есть «границей» атома является орбита его внешнего электрона. А можно ли определить радиус атома?
Инструкция
Для упрощения решения представьте, что атом имеет шарообразную форму. То есть его внешний электрон вращается вокруг ядра по круговой орбите (что в реальности бывает далеко не всегда).
Затем возьмите Таблицу Менделеева, чтобы определить молярную массу элемента, радиус атома которого нас интересует. Обозначьте ее буквой m, к примеру. Вспомните, что молярная масса выражается в граммах на моль, то есть указывает, сколько граммов вещества содержится в одном его моле.
Потом вам надо вспомнить само определение моля и его связь с универсальным числом Авогадро, которое приблизительно равно 6,022*10 в степени 23. Иными словами, та самая молярная масса m, определенная по Таблице Менделеева, содержит 6,022*10 в степени 23 атомов этого вещества.
После чего вам необходимо узнать его плотность. Для этого воспользуйтесь любым химическим или техническим справочником. Обозначьте плотность буквой ρ, например. А для чего вам надо было узнавать этот параметр? Зная плотность ρ, зная молярную массу m, вы в одно действие найдете, какой объем v занимает один моль этого вещества по следующей формуле v=m/ρ.
Ну, а для чего вам надо знать объем, занимаемый одним молем вещества? Зная, в каком объеме содержится то самое число Авогадро атомов этого вещества, вы без малейшего труда посчитаете, какой объем занимает один атом (имеющий строго шарообразную форму). Иными словами, объем одного атома равен m/6,022*10 в степени 23ρ.
Учитывая, что формула объема шара — 4πRв степени 3/3, вы без малейшего труда вычислите, чему равен этот самый радиус. Преобразуя равенство, вы получите следующее решение:
R в степени 3 = 3m/4πρх6,022*10 в степени 23
Извлеките из полученного результата кубический корень, и вот он – искомый радиус атома!
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.