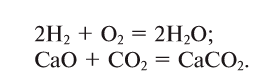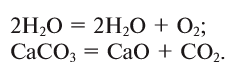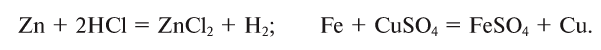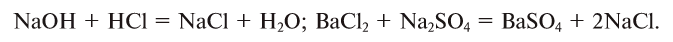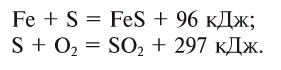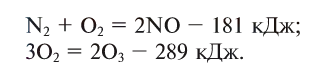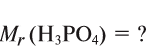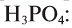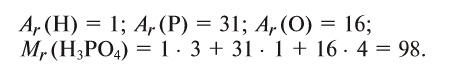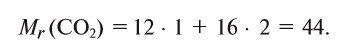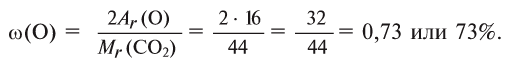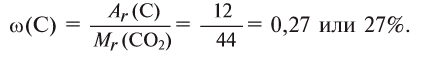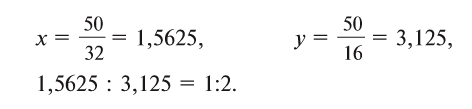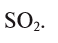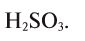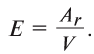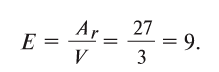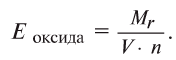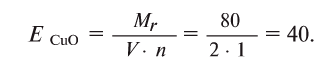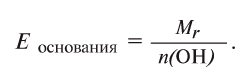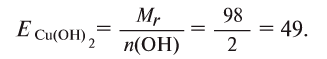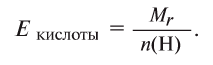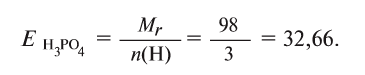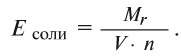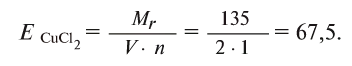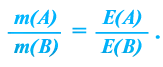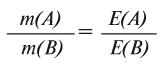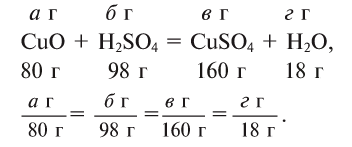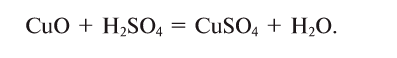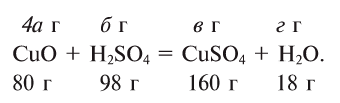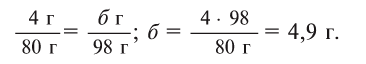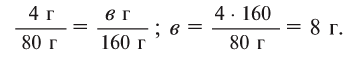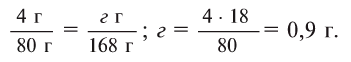Содержание:
Типы химических реакций: присоединения, разложения, обмена и замещения:
Химические реакции подразделяются на несколько типов в зависимости от вступающих в реакцию исходных веществ (реагентов), количества образующихся продуктов реакции и выделения или поглощения энергии.
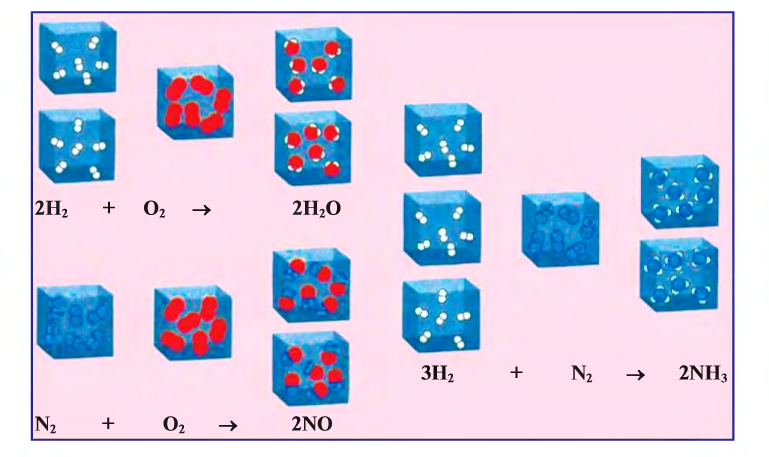
Рис. 17. Образование различных веществ (реакции присоединения)
По количеству образующихся и вступающих в реакцию компонентов их можно разделить на следующие типы:
Реакции присоединения
1. В реакциях присоединения (рис. 17) из одного или нескольких исходных веществ получается одно новое вещество: А + В + … = С:
Реакции разложения
2. В реакциях разложения из одного вещества образуется несколько новых веществ: С = А + В …:
Реакции замещения
3. В реакциях замещения простое вещество, вступая в реакцию со сложным веществом, занимает место в составе сложного вещества, в результате образуются новое простое и сложное вещества: АВ + С = АС + В:
Реакции обмена
4. В реакциях обмена составные части сложных веществ взаимообмениваются: АВ + CD = AD + ВС:
В процессе протекания химических реакций может выделяться или поглощаться тепло.
Энергия, выделяющаяся в процессе химической реакции, называется химической энергией.
Химическая энергия может быть превращена в тепловую, световую, механическую и электрическую энергию.
В большинстве случаев химическая энергия превращается в тепловую энергию и наоборот.
Рис. 18. Экзотермические реакции
Количество выделяемой или поглощаемой во время химической реакции энергии называется тепловым эффектом (Q).
Тепловой эффект наблюдается в результате разрыва или возникновения химической связи и количественно выражается в килоджоулях (кДж).
Реакции, сопровождающиеся выделением тепла (энергии), называются экзотермическими (ekzo — наружу) (см. рис. 18). В этих реакциях тепловой эффект изображается знаком «+» (плюс).
Реакции, сопровождающиеся поглощением тепла (энергии), называются эндотермическими (endo — внутрь). В таких реакциях тепловой эффект обозначается знаком «—» (минус):
Расчет относительной молекулярной массы и количества вещества
Для определения относительной молекулярной массы вещества 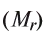
Например,
Зная относительную атомную массу водорода, фосфора и кислорода, вычисляем относительную молекулярную массу
1. Определите относительную молекулярную массу следующих веществ:
Расчет массовой доли элементов в сложных веществах
Массовые доли (содержание) элементов в составе вещества выражаются в процентах (%).
Найдем процент содержания (со) углерода и кислорода в углекислом газе
Расчет:
1. Вычисляем относительную молекулярную массу
2. Находим массовую долю кислорода в
3. Находим массовую долю углерода в
О т в е т: 73% О и 27% С.
1. Определите массовые доли элементов, входящих в состав следующих веществ:
2. Каковы массовые доли (%) S и О в составе оксида серы (IV)?
3. На предприятии «Ферганаазог» производится минеральное удобрение 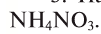
4. В каком из этих удобрений процентная доля азота наибольшая: 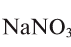
Определение формулы вещества по количественным отношениям входящих в его состав элементов
1. Определите формулу соединения, в состав которого входит 50% серы и 50% кислорода.
Вычисление:
Из условия задания известно, что вещество содержит атомы серы (S) и кислорода (О). Следовательно, формулу вещества можно изобразить как 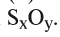
Отсюда формула вещества —
2. Определите формулу соединения, содержащего 2,4% Н, 39,1% S и 58,5% О.
Расчет:
Известно, что в состав вещества входят атомы Н, S и О. Искомая формула вещества будет иметь вид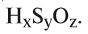
Из этого следует, что формула вещества —
Вычисление эквивалента простых и сложных веществ
Определение эквивалента простых веществ и элементов.
Эквивалент химического элемента (£) — отношение атомной массы 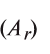
Пользуясь этой формулой, можно легко вычислить эквивалент элемента. Например, Аг алюминия — 27, а его валентность V — 3. Подставляя эти значения в формулу, находим его эквивалент:
Если элемент обладает переменной валентностью, то меняется и его эквивалент. Например, медь может иметь валентность 1 и 2, при этом в первом случае ее эквивалент будет равен 64, а во втором — 32.
Определение эквивалента оксидов
Чтобы определить эквивалент оксида, необходимо его относительную молекулярную массу 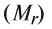
Например, эквивалент оксида меди (СиО) будет равен:
Определение эквивалента оснований
Для определения эквивалента оснований следует относительную молекулярную массу вещества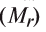
Например, эквивалент гидроксида меди 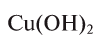
Определение эквивалента кислот
Для определения эквивалента кислот нужно относительную молекулярную массу вещества 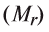
Например, эквивалент 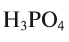
32’66′
Определение эквивалента солей
Для определения эквивалента солей следует относительную молекулярную массу вещества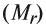
Например, эквивалент хлорида меди (II)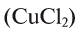
Решение задач на закон эквивалентов
Под эквивалентностью вещества понимают количество участвующего в определенной реакции вещества с 1 г водорода 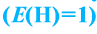
Вещества вступают в реакции пропорционально их эквивалентам.
При вступлении в реакцию вещества A и вещества В математическое выражение их эквивалентной закономерности будет следующим:
1. В составе оксида алюминия имеется 52,94% алюминия и 47,06% кислорода. Найдите эквивалент алюминия, если известно, что эквивалент кислорода равен 8.
Решение:
Из условия задачи известно массовое соотношение А1 и О: 52,94 : 47,06
В соответствии с формулой
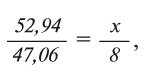
Следовательно, эквивалент алюминия А1 равен 9.
Расчеты по уравнениям химических реакций и закону сохранения массы
Массы всех веществ, участвующих в химических реакциях, находятся в постоянных пропорциональных соотношениях. Например:
Если известно количество хотя бы одного вступающего в реакцию вещества, то можно рассчитать количество других участвующих в реакции веществ.
Пример:
Сколько граммов 
Решение:
Напишем уравнение реакции:
Под формулами участвующих в реакции веществ запишем значения их молярных масс. Над уравнением запишем приведенные в условиях задачи значения масс веществ и те, которые необходимо найти:
Теперь находим, сколько серной кислоты нужно для реакции. Для этого составляем пропорцию и решаем ее:
Далее рассчитываем, сколько образуется сернокислой меди (II):
Теперь находим количество образовавшейся воды:
Ответ: 4,9 г серной кислоты, 8 г сульфата меди и 0,9 г воды.
- Атом в химии
- Кислород как химический элемент
- Водород как химический элемент
- Вода в химии и её элементный состав, молекулярное строение, формула и молярная масса
- Основные законы и понятия химии
- Место химии в системе наук
- Перспективы химического производства
- Высоко-молекулярные соединения
Химические реакции в органической химии можно классифицировать по изменению состава веществ.
Реакции без изменения состава веществ
Без изменения состава органических веществ происходят реакции изомеризации. В таких реакциях изменяется порядок соединения атомов или их расположение в пространстве. Пример:
CH2=CH−CH2−CH3бутен−1⟶500°CSiO2CH3−CH=CH−CH3бутен−2.
Реакции с изменением состава веществ
1. Реакции присоединения
В реакциях присоединения участвуют ненасыщенные вещества, к молекулам которых присоединяется водород, галогены, галогеноводород, вода и другие вещества. В каждом случае реакции имеют особые названия.
К реакциям присоединения можно отнести и полимеризацию, так как в этом случае тоже происходит соединение молекул ненасыщенных веществ.
Названия и примеры реакций присоединения приведены в таблице.
|
Гидрирование |
CH3−CHO+H2→CH3−CH2OH |
|
Галогенирование |
CH2=CH−CH3+Br2→CH2Br−CHBr−CH3 |
|
Гидрогалогенирование |
CH≡CH+HCl→CH2=CHCl |
|
Гидратация |
CH2=CH2+H2O→CH3−CH2OH |
|
Полимеризация |
nCH2=CHCl→(−CH2−CHCl−)n |
2. Реакции отщепления
К этому типу относятся реакции, в ходе которых от органического соединения отделяется часть атомов. В названиях реакций на отщепление указывает приставка де-.
|
Дегидрирование |
CH3−CH2−CH3→CH2=CH−CH3+H2 |
|
Дегидрогалогенирование |
CH2Br−CH3+NaOH⟶спиртCH2=CH2+NaBr |
|
Дегидратация |
CH3−CH2OH⟶H2SO4(конц.),170°CCH2=CH2+H2O |
3. Реакции разложения
Отдельно можно выделить группу реакций, в которых происходит частичный или полный разрыв углеродной цепи. К этой группе относятся процессы, которые происходят при промышленной переработке углеводородов.
|
Пиролиз (разложение веществ при нагревании) |
C8H18⟶t8C+9H2 |
|
Крекинг (разрыв углеродной цепи) |
CH3−CH2−CH2−CH3⟶tCH3−CH3+CH2=CH2 |
4. Реакции замещения
В органической химии замещением называют реакцию, в результате которой происходит замещение атома или группы атомов в органическом веществе. В таких реакциях могут участвовать как простые, так и сложные вещества. К реакциям замещения можно отнести также реакции поликонденсации.
Примеры реакций замещения приведены в таблице.
|
Реакция между сложным и простым веществами |
2CH3COOH+Mg→(CH3COO)2Mg+H2 |
|
Реакция между сложными веществами |
C2H5OH+HBr→C2H5Br+H2O |
|
Поликонденсация |
nNH2−(CH)5−COOH→(−NH−(CH)5−CO−)n+nH2O |
В органической химии выделяются также и другие группы реакций. Например, реакциями этерификации называют взаимодействие спиртов с карбоновыми кислотами, а реакциями гидролиза — взаимодействие воды со сложными эфирами, жирами, сахарозой, крахмалом и другими веществами.
Реакции присоединения (англ. addition reaction) — в органической химии так называются химические реакции, в которых одни химические соединения присоединяются к кратным (двойным или тройным) связям другого химического соединения. Присоединение может осуществляться как по связи углерод-углерод, так и по связи углерод-гетероатом. Реакции присоединения обозначают английскими буквами «Ad».
Общий вид реакций присоединения по связи углерод-углерод:
Общий вид реакций присоединения по связи углерод-кислород:
Обычно, реагент, к которому происходит присоединение называют субстратом, а другой («Х-Y») — атакующим реагентом.
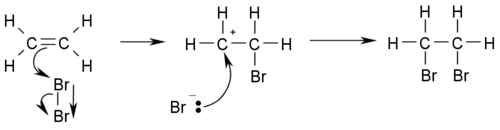
Примером реакции присоединения может служить бромирование этилена:
Реакции присоединения часто являются обратимыми, составляя пару с реакциями отщепления, поэтому следует иметь в виду, что механизм для такой «парной» реакции присоединения-отщепления является общим[1].
В зависимости от природы атакующей частицы и механизма реакции различают нуклеофильное, электрофильное, радикальное или синхронное присоединение.
Содержание
- 1 Реакции нуклеофильного присоединения
- 2 Реакции электрофильного присоединения
- 3 Реакции радикального присоединения
- 4 Реакции синхронного присоединения
- 5 Примечания
Реакции нуклеофильного присоединения
В реакциях нуклеофильного присоединения атакующей частицей является нуклеофил, то есть отрицательно заряженная частица или частица со свободной электронной парой.
Общий вид реакций нуклеофильного присоединения:
Реакции нуклеофильного присоединения обозначаются «AdN».
Реакции нуклеофильного присоединения по связи С=С достаточно редки, наибольшее распространение и практическое значение имеет присоединение по связи С=O[2]:
Среди реакций нуклеофильного присоединения наиболее распространен приведенный выше двухстадийный бимолекулярный механизм AdN2 : вначале нуклеофил медленно присоединяется по кратной связи с образованием карбаниона, который на второй стадии быстро атакует электрофильная частица[3].
Реакции электрофильного присоединения
В реакциях электрофильного присоединения атакующей частицей является электрофил, то есть положительно заряженная частица, чаще всего протон H+, или частица с дефицитом электронов.
Общий вид реакций электрофильного присоединения:
Реакции электрофильного присоединения обозначаются «AdE».
Реакции электрофильного присоединения широко распространены среди реакций непредельных углеводородов: алкенов, алкинов и диенов[4].
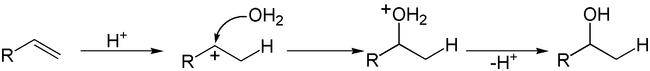
Примером таких реакций служит гидратация алкенов:
Электрофильное присоединение по связи углерод-гетероатом также достаточно распространено, причем чаще всего такой связью является С=O:
Среди реакций электрофильного присоединения наиболее распространен приведенный выше двухстадийный бимолекулярный механизм AdE2 : вначале электрофил медленно присоединяется по кратной связи с образованием карбкатиона, который на второй стадии подвергается нуклеофильной атаке[3].
Реакции радикального присоединения
В реакциях радикального присоединения атакующей частицей являются свободные радикалы.
Реакции радикального присоединения обозначаются «AdR».
Реакции радикального присоединения обычно протекают вместо реакций электрофильного присоединения в присутствии источника свободных радикалов[3]:
Реакции синхронного присоединения
В некоторых случаях присоединение по кратной связи происходит с одновременной атакой обеих атомов, что не позволяет определить приоритет атаки. Такой механизм называется синхронным присоединением. Реакции синхронного присоединения приводят к образованию циклических продуктов, поэтому они часто носят название циклоприсоединение.
Примечания
- ↑ Керри Ф, Сандберг Р. Углубленный курс органической химии: пер. с англ., в 2-х томах. — М.: Химия, 1981.
- ↑ Химическая энциклопедия./ Нуклеофильные реакции. // Главный редактор И. Л. Кнунянц. — М.: «Советская энциклопедия», 1988 год. — Т. 3.
- ↑ 1 2 3 Mарч Дж. Органическая химия, пер. с англ., т. 3, — M.: Мир, 1988
- ↑ Химическая энциклопедия./ Электрофильные реакции. // Главный редактор И. Л. Кнунянц. — М.: «Советская энциклопедия», 1988 год. — Т. 5.
| |
|
|---|---|
| Реакции замещения | Реакции нуклеофильного замещения · Реакции электрофильного замещения · Реакции радикального замещения |
| Реакции присоединения | Реакции нуклеофильного присоединения · Реакции электрофильного присоединения · Реакции радикального присоединения · Реакции синхронного присоединения |
| Реакции элиминирования | Реакции гетеролитического элиминирования · Реакции перициклического элиминирования · Реакции радикального элиминирования |
| Реакции перегруппировки | Нуклеофильные перегруппировки · Электрофильные перегруппировки · Радикальные перегруппировки |
| Реакции окисления и восстановления | Реакции окисления · Реакции восстановления |
| Прочее | Именные реакции в органической химии |
Реакции присоединения
В реакциях присоединения молекула органического соединения и молекула простого или сложного вещества соединяются в новую молекулу, при этом другие продукты реакции не образуются:
А + В 
Символ реакций присоединения: Ad или A — от англ. Addition.
Примеры:
CH2=CH-CH3 + Br2
CH2Br-CHBr-CH3
бромирование пропена
CH2=CH2 + H2O
CH3CH2OH
гидратация этилена
К реакциям присоединения относятся также реакции полимеризации:
n A 
Например, образование полиэтилена:
n CH2=CH2 
- Основная стадия процесса полимеризации – рост цепи – представляет собой последовательное присоединение молекул мономера к растущему радикалу (при радикальном механизме):
…
При протекании химических реакций происходит разрыв одних и возникновение других связей. Химические реакции условно делят на органические и неорганические. Органическими реакциям принято считать реакции, в которых, по крайней мере, одно из реагирующих веществ является органическим соединением, изменяющим свою молекулярную структуру в процессе реакции. Отличием органических реакций от неорганических является то, что, как правило, в них участвуют молекулы. Скорость таких реакции низка, а выход продукта обычно составляет всего лишь 50-80 %. Для повышения скорости реакции применяют катализаторы, повышают температуру или давление. Далее рассмотрим типы химических реакций в органической химии.
Классификация по характеру химических превращений
- Реакции замещения
- Реакции присоединения
- Реакция элиминирования (отщепления)
- Реакция изомеризации и перегруппировка
- Реакции окисления
- Реакции конденсации и поликонденсации
- Реакции разложения
Реакции замещения
В ходе реакций замещения один атом или группа атомов в начальной молекуле замещается на иные атомы или группы атомов, образуя новую молекулу. Как правило, такие реакции характерны для насыщенных и ароматических углеводородов, например:
Реакции присоединения
При протекании реакций присоединения из двух или более молекул веществ образуется одна молекула нового соединения. Такие реакции характерны для ненасыщенных соединений. Различают реакции гидрирования (восстановления), галогенирования, гидрогалогенирования, гидратации, полимеризации и т.п:
- Гидрирование – присоединение молекулы водорода:
- Галогенирование — присоединение молекулы галогена:
- Гидрогалогенирование — присоединение молекулы галогенводорода:
- Гидратация — присоединение молекулы воды:
- Полимеризация – образование высокомолекулярного соединения посредством многократного присоединения низкомолекулярного соединения, например:
Реакция элиминирования (отщепления)
В результате реакций отщепления органические молекулы теряют атомы или группы атомов, и образуется новое вещество, содержащее одну или несколько кратных связей. К реакциям элиминирования относятся реакции дегидрирования, дегидратации, дегидрогалогенирования и т.п.:
- Дегидрирование – отщепления молекулы водорода:
- Дегидратация – отщепление молекулы воды:
- Дегидрогалогенирования – отщепления молекулы галогеноводородов:
Реакции изомеризации и перегруппировка
В ходе таких реакций происходит внутримолекулярная перестройка, т.е. переход атомов или групп атомов с одного участка молекулы в другое без изменения молекулярной формулы вещества, участвующего в реакции, например:
Реакции окисления
В результате воздействия окисляющего реагента происходит повышение степени окисления углерода в органическом атоме, молекуле или ионе процесс за счет отдачи электронов, вследствие чего образуется новое соединение:
Реакции конденсации и поликонденсации
Заключаются во взаимодействии нескольких (двух и более) органических соединений с образованием новых С-С связей и низкомолекулярного соединения:
Поликонденсация – образование молекулы полимера из мономеров, содержащих функциональные группы с выделением низкомолекулярного соединения. В отличие от реакции полимеризации, в результате которых образуется полимер, имеющий состав, аналогичный мономеру, в результате реакций поликонденсации состав образованного полимера отличается от его мономера:
Реакции разложения
Это процесс расщепления сложного органического соединения на менее сложные или простые вещества:
С18H38 → С9H18 + С9H20
Классификация химических реакций по механизмам
Протекание реакций с разрывом ковалентных связей в органических соединениях возможно по двум механизмам (т.е. пути, приводящему к разрыву старой связи и образованию новой) – гетеролитическому (ионному) и гомолитическому (радикальному).
Гетеролитический (ионный) механизм
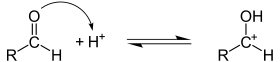
В реакциях, протекающих по гетеролитическому механизму образуются промежуточные частицы ионного типа с заряженным атомом углерода. Частицы, несущие положительный заряд называются карбкатионы, отрицательный – карбанионы. При этом происходит не разрыв общей электронной пары, а ее переход к одному из атомов, с образованием иона:
Склонность к гетеролитическому разрыву проявляют сильно полярные, например Н–O, С–О и легко поляризуемые, например С–Вr, С–I связи.
Реакции, протекающие по гетеролитическому механизму делят на нуклеофильные и электрофильные реакции. Реагент, располагающий электронной парой для образования связи называют нуклеофильным или электронодонорным. Например, HO—,RO—, Cl—, RCOO—, CN—, R—, NH2, H2O, NH3, C2H5OH, алкены, арены.
Реагент, имеющий незаполненную электронную оболочку и способные присоединить пару электронов в процессе образования новой связи.называют электрофильным реагентам относятся следующие катионы: Н+, R3C+, AlCl3, ZnCl2, SO3, BF3, R-Cl, R2C=O
Реакции нуклеофильного замещения
Характерны для алкил- и арилгалогенидов:
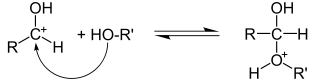
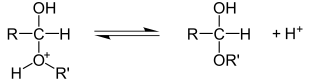
Реакции нуклеофильного присоединения
Реакции электрофильного замещения
Реакции электрофильного присоединения
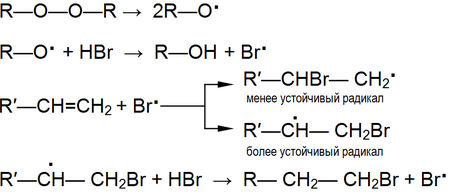
Гомолитический (радикальный механизм)
В реакциях, протекающих по гомолитическому (радикальному) механизму на первой стадии происходит разрыв ковалентной связи с образованием радикалов. Далее образовавшийся свободный радикал выступает в качестве атакующего реагента. Разрыв связи по радикальному механизму свойственен для неполярных или малополярных ковалентных связей (С–С, N–N, С–Н).
Различают реакции радикального замещения и радикального присоединения
Реакции радикального замещения
Характерны для алканов
Реакции радикального присоединения
Характерны для алкенов и алкинов
Таким образом, мы рассмотрели основные типы химических реакций в органической химии