Двухосновная предельная карбоновая кислота.
Альтернативное название
Этандиовая кислота
Формула
HООСCOOH или Н2С2О4
Свойства щавелевой кислоты
Физические свойства
| Свойство | Описание |
|---|---|
| Внешний вид | Бесцв.кристаллы |
| Молярная масса, г/моль | 90,04 |
| Плотность при 20°С, г/см3 | 1,36 |
| Температура плавления, °С | 189,5 |
| Температура кипения, °С | 100,7 |
| Температура возгонки, °С | 125 |
| Температура разложения, °С | 100-130 |
| Показатель диссоциации Ка1 | 1,27 |
| Показатель диссоциации Ка2 | 4,27 |
Химические свойства
Щавелевая кислота в водном растворе диссоциирует на ионы:
НООССООН ↔ НООССОО— + Н+ ↔ [ООССОО]2—+ 2Н+
Щавелевая кислота образует два ряда солей.
Средние соли – оксалаты:
2NaOH + НООССООН = NaOOCCOONa + 2H2O.
Кислые соли – гидрооксалаты:
КOH + НООССООН = HOOCCOOK + H2O.
Оксалаты плохо растворяются в воде за исключением оксалатов магния и щелочных металлов, поэтому щавелевая кислота осаждает из растворов ионы кальция и других металлов, кроме Mg2+, Na+, K+, Li+, Rb+ и Cs+:
(СООН)2+СаСl2 = (COO)2Ca↓ + 2HCl,
(СООН)2+PbСl2 = (COO)2Pb↓ + 2HCl.
Щавелевая кислота при нагревании:
(СООН)2 = НСООН + СО2.
При действии окислителей щавелевая кислота окисляется до угольной, которая разлагается на воду и углекислый газ:
5(СООН)2 + 2KMnO4 + 3H2SO4= 8Н2О + 10CO2↑+K2SO4 + 2MnSO4.
Щавелевая кислота горюча:
2НООССООН + О2 = 2H2O + 4CO2.
При реакции с бертолетовой солью образуется диоксид хлора:
2НООССООН + 2KClO3 = KClO3 + ClO2↑ + 2H2O + 4CO2.
Получение
Естественные способы получения
Щавелевая кислота встречается в природе в таких растениях как щавель и ревень, но в составе кислых солей – гидрооксалатов. Формула гидрооксалата калия HООСCOOК. В чистом виде встречается в некоторых грибах-трутовиках.
Лабораторный способ получения
Щавелевую кислоту в лабораторных условиях получают, окисляя сахарозу концентрированной азотной кислотой:
C12H22O11 + 36HNO3 = 6(СООН)2 + 36NO2 + 23H2O.
Получение в промышленности
- В промышленности щавелевую кислоту получают несколькими способами:
- окислением спиртов или углеводов смесью азотной и серной кислот в присутствии катализатора – оксида ванадия (V) V2O5;
- окислением этилена азотной кислотой в присутствии катализатора – нитрата палладия (II) Pd(NO3)2 или хлорида палладия (II) PdCl2;
- многостадийным процессом, в котором сначала из едкого натра и угарного газа получают формиат натрия, который затем сплавлением с едким натром превращают в оксалат натрия, и, наконец, последний превращают в щавелевую кислоту действием соляной кислоты:
NaOH + CO = HCOONa;
HCOONa + NaOH = NaOOCCOONa;
NaOOCCOONa + 2HCl = НООССООН + 2NaCl.
Применение
- Щавелевую кислоту включают в состав многих средств для очистки от ржавчины и удаления накипи.
- В кожевенном и текстильном производстве ее применяют в качестве протравы для отбеливании кожи и тканей.
- Скульпторы придают мраморным скульптурам обработкой щавелевой кислотой блеск и прочность поверхности.
- В пчеловодстве с ее помощью борются с варроатозом, нередко приводящим к полной гибели пчелиной семьи.
- Щавелевая кислота применяется и в органическом синтезе.
Пример решения задачи
Сколько граммов 5% раствора щавелевой кислоты нужно взять для полного осаждения кальция из 100 мл 27,5% раствора хлорида кальция (ρ=1,26 г/мл)?
Решение
Вес раствора:
mр-ра = 1,26·100 = 126 г.
Количество хлорида кальция в нем:
mCaCl2 = 126·27,5%/100% = 34,65 г.
Составляем пропорцию:
111 г CaCl2 – 90 г C2H2O4,
34,65 г CaCl2 – х г C2H2O4.
Отсюда:
х= (34,65·90)/111 = 28,1 г.
Ответ: 28,1 г.
Тест по теме «Щавелевая кислота»
1 час назад, Дмитрий Цветов сказал:
Русхима в городе нет, да и заказать, увы не могу

У меня тоже в моем селе нет Русхима. Ну и что. Доставку они делают и ТК и Почтой России
если надо купить точно проще чем делать
https://www.avito.ru/rossiya?q=щавелевая+кислота
.а азотную кислоту 62-66% тоже на кухне из селитры с серной кислотой получать будешь?
И начнешь конечно же с упаривания аккумуляторного электролита.
И селитра и электролит денег стоят. А где катализатор ьудешь искать?
В теме, ссылку на которую давал выше, есть еще про метод спекания опилок с едким натром.
В самый раз для пожара в доме.
Изменено 27 Августа, 2020 в 11:15 пользователем nikanykey
Щавелевая кислота, получение, свойства, химические реакции.
Щавелевая кислота (также – этандиовая кислота) – органическое вещество, относящееся к двухосновным предельным карбоновым кислотам.
Щавелевая кислота, формула, характеристики
Физические свойства щавелевой кислоты
Химические свойства щавелевой кислоты
Получение щавелевой кислоты
Безопасность при обращении с щавелевой кислотой. Требования ГОСТа
Применение щавелевой кислоты
Щавелевая кислота, формула, характеристики:
Щавелевая кислота (также – этандиовая кислота) – органическое вещество, относящееся к двухосновным предельным карбоновым кислотам.
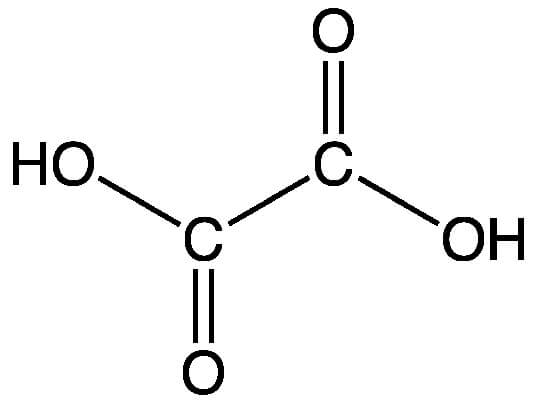
Химическая формула щавелевой кислоты C2H2O4. Рациональная формула щавелевой кислоты HOOC−COOH либо (COOH)2. Изомеров не имеет.
Строение молекулы щавелевой кислоты:
Щавелевая кислота (этандиовая кислота) – простейшая двухосновная кислота, первый член гомологического ряда двухосновных предельных карбоновых кислот.
Является сильной органической кислотой.
Щавелевая кислота по внешнему виду представляет собой бесцветные кристаллы. Имеет две кристаллические модификации: α – орторомбическая бипирамидальная (плотность 1,900 г/см3), β – моноклинная призматическая (плотность 1,895 г/см3).
Щавелевая кислота – горючее вещество. Температура самовоспламенения в слое 518 °С. Для пылевоздушной смеси нижний концентрационный предел воспламенения – 205 г/см3.
Хорошо растворяется в воде, неполностью – в диэтиловом и этиловом спирте, не растворяется в бензоле, хлороформе, петролейном эфире
Щавелевая кислота своё название получила из-за того, что образуется при щавелевокислом брожении. Впервые была получена в 1824 году немецким химиком Фридрихом Вёлером из дициана и воды.
В природе щавелевая кислота содержится в щавеле, ревене, кислице, карамболе и некоторых других растениях, а также в сырых овощах в свободном виде и в виде оксалатов калия и кальция.
Соли и сложные эфиры щавелевой кислоты называются оксалатами.
Название щавелевой кислоты на английском – oxalic acid.
Щавелевая кислота обладает токсическим действием, опасна для жизни и здоровья (опасность зависит от концентрации), обладает разъедающими свойствами.
Физические свойства щавелевой кислоты:
| Наименование параметра: | Значение: |
| Цвет | без цвета |
| Запах | без запаха |
| Вкус | кислый |
| Агрегатное состояние (при 25 °C и атмосферном давлении 1 атм.) | бесцветные кристаллы |
| Плотность орторомбической бипирамидальной кристаллической модификации (при 25 °C и атмосферном давлении 1 атм.), г/см3 | 1,9 |
| Плотность орторомбической бипирамидальной кристаллической модификации (при 25 °C и атмосферном давлении 1 атм.), кг/м3 | 1900 |
| Плотность моноклинной призматической кристаллической модификации (при 25 °C и атмосферном давлении 1 атм.), г/см3 | 1,895 |
| Плотность моноклинной призматической кристаллической модификации (при 25 °C и атмосферном давлении 1 атм.), кг/м3 | 1895 |
| Температура плавления, °C | 189,5 |
| Температура самовоспламенения, °C | 518 |
| Константа диссоциации кислоты | 1,25; 4,14 |
| Удельная теплота сгорания, МДж/кг | 2,79 |
| Молярная масса, г/моль | 90,04 |
Химические свойства щавелевой кислоты:
Щавелевая кислота является сильной органической кислотой и проявляет кислотные свойства, характерные для карбоновых кислот.
Для нее характерны следующие химические реакции:
- 1. реакция разложения щавелевой кислоты при нагревании:
C2H2O4 → CO + CO2 + H2O (to, kat = H2SO4 (конц.)).
При нагревании с концентрированной серной кислотой разлагается на моноксид углерода (угарный газ), углекислый газ и воду.
- 2. реакция щавелевой кислоты c хлоратом калия:
C2H2O4 + 2KClO3 → K2CO3 + 2ClO2 + CO2 + H2O.
Щавелевая кислота вступает в реакцию с хлоратом калия. В результате реакции образуется карбонат калия, диоксид хлора, углекислый газ и вода.
Данная реакция используется для лабораторного синтеза диоксида хлора.
- 3. реакция щавелевой кислоты c раствором аммиака:
C2H2O4 + 2NH3 → (NH4)2C2O4.
Щавелевая кислота вступает в реакцию с аммиаком, растворенном в воде. В результате реакции образуется оксалат аммония.
- 4. реакция щавелевой кислоты c йодом:
C2H2O4 + I2 → 2HI + 2CO2.
Щавелевая кислота вступает в реакцию с йодом. В результате реакции образуется йодоводород и углекислый газ.
Аналогичная реакция проистекает с хлором.
Данные реакции применяют для получения йодоводорода и хлороводорода.
- 5. реакция щавелевой кислоты c карбонатом калия (или карбонатом натрия):
K2CO3 + H2C2O4 → K2C2O4 + CO2 + H2O,
Na2CO3 + H2C2O4 → Na2C2O4 + CO2 + H2O.
Щавелевая кислота вступает в реакцию с карбонатом калия (или карбонатом натрия). В результате реакции образуется оксалат калия (или оксалат натрия), углекислый газ и вода.
Аналогичные реакции проистекают с карбонатом лития, карбонатом рубидия и карбонатом цезия.
- 6. реакция диссоциации щавелевой кислоты в водном растворе:
H2C2O4 ↔ 2H+ + C2O42-.
В водном растворе щавелевая кислота диссоциирует на ионы.
Получение щавелевой кислоты:
Щавелевую кислоту получают:
– окислением углеводов, спиртов и гликолей смесью азотной и серной кислот в присутствии оксида ванадия (V2O5);
– окислением этилена и ацетилена азотной кислотой в присутствии хлорида палладия (PdCl2) или нитрата палладия (Pd(NO3)2);
– окислением пропилена жидким оксидом азота (NO2);
– из формиата натрия.
Безопасность при обращении с щавелевой кислотой. Требования ГОСТа:
Щавелевая кислота – сильная органическая кислота, в больших количествах может вызывать раздражение слизистых оболочек пищевода, желудка, кишечника, дыхательных путей и кожных покровов.
Предельно допустимая концентрация щавелевой кислоты в воде водных объектов хозяйственно-питьевого и культурно-бытового общепользования – 0,5 мг/дм3., лимитирующий показатель вредности – общесанитарный. (см. ГОСТ 22180-76 Реактивы. Кислота щавелевая. Технические условия (с Изменениями N 1, 2)).
При работе с щавелевой кислотой следует применять индивидуальные средства защиты (респираторы типа “Лепесток” по ГОСТ 12.4.028, защитные очки по ГОСТ 12.4.013, резиновые перчатки по ГОСТ 20010), а также соблюдать правила личной гигиены.
Помещения, в которых проводятся работы с препаратом, должны быть оборудованы непрерывно действующей приточно-вытяжной вентиляцией. Анализ препарата следует проводить в вытяжном шкафу лаборатории.
Щавелевая кислота – горючее вещество. Температура самовоспламенения в слое 518 °С. Для пылевоздушной смеси нижний концентрационный предел воспламенения – 205 г/см3. Средствами пожаротушения являются тонкораспыленная вода, химическая и воздушно-механические пены.
Применение щавелевой кислоты:
Щавелевая кислота применяется:
– в текстильной и кожевенной промышленности как протрава, при покраске шелка и шерсти,
– в металлургии для чистки металлов от коррозии, оксидов, накипи, ржавчины,
– в пчеловодстве для обработки пчел,
– в бытовой химии в качестве средства для удаления ржавчины, моющих, отбеливающих и дезинфицирующих средств,
– в медицине и фармакологии,
– в аналитической и органической химии в качестве реагента и для осаждения редкоземельных элементов.
Примечание: © Фото //www.pexels.com, //pixabay.com
Коэффициент востребованности
8 751
Применение щавелевой кислоты
Как и любая кислота, щавелевая благодаря своим уникальным свойствам применяется в следующих отраслях промышленности:
— химической (при изготовлении пластмасс, красителей, чернил, пиротехники);
— металлургической (для чистки металлов от коррозии, оксидов, накипи, ржавчины);
— текстильной и кожевенной (как протрава, при покраске шелка и шерсти);
— пчеловодстве (для обработки пчел);
— бытовой химии (входит в состав многих моющих средств 
— аналитической химии (осадитель редкоземельных элементов);
— микроскопии (отбеливатель срезов);
— косметологии (отбеливающий компонент от веснушек);
— медицине и фармакологии;
— деревообрабатывающей.
Важность щавелевой кислоты для организма
Данное химическое соединение в организме человека – это промежуточный продукт, который выделяется с мочой как соли кальция. При нарушении минерального обмена соли данной кислоты принимают участие в образовании камней в мочевом пузыре и почках. Данная органическая кислота, содержащаяся в сырых овощах, очень полезна для нашего организма. Она легко соединяется с кальцием и способствует его усвоению. Щавелевая кислота в отварных овощах негативно сказывается на здоровье, так как она становится неорганической. Это приводит к связыванию кальция, а как результат – к нехватке его в костной ткани, что является причиной ее поражения. Суточное выделение щавелевой кислоты вместе с мочой у взрослого человека составляет 20 мг, у детей до 1, 29 мг/кг.
Меры предосторожности

— работы проводить в специальной лабораторной посуде из стекла. Если лабораторная посуда будет из другого материла, кислота может вступить с ней в реакцию;
— во избежание попадания щавелевой кислоты на кожу, дыхательные пути, слизистые оболочки все исследования следует проводить: в резинотехнических изделиях (сапоги, прорезиненные фартуки, перчатки смотровые, перчатки нитриловые), защитных средствах (противогаз или респиратор, очки), спецодежда;
— во время использования щавелевой кислоты запрещается принимать пищу, пить, курить;
— после завершения работ необходимо лицо и руки тщательно промыть теплой водой с мылом или нейтрализующим средством (раствором питьевой соды);
— запрещается транспортировка и хранение щавелевой кислоты совместно с пищевыми продуктами;
— соблюдать меры противопожарной безопасности, если есть необходимость в использовании нагревательных приборов.
Нужно знать, что щавелевая кислота относится к сильным органическим кислотам, употребление ее в большом количестве может стать причиной раздражения слизистой пищевода, кишечника, желудка, кожи и дыхательных путей. При попадании данного химического реактива в организм может появиться жжение, кровавая рвота. Первая помощь в таких ситуациях – обильно промыть водой пораженный участок кожи. Хранить кислоту нужно в закрытой полиэтиленовой упаковке в хорошо вентилируемом помещении на поддонах.
Щавелевую кислоту купить
Щавелевую кислоту купить, борную кислоту купить, лимонную кислоту купить, молочную кислоту купить, как и любой другой химический реактив, можно в магазине химических реактивов Москва розница и опт «Прайм Кемикалс Групп». На нашем сайте есть все, что нужно современной научной или производственной лаборатории. Покупая любой товар в нашем интернет-магазине, вы приобретаете товар c сертификатом качества, отвечающий всем стандартам ГОСТ по доступным ценам и исключаете возможность покупки подделки.
“Prime Chemicals Group” – гарантия качества предлагаемой продукции.
Щавелевую кислоту купить с доставкой по городу и области можно Выгодно!
 
|
Страница 1 из 1 |
| Автор | Сообщение | |||
|---|---|---|---|---|
|
|
|
|||
|

|
Посреди поля нашел каску немецкую, местами даже краска есть. Почитал что чистить нужно в щавелевой кислоте, не знаю где ее взять. Может кто знает где она может продаваться? |
|||
|
|
||||
|
||||
|

|
В аптеки спроси. |
|||
|
|
||||
|
||||
|

|
В интернете. Запрос дай в поисковик. |
|||
|
|
||||
|
||||
|

|
У нас щавелька в аптеках есть.В флакончиках по 80 гр.А как ей пользоваться?У меня футляр для сменных стволов от MG-34.Тоже местами с краской. |
|||
|
|
||||
|
||||
|
      
|
игорь-2 {писал(а)}: У нас щавелька в аптеках есть.В флакончиках по 80 гр.А как ей пользоваться?У меня футляр для сменных стволов от MG-34.Тоже местами с краской. Растёт кислота оная в виде порошка зернистого, можно сделать раствор любой концентрации, Пользоваться просто — делаете n-процентный раствор (приходит с опытом, обычно сильные не используют — можно упустить момент лишнего воздействия на предмет обработки), делать его лучше в пластиковом ведре (на оцинкованное и проч. металл. она воздействует) и, ВНИМАНИЕ!!!, она очень вонючая |
|||
|
|
||||
|
||||
|

|
Если трудно достать щавеливою можно использовать САНОКС (средство для чистки от ржавчины). |
|||
|
|
||||
|
||||
|

|
А этот санокс краску не съест ? |
|||
|
|
||||
|
||||
|
 
|
….а у меня на работе можно лопатой себе насыпать…. |
|||
|
|
||||
|
||||
|
  
|
А к работе в котельных ни кто из наших не причастен? |
|||
|
|
||||
|
||||
|
 
|
Ckit {писал(а)}: А к работе в котельных ни кто из наших не причастен? Трилон Б продается в аптеках. |
|||
|
|
||||
|
||||
|
      
|
Ckit {писал(а)}: А к работе в котельных ни кто из наших не причастен? Заказывал на Юноне у человека, который там химией торгует. Он продаёт в пластиковых банках по 700 г., производства Микрохим, стоило около 200 рублей, уже не помню, могу в субботу его спросить. |
|||
|
|
||||
|
||||
|
  
|
не надо спрашивать, мне как-то пакет килограмма на 2-3 затак отдавали, этот трилон десятками килограммов закидывают в воду. |
|||
|
|
||||
|
||||
|

|
Щавеливой не чистил, поэтому не могу сравнивать. |
|||
|
|
||||
|
||||
|
      
|
Ckit {писал(а)}: не надо спрашивать, мне как-то пакет килограмма на 2-3 затак отдавали, этот трилон десятками килограммов закидывают в воду. Век живи, век учись |
|||
|
|
||||
 
|
Страница 1 из 1 |