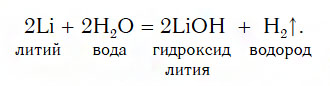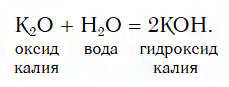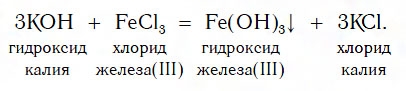Основания

4.5
Средняя оценка: 4.5
Всего получено оценок: 2549.
4.5
Средняя оценка: 4.5
Всего получено оценок: 2549.
Один из классов сложных неорганических веществ – основания. Это соединения, включающие атомы металла и гидроксильную группу, которая может отщепляться при взаимодействии с другими веществами.
Строение
Основания могут содержать одну или несколько гидроксо-групп. Общая формула оснований – Ме(ОН)х. Атом металла всегда один, а количество гидроксильных групп зависит от валентности металла. При этом валентность группы ОН всегда I. Например, в соединении NaOH валентность натрия равна I, следовательно, присутствует одна гидроксильная группа. В основании Mg(OH)2 валентность магния – II, Al(OH)3 валентность алюминия – III.
Количество гидроксильных групп может меняться в соединениях с металлами с переменной валентностью. Например, Fe(OH)2 и Fe(OH)3. В таких случаях валентность указывается в скобках после названия – гидроксид железа (II), гидроксид железа (III).
Физические свойства
Характеристика и активность основания зависит от металла. Большинство оснований – твёрдые вещества белого цвета без запаха. Однако некоторые металлы придают веществу характерную окраску. Например, CuOH имеет жёлтый цвет, Ni(OH)2 – светло-зелёный, Fe(OH)3 – красно-коричневый.
Виды
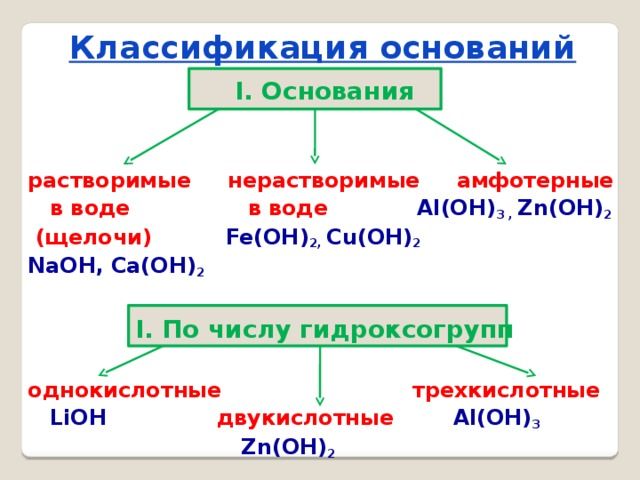
Основания классифицируются по двум признакам:
- по количеству групп ОН – однокислотные и многокислотные;
- по растворимости в воде – щёлочи (растворимые) и нерастворимые.
Щёлочи образуются щелочными металлами – литием (Li), натрием (Na), калием (K), рубидием (Rb) и цезием (Cs).
Кроме того, к активным металлам, образующим щёлочи, относят щелочноземельные металлы – кальций (Ca), стронций (Sr) и барий (Ba). Эти элементы образуют следующие основания:
- LiOH;
- NaOH;
- KOH;
- RbOH;
- CsOH;
- Ca(OH)2;
- Sr(OH)2;
- Ba(OH)2.
Все остальные основания, например, Mg(OH)2, Cu(OH)2, Al(OH)3, относятся к нерастворимым.
По-другому щёлочи называются сильными основаниями, а нерастворимые – слабыми основаниями. При электролитической диссоциации щёлочи быстро отдают гидроксильную группу и быстрее вступают в реакцию с другими веществами. Нерастворимые или слабые основания менее активные, т.к. не отдают гидроксильную группу.
Особое место в систематизации неорганических веществ занимают амфотерные гидроксиды. Они взаимодействуют и с кислотами, и с основаниями, т.е. в зависимости от условий ведут себя как щёлочь или как кислота. К ним относятся Zn(OH)2, Al(OH)3, Pb(OH)2, Cr(OH)3, Be(OH)2 и другие основания.
Получение
Основания получают различными способами. Самый простой – взаимодействие металла с водой:
Ba + 2H2O → Ba(OH)2 + H2.
Щёлочи получают в результате взаимодействия оксида с водой:
Na2O + H2O → 2NaOH.
Нерастворимые основания получаются в результате взаимодействия щелочей с солями:
CuSO4 + 2NaOH → Cu(OH)2↓+ Na2SO4.
Химические свойства
Основные химические свойства оснований описаны в таблице.
|
Реакции |
Что образуется |
Примеры |
|
С кислотами |
Соль и вода. Нерастворимые основания взаимодействуют только с растворимыми кислотами |
Cu(OH)2↓ + H2SO4 → CuSO4 +2H2O |
|
Разложение при высокой температуре |
Оксид металла и вода |
2Fe(OH)3 → Fe2O3 + 3H2O |
|
С кислотными оксидами (реагируют щёлочи) |
Соль |
NaOH + CO2 → NaHCO3 |
|
С неметаллами (вступают щёлочи) |
Соль и водород |
2NaOH + Si + H2O → Na2SiO3 +H2↑ |
|
Обмена с солями |
Гидроксид и соль |
Ba(OH)2 + Na2SO4 → 2NaOH + BaSO4↓ |
|
Щелочей с некоторыми металлами |
Сложная соль и водород |
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑ |
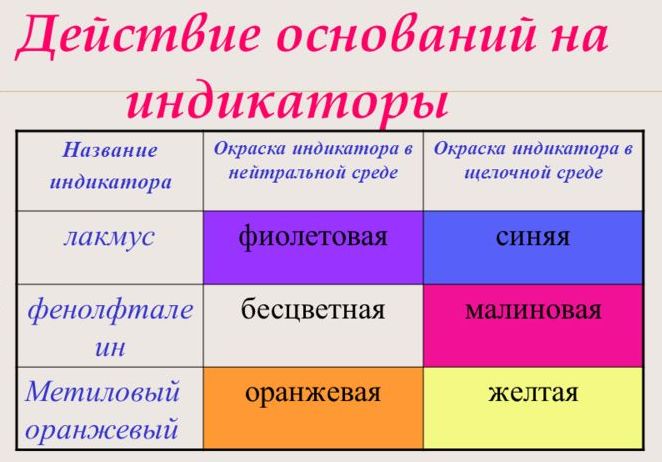
С помощью индикатора проводится тест на определение класса основания. При взаимодействии с основанием лакмус становится синим, фенолфталеин – малиновым, метилоранж – жёлтым.
Что мы узнали?
Из урока 8 класса химии узнали об особенностях, классификации и взаимодействии оснований с другими веществами. Основания – сложные вещества, состоящие из металла и гидроксильной группы ОН. Они делятся на растворимые или щёлочи и нерастворимые. Щёлочи – более агрессивные основания, быстро реагирующие с другими веществами. Основания получают при взаимодействии металла или оксида металла с водой, а также в результате реакции соли и щёлочи. Основания реагируют с кислотами, оксидами, солями, металлами и неметаллами, а также разлагаются при высокой температуре.
Тест по теме
Доска почёта

Чтобы попасть сюда — пройдите тест.
-
Никита Ковалёв
9/10
-
Еркежан Рысова
10/10
-
Александр Котков
10/10
-
Мишлен Громов
10/10
-
Вика Мартынова
10/10
-
Ольга Хромцова
10/10
-
Лилия Швец
10/10
-
Наталья Чернова
10/10
-
Максим Макеев
10/10
-
Сергей Ефремов
8/10
Оценка доклада
4.5
Средняя оценка: 4.5
Всего получено оценок: 2549.
А какая ваша оценка?
Щелочи: определение, химические свойства, методы получения
Материал по химии
Оглавление
- Как связаны щелочи с основаниями?
- Чем отличаются щёлочи от остальных оснований?
- Как определить, является ли основание растворимым, то есть щелочью, если его нет в таблице растворимости?
- Физические свойства щелочей
- Химические свойства щелочей
- Получение щелочей
Как связаны щелочи с основаниями?
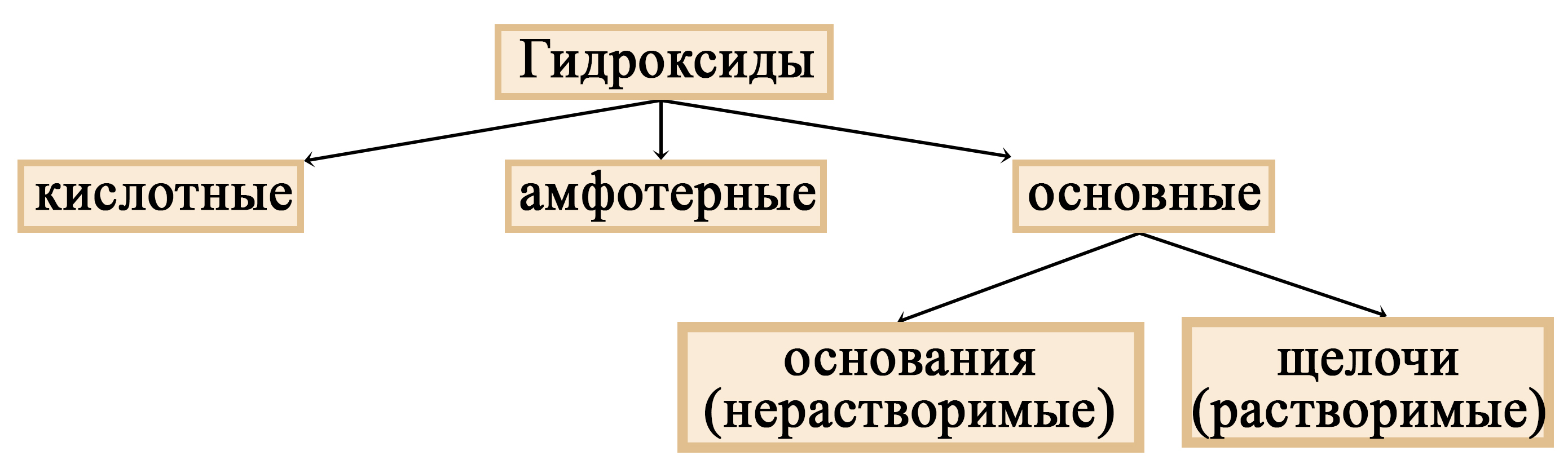
Щелочи – это небольшая группа неорганических веществ, относящихся к основным гидроксидам или основаниям. Для начала разберемся, какие вещества можно называть основаниями. Основания – это вещества, содержащие гидроксо-группу (‒OH), которая в неорганической химии (в случае с основаниями) пишется в конце молекулы, например: NaOH, Fe(OH)2, Ba(OH)2, но это определение не точное, ведь Fe(OH)3 и Zn(OH)2 имеют сходную формулу, однако, основаниями не являются. Точнее будет сказать, что основания – это гидроксиды, в которых металл находится в степени окисления «+1» или «+2» (кроме цинка и бериллия, образующих в степени окисления «+2» амфотерные оксиды и гидроксиды).
Таблица 1. – Основания и амфотерные гидроксиды
|
Это основания: |
Это НЕ основания: |
|
NaOH KOH Mg(OH)2 Ca(OH)2 Fe(OH)2 |
Al(OH)3 Fe(OH)3 Cr(OH)3 Zn(OH)2 Be(OH)2 |
|
Потому что содержат металл в степени окисления «+1» или «+2» |
Так как в этой группе есть гидроксиды, имеющие металл в степени окисления «+3», и два исключения — Zn(OH)2 и Be(OH)2. Все приведенные выше вещества являются амфотерными гидроксидами, а не основаниями |
Подробнее об отличиях понятий «гидроксиды» и «основания» можно прочитать в статье «Классификация гидроксидов и оснований»
Кроме отличий в степени окисления, основания и амфотерные гидроксиды отличаются так же по реакционной способности. Так, амфотерные гидроксиды могут реагировать как с кислотами, так и с основаниями, а основания могут реагировать с кислотами, но не могут реагировать с другими основаниями. Подробнее о химических свойствах амфотерных гидроксидов можно прочитать в статье «Амфотерные гидроксиды. Получение, химические свойства, образование средних и комплексных солей»
Чем отличаются щёлочи от остальных оснований?
Основания можно разделить на две группы: растворимые и нерастворимые. Растворимые иначе называют щелочами. То есть щелочи – это растворимые основания (растворимые основные гидроксиды).
Таблица 2. – Основания и щёлочи
|
Щелочи (растворимые основания) |
Остальные основания (нерастворимые основания) |
|
NaOH KOH Ba(OH)2 |
Mg(OH)2 Fe(OH)2 Ni(OH)2 |
Место щелочей в классификации гидроксидов
Щелочи – растворимые основания
Как определить, является ли основание растворимым, то есть щелочью, если его нет в таблице растворимости?
В состав щелочей входят металлы IА-группы Периодической Системы Д. И. Менделеева, а также кальций, стронций и барий.
Полный список щелочей:
NaOH – гидроксид натрия, едкий натр, гидроокись натрия, каустическая сода
KOH – гидроксид натрия, едкое кали, гидроокись калия
LiOH – гидроксид лития, гидроокись лития
CsOH – гидроксид цезия, гидроокись цезия
FrOH – гидроксид франция, гидроокись франция
RbOH – гидроксид рубидия, гидроокись рубидия
Ba(OH)2 – гидроксид бария, едкий барий, баритовая вода
Ca(OH)2 – гидроксид кальция, гашеная известь, известковое молоко, известковая вода.
Sr(OH)2 – гидроксид стронция
Остальные основания считаем нерастворимыми (кроме аммиака, образующего гидрат аммония, являющегося хоть и растворимым, но нестойким соединением). Гидроксид аммония, образующийся при пропускании аммиака через воду, можно представить в виде формулы NH4OH (лучше NH3·H2O – гидрат аммония) является растворимым (раствор называют нашатырным спиртом), однако щелочью это вещество не является.
Гидроксид лития и гидроксид кальция растворяются не так хорошо, как другие основания, но все равно считаются щелочами.
Задание в формате ЕГЭ с ответом:
Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Ga(OH)3
- RbOH
- Cr(OH)2
- щелочь
- нерастворимое основание
- амфотерный гидроксид
Комментарий к заданию: Галлий, в представленном гидроксиде, имеет степень окисления +3, поэтому он относится к группе амфотерных гидроксидов. Гидроксид рубидия – щелочь, так как рубидий – элемент IА-группы. Гидроксид хрома – нерастворимое основание, так как хром в степени окисления +2 не является амфотерным, и не относится к щелочным или щелочноземельным металлам, поэтому не может образовать щелочь.
Пример задания из КИМ ЕГЭ:
Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Sr(OH)2
- Zn(OH)2
- Fe(OH)2
- щелочь
- нерастворимое основание
- амфотерный гидроксид
Комментарий к заданию: Стронций является щелочноземельным металлом (металлы IIА-группы, кроме магния и бериллия, образуют растворимые гидроксиды), поэтому образует щелочь. Гидроксид цинка вместе с гидроксидом бериллия входят в группу исключений и, несмотря на вторую валентность, образуют амфотерные гидроксиды. Гидроксид железа нерастворим и не входит в группу амфотерных веществ, он является нерастворимым основанием.
Щёлочи, являясь сильными основаниями, диссоциируют в воде очень быстро, тогда как нерастворимые основания диссоциируют медленно, ступенчато:
|
Диссоциация щелочей |
Диссоциация слабых оснований |
|
Ca(OH)2 = Ca2+ + 2OH‒ |
Fe(OH)2 = FeOH+ + OH‒ (I ступень) FeOH+ = Fe2+ + OH‒(II ступень) |
|
Диссоциация настолько быстрая, что ступенчатостью процесса можно пренебречь |
Диссоциация очень медленная, быстрее идет по первой ступени, по второй ступени практически не идёт |
Физические свойства щелочей
Гидроксиды щелочных металлов (металлов IА-группы) – твердые бесцветные кристаллические вещества. Как уже было описано выше, большинство из них очень хорошо растворимы в воде. Гидроксиды щелочноземельных металлов хуже растворяются в воде.
Химические свойства щелочей
Основные свойства гидроксидов в Периодической системе возрастают справа налево и сверху вниз. Поэтому все щелочи, образованные металлами IА-группы сильнее щелочей, образованных металлами IIА-группы.
Щелочи окрашивают фенолфталеин в малиновый цвет.
Твёрдые щелочи и их концентрированные растворы разъедают живые ткани, поэтому работать с ними нужно в перчатках, а при растирании твёрдой щелочи в ступке необходимо надевать очки.
- Щелочи реагируют с кислотными оксидами, образуя либо соль и воду, либо кислую соль:
Щелочь + кислотный оксид = соль + вода
Щелочь + кислотный оксид = кислая соль
Рассмотрим эти реакции на примере образования карбонатов и гидрокарбонатов.
Для щелочей, содержащих одновалентный катион (катион в степени окисления «+1») справедлива общая схема реакции:
2MeOH + CO2 = Me2CO3 + H2O
Или
MeOH + CO2 = MeHCO3
Например:
2NaOH + CO2 = Na2CO3 + H2O
NaOH + CO2 = NaHCO3
2KOH + CO2 = K2CO3 + H2O
KOH + CO2 = KHCO3
Для щелочей, содержащих двухвалентный металл (катион в степени окисления «+2») справедлива общая схема реакции:
Me(OH)2 + CO2 = MeCO3 + H2O
Или
Me(OH)2 + 2CO2 = Me(HCO3)2
Например:
Ca(OH)2 + CO2 = CaCO3 + H2O
Ca(OH)2 + 2CO2 = Ca(HCO3)2
Ba(OH)2 + CO2 = BaCO3 + H2O
Ba(OH)2 + 2CO2 = Ba(HCO3)2
Образование кислых и средних солей
Щелочи с кислотными оксидами
Щелочи при плавлении разрушают стекло и фарфор, основным компонентом которых является кислотный оксид SiO2:
2NaOH(тв) + SiO2(тв) = Na2SiO3(тв) + H2O(г)
Некоторые оксиды диспропорционируют в щелочах (участвуют в реакции самоокисления-самовосстановления). К таким оксидам относят оксид азота IV, который в щелочах превращается одновременно и в нитрит-ион (NO2‒), и нитрат-ион (NO3‒):
2KOH + 2NO2 = KNO2 + KNO3 + H2O
2Ca(OH)2 + 4NO2 = Ca(NO2)2 + Ca(NO3)2 + 2H2O
Для того, чтобы получить только нитрат-ион необходимо присутствие кислорода:
4KOH + 4NO2 + O2 = 4KNO3 + 2H2O
2Ca(OH)2 + 4NO2 + O2 = 2Ca(NO3)2 + 2H2O
О других свойствах кислотных оксидов можно прочитать в статье «Свойства кислотных оксидов»
- Щелочи реагируют с кислотами. Притом, если кислота одноосновная, то образуется только средняя соль, если кислота многоосновная, то может образоваться как средняя, так и кислая соль.
Узнать, как определить тип кислоты можно в статье «Классификация кислот»
А) щелочь + одноосновная кислота = соль + вода
NaOH + HClO3 = NaClO3 + H2O
LiOH + HNO3 = LiNO3 + H2O
KOH + HI = KI + H2O
Ca(OH)2 + 2HCl = CaCl2 + 2H2O
Ba(OH)2 + 2HClO4 = Ba(ClO4)2 + 2H2O
Sr(OH)2 + HPO3 = Sr(PO3)2 + H2O
Б) щелочь + двухосновная кислота = соль + вода
Щелочь + двухосновная кислота = кислая соль + вода
2NaOH + H2SO4 = Na2SO4 + 2H2O
NaOH + H2SO4 = NaHSO4 + H2O
Ba(OH)2 + H2S = BaS + 2H2O
Ba(OH)2 + 2H2S = Ba(HS)2 + 2H2O
Для получения кислой соли необходим недостаток щелочи (избыток кислоты).
Задание по образцу ФИПИ:
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Sr(OH)2 + SO2 =
- Sr(OH)2 +2SO2 =
- Sr(OH)2 + H2SO4 =
- Sr(OH)2 + 2H2SO4 =
- SrSO4 + 2H2O
- SrSO3 + H2O
- SrSO4 + H2O
- Sr(HSO4)2 + 2H2O
- Sr(HSO3)2 + H2O
- Sr(HSO3)2
- В отличие от нерастворимых оснований, щелочи реагируют с растворимыми солями. Условия типичны для обменных реакций (в продуктах должен появиться газ или осадок):
2NaOH + CuSO4 = Na2SO4 + Cu(OH)2↓
LiOH + NH4Cl = LiCl + NH3↑ + H2O
2KOH + Fe(NO3)2 = 2KNO3 + Fe(OH)2↓
Ca(OH)2 + 2NaF = CaF2↓ + 2NaOH
Ba(OH)2 + K2SO4 = BaSO4↓ + 2KOH
Sr(OH)2 + Na2SiO3 = SrSiO3↓ + 2NaOH
Попробуйте решить задание ЕГЭ:
Из предложенного перечня веществ выберете три вещества, с которыми гидроксид натрия (р-р) не реагирует:
- LiCl
- NH4Br
- CrSO4
- PbSO4
- KNO3
- CuSO4
Комментарий к заданию: помните, что исходная соль должна быть растворимой, а одно из полученных веществ – газ или осадок.
- Щелочи реагируют с кислыми солями с образованием средних солей:
NaHSO3 + NaOH = Na2SO3 + H2O
Ca(HCO3)2 + Ca(OH)2 = 2CaCO3 + 2H2O
- Твёрдые щелочи реагируют с амфотерными оксидами и гидроксидами при сплавлении, при этом образуется средняя соль, в катион которой входит щелочной или щелочноземельный металл, а в анион – амфотерный металл:
2NaOH + Al2O3 = 2NaAlO2 + H2O
2NaOH + ZnO = Na2ZnO2 + H2O
Ca(OH)2 + Al2O3 = Ca(AlO2)2 + H2O
Ca(OH)2 + ZnO = CaZnO2 + H2O
Из предложенного перечня веществ выберете три вещества, с которыми реагирует гидроксид калия:
- P2O5
- Cr2O3
- NiO
- FeO
- CaO
- ZnO
Комментарий к заданию: Не забывайте, что щелочи реагируют не только с амфотерными, но и с кислотными оксидами.
О том, как амфотерные оксиды реагируют с щелочами и другими веществами, а также о том, как можно прочитать в статье «Амфотерные оксиды»
NaOH + Al(OH)3 = NaAlO2 + 2H2O
NaOH + Zn(OH)2 = Na2ZnO2 + H2O
Ca(OH)2 + 2Al(OH)3 = Ca(AlO2)2 + 4H2O
Ca(OH)2 + Zn(OH)2 = CaZnO2 + 2H2O
Подробнее о свойствах амфотерных гидроксидов можно прочитать в этой статье
- Концентрированные растворы щелочей растворяют амфотерные оксиды и гидроксиды с образованием комплексных солей:
2KOH + Fe2O3 + 3H2O = 2K[Fe(OH)4]
2KOH + BeO + H2O = K2[Be(OH)4]
Ba(OH)2 + Fe2O3 + 3H2O = Ba[Fe(OH)4]2
Ba(OH)2 + BeO + H2O = Ba[Be(OH)4]
KOH + Fe(OH)3 = K[Fe(OH)4]
2KOH + Be(OH)2 = K2[Be(OH)4]
Ba(OH)2 + 2Fe(OH)3 = Ba[Fe(OH)4]2
Ba(OH)2 + Be(OH)2 = Ba[Be(OH)4]
- Концентрированные щелочи вступают в реакции с некоторыми металлами (Al, Be, Zn) с образованием комплексной соли и выделением водорода:
2NaOH + 2Al + 6H2O = 2Na[Al(OH)4] + 3H2↑
2NaOH + Be + 2H2O = Na2[Be(OH)4] + H2↑
2NaOH + Zn + 2H2O = Na2[Zn(OH)4] + H2↑
Ba(OH)2 + 2Al + 6H2O = Ba[Al(OH)4]2 + 3H2↑
Ba(OH)2 + Zn + 2H2O = Ba[Zn(OH)4] + H2↑
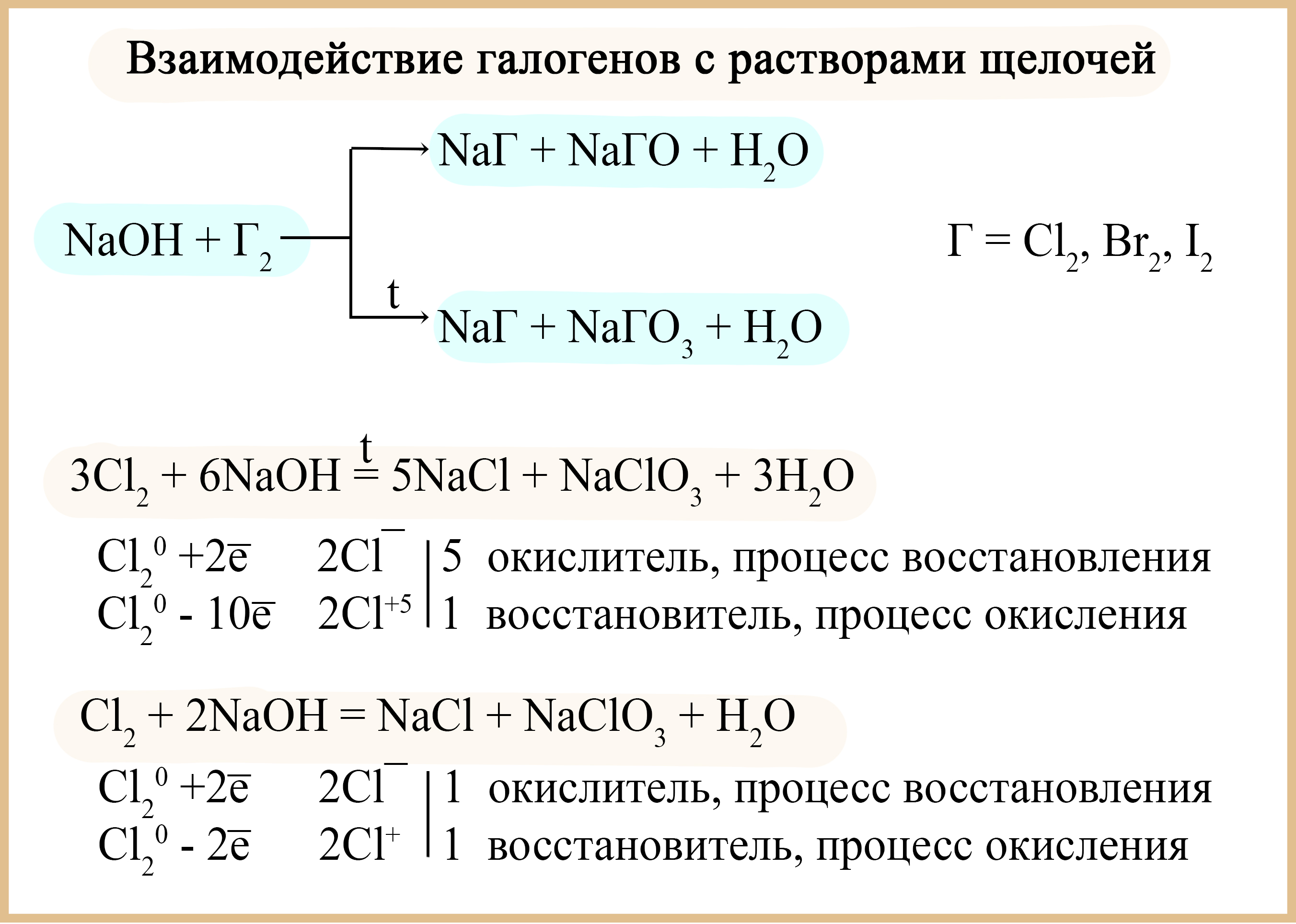
- Хлор, бром, йод диспропорционируют в щелочах, продукты реакции зависят от температуры, при которой происходит реакция:
Cl2 + 2NaOH(холодный) = NaCl + NaClO +H2O
3Cl2 + 6NaOH(горячий) = 5NaCl + NaClO3 + 3H2O
Реакция хлора с гидроксидом натрия
Диспропорционирование галогенов в щелочах
- Фосфор, сера также самоокисляются-самовосстанавливаются в щелочах:
P4 + 3NaOH + 3H2O = 3NaH2PO2 + PH3
3S + 6NaOH = 2Na2S + Na2SO3 + 3H2O
- Кремний реагирует с щелочами в качестве восстановителя:
Si + 2NaOH + H2O = Na2SiO3 + 2H2↑
Получение щелочей
- Щелочи можно получить из гидридов, нитридов, фосфидов, карбидов:
LiH + H2O = LiOH + H2↑
CaH2 + 2H2O = Ca(OH)2 + 2H2↑
Na3N + 3H2O = 3NaOH + NH3↑
Ca3N2 + 6H2O = 3Ca(OH)2 + 2NH3↑
K3P + 3H2O = 3KOH + PH3↑
Ba3P2 + 6H2O = 3Ba(OH)2 + 2PH3↑
Na4C + 4H2O = 4NaOH + CH4↑
CaC2 + 2H2O = Ca(OH)2 + C2H2↑
- При растворении оксида щелочного или щелочноземельного металла в воде образуется раствор щелочи:
Na2O + H2O = 2NaOH
BaO + H2O = Ba(OH)2
Реакции идут с выделением большого количества теплоты, то есть являются экзотермическими.
- Щелочи можно получить растворением пероксидов в воде (характерно для получения гидроксида натрия, гидроксида калия и гидроксида бария):
Na2O2 + 2H2O = H2O2 + 2NaOH
BaO2 + 2H2O = H2O2 + Ba(OH)2
- Раствор щелочи получают при растворении щелочного или щелочноземельного металла в воде:
2K + 2H2O = 2KOH + H2↑
Sr + 2H2O = Sr(OH)2 + H2↑
- Растворы щелочей можно получить обменными реакциями:
Li2SO4 + Ba(OH)2 = 2LiOH + BaSO4↓
K2SO4 + Sr(OH)2 = 2KOH + SrSO4↓
- Раствор щелочи можно получить электролизом раствора соли, содержащей катион щелочного или щелочноземельного металла и бескислородный анион, например раствор гидроксида калия получают электролизом раствора хлорида калия:
KCl + H2O = KOH + H20↑ + Cl20↑
Катод: 2H2O + 2ē = H20↑ + 2OH‒
Анод: 2Cl‒ ‒2ē = Cl20
Электролизом расплава соли, содержащей щелочной металл, щелочь получить нельзя. Этим способом получают сам щелочной металл.
|
К щёлочям относят: Гидроксиды щёлочных металлов (щелочные металлы — это литий, натрий, калий, рубидий, цезий, франций, унуненний). Гидроксиды щёлочноземельных металлов (кальций, стронций, барий, радий). Основания, которые хорошо растворяются в воде, относятся к щёлочям. В частности, к ним можно отнести вещества: NaOH (гидроксид натрия, едкий натр) Ba(OH)2 (гидроксид бария, едкий бариат) KOH (гидроксид калия) и др. Взаимодействие с кислотами: Это основное свойство щелочей, данную реакцию называют реакцией нейтрализации. В её результате образуется соль и вода. Fe(OH)3 + 3HCL = FeCl3 + H2O. За прохождением реакций можно наблюдать по изменениям окраски индикаторов. Применение: В медицине, в различных сферах промышленности (сельское хозяйство — в качестве производства удобрений, рыболовство — очистка прудов), в качестве электролита. автор вопроса выбрал этот ответ лучшим spring948374 5 лет назад Щелочами называются растворимые в воде основания металлов. Металлы эти так и называют: щелочные, щелочноземельные. Это калий, кальций, барий, натрий, литий, цезий, рубидий, магний и другие. Примеры щелочей: гидроксид натрия (едкий натр), гидроксид калия (едкое кали, каустический поташ), гидроксид кальция. Щёлочи нейтрализуются кислотами, в результате реакции остаётся соль металла и вода. Щелочью можно определить как основание, которое растворяется в воде. Например, гидроксид натрия, гидроксид калия и карбонат натрия являются щелочами. Щелочные вещества различаются по своей силе действия. Большая часть щелочных веществ являются токсичными, некоторые из них могут вызывать коррозию, а некоторые могут раздражать кожу и глаза. Более сильные щелочи могут вызывать ожоги, а в случае проглатывания — смерть или внутренние травмы. Основываясь на силе воздействия, щелочи могут быть: Мягкие — пример мягкой щелочи — пищевая сода (бикарбонат натрия) Умеренные — типичные примеры мягких щелочей включают домашний аммиак, буру и тринатрийфосфат Очень сильные — наиболее часто встречаются сильные щелочи — стиральная сода (карбонат натрия) и щелочь (каустическая сода). По определению, щёлочь — это растворимое основание. То есть если основание не растворимо в воде, то это не щелочь. Пример нерастворимых оснований — гидроксид железа Fe(OH)3, гидроксид меди Cu(OH)2 и многие другие. Примеры растворимых оснований: гидроксид натрия (едкий натр, каустическая сода) NaOH, гидроксид калия (историческое название — едкое кали) КОН, гидроксид лития LiOH, гидроксиды рубидия и цезия RbOH и CsOH, гидроксид бария Ва(ОН)2, гидроксид одновалентного таллия TlOH; более слабые щелочи — гидроксиды стронция Sr(OH)2 и гидроксид кальция Са(ОН)2. К щелочам относят также гидроксид аммония (водный раствор аммиака) NH4OH, который существует только в растворе. Условно к щелочам можно отнести карбонаты щелочных металлов, например, соду Na2CO3. Водные растворы всех щелочей характеризуются высокой концентрацией гидроксид-анионов ОН-. Гидроксиды щелочных металлов называют также едкими щелочами. Все щелочи разрушают кожу, поэтому они не должны на нее попадать. Особенно опасно попадание щелочи в глаза. Zolotynka 5 лет назад Существует четкая градация веществ, в зависимости от содержания в них рН. Так, вещества с рН 7 называют нейтральными, с рН выше 7 — щелочными, ниже — кислотами. Все щелочи являются основаниями и растворимы в воде, однако не все основания — щелочи. Основания представляет собой вещества, которые нейтрализует кислоту. Так, например, оксиды и гидроксиды металлов реагируют с кислотами и образуют нейтральные вещества. Когда щелочи добавляют к кислоте, рН смеси повышается, образуя нейтральные продукты. Реакция, в результате которой кислотность или щелочность нейтрализуется, называется нейтрализацией. Примерами щелочей могут быть: отбеливатель, мыльная вода, аммиак, разрыхлитель, морская вода и т.д. Maria Muzja 5 лет назад Скорее всего, такой вопрос может заинтересовать школьников и студентов, давайте разберемся. Щелочь — это в химии, растворимое в воде сильное основание, которое создает в водном растворе очень большую концентрацию ионов «ОН», это «гидроксид» какого-то из щелочно-земельных/щелочных металлов. Слово произошло от слова «щелок». Еще можно так сказать, что это электролиты, которые диссоциируются в водных растворах на катионы металла/гидроксид анионы. Nelli4ka 6 лет назад К щелочам относят сильные основания, которые весьма хорошо растворяются в воде, при этом реакция сопутствует с выделением тепла. Такими основаниями являются гидроксиды металлов I а и II а подгрупп периодической системы. Формула вещества формируется из двух компонентов: собственно, наименования металла и гидроксогруппы OH. Щелочь способна нейтрализовать кислоту, при этом выделяется вода и соль. moreljuba 6 лет назад Под таким понятием как «щёлочи» имеются ввиду растворяемые в воде и в тоже время сильные основания, которые способны создавать в водных растворах огромную концентрацию ионов ОН-. К щёлочам можно отнести: 1) Гидроксиды так называемых щелочных металов, например, это калий, натрий, литий; 2) Гидроксиды так назваемых щёлочноземельных металлов, например, это кальций, радий, стронций. Ещё: владсандрович 6 лет назад Под словом щелочь, понимают как металлы, так и химические основания в целом. Если щелочь, отображается не в металле, а в каком либо химическом образовании, то как правило, его чертой является то, что эта субстанция, хорошо растворяется в воде. Что касается металлов, то все они входят, в две под группы, LA LLA, таблице Менделеева: Donfalcon 5 лет назад Щелочь — это химическое соединение, так называемые гидроксиды металлов. Химическая формула щелочей состоит из атома щелочного или щелочноземельного металла и гидроксигруппы обозначаемой ОН. Примерами щелочей являются гидроксид лития — LiOH, гидроксид натрия — NaOH. Знаете ответ? |
В уроке 38 «Получение и применение оснований» из курса «Химия для чайников» рассмотрим способы получения щелочей и нерастворимых оснований, а ещё узнаем где в каких отраслях они применяются.
Поскольку растворимые и нерастворимые основания отличаются по свойствам, эти вещества получают разными способами.
Содержание
- Получение щелочей
- Взаимодействие активных металлов (Li, Na, К, Ca, Ba) с водой
- Взаимодействие оксидов активных металлов с водой
- Получение нерастворимых оснований
- Применение оснований
Получение щелочей
Для получения щелочей можно использовать следующие реакции.
Взаимодействие активных металлов (Li, Na, К, Ca, Ba) с водой
Например:
Поскольку эти реакции протекают очень бурно (рис. 121), на практике их используют редко.
Взаимодействие оксидов активных металлов с водой
Например:
Некоторые щелочи (NaOH, KOH) получают, пропуская электрический ток через водные растворы солей NaCl или KCl. При этом наряду со щелочами образуются и другие ценные вещества — водород H2 и хлор Сl2.
Получение нерастворимых оснований
Нерастворимые основания получают взаимодействием растворимых оснований (щелочей) с солями. Образующиеся нерастворимые основания выделяются из растворов в виде осадков.
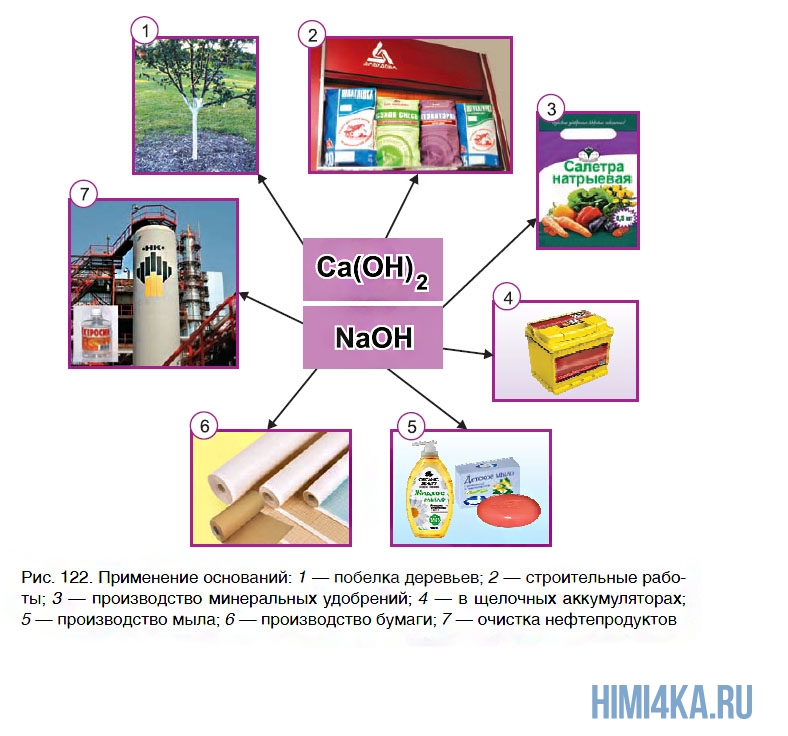
Применение оснований
Из всех оснований наиболее широкое применение находят щелочи. Раствор одной из них вы наверняка сможете найти дома. Эту жидкость под названием «Крот» используют в быту для промывания труб, идущих от кухонных раковин. Дело в том, что эти трубы постепенно засоряются остатками жира, которые мешают стоку воды. А щелочи обладают способностью растворять жиры. Поэтому достаточно в засоренную трубу влить небольшое количество «Крота», и через некоторое время проблема будет решена.
В последнее время в быту получили широкое распространение щелочные гели — густые жидкости, содержащие гидроксид натрия. Они предназначены для быстрого удаления остатков пригоревшего жира с поверхности кухонных плит и СВЧ- печей.
Большое количество гидроксида кальция используется в производстве сахара из сахарной свеклы. Некоторые области применения оснований показаны на рисунке 122.
Из нерастворимых оснований применение находят гидроксиды алюминия Al(OH)3 и магния Mg(OH)2. Они входят в состав медицинского препарата «Алмагель», который используют при заболеваниях пищеварительной системы.
Поскольку щелочи оказывают разрушающее действие на кожу, при их практическом использовании следует соблюдать правила безопасности.
Краткие выводы урока:
- Щелочи образуются при взаимодействии некоторых металлов и их оксидов с водой.
- Нерастворимые основания получаются в результате взаимодействия щелочей с солями.
Надеюсь урок 38 «Получение и применение оснований» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
В (1754) году французский химик Г. Руэль ((1703)–(1770)) ввёл термин «основание», подразумевая, что к соединениям данного класса относится любое вещество, которое способно взаимодействовать с кислотами, образуя соли.
Гийом Франсуа Руэль
(1703)–(1770)
Позже значение этого термина неоднократно уточнялось. Одно из определений, которым пользуются в настоящее время, звучит так:
Основаниями называют сложные вещества, в состав которых входят металлические химические элементы, соединённые с одной или несколькими гидроксогруппами (группами атомов (-OH)).
Исходя из этого, общую химическую формулу оснований можно изобразить следующим образом:
где (M) — знак металлического химического элемента,
а (n) — индекс, численно совпадающий с валентностью металла.
Основания относятся к электролитам, то есть к веществам, растворы и расплавы которых проводят электрический ток.
С точки зрения теории электролитической диссоциации, основания — электролиты, которые, диссоциируя, из отрицательно заряженных ионов образуют только гидроксид-ионы.
Номенклатура оснований
Название основания состоит из слова «гидроксид» и названия металлического химического элемента в родительном падеже. Если металлический элемент имеет переменную валентность, то последняя указывается римскими цифрами в скобках без пробела сразу же после названия металла.
Пример:
— гидроксид железа((II)),
— гидроксид хрома((II)).
Растворимые в воде основания называют щелочами.
По их способности растворяться в воде основания делят на растворимые и практически нерастворимые.
|
Примеры: Ca(OH)2
— гидроксид кальция. |
Примеры: Cu(OH)2
— гидроксид меди((II)), Fe(OH)2
— гидроксид железа((II)), Cr(OH)2
— гидроксид хрома. |
Источники:
https://upload.wikimedia.org/wikipedia/commons/d/d5/Guillaume-Fran%C3%A7ois_Rouelle.jpg