Неорганическая соль, соль щелочного металла калия и метакремниевой кислоты.
Альтернативное название
Калий кремнекислый; калиевая силикат-глыба; К метасиликат калия
Формула
K2SiO3
Физические свойства
| Свойство | Описание |
|---|---|
| Внешний вид | Бесцветные прозрачные кристаллы или белые хлопья |
| Молярная масса | 976 г/моль |
| Температура плавления | -97oС |
| Плотность | 2,6 г/см3 |
Химические свойства
При взаимодействии с сильными кислотами оседает гелеобразный осадок кремниевых кислот общей формулы nH20·mSiO2:
m K2SiO3 + 2m HCl + (n-m) H2O = 2m KCl + nH20·mSiO2↓.
При взаимодействии с плавиковой кислотой образуется гексафторосиликат калия:
K2SiO3 + 6HF = K2[SiF6]↓ + 3H20.
В водном растворе подвергается гидролизу. В холодной воде гидролиз частичный:
K2SiO3 + 6HF = KHSiO3 + KOH,
а в горячей он протекает до конца с образованием осадка кремниевых кислот:
K2SiO3 + (n+1) H2O = 2KOH + SiO2· nH20 ↓.
Силикат калия реагирует с диоксидом углерода:
K2SiO3 + СО2 = SiO2 ↓+ K2CO3.
Получение в промышленности
В промышленности силикат калия получают сплавлением оксида кремния (кварцевого песка) с гидроксидом калия (едким кали) или с карбонатом калия (поташем):
SiO2 + 2KOH = K2SiO3+ Н2О,
SiO2 + K2CO3 = K2SiO3+ СО2.
В первом случае процесс заканчивается при температуре 950-1000°С, во втором – при 1050°С. В результате получается калиевая силикат-глыба. Растворяя ее в горячей воде получают калиевое жидкое стекло. Водный раствор силиката калия имеет консистенцию очень вязкой тягучей жидкости.
Применение
Силикат калия в виде жидкого стекла применяется как клей для склеивания бумаги, стекла, дерева и металла, его добавляют в строительные материалы. Им обрабатывают почву вокруг свай при сооружении фундаментов. В литейном производстве из него и смесей с другими веществами делают литейные формы. Входит он и в состав некоторых строительных смесей для предотвращения их слеживаемости.
В сельском хозяйстве силикат калия применяют в качестве кремниевого удобрения, повышающего урожайность и иммунитет растений к болезням и неблагоприятным условиям среды.
Силикат кальция используется в производстве красок. Получающиеся краски применяют для внутренних работ в помещениях и обладают высокой огнестойкостью. Оценили их и художники как одни из лучших для фресок.
В пищевой промышленности он применялся в России до 2010 г как пищевая добавка Е560 применяемая как средство для предотвращения слеживаемости. Его добавляли в сухое молоко, соль, сахар и другие продукты. Сейчас он запрещен в большинстве стран, кроме Китая и Украины до выяснения его влияния на окружающую среду. Также его подозревают в том, что при передозировке он вреден для желудка и кишечника. Проводятся исследования с целью вынесения окончательного решения об обоснованности его применения в пищевой промышленности.
В медицине его применяют для снижения слеживаемости порошков, а также в качестве вспомогательного вещества в составе таблеток. При умеренном употреблении (не более 30 мг в сутки) силикат калия безвреден.
Пример решения задачи
Какое осмотическое давление 20% раствора силиката калия при температуре 60°С? Плотность раствора равна 1,2 г/мл.
Решение
Вес 1000 мл раствора равен 1,2·1000 = 1200 г.
Молярная масса силиката калия М = 154,28 г/моль.
Составляем пропорцию:
в 100 г раствора – 20 г K2SiO3,
в 1200 г раствора – х г K2SiO3.
х = 1200 · 20 / 100 = 240 г.
Уравнение диссоциации K2SiO3:
K2SiO3 = 2K+ + SiO32-.
Число ионов, образующихся при диссоциации K2SiO3/, i=3.
Молярная концентрация раствора
СМ = 240 / 154,28 = 1,556 моль/л = 1556 моль/м3.
Осмотическое давление:
росм = i· СМ ·R· T = 3·1556 ·8.314 · (60+273) = 1,29·107 Па = 1,29·107 / 1,013·105 = 127,5 атм.
Ответ: 127,5 атм.
Силикат калия
Характеристики и физические свойства силиката калия
Он растворяется в холодной воде (гидролизуется по аниону).
Рис. 1. Силикат калия. Внешний вид.
Таблица 1. Физические свойства силиката калия.
|
Молекулярная формула |
K2SiO3 |
|
Молярная масса, г/моль |
154 |
|
Температура плавления, oС |
976 |
Получение силиката калия
Силикат калия образуется при сплавлении оксида кремния (IV) с карбонатом калия (1) или гидроксидом калия (2):
SiO2 + K2CO3 = K2SiO3 + CO2↑ (t = 1150oC) (1);
SiO2 + 2KOH = K2SiO3 + H2O (t = 900 — 1000oC) (2).
Химические свойства силиката калия
Силикат калия представляет собой среднюю соль, образованную сильным основанием – гидроксидом калия (KOH) и слабой кислотой – кремниевой (H2SiO3). В водном растворе она подвергается гидролизу по аниону. Наличие гидроксид-ионов свидетельствует о щелочном характере среды.
K2SiO3↔ 2K+ + SiO32-;
K+ + SiO32- + HOH ↔ HSiO3— + K+ + OH—;
K2SiO3 + H2O↔KHSiO3 + KOH.
K+ + HSiO3— + HOH ↔H2SiO3+ K+ + OH—;
KHSiO3 +H2O↔H2SiO3 + KOH.
Силикат калия разлагается в горячей воде:
K2SiO3 + H2Ohot = 2KOH + SiO2×nH2O↓.
Эта соль взаимодействует с кислотами (3) и диоксидом углерода (4):
K2SiO3 + 2HCldilute = SiO2↓ + 2KCl + H2O (3);
K2SiO3 + CO2 = SiO2↓ + K2CO3 (4).
Применение силиката калия
Силикат калия используется в пищевой промышленности (добавка Е560), при производстве косметических средств, фармацевтических препаратов и кремнийсодержащих минеральных удобрений.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |
From Wikipedia, the free encyclopedia
|
|

|
|
| Names | |
|---|---|
| Preferred IUPAC name
Potassium metasilicate |
|
| Other names
Liquid glass |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChemSpider |
|
| ECHA InfoCard | 100.029.989 |
| EC Number |
|
| E number | E560 (acidity regulators, …) |
|
PubChem CID |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
K2O3Si |
| Molar mass | 154.279 g·mol−1 |
| Appearance | White crystals |
| Hazards | |
| GHS labelling: | |
|
Pictograms |
 
|
|
Signal word |
Danger |
|
Hazard statements |
H314, H335 |
|
Precautionary statements |
P260, P261, P264, P271, P280, P301+P330+P331, P303+P361+P353, P304+P340, P305+P351+P338, P310, P312, P321, P363, P403+P233, P405, P501 |
| NFPA 704 (fire diamond) |
1 0 0 |
| Related compounds | |
|
Other anions |
Potassium carbonate Potassium germanate Potassium stannate Potassium plumbate |
|
Other cations |
Sodium silicate |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Potassium silicate is the name for a family of inorganic compounds. The most common potassium silicate has the formula K2SiO3, samples of which contain varying amounts of water. These are white solids or colorless solutions.[1]
Synthesis, structure, reactions[edit]
Potassium silicate can be synthesized in the laboratory by treating silica with potassium hydroxide, according to this idealized equation:
These solutions are highly alkaline. Addition of acids causes the reformation of silica.
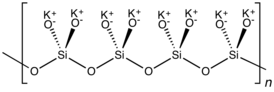
K2SiO3 adopts a chain or cyclic structures with interlinked SiO32− monomers. Each Si is tetrahedral.
Uses[edit]
Woodwork protection against fire[edit]
Impregnation of wood with a potassium silicate solution is an easy and low cost way for rendering the woodwork of houses secure against catching fire. The woodwork is first saturated with a diluted and nearly neutral solution of potash silicate. After drying, one or two coats of a more concentrated solution are usually applied.[2]
Horticulture[edit]
In horticulture, potassium silicate is used as a soluble source of potassium and silica. It makes the growing medium more alkaline.
It is also used as a supplement (in conjunction with normal fertilizer) for the numerous benefits that increasing the availability of silicon compounds has. Silicon-containing compounds are valuable to a plant, and serve to support the plant. Stems thicken, the plant becomes more tolerant to drought and resists wilting, and the plant gets larger leaves and fruit (because the stem can support more weight).[3] The thicker cell walls of the plant also provides an added mechanical resistance to sap sucking insects (e.g. spider mite) and various pathogenic fungi (e.g. powdery mildew).
Industrial uses[edit]
Some metal cleaning formulations use potassium silicate, which also serves as a corrosion inhibitor.[4] It also finds various uses in the fabrication of welding rods or even of cosmetics.
Silicon Dioxide production[edit]
Potassium silicate may also be employed in the glass recycling as an intermediate step in obtaining relatively pure and cheap SiO2 for further processing (e.g. for fused glass).[5]
Safety[edit]
Potassium silicate is strongly alkaline.[6]
See also[edit]
- Sodium silicate
- Silica gel
References[edit]
- ^ Gerard Lagaly, Werner Tufar, A. Minihan, A. Lovell «Silicates» in Ullmann’s Encyclopedia of Industrial Chemistry, Wiley-VCH, 2005. doi:10.1002/14356007.a23_661
- ^ Cobleigh, Rolfe (1909). Handy farm devices and how to make them. Part II: Worth knowing to render wood fireproof. New York: Orange Judd.
- ^ S. Y. Wang & G. J. Galletta (1998) Foliar application of potassium silicate induces metabolic changes in strawberry plants, Journal of Plant Nutrition, 21:1, 157-167, doi:10.1080/01904169809365390
- ^ Elmore AR (2005). «Final report on the safety assessment of potassium silicate, sodium metasilicate, and sodium silicate». Int. J. Toxicol. 24 (Suppl 1): 103–17. doi:10.1080/10915810590918643. PMID 15981734. S2CID 208153862.
- ^ Mori, H. (2003-08-01). «Extraction of silicon dioxide from waste colored glasses by alkali fusion using potassium hydroxide». Journal of Materials Science. 38 (16): 3461–3468. doi:10.1023/A:1025100901693. ISSN 1573-4803.
- ^ Mori, H. (2003-08-01). «Extraction of silicon dioxide from waste colored glasses by alkali fusion using potassium hydroxide». Journal of Materials Science. 38 (16): 3461–3468. doi:10.1023/A:1025100901693. ISSN 1573-4803.
External links[edit]
Силикат калия — это неорганическое соединение калия и метакремниевой кислоты. Вещество применяется во многих областях: как кремнийсодержащее удобрение в садоводстве, в качестве пропитки, препятствующей возгоранию древесных изделий, для получения сварочных смесей, как антикоррозийный элемент. Калиевый силикат в составе косметических и лекарственных средств выполняет функцию антислёживающего агента, он проявляет бактерицидное и эмульгирующее действие. Ранее применялся в пищевой отрасли под кодом Е560, сегодня эта добавка запрещена в связи с доказанным вредом желудочно-кишечному тракту.
Содержание
- Что такое силикат калия, формула
- Физические свойства, внешний вид
- Химические свойства, реакции
- Производство и получение, уравнение калия силиката
- Применение
- Применение в пищевой промышленности, косметологии и фармацевтике
- Применение в сельском хозяйстве и других областях
- Польза и вред пищевой добавки
- Упаковка, транспортировка, класс опасности
- Где купить и сколько стоит
- Заключение
Что такое силикат калия, формула
Силикат калия представляет собой калиевую соль кремниевой кислоты – слабое нестабильное вещество с химической формулой H2SiO3. Кремнекислый калий описывается формулой K2SiO3. Он не встречается в природе, синтезирован искусственным путём. Является результатом замещения двух атомов водорода калием – высокореактивным металлом щелочной группы. Молекула представляет собой полимерные единицы, состоящие из кремния, соединённого с двумя кислородами (валентность +4) посредством ковалентных полярных связей, с положительно заряженным калием.
Физические свойства, внешний вид
Силикат калия — это порошок, хлопья либо мелкодисперсные кристаллы беловатого либо желтоватого цвета, могут быть бесцветные. Не имеет вкуса и запаха, высоко гигроскопичный. Растворяется в воде, при нагревании растворимость улучшается. В холодном растворе образует коллоиды, взвесь мелких частичек в жидкой фазе, в горячем – разлагается.
Концентрированный раствор силиката называют жидким стеклом, широко применяется для выпуска стройматериалов, огнеупорных красок, машинного масла. При этом формируется гидрозоль – равномерно распределённая взвесь твёрдого тонко распыленного твёрдого вещества в воде. Атомарный состав гидрозоля: SiO2∙nH2O. Не смешивается со спиртами, в частности с этанолом.
Плавится в пределах 976-978 °С, плотность низкая. Раствор силиката характеризуется сильнощелочной реакцией из-за гидролиза по аниону, который сопровождается отделением большого количества гидроксильных группировок (-OH). Проявляет высокую адсорбирующую способность.
Химические свойства, реакции
Силикат калия реагирует с кислотами, вступая в реакцию ионного обмена. Так, при взаимодействии с хлороводородом выделяется хлорид калия:
K2SiO3 + 2HCl → 2KCl + H2SiO3↓
Это качественная реакция, осаждается слаборастворимая кислота калия – желейного белёсого студенистого осадка. Силикат калия реагирует с газами, с диоксидом углерода даёт кремнезём и карбонат:
K2SiO3 + CO2 → SiO2↓ + K2CO3
Гидролиз протекает в растворе, реакция сопровождается выделением гидрометасиликата калия, калиевых и гидроксид-ионов:
K2SiO3 + H2O → KHSiO3 + HO– + K+
Силикат калия реагирует с горячей жидкостью, при этом начинается необратимое разложение до едкого кали:
K2SiO3 + 2H2O → 2KOH + H2SiO3↓
Реакция с плавиковой кислотой калия силиката даёт гексафторосиликат калия:
K2SiO3 + HF → K2[SiF6]↓ + 3H2O.
Производство и получение, уравнение калия силиката
Кристаллы силиката калия
Метасиликат калия в лабораторных и промышленных условиях синтезируют путём сплавления. Карбонат калия реагирует с оксидом:
SiO2 + K2CO3 → K2SiO3 + CO2↑
Из уравнения калия силиката следует, что это обратимая реакция, которая может идти в обе стороны. Она протекает при нагреве порядка 1150 °С. Менее жёсткий температурный режим возможен при смешивании кремнезёма с каустическим поташем:
SiO2 + KOH → K2SiO3 + H2O
Процесс производства идёт в несколько этапов:
- Подготавливают сырьё, им служит в основном кварцевый песок. Необходимо, чтобы он был чист от негашёной извести, оксидов железа, алюминия. При необходимости его дополнительно обогащают для снижения концентрации вредных примесей. В качестве источника щёлочи выбирают сульфат натрия, соду.
- Для получения шихты – однородной смеси материалов, их смешивают, проводят увлажнение до 6%, это улучшает однородность и облегчает перемешивание. При этом на поверхности кварцевых зерен образуется щелочная плёнка, что интенсифицирует силикатообразование.
- Дальнейшие этапы протекают при постепенном снижении и повышении режима температуры. При 100-120 °С удаляют излишнюю влагу.
- При 500 °С происходят полиморфные превращения кварца: изменение модификации (тригональная, гексональная).
- При 855 °С расплавляются различные составляющие шихты, например, натриевая соль угольной кислоты.
- При 900 °С образуется силикат калия. При дальнейшем нагреве (1400 °С) формирует стекольная масса, которая затем охлаждается. Для выработки чистого соединения на этом этапе его фильтруют.
- Кристаллы отправляются в вакуумную сушку, где освобождаются от избыточного увлажнения, затем просеиваются.
Применение
Силикат калия используется в лёгкой и тяжёлой промышленности. Это сырьё для изготовления стекла, устойчивых к возгоранию стройматериалов. Другая сфера применения силикатного порошка – удобрение для почв, бедных кремнием. Гидрированный силикат натрия хорошо склеивает металл, дерево и бумагу, укрепляет фундамент построек, подходит для создания литейных форм. Реагент нашел применение в медицине и косметике, он предотвращает образование комочков, уничтожает патогенную микрофлору.
Применение в пищевой промышленности, косметологии и фармацевтике
Добавка Е560 до 2010 года в большинстве стран использовалась как эмульгатор и стабилизатор. Она не давала сыпучим продуктам слёживаться, поглощать влажность из воздуха, образуя комочки, способствовала сохранению привлекательного товарного вида. После тщательных исследований выяснилось, что силикат калия небезопасен, после чего его исключили из оборота многие государства, кроме Украины и Китая. Ранее встречался на упаковке такой продукции, как:
- быстрорастворимые напитки;
- мука;
- соль;
- сахар, сахарная пудра;
- супы и картофельное пюре быстрого приготовления;
- кофе, какао.
Несмотря на запрет в пищевой индустрии, силикат калия добавляется в косметику. Часто производители вносят его в сыпучие средства, такие как тени для век, румяна, пудру, сухие духи, антиперспиранты, присыпки. Играет роль связующего компонента, продлевает срок годности, негативно влияет на бактерии и грибки, подавляя их жизнедеятельность.
Схожую функцию силикат калия выполняет в лекарствах. Его добавляют в таблетированные формы для увеличения стойкости таблетки к действию повреждающих механических факторов, для эмульгации активного компонента со вспомогательными. Важен для медицинской сферы, поскольку препятствует образованию комков в порошковых смесях.
Применение в сельском хозяйстве и других областях
Силикат калия — это хорошая подкормка, восстанавливающая содержание микроэлементов в клеточном соке. При недостатке этого элемента растения чувствуют себя плохо, это сопровождается такими симптомами, как:
- побеги истончаются и становятся более ломкими;
- листья теряют хлорофилл, начинают желтеть и увядать;
- снижается урожайность за счёт потери некоторых цветков способности к опылению;
- цветение отсутствует или менее обильное;
- плохо растут корни;
- нарушается солевой обмен, хуже усваивают азот и фосфор, понижается продуктивность зелёной массы.
Удобрение понижает кислотность субстрата. В кислых почвах растения развиваются хуже, поэтому при избытке органических кислот (фульвокислоты, винная, уксусная и др.) необходимо повышать значение водородного показателя.
Из-за специфических свойства возможно применение как внекорневой и как прикорневой подкормки. Он способствует упрочнению листьев, стеблей и побегов, укрепляет клеточную стенку при сохранении её упругости, запускает рост и цветение декоративных культур. Стимулируется устойчивость к стрессовым факторам, улучшается морозостойкость, засухоустойчивость. Благодаря силикату у растений формируется стойкий иммунитет против патогенов и вредителей.
В строительстве силикат калия – кислото- и гидроупорная добавка в строительные спецпродукты. Это пластификатор бетона и цемента, улучшает его прочность и устойчивость при застывании, снижает нагрузку повреждающих факторов среды. Он необходим для производства электродов, а также сварок, литья. Его добавляют в краски, которые можно использовать для внутренних и внешних отделочных работ, они устойчивы к действию пламени, отличаются низкой пожароопасностью.
Польза и вред пищевой добавки
Е560 не приносит организму пользы, поскольку минералы в таком виде не усваиваются организмом и находятся в продукции в слишком низкой концентрации. Попадая в ЖКТ, соединение проходит через него и выделяется неизменным.
Существуют данные о негативном влиянии силиката на слизистую желудка и кишечника. Он токсичен и очень щелочной, способен вызывать повреждения тканей и провоцировать обострение хронических заболеваний. Учёные предполагают, что он может вредить и окружающей среде, однако однозначного ответа пока нет, проводятся испытания.
Упаковка, транспортировка, класс опасности
Силикат калия относится к 4 классу (малоопасные). При перевозке он упаковывается в вакуумированные полиэтиленовые мешки, мягкие контейнеры, картонные коробки. Раствор силиката транспортируют в плотно закрытых канистрах или бочках.
Где купить и сколько стоит
Силикат калия продаётся заводами-производителями оптом. Цена порошкообразного товара от 70 рублей за 1 кг, раствора – 100-120 руб/л. В качестве удобрения его можно приобрести в садовых магазинах от 80 рублей за 200 грамм.
Заключение
Силикат калия – это огнезащитный реактив, который эффективно повышает температуру возгорание пигментов. Он стабилизирует строительные смеси, повышает их прочность, входит в состав сжижженного стекла, ориентированного на склейку поверхностей разной природы. Использовался в сухих продуктах питания, стабилизируя их структуру, позже исключён из списка безопасных добавок. До сих пор применяется в сыпучей косметике, присыпках, медицинских препаратах. Восполняет дефицит калия в растениях, способствует повышению значения pH почвы.
Читайте также:
- Силикат натрия: свойства, описание, применение
- Нитрат серебра: свойства, реакции, инструкция, применение
- Сульфат алюминия: свойства, применение
- Дихлорметан: свойства, реакции, применение
Сайт предоставляет информацию в справочных целях, только для ознакомления. Поставить диагноз и назначить адекватное лечение может только врач! Медикаменты и народные средства должны назначаться специалистом, так как имеют противопоказания и побочные действия! Посещение и консультации квалифицированного специалиста строго обязательны!
Загрузка…
Содержание
- Силикат калия
- Характеристики и физические свойства силиката калия
- Получение силиката калия
- Химические свойства силиката калия
- Применение силиката калия
- Примеры решения задач
- Кремний. Химия кремния и его соединений
- Кремний
- Положение в периодической системе химических элементов
- Электронное строение кремния
- Физические свойства, способы получения и нахождение в природе кремния
- Качественные реакции
- Соединения кремния
- Способы получения кремния
- Химические свойства
- Бинарные соединения кремния
- Силициды металлов
- Силан
- Карбид кремния
- Галогениды кремния
- Оксид кремния (IV)
- Физические свойства и нахождение в природе
- Химические свойства
- Кремниевая кислота
- Строение молекулы и физические свойства
- Способы получения
- Химические свойства
- Силикаты
Силикат калия
Характеристики и физические свойства силиката калия
Он растворяется в холодной воде (гидролизуется по аниону).
Рис. 1. Силикат калия. Внешний вид.
Таблица 1. Физические свойства силиката калия.
Молярная масса, г/моль
Температура плавления, o С
Получение силиката калия
Силикат калия образуется при сплавлении оксида кремния (IV) с карбонатом калия (1) или гидроксидом калия (2):
Химические свойства силиката калия
Силикат калия представляет собой среднюю соль, образованную сильным основанием – гидроксидом калия (KOH) и слабой кислотой – кремниевой (H2SiO3). В водном растворе она подвергается гидролизу по аниону. Наличие гидроксид-ионов свидетельствует о щелочном характере среды.
K + + SiO3 2- + HOH ↔ HSiO3 — + K + + OH — ;
Силикат калия разлагается в горячей воде:
Эта соль взаимодействует с кислотами (3) и диоксидом углерода (4):
Применение силиката калия
Силикат калия используется в пищевой промышленности (добавка Е560), при производстве косметических средств, фармацевтических препаратов и кремнийсодержащих минеральных удобрений.
Примеры решения задач
| Задание | Какая масса оксида кремния (IV), содержащего 25% примесей,потребуется для получения силиката калия массой 10 г по реакции с карбонатом калия? |
| Решение | Запишем уравнение реакции взаимодействия оксида кремния (IV) с карбонатом калия с образованием силиката калия: |
Рассчитаем количество моль силиката калия (молярная масса равна 154 г/моль):
Согласно уравнению реакции n (K2SiO3) : n (SiO2) = 1: 1. Значит,
Тогда масса оксида кремния (IV) будет равна (молярная масса – 60 г/моль):
Учитывая наличие примесей в составе оксида кремния (IV) его масса будет равна:
m (SiO2) =3,6 × 0,25 = 0,9 г.
Ответ Масса оксида кремния (IV) равна 0,9 г.
| Задание | Какая масса кремниевой кислоты может быть получена при взаимодействии 300 мл 25%-ного раствора силиката калия (плотность 1,1 г/мл) и соляной кислоты? |
| Решение | Запишем уравнение реакции: |
Найдем массу раствора силиката калия, а также массу растворенного вещества K2SiO3 в нем:
msolution =300 × 1,1 = 330 г.
Рассчитаем количество моль силиката калия (молярная масса равна 154 г/моль):
Согласно уравнению реакции n (K2SiO3) : n (H2SiO3) = 1: 1. Значит,
Тогда, масса образующейся кремниевой кислоты будет равна (молярная масса – 78 г/моль):
Источник
Кремний. Химия кремния и его соединений
Кремний
Положение в периодической системе химических элементов
Кремний расположен в главной подгруппе IV группы (или в 14 группе в современной форме ПСХЭ) и в третьем периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение кремния
Электронная конфигурация кремния в основном состоянии :
+14Si 1s 2 2s 2 2p 6 3s 2 3p 2
Электронная конфигурация кремния в возбужденном состоянии :
+14Si * 1s 2 2s 2 2p 6 3s 1 3p 3
Атом кремния содержит на внешнем энергетическом уровне 2 неспаренных электрона и 1 неподеленную электронную пару в основном энергетическом состоянии и 4 неспаренных электрона в возбужденном энергетическом состоянии.
Степени окисления атома кремния — от -4 до +4. Характерные степени окисления -4, 0, +2, +4.
Физические свойства, способы получения и нахождение в природе кремния
Кремний — второй по распространенности элемент на Земле после кислорода. Встречается только в виде соединений. Оксид кремния SiO2 образует большое количество природных веществ – горный хрусталь, кварц, кремнезем.
Простое вещество кремний – атомный кристалл темно-серого цвета с металлическим блеском, довольно хрупок. Температура плавления 1415 °C, плотность 2,33 г/см 3 . Полупроводник.
Качественные реакции
Качественная реакция на силикат-ионы SiO3 2- — взаимодействие солей-силикатов с сильными кислотами . Кремниевая кислота – слабая. Она легко выделяется из растворов солей кремниевой кислоты при действии на них более сильными кислотами.
Например , если к раствору силиката натрия прилить сильно разбавленный раствор соляной кислоты, то кремниевая кислота выделится не в виде осадка, а в виде геля. Раствор помутнеет и «застынет».
Na2SiO3 + 2HCl = H2SiO3 + 2 NaCl
Видеоопыт взаимодействия силиката натрия с соляной кислоты (получение кремниевой кислоты) можно посмотреть здесь.
Соединения кремния
Основные степени окисления кремния +4, 0 и -4.
Наиболее типичные соединения кремния:
| Степень окисления | Типичные соединения |
| +4 | оксид кремния (IV) SiO2
бинарные соединения с неметаллами (карбид кремния SiC) |
| -4 | силан SiH4
силициды металлов (силицид натрия Na4Si) |
Способы получения кремния
В свободном состоянии кремний был получен Берцелиусом в 1822 г. Его латинское название «силиций» произошло от латинского слова « sile х», что означает «кремень». Аморфный кремний в лаборатории можно получить при прокаливании смеси металлического магния с диоксидом кремния. Для опыта диоксид кремния следует тщательно измельчить. При нагревании смеси начинается бурная реакция. Одним из продуктов этой реакции является аморфный кремний.
SiO2 + 2Mg → Si + 2MgO
Видеоопыт взаимодействия оксида кремния (IV) с магнием можно посмотреть здесь.
Еще один способ получения кремния в лаборатории — восстановление из оксида алюминием:
В промышленности использовать дорогие алюминий и магний неэффективно, поэтому используют другие, более дешевые способы:
1. Восстановление из оксида коксом в электрических печах:
SiO2 + 2C → Si + 2CO
Однако в таком процессе процессе образующийся кремний загрязнен примесями карбидов кремния, и для производства, например, микросхем уже не подходит.
2. Наиболее чистый кремний получают восстановлением тетрахлорида кремния водородом при 1200 °С:
SiCl4 +2H2 → Si + 4HCl
или цинком :
SiCl4 + 2Zn → Si + 2ZnCl2
3. Также чистый кремний получается при разложении силана :
Химические свойства
При нормальных условиях кремний существует в виде атомного кристалла, поэтому химическая активность кремния крайне невысокая.
1. Кремний проявляет свойства окислителя (при взаимодействии с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя (при взаимодействии с элементами, расположенными выше и правее). Поэтому кремний реагирует и с металлами , и с неметаллами .
1.1. При обычных условиях кремний реагирует с фтором с образованием фторида кремния (IV):
При нагревании кремний реагирует с хлором, бромом, йодом :
1.2. При сильном нагревании (около 2000 о С) кремний реагирует с углеродом с образованием бинарного соединения карбида кремния (карборунда):
C + Si → SiC
При температуре выше 600°С взаимодействует с серой:
Si + 2S → SiS2
1.3. Кремний не взаимодействует с водородом .
1.4. С азотом кремний реагирует в очень жестких условиях:
1.5. В реакциях с активными металлами кремний проявляет свойства окислителя. При этом образуются силициды:
2Ca + Si → Ca2Si
Si + 2Mg → Mg2Si
1.6. При нагревании выше 400°С кремний взаимодействует с кислородом :
2. Кремний взаимодействует со сложными веществами:
2.1. В водных растворах щелочей кремний растворяется с образованием солей кремниевой кислоты. При этом щелочь окисляет кремний.
2.2. Кремний не взаимодействует с водными растворами кислот , но аморфный кремний растворяется в плавиковой кислоте с образованием гексафторкремниевой кислоты :
При обработке кремния безводным фтороводородом комплекс не образуется:
С хлороводородом кремний реагирует при 300 °С, с бромоводородом – при 500 °С.
2.3. Кремний растворяется в смеси концентрированных азотной и плавиковой кислот :
3Si + 4HNO3 + 12HF → 3SiF4 + 4NO + 8H2O
Бинарные соединения кремния
Силициды металлов
Силициды – это бинарные соединения кремния с металлами, в которых кремний имеет степень окисления -4. Химическая связь в силицидах металлов — ионная.
Силициды, как правило, легко гидролизуются в воде или в кислой среде.
Например , силицид магния разлагается водой на гидроксид магния и силан:
Соляная кислота легко разлагает силицид магния:
Получают силициды сплавлением простых веществ или восстановлением смеси оксидов коксом в электропечах:
2Mg + Si → Mg 2 Si
2MgO + SiO2 + 4C → Mg2Si + 4CO
Силан
Силан – это бинарное соединение кремния с водородом SiH4, ядовитый бесцветный газ.
Если поместить порошок силицида магния в очень слабый раствор соляной кислоты, то на поверхности раствора образуются пузырьки газа. Они лопаются и загораются на воздухе. Это горит силан. Он образуется при взаимодействии кислоты с силицидом магния:
Видеоопыт получения силана из силицида магния можно посмотреть здесь.
На воздухе силан горит с образованием SiO2 и H2O:
Видеоопыт сгорания силана можно посмотреть здесь.
Силан разлагается водой разлагается с выделением водорода:
Силан разлагается (окисляется) щелочами :
Силан при нагревании разлагается :
Карбид кремния
В соединениях кремния с неметаллами — ковалентная связь.
Рассмотрим карбид кремния – карборунд Si +4 C -4 . Это вещество с атомной кристаллической решеткой. Он имеет структуру, подобную структуре алмаза и характеризуется высокой твердостью и температурой плавления, а также высокой химической устойчивостью.
Карборунд окисляется кислородом при высокой температуре:
Карборунд окисляется кислородом в расплаве щелочи :
Галогениды кремния
Хлорид и фторид кремния – галогенангидриды кремниевой кислоты.
SiCl4.
Получают галогениды кремния действием хлора на сплав оксида кремния с углем :
Галогениды кремния разлагаются водой до кремниевой кислоты и хлороводорода:
Хлорид кремния (IV) восстанавливается водородом :
SiCl4 + 2H2 → Si + 4HCl
Оксид кремния (IV)
Физические свойства и нахождение в природе
Оксид кремния (IV) – это твердое вещество с атомной кристаллической решеткой. В природе встречается в виде кварца, речного песка, кремнезема и прочих модификаций:
Химические свойства
Оксид кремния (IV) – типичный кислотный оксид . За счет кремния со степенью окисления +4 проявляет слабые окислительные свойства.
1. Как кислотный оксид, диоксид кремния (IV) взаимодействует с растворами и расплавами щелочей и в расплаве с основными оксидами . При этом образуются силикаты.
Например , диоксид кремния взаимодействует с гидроксидом калия:
Еще пример : диоксид кремния взаимодействует с оксидом кальция.
SiO2 + CaO → CaSiO3
2. Оксид кремния (IV) не взаимодействует с водой , т.к. кремниевая кислота нерастворима .
3. Оксид кремния (IV) реагирует при сплавлении с карбонатами щелочных металлов . При этом работает правило: менее летучий оксид вытесняет более летучий оксид из солей при сплавлении.
Например , оксид кремния (IV) взаимодействует с карбонатом калия. При этом образуется силикат калия и углекислый газ:
4. Из кислот диоксид кремния реагирует только с плавиковой или с газообразным фтороводородом :
5. При температуре выше 1000 °С оксид кремния реагирует с активными металлами, при этом образуется кремний.
Например , оксид кремния взаимодействует с магнием с образованием кремния и оксида магния:
SiO2 + 2Mg → Si + 2MgO
Видеоопыт взаимодействия оксида кремния (IV) с магнием можно посмотреть здесь.
При избытке восстановителя образуются силициды:
SiO2 + 4Mg → Mg2Si + 2MgO
6. Оксид кремния (IV) взаимодействует с неметаллами.
Например , оксид кремния (IV) реагирует с водородом в жестких условиях. При этом оксид кремния проявляет окислительные свойства:
Еще пример : оксид кремния взаимодействует с углеродом. При этом образуется карборунд и угарный газ:
SiO2 + 3С → SiС + 2СО
При сплавлении оксид кремния взаимодействует с фосфатом кальция и углем:
Кремниевая кислота
Строение молекулы и физические свойства
Кремниевые кислоты — очень слабые, малорастворимые в воде соединения общей формулы nSiO2•mH2O. Образует коллоидный раствор в воде.
Метакремниевая H2SiO3 существует в растворе в виде полимера:
Способы получения
Кремниевая кислота образуется при действии сильных кисло т на растворимые силикаты (силикаты щелочных металлов).
Например , при действии соляной кислоты на силикат натрия:
Видеоопыт получения кремниевой кислоты из силиката натрия можно посмотреть здесь.
Даже слабая угольная кислота вытесняет кремниевую кислоту из солей:
Химические свойства
1. Кремниевая кислота — нерастворимая. Кислотные свойства выражены очень слабо, поэтому кислота реагирует только с сильными основаниями и их оксидами :
Например , кремниевая кислота реагирует с концентрированным гидроксидом калия:
2. При нагревании кремниевая кислота разлагается на оксид и воду :
Силикаты
Силикаты — это соли кремниевой кислоты. Большинство силикатов нерастворимо в воде, кроме силикатов натрия и калия, их называют «жидким стеклом».
Способы получения силикатов:
1 . Растворение кремния, кремниевой кислоты или оксида в щелочи:
2. Сплавление с основными оксидами:
СаО + SiO2 → CaSiO3
3. Взаимодействие растворимых силикатов с солями:
Оконное стекло (натриевое стекло) — силикат натрия и кальция: Na2O·CaO·6SiO2.
Стекло получают при сплавлении в специальных печах смеси соды Na2CO3, известняка CaCO3 и белого песка SiO2:
Для получения специального стекла вводят различные добавки, так стекло содержащее ионы Pb 2+ – хрусталь; Cr 3+ – имеет зеленую окраску, Fe 3+ – коричневое бутылочное стекло, Co 2+ – дает синий цвет, Mn 2+ – красновато-лиловый.
Источник













