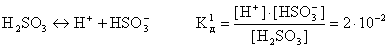Темы кодификатора ЕГЭ: Электролитическая диссоциация электролитов вводных растворах. Сильные и слабые электролиты.
Электролиты – это вещества, растворы и расплавы которых проводят электрический ток.
Электрический ток – это упорядоченное движение заряженных частиц под действием электрического поля. Таким образом, в растворах или расплавах электролитов есть заряженные частицы. В растворах электролитов, как правило, электрическая проводимость обусловлена наличием ионов.
Ионы – это заряженные частицы (атомы или группы атомов). Разделяют положительно заряженные ионы (катионы) и отрицательно заряженные ионы (анионы).
Электролитическая диссоциация — это процесс распада электролита на ионы при его растворении или плавлении.
Разделяют вещества — электролиты и неэлектролиты. К неэлектролитам относятся вещества с прочной ковалентной неполярной связью (простые вещества), все оксиды (которые химически не взаимодействуют с водой), большинство органических веществ (кроме полярных соединений — карбоновых кислот, их солей, фенолов) — альдегиды, кетоны, углеводороды, углеводы.
К электролитам относят некоторые вещества с ковалентной полярной связью и вещества с ионной кристаллической решеткой.
В чем же суть процесса электролитической диссоциации?
Поместим в пробирку несколько кристаллов хлорида натрия и добавим воду. Через некоторое время кристаллы растворятся. Что произошло?
Хлорид натрия – вещество с ионной кристаллической решеткой. Кристалл NaCl состоит из ионов Na+ и Cl—. В воде этот кристалл распадается на структурные единицы-ионы. При этом распадаются ионные химические связи и некоторые водородные связи между молекулами воды. Попавшие в воду ионы Na+ и Cl— вступают во взаимодействие с молекулами воды. В случае хлорид-ионов можно говорить про электростатическое притяжение дипольных (полярных) молекул воды к аниону хлора, а в случае катионов натрия оно приближается по своей природе к донорно-акцепторному (когда электронная пара атома кислорода помещается на вакантные орбитали иона натрия). Окруженные молекулами воды ионы покрываются гидратной оболочкой. Диссоциация хлорида натрия описывается уравнением:
NaCl = Na+ + Cl–
При растворении в воде соединений с ковалентной полярной связью, молекулы воды, окружив полярную молекулу, сначала растягивают связь в ней, увеличивая её полярность, затем разрывают её на ионы, которые гидратируются и равномерно распределяются в растворе. Например, соляная ксилота диссоциирует на ионы так: HCl = H+ + Cl—.
При расплавлении, когда происходит нагревание кристалла, ионы начинают совершать интенсивные колебания в узлах кристаллической решётки, в результате чего она разрушается, образуется расплав, который состоит из ионов.
Процесс электролитической диссоциации характеризуется величиной степени диссоциации молекул вещества:
Степень диссоциации — это отношение числа продиссоциировавших (распавшихся) молекул к общему числу молекул электролита. Т.е., какая доля молекул исходного вещества распадается в растворе или расплаве на ионы.
α=Nпродисс/Nисх, где:
Nпродисс — это число продиссоциировавших молекул,
Nисх — это исходное число молекул.
По степени диссоциации электролиты делят на делят на сильные и слабые.
Сильные электролиты (α≈1):
1. Все растворимые соли (в том числе соли органических кислот — ацетат калия CH3COOK, формиат натрия HCOONa и др.)
2. Сильные кислоты: HCl, HI, HBr, HNO3, H2SO4 (по первой ступени), HClO4 и др.;
3. Щелочи: NaOH, KOH, LiOH, RbOH, CsOH; Ca(OH)2, Sr(OH)2, Ba(OH)2.
Сильные электролиты распадаются на ионы практически полностью в водных растворах, но только в ненасыщенных. В насыщенных растворах даже сильные электролиты могут распадаться только частично. Т.е. степень диссоциации сильных электролитов α приблизительно равна 1 только для ненасыщенных растворов веществ. В насыщенных или концентрированны растворах степень диссоциации сильных электролитов может быть меньше или равна 1: α≤1.
Слабые электролиты (α<1):
1. Слабые кислоты, в т.ч. органические;
2. Нерастворимые основания и гидроксид аммония NH4OH;
3. Нерастворимые и некоторые малорастворимые соли (в зависимости от растворимости).
Неэлектролиты:
1. Оксиды, не взаимодействующие с водой (взаимодействующие с водой оксиды при растворении в воде вступают в химическую реакцию с образованием гидроксидов);
2. Простые вещества;
3. Большинство органических веществ со слабополярными или неполярными связями (альдегиды, кетоны, углеводороды и т.д.).
Как диссоциируют вещества? По степени диссоциации различают сильные и слабые электролиты.
Сильные электролиты диссоциируют полностью (в насыщенных растворах), в одну ступень, все молекулы распадаются на ионы, практически необратимо. Обратите внимание — при диссоциации в растворе образуются только устойчивые ионы. Самые распространенные ионы можно найти в таблице растворимости — это ваша официальная шпаргалка на любом экзамене. Степень диссоциации сильных электролитов примерно равна 1. Например, при диссоциации фосфата натрия образуются ионы Na+ и PO43–:
Na3PO4 → 3Na+ +PO43-
NH4Cr(SO4)2 → NH4+ + Cr3+ + 2SO42–
Диссоциация слабых электролитов: многоосновных кислот и многокислотных оснований происходит ступенчато и обратимо. Т.е. при диссоциации слабых электролитов распадается на ионы только очень небольшая часть исходных частиц. Например, угольная кислота:
H2CO3 ↔ H+ + HCO3–
HCO3– ↔ H+ + CO32–
Гидроксид магния диссоциирует также в 2 ступени:
Mg(OH)2 ⇄ Mg(OH) + OH–
Mg(OH)+ ⇄ Mg2+ + OH–
Кислые соли диссоциируют также ступенчато, сначала разрываются ионные связи, затем — ковалентные полярные. Например, гидрокабонат калия и гидроксохлорид магния:
KHCO3 ⇄ K+ + HCO3– (α=1)
HCO3– ⇄ H+ + CO32– (α < 1)
Mg(OH)Cl ⇄ MgOH+ + Cl– (α=1)
MgOH+ ⇄ Mg2+ + OH– (α<< 1)
Степень диссоциации слабых электролитов намного меньше 1: α<<1.
Основные положения теории электролитической диссоциации, таким образом:
1. При растворении в воде электролиты диссоциируют (распадаются) на ионы.
2. Причина диссоциации электролиты в воде – это его гидратация, т.е. взаимодействие с молекулами воды и разрыв химической связи в нем.
3. Под действием внешнего электрического поля положительно заряженные ионы двигаются к отрицательно заряженному электроду — катоду, их называют катионами. Отрицательно заряженные электроны двигаются к положительному электроду – аноду. Их называют анионами.
4. Электролитическая диссоциация происходит обратимо для слабых электролитов, и практически необратимо для сильных электролитов.
5. Электролиты могут в разной степени диссоциировать на ионы — в зависимости от внешних условий, концентрации и природы электролита.
6. Химические свойства ионов отличаются от свойств простых веществ. Химические свойства растворов электролитов определяются свойствами тех ионов, которые из него образуются при диссоциации.
Примеры.
1. При неполной диссоциации 1 моль соли общее количество положительных и отрицательных ионов в растворе составило 3,4 моль. Формула соли – а) K2S б) Ba(ClO3)2 в) NH4NO3 г) Fe(NO3)3
Решение: для начала определим силу электролитов. Это легко можно сделать по таблице растворимости. Все соли, приведенные в ответах — растворимые, т.е. сильные электролиты. Далее, запишем уравнения электролитической диссоциации и по уравнению определим максимально число ионов в каждом растворе:
а) K2S ⇄ 2K+ + S2–, при полном распаде 1 моль соли образуется 3 моль ионов, больше 3 моль ионов не получится никак;
б) Ba(ClO3)2 ⇄ Ba2+ + 2ClO3–, опять при распаде 1 моль соли образуется 3 моль ионов, больше 3 моль ионов не образуется никак;
в) NH4NO3 ⇄ NH4++ NO3–, при распаде 1 моль нитрата аммония образуется 2 моль ионов максимально, больше 2 моль ионов не образуется никак;
г) Fe(NO3)3 ⇄ Fe3+ + 3NO3–, при полном распаде 1 моль нитрата железа (III) образуется 4 моль ионов. Следовательно, при неполном распаде 1 моль нитрата железа возможно образование меньшего числа ионов (неполный распад возможен в насыщенном растворе соли). Следовательно, вариант 4 нам подходит.
Ответ г).
Как определить сильные и слабые электролиты
Электролиты — это вещества, сплавы веществ или растворы, которые имеют способность электролитически проводить гальванический ток. Определить, к каким электролитам относится вещество, можно применяя теорию электролитической диссоциации.

Инструкция
Суть данной теории заключается в том, что при расплавлении (растворении в воде) практически все электролиты раскладываются на ионы, которые бывают как положительно, так и отрицательно заряженные (что и называется электролитической диссоциацией). Под воздействием электрического тока отрицательные (анионы «-») движутся к аноду (+), а положительно заряженные (катионы, «+»), движутся к катоду (-). Электролитическая диссоциация – это обратимый процесс (обратный процесс носит название «моляризация»).
Степень (a) электролитической диссоциации находится в зависимости от природы самого электролита, растворителя, и от их концентрации. Это отношение числа молекул (n) , которые распались на ионы к общему числу введенных в раствор молекул (N). Получаете: a = n / N
Таким образом, сильные электролиты — вещества, полностью распадающиеся на ионы при растворении в воде. К сильным электролитам, как правило, относятся вещества с сильнополярными или ионными связями: это соли, которые хорошо растворимы, сильные кислоты (HCl, HI, HBr, HClO4, HNO3, H2SO4), а также сильные основания (KOH, NaOH, RbOH, Ba(OH)2, CsOH, Sr(OH)2, LiOH, Ca(OH)2). В сильном электролите вещество, растворенное в нем, находится по большей части в виде ионов (анионов и катионов); молекул, которые недиссоциированные — практически нет.
Слабые электролиты — такие вещества, которые диссоциируют на ионы лишь частично. Слабые электролиты вместе с ионами в растворе содержат молекулы недиссоциированные. Слабые электролиты не дают в растворе сильной концентрации ионов.
К слабым относятся:
— органические кислоты (почти все) (C2H5COOH, CH3COOH и пр.);
— некоторые из неорганических кислот (H2S, H2CO3 и пр.);
— практически все соли, малорастворимые в воде, гидроксид аммония, а также все основания (Ca3(PO4)2; Cu(OH)2; Al(OH)3; NH4OH);
— вода.
Они практически не проводят электрический ток, или проводят, но плохо.
Обратите внимание
Хотя чистая вода проводит электрический ток очень плохо, она все-таки имеет измеримую электрическую проводимость, объясняемую тем, что вода немного диссоциирует на гидроксид-ионы и ионы водорода.
Полезный совет
Большинство электролитов – вещества агрессивные, поэтому при работе с ними будьте предельно осторожны и соблюдайте правила техники безопасности.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
-
Степень диссоциации. Сильные и слабые электролиты
Кроме
константы диссоциации силу электролита
можно определить по значению другого
параметра, зависящего от концентрации
раствора. Таким параметром является
кажущаяся
степень диссоциации
которая
показывает долю молекул распавшихся
на ионы.
Степень
диссоциации (
) — это отношение числа распавшихся на
ионы молекул (Nдис.)
к общему числу молекул растворенного
вещества (Nобщ.):
(7.6.4.)
Степень
диссоциации выражают в долях единицы
или в процентах. Поскольку общее число
молекул вещества в растворе пропорционально
количеству его вещества и его молярной
концентрации, то можно записать:
(7.6.5.)
где
nдис.
и cдис.
— соответственно, количество и молярная
концентрация растворенного вещества,
подвергшегося электролитической
диссоциации.
К
сильным электролитам условно относят
вещества, кажущаяся степень диссоциации
которых в растворе превышает 30% (
> 0,3). При
< 3% (
< 0,03) электролиты считают слабыми, в
других случаях о них говорят как об
электролитах средней силы.
Степень
диссоциации обычно определяют по данным
измерения электропроводности растворов,
которая прямо пропорциональна концентрации
свободно движущихся ионов. При этом
получают не истинные значения ,
а кажущиеся значения. Они всегда меньше
истинных значений ,
т.к. ионы при движении к электродам
сталкиваются и частично уменьшают свою
подвижность, особенно при высокой их
концентрации в растворе, когда возникает
электростатическое притяжение между
ионами. Например, истинное значение
степени электролитической диссоциации
HCl в разбавленном растворе равно 1, в 1 М
растворе
= 0,78 (78%) при 180
С, однако, в этом растворе не содержится
22% недиссоциированных молекул HCl,
практически все молекулы диссоциированы.
Электролиты,
которые в разбавленном водном растворе
диссоциируют практически полностью,
называют сильными электролитами.
К
сильным электролитам в водных растворах
принадлежат почти все соли, многие
неорганические кислоты (H2SO4,
HNO3,
HClO4,
галогеноводородные, кроме HF и др.),
гидроксиды s-элементов (исключение —
Be(OH)2
и Mg(OH)2).
Кажущиеся значения a этих электролитов
находятся в пределах от 70 до 100%. Диссоциация
сильных электролитов — это практически
необратимый процесс:
HCl
H+
+ Cl—
или HCl = H+
+ Cl—
С
точки зрения теории электролитической
диссоциации кислоты
— это вещества, диссоциирующие в водном
растворе с образованием катионов
водорода и анионов кислотного остатка,
основания — это вещества, диссоциирующие
в водном растворе с образованием
гидроксид-ионов OH—
и катионов металла.
Слабые
многоосновные кислоты диссоциируют
ступенчато. Каждую ступень характеризуют
своим значением константы диссоциации,
например:
В
связи со ступенчатой диссоциацией
многоосновные
кислоты способны образовывать кислые
соли,
NaHSO4,
NaHCO3,
K2HPO4
и т.д.
Слабые
многокислотные основания диссоциируют
ступенчато:
Этим
объясняют способность
многокислотных оснований образовывать
основные соли:
CuOHCl, (ZnOH)2SO4
и др.
Электролиты,
которые в разбавленном водном растворе
диссоциируют частично, называют слабыми.
Диссоциация слабых электролитов —
обратимый процесс
например:
|
|
|
|
HCN |
7·10-5 |
|
|
0,013 |
Степень
электролитической диссоциации
зависит от:
-
природы
электролита и растворителя; -
концентрации
раствора; -
температуры
и
возрастает
при увеличении разбавления раствора:
|
C(CH3COOH) |
0,2 |
0,1 |
0,05 |
0,01 |
0,005 |
0,001 |
|
|
0,05 |
1,4 |
1,9 |
4,2 |
6,0 |
12,4 |
|
слабый |
электролит |
Степень
диссоциации возрастает при увеличении
температуры раствора. Увеличение
кинетической энергии растворенных
частиц способствует распаду молекул
на ионы, что приводит к возрастанию
степени диссоциации при нагревании
растворов.
Если
в растворе слабой кислоты или слабого
основания увеличить концентрацию
одноименного иона введением соответствующей
соли, то наблюдается резкое изменение
степени диссоциации слабого электролита.
Рассмотрим, например, как изменится
уксусной кислоты (CH3COOH) при введении в
раствор ацетата натрия (введение
одноименных ионов CH3COO-).
Согласно
принципу Ле Шателье равновесие процесса
диссоциации
сместится
влево в результате увеличения концентрации
ацетат-ионов CH3COO—,
образующихся при диссоциации ацетата
натрия:
CH3COONa
CH3COO—
+ Na+.
Такое
смещение равновесия в сторону образования
CH3COOH
означает уменьшение степени ее диссоциации
и приводит к уменьшению концентрации
ионов водорода, например:
|
C(CH3COOH), |
0,01 |
0,01 |
|
C(CH3COONa), |
0,01 |
|
|
[H+], |
4,32·0-4 |
1,86·10-5 |
Таким
образом, в результате введения в 1 л 0,01
М раствора CH3COOH
0,01 моль CH3COONa
концентрация ионов водорода уменьшилась
в
.
С
точки зрения теории электролитической
диссоциации амфотерные
гидроксиды (амфолиты) — это вещества,
диссоциирующие в водном растворе как
по типу кислот, так и по типу оснований.
К ним относят Be(OH)2,
Zn(OH)2,
Pb(OH)2,
Sn(OH)2,
Al(OH)3,
Cr(OH)3,
и др. Например, уравнения электролитической
диссоциации Be(OH)2:
1)
диссоциация по типу основания:
Be(OH)2
+ 3H2O
OH—
+ [BeOH(H2O)3]
[BeOH(H2O)3]
+ H2O
OH—
+ [Be(H2O)4]
2)
диссоциация
по
типу
кислоты:
Be(OH)2
+ 2H2O
H+
+ [Be(OH)3H2O]
[Be(OH)2H2O]
H+
+ [Be(OH)3]
-
Закон
разведения ОствальдаВильгельм
Фридрих Оствальд
(2.09.1853,—4.04.1932)—
балтийский
немец,
физико-химик и философ-идеалист,
лауреат Нобелевской
премии по химии
1909
года.
Член-корреспондент
Петербургской
АН
(1895).
Между константой и степенью
диссоциации существует определенная
закономерность, которую в 1888г.обнаружил В.Оствальд
и сумел ее объяснить. Эта закономерность
впоследствии была названа законом
разведения Оствальда.
Экспериментальное установление
правильности закона разбавления
Оствальда имело большое значение для
обоснования теории электролитической
диссоциации.
Kдсвязана спростой зависимостью. Если общую молярную
концентрацию электролита в растворе
обозначить СКА, то для бинарных
электролитов концентрации ионов Ky+и Ax-будут равны·CKA. Очевидно, что
[Ky+]
= [Ax-]
= ·CKA
,
[KA]
= CKA
— ·CKA
= CKA·(1-
), тогда
(7.6.6.)
Для
слабых электролитов
0 и (1 —
)
1. Следовательно,

Полученная
зависимость является математическим
выражением закона
разбавления Оствальда:
степень
диссоциации слабого электролита
увеличивается при разбавлении раствора
обратно пропорционально корню квадратному
из его молярной концентрации.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #