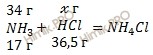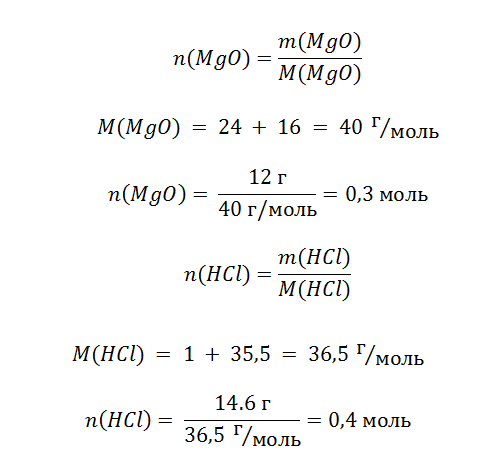Сколько соли образуется
Сколько соли образуется в граммах при взаимодействии 44,8 литров аммиака (NH3) и 33,6 литров хлороводорода (HCl).
Решение задачи
Напомню, вещества вступают в реакцию в определенных стехиометрических отношениях. Если для реакции взяты вещества в отношениях, не соответствующих стехиометрическим, то одно из них окажется в избытке. Масса образовавшегося продукта определяется по массе исходного вещества, прореагировавшего полностью. Такие задачи относят к задачам на избыток-недостаток.
Составим уравнение реакции взаимодействии аммиака (NH3) c хлороводородом (HCl):
Сколько соли образуется.
Используя формулу перерасчета, найдем массу аммиака (NH3) и хлороводорода (HCl), вступивших в реакцию:
Рассчитаем молярные массы аммиака (NH3), хлороводорода (HCl) и соли хлорида аммония (NH4Cl) (смотри таблицу Менделеева):
M (NH3) = 14 + 3 ⋅ 1 = 17 (г/моль);
M (HCl) = 1 + 35,5 = 36,5 (г/моль);
M (NH4Cl ) = 14 + 4 ⋅ 1 + 35,5 = 53,5 (г/моль).
Получаем:
m (NH3) = 44,8 ⋅ 17 /22,4 = 34 (г);
m (HCl) = 33,6 ⋅ 36,5 /22,4 = 54,75 (г).
Найдем, какое из веществ, вступивших в реакцию, дано в избытке, какое – в недостатке. Для удобства расчета за х г примем массу хлороводорода (HCl):
17 г NH3 вступает в реакцию с 36,5 г HCl
34 г NH3 вступает в реакцию с х г HCl
Откуда:
Следовательно, хлороводород (HCl) дан в недостатке, так как по условию его 54,75 г, а по расчету необходимо 73 г, поэтому расчет ведем по хлороводороду (HCl), найдем сколько грамм образуется:
36,5 г HCl участвует в образовании 53,5 г соли
54,75 г HCl участвует в образовании у г соли
Откуда найдем сколько соли образуется:
Ответ:
масса соли 80,25 грамм.
Похожие задачи
План урока:
Основные величины и формулы их нахождения
Основные величины и формулы их нахождения
Ключевым понятием в химии является вещество. Урок 2 в данном курсе, напомнит Вам, все необходимые сведения. Формула для определения количества вещества, в зависимости от исходных данных, выражается в следующем виде.
Для веществ характерно взаимодействие друг с другом. Перед химиками стоит задача вычислить какое количество вещества необходимо для реакции с другим веществом.В химической промышленности, на производстве важно знать, какая масса или объём реагентов необходим, и сколько возможно получить в итоге реакции продукта. Вещества реагируют между собой в определённых количествах, точнее эквивалентах. Как трактовать последнее предложение. Вспомните себя маленькими, когда вы только начинали изучать количество, на примере мячиков, яблок, конфет и т.д.
Согласитесь, что самому большому шарику будет тесно в маленьком стаканчике, впрочем, как и маленькому шарику не совсем уютно будет в большом стаканчике. Т.е. мы выбираем стаканчик для шарика эквивалентно его размеру.
Возьмём, к примеру, кислород, который реакционно-способный и окисляет другие соединения.
Вспомним закон сохранения массы вещества (ЗСМВ), без которого невозможно составить химические уравнения.
Источник
Следует отметить, чтобы прореагировало 1 моль СН4, необходим кислород количеством молей 2. Снова обращаясь к базовому закону, мы видим, что реагентов и продуктов масса одинаковая, точнее 80 г. Почему именно эта цифра, и откуда она взялась. Для этого смотрим на уравнение реакции.
Другими словами, чтобы образовалось 1 моль СО2 и 2 моль Н2О, необходимо чтобы метан и кислород прореагировали пропорционально 1: 2.
Выразим массу, которая будет соответствовать этому количеству вещества.
m = n * M
Вспомним, каким образом вычисляется молярная масса.
Давайте попробуем чуть-чуть усложниться, к примеру, будет реагировать не 1 моль метана, а 2,5 моль. Сколько тогда потребуется О2?
И здесь приведём такой наглядный пример. Один килограмм конфет стоит 2 рубля. Сколько Вам понадобится денег, чтобы купить 2,5 кг. Не составит труда дать ответ, что необходимо потратить 5 рублей. А если, Вы захотите 4 кг, то придётся попросить у родителей уже 8 рублей. Вот эти размышления перенесём на наш пример.
Какое количество мы бы не взяли метана, то кислорода необходимо в 2 раза больше. Т.е. для реакции 2,5 моль СН4 необходим О2 количеством 5 моль.
Количество вещества – это уникальная величина, от которой можно перейти к другим параметрам вещества (m или V), используя основные формулы.
Рассмотрим задачи на определение массы вещества,а также объёма с помощью химических уравнений. Как и при решении, абсолютно всех задач, первое, что мы делаем, читаем внимательно условие и выписываем все известные физические величины (дано), а также определяем, что неизвестно (найти).
Задача 1. Сколько литров (н. у.) кислорода необходимо потратить для полного сгорания 8,5 г сероводорода.
Дано:
m(H2S) = 8,5 г
Найти:
V(O2) — ?
Решение.
Переведём условие задачи на химический язык, т.е. составим уравнение реакции. Важно отметить, что для удобства и лёгкости решения подчеркните те соединения, о которых идёт речь.
Теперь обратим внимание на коэффициенты в химических уравнениях, именно они отвечают за соотношение веществ.
Следует заметить, что массу (г) сероводорода необходимо выразить в количестве (моль).
Запишем мольное соотношение сероводорода и кислорода, в значение числителя подставляем коэффициенты с уравнения, а в знаменателе – что известно в условии задания.
Из пропорции определим число молей для кислорода.
Ответим на вопрос задачи (находим объём кислорода)
Ответ. V(O2) = 8.4 л
Теперь представим следующую ситуацию, Вам на день Рождения или на другой праздник подарили деньги, чтобы Вы приобрели себе желаемую вещь. К примеру, вы хотите себе наушники, карту памяти и новый чехол на телефон. Возникает закономерный вопрос, а хватит ли Вам денег. Такие задачи встречаются и в химии.
Задача 2. Хватит ли 10 л кислорода для сгорания 12 г магния и 0,6 г углерода (н.у.)?
Дано:
V(O2) = 10 л
m(Mg) = 12 г
m(C) = 0,6 г
Найти:
V(O2) — ?
Решение
Особенность этой задачи, что будет два уравнения реакции, взаимодействие О2 отдельно с магнием и углеродом. Это как покупка в двух разных магазинах. Используя алгоритм, приведённый выше, вычислим количество вещества кислорода. Следует заметить, что отдельно ведём расчёт по магнию (или по углероду), заполняя данные таблицы.
Обратите внимание, в предыдущей задаче кислород был в избытке, в объёме 10 – 6,72 = 3,28 л. Этому избытку не с чем реагировать. Представьте, что Вы помощник деда Мороза и пакуете новогодние подарки. Допустим в одном наборе должно содержаться 5 шоколадных конфет и 8 карамелек. Вам необходимо разделить 55 шоколадки и 72 карамельки. Вопрос: сколько наборов у Вас получится? Проведём нехитрые математические исчисления, знакомые Вам ещё с курса математики младшей школы.
55 : 5 = 11
72 : 8 = 9
И что получается, что шоколадки можно разместить в 11 наборов, а карамельки только в 9. Таким образом, получится 9 новогодних подарков, и 10 (5 ∙ 2 = 10) шоколадок будут лишними, они в избытке.
Расчёты по химическим уравнениям, где один из реагентов берётся в избытке (т.е. его больше, чем необходимо), проводятся аналогично, как и с одним известным веществом.
Задача 3. 48,75 цинка привели в реакцию с 5,6 л (условия нормальные) хлора. Сколько соли получилось в итоге, ответ выразите в граммах.
Дано:
V(Cl2) = 5.6 л
m(Zn) = 48.75 г
Найти:
m(ZnCl2) — ?
Решение.
Составим схему взаимодействия, не забудьте отметить количество реагирующих молей.
Теперь наша с Вами задача определить, какое вещество прореагировало полностью, а какое осталось в избытке. Вспомните пакеты с подарками, какие конфеты мы разложили полностью и почему остались шоколадные лишними. Поможет определиться с избытком, решение неравенства.
n (Zn) ? n (Cl2) ?
Расчёт для цинка производится согласно формуле:
Хлор – это газообразное вещество, поэтому нужно применить формулу:
Сравним полученные значения n(Zn) > n(Cl2), цинк находится в избытке, поэтому расчёт ведём по хлору, который прореагировал полностью количеством 0,25 моль.
Из пропорции вычислим количество образованной соли (не забываем, что числитель отвечает за коэффициенты, а знаменатель – это данные в условии).
Ответ. Масса соли равна 34 г.
Большинство химических реакций происходит в растворе. Однако при расчётах необходима масса именно растворённого вещества, которое непосредственно реагирует. Допустим, команда с 12 человек, которая на 25% состоит из девочек и 75% мальчиков, поехала на соревнования. В одном из этапов участвуют только мальчики. Ваша задача определить, сколько мальчиков поехало на соревнования.
Вот эти 9 мальчишек и участвовали в определённом туре, а девочки на данный момент были не в счёт, они были в группе поддержки.
Задача 4. На 12 г оксида магния подействовали 146 г раствора соляной кислоты, с массовой долей раствора 10%. Вычислите, сколько соли образовалось в процессе взаимодействия этих веществ?
Дано:
m(MgO) = 12 г
mр-ра(HCl) = 146 г
Wр-ра(HCl) = 10%
Найти:
m(MgCl2) — ?
Решение
Особенностью этой задачи является то, что в условии указана масса всего раствора, а необходимо знать только,сколько содержится кислоты, которая будет реагировать с MgO. Формула определения массы вещества, находящегося в растворе, выражается в следующем виде.
Обратите внимание, что из всей массы раствора (146 г) реагирует только 10%, а именно 14,6 г.
Теперь задача определить, какого из реагентов больше и он прореагирует не полностью.
Схема показывает, что для реакции 0,3 моль MgO требуется 0,6 моль кислоты. На это размышление нам указывает схема реакции. Для полного растворения оксида необходимо потратить в 2 раза больше HCl, смотрите соотношение 1:2.Однако в нашем распоряжении есть только 0,4 моль, поэтому n(MgO) >n(HCl), оксид находится в избытке, в то время как кислота прореагировала полностью и мы смело можем использовать её количество вещества для расчёта массы соли.
Снова воспользуемся пропорцией, чтобы узнать количество образованной соли.
Теперь не составит особого труда найти массу.
Ответ. m(MgCl2) = 19 г.
В желаниях человечества изобрести идеальную машину, во время работы которой не будет никаких потерь. Однако на выходе не бывает заветных 100%. Аналогично и во время химических процессов на производстве или лаборатории не удаётся получить продукт с выходом реакции 100%. При решении задач мы вычисляем так называемый теоретический выход, что должно быть в идеальной ситуации. Но мы живём в реальном мире, где есть потери: газообразные продукты могут улетучиться, осадок, образованный в процессе реакции, можно не в полной мере выделить из раствора. Поэтому практический выход всегда будет меньше теоретического.
Задача 5. В результате взаимодействия 59,5 г нитрата серебра с избытком раствора соляной кислоты, был выделен осадок массой 45 г. Определите выход реакции.
Дано:
m(AgNO3) = 59.5 г
m(осадка) = 45 г
Найти:
η — ?
Решение.
Своеобразие этого типа задач в том, что необходимо отличать теоретическую и практическую массу продукта. Маленькой подсказкой вам послужит время глагола, если видите прошедшее или настоящее время (получено, выделили), значит это практическая масса. Чтобы найти выход продукта, необходимо вычислить теоретическую массу или объём (вот за эти параметры как раз и отвечает схема реакции).
Используя привычный алгоритм, определим n нитрата серебра.
Следующим шагом будет определить количество вещества, выпавшего в осадок (AgCl).
Вычислим массу осадка, это будет теоретическая, т.е. та, которая должна получиться, если бы не было потерь.
В идеальной ситуации, мы бы получили 50,225 г, что составило бы 100%. Однако во время процесса образовалось только 45 г продукта. Получается, выход реакции будет меньше и составит:
Ответ. η = 89,6%
Особый тип задач на определение молярной массы вещества. Состав соединений мы можем узнать с химической формулы. При решении этого типа необходимо вспомнить следующие понятия– это доля (массовая) элемента и относительная плотность газов.
Однако следует заметить, что величину D мы можем использовать только для газообразных соединений.
Задача 6. Определите объём кислорода (условия нормальные), что потребуется для сжигания вещества массой 180 г, которое состоит на 26,67 % из углерода, 2,24 % водорода, а также кислорода. Известно, что равняется 45.
Дано:
DH2 = 45
W(C) = 26.67%
W(H) = 2.24%
m(CxHyOz) = 180 г
Найти:
Формула — ?
V(O2) — ?
Решение.
Чтобы решить эту, на первый взгляд, запутанную задачу, нам необходимо сначала определить, что это за соединение, чтобы была возможность составить уравнения химических реакций.
Однако в условии известно только процентный состав вещества. Но всё-таки, этих данных нам достаточно, чтобы найти формулу вещества.
Запишем выражение для нахождения количества атомов углерода (х), водорода (у) и кислорода (z). Представьте, вы купили в коробке шоколадные конфеты из трёх видов.
Следует отметить, что они имеют разную форму, начинку, как следствие и вес. Вернёмся к нашему веществу, которое состоит из 3 элементов, имеющих разнуюAr. Так вот на долю углерода выпадает 26,67% (условно допустим, что это конфета в виде сердечка), водород занимает 2,24% (конфета с воздушной начинкой), а все остальные конфеты в коробке с ореховой начинкой (в соединении их роль играют атомы кислорода). Вопрос: сколько штук занимает каждый вид конфетки? Логично узнать вес одной конфеты (в нашем случае это Ar элементов). Разделив процентное содержание на атомную массу элемента, получим их количество.
Такого же ведь количества конфет не будет в коробке, вы, наверное, слабо себе можете представить, что там будут находиться части конфет. Чтобы получить целые числа, необходимо, выбрать из этих чисел самое маленькое и каждое на него разделить.
Вычисления показывают, что соотношение элементов в данном соединении можно записать в следующем виде: СНО2. Уточним правильность наших расчётов, определив его молекулярную массу, используя величину D.
Обратите внимание, первоначальная запись формулы вещества СНО2 отвечает молярной массе
Однако, это вещество в 45 раз тяжелее водорода, что отвечает 90 г/моль.Чтобы получить её, мы сохранили соотношение элементов 1:1:2, при этом умножили количество каждого элемента на 2. Следовательно, молекулярная формула С2Н2О4.
Количество вещества, отвечающее 45 г вещества С2Н2О4, вычислим привычным методом.
Используя мольное соотношение, определим число молей кислорода, а также его объём.
Ответ. Для сгорания 45 г С2Н2О4 необходимо 5,6 л кислорода.
Обобщая всё выше сказанное, как решать расчётные задачи по химии, с улыбкой или с шоком, принимать решение только Вам. Рассмотрим ещё одну задачу.
Задача 7. Пропан (С3Н8), объёмом 84 л, который содержит 25% негорючих примесей, сожгли в 56 л кислорода. Газ, который выделился, пропустили через гидроксид бария, определите массу осадка, если выход продукта реакции составил 89%.
Дано:
V(С3H8) = 84 л
W(примеси) = 25%
V(O2) = 56 л
η = 89%
Найти:
m(осадка) — ?
Решение.
На что здесь следует обратить внимание. Пропан содержит не горючие примеси. Представьте, вам необходимо в торт 84 г очищенных орехов. Вы идёте в магазин, приобретаете необходимую массу, но придя домой обнаружили, что там 25% содержится мелких остатков скорлупы. Т.е. масса орехов не будет 84 г. Чистых орехов будет 100% — 25% = 75%.
Негорючие примеси входят в общий объём, а гореть будет только пропан. Находим, сколько же его содержится в 84 л.
Составим схему горения газа
Определим количество вещества реагирующих газов
На первый взгляд кажется, что пропан в избытке n(C3H8) > n(O2). Однако посмотрите на уравнение реакции, чтобы сгорело 2,8125 моль пропана необходимо в 5 раз больше кислорода, что составит 14 моль. По этой причине расчёт будем вести по кислороду.
Это количество СО2 пропускают через Ва(ОН)2, что можно отобразить схемой.
Найдём массу ВаСО3, которая будет в виде осадка
Теперь необходимо усчитать выход соли, который составил всего лишь 89%.
Ответ. m(BaCO3) = 263 г.
ОТВЕТЫ
19,95г
Mg + 2HCl = MgCl2 + H2
v(Mg) = m(Mg) / M(Mg) = 5г / 24 г/моль =0,21 моль
v(Mg) = v(MgCl2) = 0,21 моль (по уравнению коэффициенты 1:1)
m(MgCl2) = v(MgCl2) * M(MgCl2) = 0,21 моль * 95 г/моль = 19,95г
0
Отв. дан
2021-11-14 00:00:00
Vinris
Кислые и средние соли
09-Дек-2014 | комментария 4 | Лолита Окольнова
Задания на соли встречаются в ЕГЭ не только в части А, но и в части С.
Давайте разберем основные примеры задач на
кислые и средние соли
1. Определите, какое вещество, и в каком количестве образуется, если прореагировали (н.у.):
а) 0,2 моль Н2S и 0,2 моль КОН;
б) 2,24 л SO2 и 4 г NaOH;
в) 4,48 л СО2 и 7,4 г Са(ОН)2;
г) 4,48 л аммиака и 19,6 г серной кислоты;
д) 0,3 моль гидроксида натрия и 0,3 моль фосфорной кислоты;
е) 4,48 л аммиака и 100 г 9,8 %-ного раствора фосфорной кислоты;
ж) 14,2 г Р2О5 и 0,4 моль КОН;
з) 5,6 г оксида кальция и 0,2 моль серной кислоты.
Итак, как образуются кислые и средние соли?
Обычно это взаимодействие основного оксида или основания с кислотой или кислотным оксидом.
Какая соль образуется — зависит от соотношения реагентов
LiOH + H2SO3 = LiHSO3 + H2O (образовалась кислая соль)
(1 моль щелочи : 1 моль кислоты)
2LiOH + H2SO4 = Li2SO4 + 2H2O (образовалась средняя соль)
(2 моль щелочи : 1 моль кислоты)
Вывод:
- если в избытке основание, то образуется средняя соль;
- при эквимолярном соотношении — кислая соль
Обратите внимание — сравнивать нужно именно количества веществ — моли!
В нашем задании:
а) соотношение сероводорода и гидроксида калия 1:1, значит, получится кислая соль KHS;
б) 0,1 моль SO2 и 0,1 моль NaOH (формулы: n=mMr и т=VV м). Соль — NaHSO3
в) 0,2 моль CO2 и 0,1 моль Ca(OH)2:
CO2 + Ca(OH)2 = CaCO3 + H2O
Т.к. реагируют двухвалентный кальций и кислотный остаток имеет заряд -2, то образуется карбонат кальция — средняя соль
г) 0,2 моль NH3 и 0.2 моль H2SO4. Соотношение 1:1, значит, получится соль — NH4HSO4 — гидросульфат аммония;
д) NaOH и H3PO4. Соотношение 1:1. Получится NaH2PO4 — дигидрофосфат натрия — кислая соль;
e) 0.2 моль NH3 и 0.1 моль (см. формулу массовой доли ω). Аммиак в избытке, значит, получится средняя соль — (NH4)2SO4
ж) 0.1 моль P2O5 и 0,4 моль КОН
3KOH + H3PO4 = K3PO4 + 3H2O
Гидроксид калия дан в значительном избытке, значит, получится фософат калия — средняя соль
з) 0.1 моль CaO и 0.2 моль H2SO4
CaO + 2H2SO4 = Ca(НSO4)2 + H2O
2. Определить количества растворенных веществ в растворе, полученном пропусканием через 200 г 4 %-ного раствора гидроксида натрия при н.у.:
а) 1,12 л углекислого газа;
б) 2,24 л сернистого газа;
в) 3,36 л сероводорода;
г) 4,48 л углекислого газа;
д) 20 г SO3.
n(NaOH)=m(раствора)*ω Mr = 200 г*0.04 40 гмоль = 0.2 моль
Выпишем все уравнения:
CO2 + 2NaOH = Na2CO3 + H2O
0,05 0.2 —> 0,05 моль
SO2 + 2NaOH = Na2SO3 + H2O
0.1 0.2 —> 0.1 моль
H2S + NaOH = NHS + H2O
0,15 0.2 моль —> 0,15 моль
CO2 + NaOH = NaHCO3
0.2 0.2 —> 0.2 моль
SO3 + NaOH = NaHSO4
0.25 0.2 —> 0.2 моль
Количества вещества продукта реакции находим традиционно по недостатку.
Обсуждение: «Кислые и средние соли»
(Правила комментирования)
Какой объём водорода (н.у.) и количество вещества соли образуется при взаимодействии соляной кислоты с алюминием массой 540 мг, содержащим примеси с массовой долей 4%?
reshalka.com
ГДЗ учебник по химии 8 класс Габриелян. §29. Вопросы и задания. Номер №1
Решение
Дано:
m (Al с примесями) = 540 мг;
ω (примеси) = 4 %;
Найти:
V
(
H
2
)
− ?
n
(
A
l
C
l
3
)
− ?
Решение:
2
A
l
+
6
H
C
l
=
2
A
l
C
l
3
+
3
H
2
;
ω
ч
и
с
т
(
A
l
)
=
100
−
4
=
96
% или 0,96;
m (Al с примесями) = 540 * 0,001 = 0,54 г;
m
ч
и
с
т
(
A
l
)
=
m
(
A
l
с
п
р
и
м
е
с
я
м
и
)
∗
ω
ч
и
с
т
(
A
l
)
=
0
,
54
∗
0
,
96
=
0
,
5184
г;
n
=
m
M
;
M (Al) = 27 г/моль;
n
(
A
l
)
=
$
m
ч
и
с
т
(
A
l
)
M
(
A
l
)
=
0
,
5184
27
=
0
,
0192
моль.
Запишем уравнение реакции и составим пропорции:
2
A
l
0
,
0192
м
о
л
ь
2
м
о
л
ь
+
6
H
C
l
=
2
A
l
C
l
3
х
2
м
о
л
ь
+
3
H
2
y
3
м
о
л
ь
;
x
=
n
(
A
l
C
l
3
)
=
0
,
0192
∗
2
2
=
0
,
0192
моль;
y
=
n
(
H
2
)
=
0
,
0192
∗
3
2
=
0
,
0288
моль;
V
=
V
m
∗
n
;
V
m
= 22,4 л/моль;
V
(
H
2
)
=
V
m
∗
n
(
H
2
)
=
22
,
4
∗
0
,
0288
=
0
,
6451
л.
Ответ. 0,0192 моль; 0,6451 л.