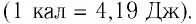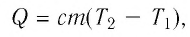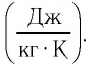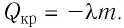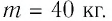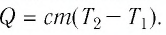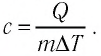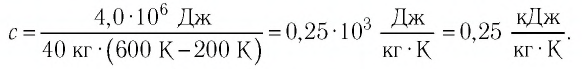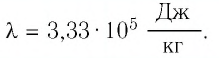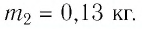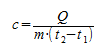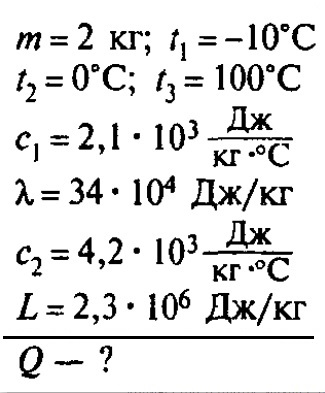Содержание:
Количество теплоты:
В чём причина изменения внутренней энергии макроскопического тела при теплообмене?
Теплообмен
Другим способом изменения внутренней энергии термодинамической системы является теплообмен.
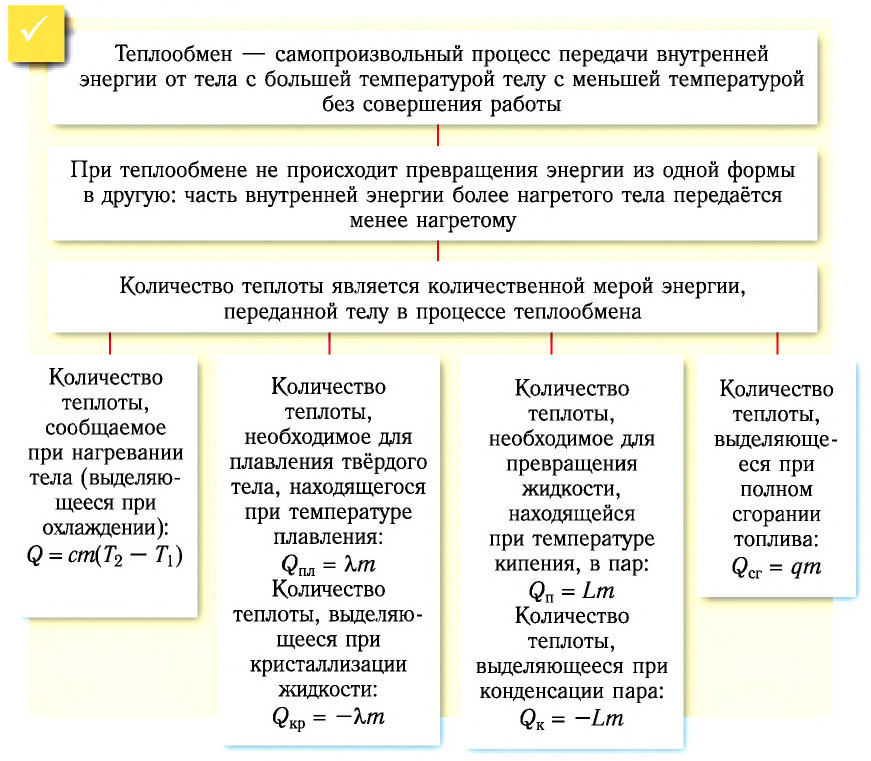
Теплообмен — самопроизвольный процесс передачи внутренней энергии от тела с большей температурой телу с меньшей температурой без совершения работы.
Теплообмен между контактирующими телами называют теплопередачей. За счёт переданной при этом энергии увеличивается внутренняя энергия одного тела и уменьшается внутренняя энергия другого. Если, например, привести в соприкосновение два тела с разными температурами, то частицы более нагретого тела будут передавать часть своей кинетической энергии частицам менее нагретого тела. В результате внутренняя энергия одного тела уменьшается, а другого увеличивается.
Таким образом, при теплопередаче не происходит превращения энергии из одной формы в другую: часть внутренней энергии более нагретого тела передаётся менее нагретому.
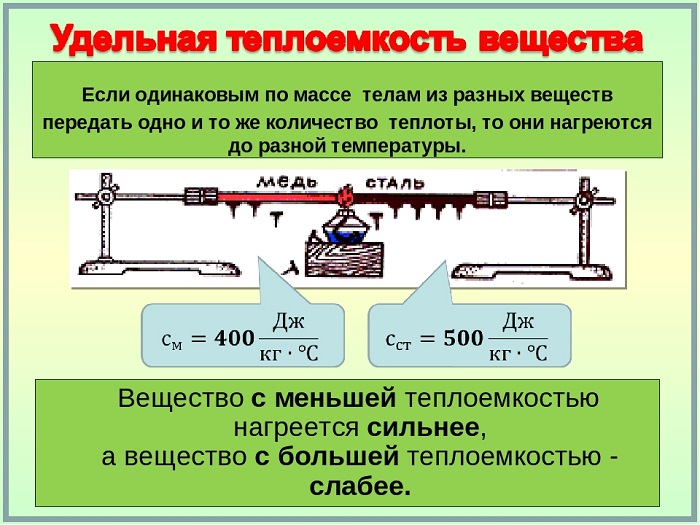
Количество теплоты и удельная теплоёмкость
Количественной мерой энергии, сообщённой телу (или отданной им) в процессе теплообмена, является количество теплоты.
В СИ единицей количества теплоты Q является джоуль (Дж). Иногда для измерения количества теплоты используют внесистемную единицу — калорию
Если процесс теплообмена не сопровождается изменением агрегатного состояния вещества, то
где 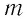
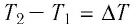
Удельная теплоёмкость зависит от свойств данного вещества и, как показывает опыт, в достаточно большом интервале температур практически не изменяется. Однако удельная теплоёмкость газа зависит от того, при каком процессе (изобарном или изохорном) осуществляется теплообмен.
Интересно знать:
Физическая величина, равная произведению массы тела на удельную теплоёмкость вещества, носит название теплоёмкость тела. Обозначают теплоёмкость С и измеряют в джоулях, деленных на кельвин 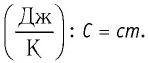
Удельная теплота плавления
Физическую величину, численно равную количеству теплоты, необходимому для превращения кристаллического вещества массой 1 кг, взятого при температуре плавления, в жидкость той же температуры, называют удельной теплотой плавления 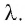
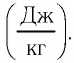
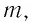
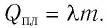
Удельная теплота парообразования
Физическую величину, численно равную количеству теплоты, которое необходимо передать жидкости массой 1 кг, находящейся при температуре кипения, для превращения её при постоянной температуре в пар, называют удельной теплотой парообразования L. Единицей измерения этой величины является джоуль, делённый на килограмм 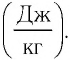
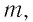
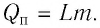
Удельная теплота сгорания топлива
Физическую величину, численно равную количеству теплоты, выделяющемуся при полном сгорании топлива массой 1 кг, называют удельной теплотой сгорания 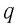
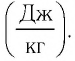
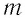
Это количество теплоты передаётся телам, образующим термодинамическую систему, и по отношению к ним является положительной величиной.
- Заказать решение задач по физике
Примеры решения задач
Пример №1
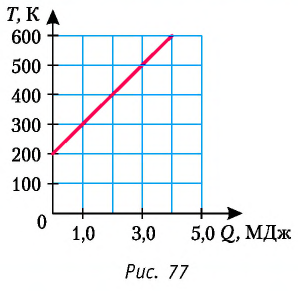
На рисунке 77 представлен график зависимости абсолютной температуры нагреваемого тела от переданного ему количества теплоты. Воспользовавшись таблицей на с. 84, определите вещество, из которого изготовлено тело, если его масса
Решение:
Для того чтобы определить вещество, из которого изготовлено тело, найдём его удельную теплоёмкость с. Анализируя график, делаем вывод, что при нагревании тела от температуры 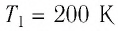
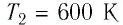
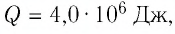
Следовательно, удельная теплоёмкость вещества
Полученное значение удельной теплоёмкости соответствует олову.
Ответ: 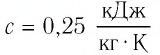
Пример №2
В налитую в сосуд воду, масса которой 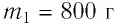
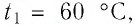
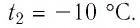
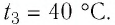
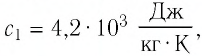
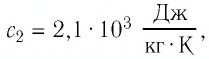
Решение:
Ответ:
- Расчет количества теплоты при нагревании и охлаждении
- Удельная теплота сгорания топлива
- Плавление и кристаллизация в физике
- Испарение жидкостей в физике
- Конвекция в физике
- Излучение тепла в физике
- Виды излучений в физике
- Инфракрасные излучения
Количество теплоты — еще один изученный нами вид энергии. Эту энергию тело получает или отдает при теплопередаче. Мы установили, что количество теплоты, необходимое для нагревания тела, зависит от массы тела, разности температур и рода вещества. Нам известен физический смысл удельной теплоемкости и некоторые ее табличные значения для разных веществ. В этом уроке мы перейдем к численному расчету количества теплоты, необходимой для нагревания тела или выделяемого им при охлаждении.
Зачем это нужно? На самом деле, на практике очень часто используют подобные расчеты.
При строительстве зданий и проектировании систем отопления важно знать, какое количество теплоты необходимо отдавать для полного обогрева всех помещений. С другой стороны, также необходима информация о том, какое количество теплоты будет уходить через окна, стены и двери.
Формула для расчета количества теплоты
Допустим, на нужно узнать, какое количество теплоты получила при нагревании железная деталь. Масса детали $3 space кг$. Деталь нагрелась от $20 degree C$ до $300 degree C$.
Возьмем значение теплоемкости железа из таблицы — $460 frac{Дж}{кг cdot degree C}$. Объясним смысл этой величины: на нагревание куска железа массой $1 space кг$ на $1 degree C$ необходимо затратить количество теплоты, равное $460 space Дж$.
- Масса детали у нас в 3 раза больше, значит, на ее нагрев потребуется в 3 раза большее количество теплоты — $1380 space Дж$
- Температура изменилась не на $1 degree C$, а на $280 degree C$
- Значит, необходимо в 280 раз большее количество теплоты: $1380 space Дж cdot 280 = 386 400 space Дж$
Тогда, формула для расчета количества теплоты, необходимой для нагревания тела или выделяемого им при охлаждении примет вид:
$Q = cm(t_2 — t_1)$,
где $Q$ — количество теплоты,
$c$ — удельная теплоемкость вещества, из которого состоит тело,
$m$ — масса тела,
$t_1$ — начальная температура тела,
$t_2$ — конечная температура тела.
Чтобы рассчитать количество теплоты, которое необходимо затратить для нагревания тела или выделяемое им при охлаждении, нужно удельную теплоемкость умножить на массу тела и на разность конечной и начальной температур.
Рассмотрим подробнее особенности расчета количества теплоты на примерах решения задач.
Расчет количества теплоты, затраченного на нагревание двух тел
В железный котелок массой $4 space кг$ налили воду массой $10 space кг$ (рисунок 1). Их температура $25 degree C$. Какое количество теплоты нужно затратить, чтобы нагреть котелок и воду до температуры $100 degree C$?
Обратите внимание, что нагреваться будут сразу два тела: и котелок, и вода в нем. Между постоянно будет происходить теплообмен. Поэтому их температуры мы можем считать одинаковыми.
Отметим, что массы котелка и воды различные. Также они имеют различные теплоемкости. Значит, полученные ими количества теплоты будет различными.
Теперь мы можем записать условие задачи и решить ее.
Дано:
$m_1 = 4 space кг$
$c_1 = 460 frac{Дж}{кг cdot degree C}$
$m_2 = 10 space кг$
$c_2 = 4200 frac{Дж}{кг cdot degree C}$
$t_1 = 25 degree C$
$t_2 = 100 degree C$
Q-?
Посмотреть решение и ответ
Скрыть
Решение:
Для расчета полученного количества теплоты используем формулу $Q = cm(t_2 — t_1)$.
Запишем эту формулу для количества теплоты, полученного котелком:
$Q_1 = c_1m_1(t_2 — t_1)$.
Рассчитаем это количество теплоты:
$Q_1 = 460 frac{Дж}{кг cdot degree C} cdot 4 space кг cdot (100 degree C — 25 degree C) = 1840 frac{Дж}{degree C} cdot 75 degree C = 138 000 space Дж = 138 space кДж$.
Количество теплоты, полученное водой при нагревании будет равно:
$Q_2 = c_2m_2(t_2 — t_1)$.
Подставим численные значения и рассчитаем:
$Q_2 = 4200 frac{Дж}{кг cdot degree C} cdot 10 space кг cdot (100 degree C — 25 degree C) = 42000 frac{Дж}{degree C} cdot 75 degree C = 3 150 000 space Дж = 3150 space кДж$.
Общее количество теплоты, затраченное на нагревание котелка и воды:
$Q = Q_1 +Q_2$,
$Q = 138 space кДж + 3150 space кДж = 3288 space кДж$.
Ответ: $Q = 3288 space кДж$.
Расчет количества теплоты при смешивании жидкостей
Горячую воду разбавили холодной и получили температуру смеси $30 degree C$. Горячей воды с температурой $100 degree C$ при этом было $0.3 space кг$. Холодная вода имела массу $1.4 space кг$ и температуру $15 degree C$. Рассчитайте, какое количество теплоты было отдано горячей водой при остывании и получила холодная вода при нагревании. Сравните эти количества теплоты.
Дано:
$c_1 = c_2 = c = 4200 frac{Дж}{кг cdot degree C}$
$m_1 = 0.3 space кг$
$m_2 = 1.4 space кг$
$t_1 = 100 degree C$
$t_2 = 15 degree C$
$t = 30 degree C$
$Q_1 — ?$
$Q_2 — ?$
Посмотреть решение и ответ
Скрыть
Решение:
Запишем формулу для расчета количества теплоты, отданного горячей водой при остывании от $100 degree C$ до $30 degree C$:
$Q_1 = cm_1(t_1 — t)$.
Рассчитаем эту величину:
$Q_1 = 4200 frac{Дж}{кг cdot degree C} cdot 0.3 space кг cdot (100 degree C — 30 degree C) = 1260 frac{Дж}{degree C} cdot 70 degree C = 88 200 space Дж = 88.2 space кДж$.
Запишем формулу для расчета количества теплоты, полученного холодной водой при нагревании от $15 degree C$ до $30 degree C$:
$Q_2 = cm_2(t — t_2)$.
Рассчитаем эту величину:
$Q_1 = 4200 frac{Дж}{кг cdot degree C} cdot 1.4 space кг cdot (30 degree C — 15 degree C) = 5880 frac{Дж}{degree C} cdot 15 degree C = 88 200 space Дж = 88.2 space кДж$.
$Q_1 = Q_2 = 88.2 space кДж$.
Ответ: $Q_1 = Q_2 = 88.2 space кДж$.
В ходе решения этой задачи мы увидели, что количество теплоты, отданное горячей водой, и количество теплоты, полученное холодной водой, равны. Другие опыты дают схожие результаты.
Значит,
Если между телами происходит теплоообмен, то внутренняя энергия всех нагревающихся тел увеличивается на столько, на сколько уменьшается внутренняя энергия остывающих тел.
На практике часто получается так, что отданная горячей водой энергия больше, чем полученная холодной. На самом деле, горячая вода при охлаждении передает какую-то часть своей внутренней энергии воздуху и сосуду, в котором происходит смешивание.
Есть 2 способа учесть этот фактор:
- Если мы максимально сократим потери энергии, то добьемся приблизительного равенства отданной и полученной энергий
- Если рассчитать и учесть потери энергии, то можно получить точное равенство
Расчет температуры при известной величине количества теплоты
При нагревании куска меди было затрачено $22 space кДж$. Масса этого куска составляет $300 space г$. Начальная температура была равна $20 degree C$. До какой температуры нагрели кусок меди?
Дано:
$m = 300 space г$
$t_1 = 20 degree C$
$c = 400 frac{Дж}{кг cdot degree C}$
$Q = 22 space кДж$
СИ:
$0.3 space кг$
$22 000 space Дж$
$t_2 — ?$
Посмотреть решение и ответ
Скрыть
Решение:
Запишем формулу для расчета количества теплоты:
$Q = cm(t_2 — t_1)$.
Постепенно выразим из этой формулы искомую температуру $t_2$:
$t_2 — t_1 = frac{Q}{cm}$,
$t_2 = frac{Q}{cm} + t_1$.
Рассчитаем $t_2$:
$t_2 = frac{22 000 space Дж}{400 frac{Дж}{кг cdot degree C} cdot 0.3 space кг} + 20 degree C approx 183 degree C + 20 degree C approx 203 degree C$.
Ответ: $t_2 approx 203 degree C$.
Физика под удельной теплоемкостью понимает количество теплоты, которое термодинамическое вещество или система способно поглотить до повышения температуры.
Определение из учебника говорит, что это количество тепла, необходимое для создания температуры при нагревании.
Количество теплоты
Единица измерения — джоуль. Другой распространенной формой измерения является использование калорий.
Обозначается латинской буквой Q.
Удельная теплоемкость вещества
Это физическая величина, выражающая количество тепла, необходимое веществу на единицу массы для повышения температуры на одну единицу.
Таким образом, удельная теплоёмкость является свойством вещества, поскольку его значение является репрезентативным для каждого вещества, каждое из которых, в свою очередь, имеет различные значения в зависимости от того, в каком состоянии оно находится (жидкое, твердое или газообразное).
Удельная теплоёмкость обозначается маленькой буквой c и измеряется в Дж/кг∗°С, представляет собой коэффициент повышения температуры в одной единице всей системы или всей массы вещества.
Кроме того, удельная теплоёмкость меняется в зависимости от физического состояния вещества, особенно в случае твердых частиц и газов, поскольку его молекулярная структура влияет на теплопередачу в системе частиц. То же самое относится и к условиям атмосферного давления: чем выше давление, тем ниже удельное тепло.
Основной состав удельной теплоты вещества должен быть с = С/m, т. е. удельная теплота равна соотношению калорийности и массы. Однако когда это применяется к данному изменению температуры, говорят о средней удельной теплоемкости, которая рассчитывается на основе следующей формулы:
где:
Q — передача тепловой энергии между системой и средой (Дж);
m — масса системы (кг);
Δt или (t2 — t1) — повышение температуры, которой она подвергается (°C).
Формула для нахождения количества теплоты Q:
Q = c∗m(t2 — t1)
Чем выше удельная теплоёмкость вещества, тем больше тепловой энергии потребуется, чтобы его температура повысилась. Например, для нагрева воды (своды = 4200 Дж/кг∗°С) потребуется больше тепловой энергии, чем для нагрева свинца (ссвинца = 140 Дж/кг∗°С).
Уравнение теплового баланса:
Q отданное + Q полученное = 0.
Ниже представлена таблица значений удельной теплоёмкости некоторых веществ:
Примеры решения задач
Следующие задачи покажут примеры расчета необходимого количества теплоты.
Задача №1
Сколько теплоты нужно, чтобы изо льда массой 2 кг, взятого при температуре -10°С, получить пар при 100°С?
Решение:
Ответ: чтобы изо льда массой 2 кг, взятого при температуре -10°С, получить пар при 100°С, нужно взять 6,162 мегаджоулей теплоты.
Задача №2
В железный котёл массой 5 кг налита вода массой 10 кг. Какое количество теплоты нужно передать котлу с водой для изменения их температуры от 10 до 100°С?
Начнем решение и отметим, что нагреваться будет и котёл, и вода. Разница температур составит 1000С — 100С = 900С. Т. е. и температура котла изменится на 90 градусов, и температура воды также изменится на 90 градусов.
Количества теплоты, которые получили оба объекта (Q1
– для котла и Q2 — для воды), не будут одинаковыми. Мы найдем общее количество теплоты по формуле теплового баланса Q = Q1 + Q2.
На практике часто приходится проводить различные тепловые расчёты. Для увеличения эргономичности тепловой системы жилых домов измеряют количество тепловой энергии, рассеиваемой через вентиляцию, окна, расщелины.
Для расчёта количества тепловой энергии нужно измерить массу (m), разность температуры в начале и в конце процесса
Δt=tкон−tнач
, а также знать теплоёмкость (c) данного вещества.
Чтобы нагреть некоторое вещество массой (1) кг на (1°C), необходимо затратить количество теплоты, равное удельной теплоёмкости (c) данного вещества.
Количество теплоты, получаемое веществом при нагревании, прямо пропорционально удельной теплоёмкости вещества, его массе и разности температур, то есть:
Q=cmΔt
или
Данная формула даёт возможность найти и выделяемую при охлаждении вещества теплоту.
Чтобы рассчитать количество теплоты, необходимое для нагревания вещества (или выделяемое им при охлаждении), следует удельную теплоёмкость вещества умножить на его массу и на разность между конечной и начальной температурой вещества.
Так как конечная температура остывающего вещества меньше его начальной температуры:
то изменение температуры оказывается отрицательным числом:
Значит, и выделяемое веществом количество теплоты выражается отрицательным числом:
Последний факт обозначает не рост, а убыль внутренней энергии вещества.
- Подробности
- Обновлено 08.02.2019 16:27
- Просмотров: 465
Назад в «Оглавление» — смотреть
1. Что нужно знать, чтобы вычислить количество теплоты, полученное телом при нагревании или выделенное им при остывании?
Чтобы вычислить количество теплоты, полученное телом при нагревании или выделенное им при остывании, надо знать удельную теплоемкость вещества, массу тела, конечную и начальную температуру.
2.
Как рассчитывают количество теплоты, сообщённое телу при его нагревании или выделяющееся при его охлаждении?
Чтобы подсчитать количество теплоты, необходимое для нагревания тела или выделяемое им при охлаждении, нужно удельную теплоемкость вещества умножить на массу тела и на разность между большей и меньшей его температурами:
Q = cm(t2-t1)
где с — удельная теплоемкость вещества (Дж/кг °С)
m — масса тела (кг)
(t2-t1) — разность конечной и начальной температур (°С)
Например:
Задача1
В железный котел массой 10 кг налита вода массой 20 кг.
Какое количество теплоты нужно передать котлу с водой для изменения их температуры от 10 до 100 °С?
Оба тела — и котел, и вода — будут нагреваться вместе.
Между ними происходит теплообмен, и их температуры можно считать одинаковыми, т. е. температура котла и воды изменяется на 100°С — 10°С=90°С.
Но количества теплоты, полученные котлом и водой, не будут одинаковыми, ведь их массы и удельные теплоемкости различны.
Задача 2
Смешали воду массой 0,8 кг, имеющую температуру 25°С, и кипяток массой 0,2 кг.
Температуру полученной смеси измерили, и она оказалась равной 40 °С.
Вычислить, какое количество теплоты отдал кипяток при остывании и получила холодная вода при нагревании.
Сравнить эти количества теплоты.
4. Какой вывод можно сделать из опыта по смешиванию холодной и горячей воды? Почему на практике эти энергии не равны?
Количество теплоты, отданное горячей водой, и количество теплоты, полученное холодной водой, равны между собой.
То есть, если между телами происходит теплообмен, то внутренняя энергия всех нагревающихся тел увеличивается настолько, насколько уменьшается внутренняя энергия остывающих тел.
Однако на практике обычно получается, что отданная горячей водой энергия больше энергии, полученной холодной водой.
Это объясняется тем, что часть энергии передается окружающему воздуху, а часть энергии — сосуду, в котором смешивали воду.
Равенство отданной и полученной энергий будет тем точнее, чем меньше потери энергии.
Назад в «Оглавление» — смотреть