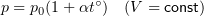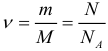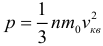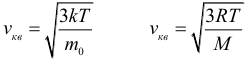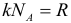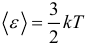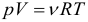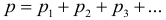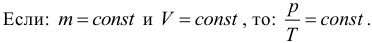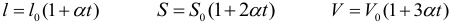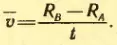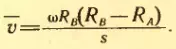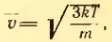Для характеристики движения молекул в физике используют две скорости: среднюю и среднюю квадратичную скорость молекул.
Важно. Следует обязательно понимать, что в реальных условиях мы не можем точно знать ни конкретное число молекул в системе, ни тем более скорость каждой из них в конкретный момент времени. Это обусловлено неимоверно гигантским числом частиц в реальных и даже сколько-нибудь приближенных к ним системах. Например, в 1 см3 при давлении 200 мм. рт. ст. содержится 4,18*1018 молекул водорода. Говоря более понятными категориями, это более чем 4 миллиарда миллиардов. Заметим, что указанное давление меньше атмосферного почти в 4 раза. Последнее в среднем равняется 760 мм. рт. ст. Разрежённый водород по своим свойствам наиболее близок к идеальному газу. В данном случае физика вынуждена иметь дело с распределениями скоростей и энергий частиц.
Что такое средняя скорость движения молекул
Среднюю скорость движения молекул часто именуют скоростью их теплового движения.
Определение 1
Вид формулы средней относительной скорости молекул в физике можно представить выражением:
[text { Vотн }=sqrt{2} sqrt{frac{8 R T}{pi m_{0}}}]
Выражение под корнем – средняя скорость молекул идеального газа.
Как определить среднюю квадратичную скорость движения молекул
Определение 2
Средней квадратичной скоростью молекул идеального газа называют величину равную квадратному корню из среднего арифметического величины квадратов скоростей каждой из молекул.
Средняя скорость молекул равна:
[leftlanglemathrm{V}_{mathrm{KB}}rightrangle=sqrt{frac{1}{N} sum_{i=1}^{N} v_{i}^{2}}]
Если обе её части возвести в квадрат и проинтегрировать, то получим выражение:
[langlemathrm{VKB}rangle^{2}=int_{0}^{infty} v^{2} F(v) d v]
Ещё одно выражение для среднеквадратичной скорости:
[leftlangle V_{K B}rightrangle=sqrt{frac{3 k T}{m_{0}}}=sqrt{frac{3 R T}{mu}}]
Именно она присутствует в уравнении, именуемом основным уравнением молекулярно-кинетической теории
P = (1/3)nm*<Vкв>
Где n – концентрация молекул, которая вычисляется делением их общего числа на объём.
Пример. 1.
Рассмотрим простейший случай, чтобы использование интегрирования не затруднило понимание сути явления и помогло лучше понять материал. Вычислим как меняется средняя скорость движения молекул в идеальном газе при линейном увеличении его давления. График следующий:
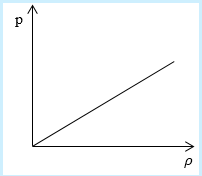
Напомним, что средняя скорость частиц:
[mathrm{Vcp}=sqrt{frac{8 R T}{pi m_{0}}}]
Если присмотреться к представленному графику, то можно заметить, что P приблизительно равно ρ. Эти две величины можно связать соотношением
P=C*ρ
Где С – некоторая постоянная величина, константа.
Далее считаем m0= ρ/n, p = n*k*T = C* ρ. Отсюда следует, что k*T = (C*ρ)/n.
Нужно лишь подставить эти значения в формулу для средней скорости:
[V c p=sqrt{8 mathrm{kT} / pi mathrm{m}}=sqrt{(8 mathrm{C} rho / pi mathrm{n})(mathrm{n} / rho)}=sqrt{8 mathrm{C} / pi}]
В полученном выражении нет ни одной переменной величины, т. е. при увеличении давления, вопреки ожиданиям, скорость оказалась неизменной.
Ответ: В процессе, который был дан нам на графике, при увеличении давления средняя скорость молекул никак не меняется.
Нет времени решать самому?
Наши эксперты помогут!
Пример. 2.
Определим среднюю квадратичную скорость молекул газа при условии, что нам известны его давление (P), молярная масса (M) и концентрация частиц (n).
Воспользуемся формулой:
[leftlanglemathrm{V}_{kappa в}rightrangle=sqrt{frac{3 k T}{m_{0}}}=sqrt{frac{3 R T}{mu}}]
Также нам потребуется уравнение Менделеева-Клайперона
Здесь мы воспользовались тем, что:
m/μ = N/Na
PV = (m/μ)*RT = (N/Na)*RT
Если обе части этого уравнения поделить на V и принять во внимание, что
(N/V) = n, то можно получить
P = (n/Na)*RT. Отсюда находим, что RT = (p*N)/n
Если мы это подставим в выражение для среднеквадратичной скорости [leftlangle V_{K B}rightrangle=sqrt{3 mathrm{kT} / mathrm{m}_{0}}=sqrt{3 mathrm{RT} / mu}], получим, что средняя квадратичная скорость движения молекул газа: [leftlangle V_{K B}rightrangle=sqrt{left(3 rho N_{a}right) /(mu mathrm{n})}]
Ответ: Формула средней квадратичной скорости молекул исходя из данный нам условий следующая:
[leftlangle V_{K B}rightrangle=sqrt{left(3 rho N_{a}right) /(mu mathrm{n})}]
Molecular speed is defined as the speed of the group of molecules in an ideal gas. Molecular speed is an important concept in the kinetic theory of gases. According to the kinetic theory of gases, the molecules of a gas are in constant motion and move in a straight line until they collide with another molecule. All the molecules of an ideal gas undergo elastic collision. It explains why small molecules diffuse more rapidly than large molecules. The molecular speed of a gas is directly proportional to its speed and inversely proportional to its molar mass. The molecular speed of a gas increases with an increase in the temperature of the gas. For example, Helium has the lowest molecular mass and thus has the highest molecular speed.
Types of Molecular Speed
The concept of molecular speed states that a cluster of atoms moves at a typical rate. The particles in an ideal gas don’t come into contact with one another. Let us see different types of molecular speed and how to calculate them. Molecular speed can be of 3 types which are as follows:
Average Molecular Speed
It is the average speed of a group of molecules in a gas. It is denoted using . It can be calculated using the formula:
where,
- T is the temperature of the gas in Kelvin
- M is the molar mass
- R is the Ideal gas constant, 8.314 kg*m2/s2*mol*K
Root Mean Square Speed
It is the measure of the speed of the particles in particular gas. It is denoted by vrms and can be calculated using the formula:
where,
- T is the temperature of the gas in Kelvin
- M is the molar mass
- R is the Ideal gas constant, 8.314 kg*m2/s2*mol*K
Most Probable Speed
It is the speed which is acquired by most of the molecules in a gas. It is denoted by vp and can be calculated using the following formula:
where,
- T is the temperature of the gas in Kelvin
- M is the molar mass
- R is the Ideal gas constant, 8.314 kg*m2/s2*mol*K
Relation between Molecular Speeds
The volume of a gas molecule is little in relation to the whole volume of the container when it comes to the molecular speeds of a particle. The gas particles travel freely and with complete mobility. The force of attraction between the gaseous molecules is therefore absent.
- The relationship between average molecular speed, root mean square speed, and most probable speed is:
- The ratio between average molecular speed, root mean square speed, and most probable speed is:
Maxwell Distribution of Molecular Speeds
Maxwell and Boltzmann derived an equation to find the distribution of various types of molecular speeds in a gas. The number of molecules per unit speed is indicated on the y-axis of the Maxwell-Boltzmann distribution graph. The quantity of molecules in the gas is represented by the total area under the whole curve. The peak of the graph will move to the right if we heat the gas to a greater temperature (since the average molecular speed will increase). The graph grows higher and more narrow as the gas gets colder, similar to how the graph shortens and widens as the gas heats up.
Maxwell Distribution of Molecular Speeds
Inferences from the Graph
- The most probable speed is represented by the peak of the curve. The average molecular speed is the speed that is just a little higher than the most probable speed. The root mean square speed coincides with the average kinetic energy of the gas molecules.
- The curve will spread and flatten out when we observe the gas at increasing temperatures.
- The shape of the curve is dependent upon the molar mass and temperature of the gas.
- The curve gets taller and flatter when we consider gases of increasing molar mass.
- With the increase in temperature, the most probable speed increases, and the peak of the curve shifts to the right. The particles of gas also tend to move faster.
Solved Examples on Molecular Speed
Example 1: The temperature of gas with a molar mass of 2 g/mol is 900K. Calculate the root mean square speed of the particles of gas.
Solution:
Given, M = 2g/mol, T = 900K
R = 8.314
Example 2: Calculate the most probable speed of Helium gas at 800K.
Solution:
Given, T = 800K
For Helium, M = 4g/mol and R = 8.314
Example 3: Determine the speed of particles of m = 1 gr/mol and temperature 1500 k.
Solution:
Given, M = 1g/mol, T = 1500K and R = 8.314
Example 4: Compare the following quantities, the RMS velocity of oxygen at 80 °C and the RMS velocity of Hydrogen at 45 °C.
Solution:
To compare the quantities, we shall calculate the rms for oxygen and hydrogen for the given conditions.
Oxygen:
Given T = 80
C = 353K, Molar mass of oxygen (M) = 16g/mol
Hydrogen:
Given, T = 45°, C = 318K, Molar mass of Hydrogen (M) = 2g/mol
Thus, rms velocity of hydrogen is more than Oxygen at the given conditions.
Example 5: Find the average molecular speed of gas with a molar mass 19 g at 500K.
Solution:
Given, T = 500K, M = 19g/mol
FAQs on Molecular Speed
Question 1: What is meant by the kinetic theory of gases?
Solution:
Based on the notion that a gas is made up of atoms or molecules that are moving quickly, kinetic theory describes how gases behave.
Question 2: Why do smaller gas atoms travel more quickly?
Solution:
Because of the molecular mobility of molecules, smaller gas particles travel more quickly. At all temperatures higher than absolute zero, they have kinetic energy. The average kinetic energy of gas molecules and temperature are directly inversely correlated. At the same temperature and pressure, lighter gases will also move at speeds that are higher than heavier gases.
Question 3: What is meant by the degree of freedom?
Solution:
The amount of independent ways that the system’s path and configuration might vary is referred to as the degree of freedom.
Question 4: Describe mean energy.
Solution:
The mean energy or internal energy of one mole of gas is called the mean energy. It is represented by the letter U.
Last Updated :
11 Oct, 2022
Like Article
Save Article
Молекулярная физика Основные формулы
1. Основы молекулярно-кинетической теории. Газовые законы
1.1 Количество вещества
m — масса;
μ — молярная масса вещества;
N — число молекул;
NA = 6,02·1023 моль-1 — число Авогадро
1.2 Основное уравнение молекулярно-кинетической теории идеального газа
p — давление идеального газа;
m — масса одной молекулы;
n = N/V — концентрация молекул;
V — объем газа;
N — число молекул;

1.3 Средняя квадратичная скорость молекул идеального газа
k = 1,38·10-23 Дж/К — постоянная Больцмана;
R = kNA = 8,31 Дж/(моль·К) — универсальная газовая постоянная;
T = t+273 — абсолютная температура;
t — температура по шкале Цельсия.
1.4 Средняя кинетическая энергия молекулы одноатомного газа
1.5 Давление идеального газа
n — концентрация молекул;
k — постоянная Больцмана;
T — абсолютная температура.
1.6 Закон Бойля-Мариотта
p — давление;
V — объем газа.
1.7 Закон Шарля
p0 — давление газа при 0 °С;
α = 1/273 °C-1 — температурный коэффициент давления.
1.8 Закон Гей-Люссака
V0 — объем газа при 0 °С.
1.9 Уравнение Менделеева-Клапейрона
1.10 Объединенный закон газового состояния (уравнение Клапейрона)
1.11 Закон Дальтона
pi — парциальное давление i-й компоненты смеси газов.
2. Основы термодинамики
2.1 Внутренняя энергия идеального одноатомного газа
ν — количество вещества;
R = 8,31 Дж/(моль·К) — универсальная газовая постоянная;
T — абсолютная температура.
2.2 Элементарная работа, совершаемая газом,
при изменении объема на бесконечно малую величину dV
p — давление газа.
При изменении объема от V1 до V2
2.3 Первый закон термодинамики
ΔQ — количество подведенной теплоты;
ΔA — работа, совершаемая веществом;
ΔU — изменение внутренней энергии вещества.
2.4 Теплоемкость идеального газа
ΔQ — количество переданной системе теплоты на участке процесса;
ΔT — изменение температуры на этом участке процесса.
Оглавление:
- Основные теоретические сведения
- Основные положения МКТ
- Основное уравнение МКТ идеального газа
- Уравнение состояния идеального газа или уравнение Клапейрона-Менделеева
- Газовые законы
- Графическое изображение изопроцессов
- Неизопроцессы
- Изменение количества или массы вещества
- Перегородки или поршни
- Газовые законы и гидростатика
- Тепловое расширение тел
Основные теоретические сведения
Основные положения МКТ
К оглавлению…
Молекулярно-кинетической теорией называют учение о строении и свойствах вещества на основе представления о существовании атомов и молекул как наименьших частиц химического вещества. В основе молекулярно-кинетической теории лежат три основных положения:
- Все вещества – жидкие, твердые и газообразные – образованы из мельчайших частиц – молекул, которые сами состоят из атомов («элементарных молекул»). Молекулы химического вещества могут быть простыми и сложными и состоять из одного или нескольких атомов. Молекулы и атомы представляют собой электрически нейтральные частицы. При определенных условиях молекулы и атомы могут приобретать дополнительный электрический заряд и превращаться в положительные или отрицательные ионы (соответственно: катионы и анионы).
- Атомы и молекулы находятся в непрерывном хаотическом движении и взаимодействии, скорость которого зависит от температуры, а характер – от агрегатного состояния вещества.
- Частицы взаимодействуют друг с другом силами, имеющими электрическую природу. Гравитационное взаимодействие между частицами пренебрежимо мало.
Атом – наименьшая химически неделимая частица элемента (атом железа, гелия, кислорода). Молекула – наименьшая частица вещества, сохраняющая его химические свойства. Молекула состоит из одного и более атомов (вода – Н2О – 1 атом кислорода и 2 атома водорода). Ион – атом или молекула, у которых один или несколько электронов лишние (или электронов не хватает).
Молекулы имеют чрезвычайно малые размеры. Простые одноатомные молекулы имеют размер порядка 10–10 м. Сложные многоатомные молекулы могут иметь размеры в сотни и тысячи раз больше.
Беспорядочное хаотическое движение молекул называется тепловым движением. Кинетическая энергия теплового движения растет с возрастанием температуры. При низких температурах молекулы конденсируются в жидкое или твердое вещество. При повышении температуры средняя кинетическая энергия молекулы становится больше, молекулы разлетаются, и образуется газообразное вещество.
В твердых телах молекулы совершают беспорядочные колебания около фиксированных центров (положений равновесия). Эти центры могут быть расположены в пространстве нерегулярным образом (аморфные тела) или образовывать упорядоченные объемные структуры (кристаллические тела).
В жидкостях молекулы имеют значительно большую свободу для теплового движения. Они не привязаны к определенным центрам и могут перемещаться по всему объему жидкости. Этим объясняется текучесть жидкостей.
В газах расстояния между молекулами обычно значительно больше их размеров. Силы взаимодействия между молекулами на таких больших расстояниях малы, и каждая молекула движется вдоль прямой линии до очередного столкновения с другой молекулой или со стенкой сосуда. Среднее расстояние между молекулами воздуха при нормальных условиях порядка 10–8 м, то есть в сотни раз превышает размер молекул. Слабое взаимодействие между молекулами объясняет способность газов расширяться и заполнять весь объем сосуда. В пределе, когда взаимодействие стремится к нулю, мы приходим к представлению об идеальном газе.
Идеальный газ – это газ, молекулы которого не взаимодействуют друг с другом, за исключением процессов упругого столкновения и считаются материальными точками.
В молекулярно-кинетической теории количество вещества принято считать пропорциональным числу частиц. Единица количества вещества называется молем (моль). Моль – это количество вещества, содержащее столько же частиц (молекул), сколько содержится атомов в 0,012 кг углерода 12C. Молекула углерода состоит из одного атома. Таким образом, в одном моле любого вещества содержится одно и то же число частиц (молекул). Это число называется постоянной Авогадро: NА = 6,022·1023 моль–1.
Постоянная Авогадро – одна из важнейших постоянных в молекулярно-кинетической теории. Количество вещества определяется как отношение числа N частиц (молекул) вещества к постоянной Авогадро NА, или как отношение массы к молярной массе:
Массу одного моля вещества принято называть молярной массой M. Молярная масса равна произведению массы m0 одной молекулы данного вещества на постоянную Авогадро (то есть на количество частиц в одном моле). Молярная масса выражается в килограммах на моль (кг/моль). Для веществ, молекулы которых состоят из одного атома, часто используется термин атомная масса. В таблице Менделеева молярная масса указана в граммах на моль. Таким образом имеем еще одну формулу:
где: M – молярная масса, NA – число Авогадро, m0 – масса одной частицы вещества, N – число частиц вещества содержащихся в массе вещества m. Кроме этого понадобится понятие концентрации (количество частиц в единице объема):
Напомним также, что плотность, объем и масса тела связаны следующей формулой:
Если в задаче идет речь о смеси веществ, то говорят о средней молярной массе и средней плотности вещества. Как и при вычислении средней скорости неравномерного движения, эти величины определяются полными массами смеси:
Не забывайте, что полное количество вещества всегда равно сумме количеств веществ, входящих в смесь, а с объемом надо быть аккуратными. Объем смеси газов не равен сумме объемов газов, входящих в смесь. Так, в 1 кубометре воздуха содержится 1 кубометр кислорода, 1 кубометр азота, 1 кубометр углекислого газа и т.д. Для твердых тел и жидкостей (если иное не указано в условии) можно считать, что объем смеси равен сумме объемов ее частей.
Основное уравнение МКТ идеального газа
К оглавлению…
При своем движении молекулы газа непрерывно сталкиваются друг с другом. Из-за этого характеристики их движения меняются, поэтому, говоря об импульсах, скоростях, кинетических энергиях молекул, всегда имеют в виду средние значения этих величин.
Число столкновений молекул газа в нормальных условиях с другими молекулами измеряется миллионами раз в секунду. Если пренебречь размерами и взаимодействием молекул (как в модели идеального газа), то можно считать, что между последовательными столкновениями молекулы движутся равномерно и прямолинейно. Естественно, подлетая к стенке сосуда, в котором расположен газ, молекула испытывает столкновение и со стенкой. Все столкновения молекул друг с другом и со стенками сосуда считаются абсолютно упругими столкновениями шариков. При столкновении со стенкой импульс молекулы изменяется, значит на молекулу со стороны стенки действует сила (вспомните второй закон Ньютона). Но по третьему закону Ньютона с точно такой же силой, направленной в противоположную сторону, молекула действует на стенку, оказывая на нее давление. Совокупность всех ударов всех молекул о стенку сосуда и приводит к возникновению давления газа. Давление газа – это результат столкновений молекул со стенками сосуда. Если нет стенки или любого другого препятствия для молекул, то само понятие давления теряет смысл. Например, совершенно антинаучно говорить о давлении в центре комнаты, ведь там молекулы не давят на стенку. Почему же тогда, поместив туда барометр, мы с удивлением обнаружим, что он показывает какое-то давление? Правильно! Потому, что сам по себе барометр является той самой стенкой, на которую и давят молекулы.
Поскольку давление есть следствие ударов молекул о стенку сосуда, очевидно, что его величина должна зависеть от характеристик отдельно взятых молекул (от средних характеристик, конечно, Вы ведь помните про то, что скорости всех молекул различны). Эта зависимость выражается основным уравнением молекулярно-кинетической теории идеального газа:
где: p — давление газа, n — концентрация его молекул, m0 — масса одной молекулы, vкв — средняя квадратичная скорость (обратите внимание, что в самом уравнении стоит квадрат средней квадратичной скорости). Физический смысл этого уравнения состоит в том, что оно устанавливает связь между характеристиками всего газа целиком (давлением) и параметрами движения отдельных молекул, то есть связь между макро- и микромиром.
Следствия из основного уравнения МКТ
Как уже было отмечено в предыдущем параграфе, скорость теплового движения молекул определяется температурой вещества. Для идеального газа эта зависимость выражается простыми формулами для средней квадратичной скорости движения молекул газа:
где: k = 1,38∙10–23 Дж/К – постоянная Больцмана, T – абсолютная температура. Сразу же оговоримся, что далее во всех задачах Вы должны, не задумываясь, переводить температуру в кельвины из градусов Цельсия (кроме задач на уравнение теплового баланса). Закон трех постоянных:
где: R = 8,31 Дж/(моль∙К) – универсальная газовая постоянная. Следующей важной формулой является формула для средней кинетической энергии поступательного движения молекул газа:
Оказывается, что средняя кинетическая энергия поступательного движения молекул зависит только от температуры, одинакова при данной температуре для всех молекул. Ну и наконец, самыми главными и часто применяемыми следствиями из основного уравнения МКТ являются следующие формулы:
Измерение температуры
Понятие температуры тесно связано с понятием теплового равновесия. Тела, находящиеся в контакте друг с другом, могут обмениваться энергией. Энергия, передаваемая одним телом другому при тепловом контакте, называется количеством теплоты.
Тепловое равновесие – это такое состояние системы тел, находящихся в тепловом контакте, при котором не происходит теплопередачи от одного тела к другому, и все макроскопические параметры тел остаются неизменными. Температура – это физический параметр, одинаковый для всех тел, находящихся в тепловом равновесии.
Для измерения температуры используются физические приборы – термометры, в которых о величине температуры судят по изменению какого-либо физического параметра. Для создания термометра необходимо выбрать термометрическое вещество (например, ртуть, спирт) и термометрическую величину, характеризующую свойство вещества (например, длина ртутного или спиртового столбика). В различных конструкциях термометров используются разнообразные физические свойства вещества (например, изменение линейных размеров твердых тел или изменение электрического сопротивления проводников при нагревании).
Термометры должны быть откалиброваны. Для этого их приводят в тепловой контакт с телами, температуры которых считаются заданными. Чаще всего используют простые природные системы, в которых температура остается неизменной, несмотря на теплообмен с окружающей средой – это смесь льда и воды и смесь воды и пара при кипении при нормальном атмосферном давлении. По температурной шкале Цельсия точке плавления льда приписывается температура 0°С, а точке кипения воды: 100°С. Изменение длины столба жидкости в капиллярах термометра на одну сотую длины между отметками 0°С и 100°С принимается равным 1°С.
Английский физик У.Кельвин (Томсон) в 1848 году предложил использовать точку нулевого давления газа для построения новой температурной шкалы (шкала Кельвина). В этой шкале единица измерения температуры такая же, как и в шкале Цельсия, но нулевая точка сдвинута:
При этом изменение температуры на 1ºС соответствует изменению температуры на 1 К. Изменения температуры по шкале Цельсия и Кельвина равны. В системе СИ принято единицу измерения температуры по шкале Кельвина называть кельвином и обозначать буквой К. Например, комнатная температура TС = 20°С по шкале Кельвина равна TК = 293 К. Температурная шкала Кельвина называется абсолютной шкалой температур. Она оказывается наиболее удобной при построении физических теорий.
Уравнение состояния идеального газа или уравнение Клапейрона-Менделеева
К оглавлению…
Уравнение состояние идеального газа является очередным следствие из основного уравнения МКТ и записывается в виде:
Данное уравнение устанавливает связь между основными параметрами состояния идеального газа: давлением, объемом, количеством вещества и температурой. Очень важно, что эти параметры взаимосвязаны, изменение любого из них неизбежно приведет к изменению еще хотя бы одного. Именно поэтому данное уравнение и называют уравнением состояния идеального газа. Оно было открыто сначала для одного моля газа Клапейроном, а впоследствии обобщено на случай большего количество молей Менделеевым.
Если температура газа равна Tн = 273 К (0°С), а давление pн = 1 атм = 1·105 Па, то говорят, что газ находится при нормальных условиях.
Газовые законы
К оглавлению…
Решение задач на расчет параметров газа значительно упрощается, если Вы знаете, какой закон и какую формулу применить. Итак, рассмотрим основные газовые законы.
1. Закон Авогадро. В одном моле любого вещества содержится одинаковое количество структурных элементов, равное числу Авогадро.
2. Закон Дальтона. Давление смеси газов равно сумме парциальных давлений газов, входящих в эту смесь:
Парциальным давлением газа называют то давление, которое он бы производил, если бы все остальные газ внезапно исчезли из смеси. Например, давление воздуха равно сумме парциальных давлений азота, кислорода, углекислого газа и прочих примесей. При этом каждый из газов в смеси занимает весь предоставленный ему объем, то есть объем каждого из газов равен объему смеси.
3. Закон Бойля-Мариотта. Если масса и температура газа остаются постоянными, то произведение давления газа на его объем не изменяется, следовательно:
Процесс, происходящий при постоянной температуре, называют изотермическим. Обратите внимание, что такая простая форма закона Бойля-Мариотта выполняется только при условии, что масса газа остается неизменной.
4. Закон Гей-Люссака. Сам закон Гей-Люссака не представляет особой ценности при подготовке к экзаменам, поэтому приведем лишь следствие из него. Если масса и давление газа остаются постоянными, то отношение объема газа к его абсолютной температуре не изменяется, следовательно:
Процесс, происходящий при постоянном давлении, называют изобарическим или изобарным. Обратите внимание, что такая простая форма закона Гей-Люссака выполняется только при условии, что масса газа остается неизменной. Не забывайте про перевод температуры из градусов Цельсия в кельвины.
5. Закон Шарля. Как и закон Гей-Люссака, закон Шарля в точной формулировке для нас не важен, поэтому приведем лишь следствие из него. Если масса и объем газа остаются постоянными, то отношение давления газа к его абсолютной температуре не изменяется, следовательно:
Процесс, происходящий при постоянном объеме, называют изохорическим или изохорным. Обратите внимание, что такая простая форма закона Шарля выполняется только при условии, что масса газа остается неизменной. Не забывайте про перевод температуры из градусов Цельсия в кельвины.
6. Универсальный газовый закон (Клапейрона). При постоянной массе газа отношение произведения его давления и объема к температуре не изменяется, следовательно:
Обратите внимание, что масса должна оставаться неизменной, и не забывайте про кельвины.
Итак, существует несколько газовых законов. Перечислим признаки того, что нужно применять один из них при решении задачи:
- Закон Авогадро применяется во всех задачах где речь идет о количестве молекул.
- Закон Дальтона применяется во всех задачах, в которых идет речь о смеси газов.
- Закон Шарля применяют в задачах, когда объем газа остается неизменным. Обычно это или сказано явно, или в задаче присутствуют слова «газ в закрытом сосуде без поршня».
- Закон Гей-Люссака применяют, если неизменным остается давление газа. Ищите в задачах слова «газ в сосуде, закрытом подвижным поршнем» или «газ в открытом сосуде». Иногда про сосуд ничего не сказано, но по условию понятно, что он сообщается с атмосферой. Тогда считается, что атмосферное давление всегда остается неизменным (если в условии не сказано иного).
- Закон Бойля-Мариотта. Тут сложнее всего. Хорошо, если в задаче написано, что температура газа неизменна. Чуть хуже, если в условии присутствует слово «медленно». Например, газ медленно сжимают или медленно расширяют. Еще хуже, если сказано, что газ закрыт теплонепроводящим поршнем. Наконец, совсем плохо, если про температуру не сказано ничего, но из условия можно предположить, что она не изменяется. Обычно в этом случае ученики применяют закон Бойля-Мариотта от безысходности.
- Универсальный газовый закон. Его используют, если масса газа постоянна (например, газ находится в закрытом сосуде), но по условию понятно, что все остальные параметры (давление, объем, температура) изменяются. Вообще, часто вместо универсального закона можно применять уравнение Клапейрона-Менделеева, вы получите правильный ответ, только в каждой формуле будете писать по две лишние буквы.
Графическое изображение изопроцессов
К оглавлению…
Во многих разделах физики зависимость величин друг от друга удобно изображать графически. Это упрощает понимание взаимосвязи параметров, происходящих в системе процессов. Такой подход очень часто применяется и в молекулярной физике. Основными параметрами, описывающими состояние идеального газа, являются давление, объем и температура. Графический метод решения задач и состоит в изображении взаимосвязи этих параметров в различных газовых координатах. Существует три основных типа газовых координат: (p; V), (p; T) и (V; T). Заметьте, что это только основные (наиболее часто встречающиеся типы координат). Фантазия составителей задач и тестов не ограничена, поэтому Вы можете встретить и любые другие координаты. Итак, изобразим основные газовые процессы в основных газовых координатах.
Изобарный процесс (p = const)
Изобарным процессом называют процесс, протекающий при неизменным давлении и массе газа. Как следует из уравнения состояния идеального газа, в этом случае объем изменяется прямо пропорционально температуре. Графики изобарического процесса в координатах р–V; V–Т и р–Т имеют следующий вид:
Обратите внимание на то, что продолжение графика в V–T координатах направлено точно в начало координат, однако этот график никогда не сможет начаться прямо из начала координат, так как при очень низких температурах газ превращается в жидкость и зависимость объема от температура меняется.
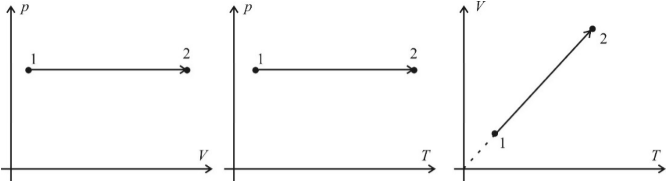
Изохорный процесс (V = const)
Изохорный процесс – это процесс нагревания или охлаждения газа при постоянном объеме и при условии, что количество вещества в сосуде остается неизменным. Как следует из уравнения состояния идеального газа, при этих условиях давление газа изменяется прямо пропорционально его абсолютной температуре. Графики изохорного процесса в координатах р–V; р–Т и V–Т имеют следующий вид:
Обратите внимание на то, что продолжение графика в p–T координатах направлено точно в начало координат, однако этот график никогда не сможет начаться прямо из начала координат, так как газ при очень низких температурах превращается в жидкость.
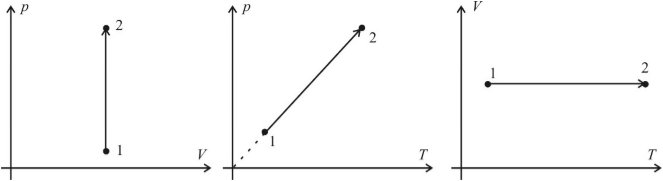
Изотермический процесс (T = const)
Изотермическим процессом называют процесс, протекающий при постоянной температуре. Из уравнения состояния идеального газа следует, что при постоянной температуре и неизменном количестве вещества в сосуде произведение давления газа на его объем должно оставаться постоянным. Графики изотермического процесса в координатах р–V; р–Т и V–Т имеют следующий вид:
Заметим, что при выполнении заданий на графики в молекулярной физике не требуется особой точности в откладывании координат по соответствующим осям (например, чтобы координаты p1 и p2 двух состояний газа в системе p(V) совпадали с координатами p1 и p2 этих состояний в системе p(T). Во–первых, это разные системы координат, в которых может быть выбран разный масштаб, а во–вторых, это лишняя математическая формальность, отвлекающая от главного – от анализа физической ситуации. Основное требование: чтобы качественный вид графиков был верным.
Неизопроцессы
К оглавлению…
В задачах этого типа изменяются все три основных параметра газа: давление, объем и температура. Постоянной остается только масса газа. Наиболее простой случай, если задача решается «в лоб» с помощью универсального газового закона. Чуть сложнее, если Вам надо отыскать уравнение процесса, описывающего изменение состояния газа, или проанализировать поведение параметров газа по данному уравнению. Тогда действовать надо так. Записать данное уравнение процесса и универсальный газовый закон (или уравнение Клапейрона-Менделеева, что Вам удобнее) и последовательно исключать ненужные величины из них.
Изменение количества или массы вещества
К оглавлению…
В сущности, ничего сложного в таких задачах нет. Надо только помнить, что газовые законы не выполняются, так как в формулировках любых из них записано «при постоянной массе». Поэтому действуем просто. Записываем уравнение Клапейрона-Менделеева для начального и конечного состояний газа и решаем задачу.
Перегородки или поршни
К оглавлению…
В задачах этого типа опять применяются газовые законы, при этом необходимо учесть следующие замечания:
- Во-первых, газ через перегородку не проходит, то есть масса газа в каждой части сосуда остается неизменной, и таким образом, для каждой части сосуда выполняются газовые законы.
- Во-вторых, если перегородка теплонепроводящая, то при нагревании или охлаждении газа в одной части сосуда температура газа во второй части останется неизменной.
- В-третьих, если перегородка подвижна, то давления по обе ее стороны равны в каждый конкретный момент времени (но это равное с обоих сторон давление может меняться со временем).
- А дальше пишем газовые законы для каждого газа по отдельности и решаем задачу.
Газовые законы и гидростатика
К оглавлению…
Специфика задач состоит в том, что в давлении надо будет учитывать «довески», связанные с давлением столба жидкости. Какие тут могут быть варианты:
- Сосуд с газом погружен под воду. Давление в сосуде будет равно: p = pатм + ρgh, где: h – глубина погружения.
- Горизонтальная трубка закрыта от атмосферы столбиком ртути (или другой жидкости). Давление газа в трубке точно равно: p = pатм атмосферному, так как горизонтальный столбик ртути не оказывает давления на газ.
- Вертикальная трубка с газом закрыта сверху столбиком ртути (или другой жидкости). Давление газа в трубке: p = pатм + ρgh, где: h – высота столбика ртути.
- Вертикальная узкая трубка с газом повернута открытым концом вниз и заперта столбиком ртути (или другой жидкости). Давление газа в трубке: p = pатм – ρgh, где: h – высота столбика ртути. Знак «–» ставится, так как ртуть не сжимает, а растягивает газ. Часто ученики спрашивают, почему ртуть не вытекает из трубки. Действительно, если бы трубка была широкой, ртуть бы стекла вниз по стенкам. А так, поскольку трубка очень узкая, поверхностное натяжение на дает ртути разорваться посередине и пропустить внутрь воздух, а давление газа внутри (меньшее, чем атмосферное) удерживает ртуть от вытекания.
Как только Вы сумели правильно записать давление газа в трубке, применяйте какой-либо из газовых законов (как правило, Бойля-Мариотта, так как большинство таких процессов изотермические, или универсальный газовый закон). Применяйте выбранный закон для газа (ни в коем случае не для жидкости) и решайте задачу.
Тепловое расширение тел
К оглавлению…
При повышении температуры возрастает интенсивность теплового движения частиц вещества. Это приводит к тому, что молекулы более «активно» отталкиваются друг от друга. Из-за этого большинство тел увеличивает свои размеры при нагревании. Не совершите типичную ошибку, сами атомы и молекулы не расширяются при нагревании. Увеличиваются лишь пустые промежутки между молекулами. Тепловое расширение газов описывается законом Гей-Люссака. Тепловое расширение жидкостей подчиняется следующему закону:
где: V0 – объем жидкости при 0°С, V – при температуре t, γ – коэффициент объемного расширения жидкости. Обратите внимание, что все температуры в этой теме нужно брать в градусах Цельсия. Коэффициент объемного расширения зависит от рода жидкости (и от температуры, что не учитывается в большинстве задач). Обратите внимание, что численное значение коэффициента, выраженное в 1/°С или в 1/К, одинаково, так как нагреть тело на 1°С это то же самое, что нагреть его на 1 К (а не на 274 К).
Для расширения твердых тел применяются три формулы, описывающие изменение линейных размеров, площади и объема тела:
где: l0, S0, V0 – соответственно длина, площадь поверхности и объем тела при 0°С, α – коэффициент линейного расширения тела. Коэффициент линейного расширения зависит от рода тела (и от температуры, что не учитывается в большинстве задач) и измеряется в 1/°С или в 1/К.
Средняя скорость теплового движения молекул. Уравнение (2.9) дает возможность найти среднюю скорость теплового движения молекул. Подставляя в это уравнение 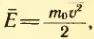

Отсюда средняя скорость молекулы (точнее, средняя квадратическая скорость) равна:
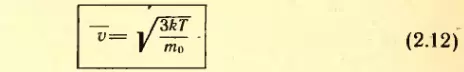
Вычисляя по формуле (2.12) скорость молекул, например азота, при t = 0°C, получим: 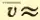
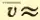
Когда впервые были получены эти числа (вторая половина XIX в.), многие физики были ошеломлены. Скорости молекул газа по расчетам оказались большими, чем скорости артиллерийских снарядов! Высказывали на этом основании даже сомнения в справедливости кинетической теории. Ведь известно, что запахи распространяются довольно медленно: нужно время порядка десятков секунд, чтобы запах духов, пролитых в одном углу комнаты, распространился до другого угла. Это нетрудно объяснить. Из-за столкновений молекул траектория каждой молекулы представляет собой запутанную ломаную линию (рис. 28). Большие скорости молекула имеет на прямолинейных отрезках ломаной. Перемещение же молекулы в каком либо направлении в среднем невелико даже за время нарядна нескольких минут. При перемещении молекулы из точки A в точку B пройденный ею путь оказывается гораздо больше расстояния |AB|.
Экспериментальное определение скоростей молекул. Опыты по определению скоростей молекул доказали справедливость формулы (2.12). Один из опытов был предложен Штерном в 1920 г.
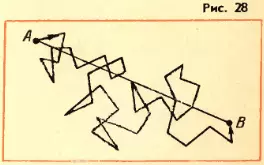
Прибор Штерна состоит из двух коаксиальных цилиндров А и В, жестко связанных друг с другом (рис. 29, а). Цилиндры могут вращаться с постоянной угловой скоростью. Вдоль оси малого цилиндра натянута тонкая платиновая проволочка C, покрытая слоем серебра. По проволочке пропускают электрический ток. В стенке этого цилиндра имеется узкая щель O. Воздух из цилиндров откачан. Цилиндр B находится при комнатной температуре.
Вначале прибор неподвижен. При прохождении тока по нити слой серебра испаряется и внутренний цилиндр заполняется газом из атомов серебра. Некоторые атомы пролетают через щель O и, достигнув внутренней поверхности цилиндра B, осаждаются на ней. В результате прямо против щели образуется узкая полоска серебра D (рис. 29, б).
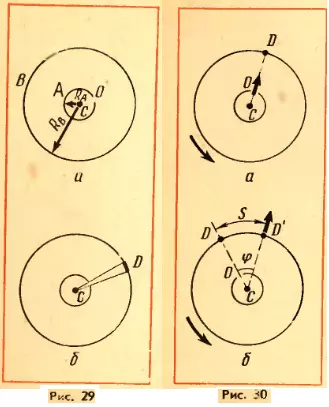
Затем цилиндры приводит во вращение с угловой скоростью ω. Теперь за время t, необходимое атому для прохождения пути, равного разности радиусов цилиндров RB — RA, цилиндры повернутся на некоторый угол φ. В результате атомы, движущиеся с постоянной скоростью, попадут на внутреннюю поверхность большого цилиндра не прямо против щели O (рис. 30, а), а на некотором расстоянии s от конца радиуса, проходящего через середину щели (рис. 30, б). Ведь атомы движутся прямолинейно. Расстояние s равно:
s = φ RB = ωtRB (2.13)
В действительности не все атомы серебра имеют одну и ту же скорость. Поэтому расстояния s для различных атомов будут несколько различаться. Под s следует понимать расстояние между участками на полоскал D и D’ с наибольшей концентрацией атомов серебра. Этому расстоянию будет соответствовать средняя скорость атомов.
Средняя скорость атома равна:
Подставляя в эту формулу значение t из выражения (2.13), получим:
Зная ω, RA и RB и измеряя среднее смещение s полоски серебра, вызванное вращением прибора, находим среднюю скорость атомов серебра.
Модули скоростей, определенные из опыта, совпадают с теоретическим значением средней квадратической скорости. Это служит экспериментальным доказательством справедливости формулы (2.12), а следовательно и (2.9), согласно которой средняя кинетическая энергия молекулы прямо пропорциональна абсолютной температуре.
Средняя скорость броуновской частицы. Формула (2.12) позволяет понять почему интенсивность броуновского движения возрастает с повышением температуры жидкости и уменьшается при увеличении массы частицы. Ведь броуновская частица, участвует в тепловом движении молекул. Поэтому ее средняя кинетическая энергия также определяется формулой (2.9), а средняя квадратическая скорость — формулой
где m — масса броуновской частицы. Если масса частицы велике, то средняя скорость ее движения настолько мала, что движение частицы практически нельзя обнаружить.
1. Как изменится средняя квадратическая скорость движения молекул при увеличении температуры в 4 раза? 2. Какие молекулы в атмосфере движутся быстрее: молекулы азота или молекулы кислорода? 3. Почему толщина слоя полоски серебра на поверхности внешнего вращающегося цилиндра в опыте Штерна неодинакова по ширине полоски?