Богом прошу, помогите! Каковы средняя квадратичная скорость и концентрация молекул водяного пар…
-
- 0
-
Богом прошу, помогите!
Каковы средняя квадратичная скорость и концентрация молекул водяного пара при температуре 0 °С и давлении 0,61 кПа?
-
Комментариев (0)
-
- 0
-
Согласно молекулярно-кинетической теории давление газа p пропорционально его концентрации n и абсолютной (то есть по шкале Кельвина) температуре T:
p = n*k*T, где
k = 1,38^10(-23) Дж/К – постоянная Больцмана;
Температуру переведём в кельвины: T = (0 + 273) К = 273 К;
Давление переведём в паскали: p = 0,61 кПа = 610 Па.
Отсюда концентрация:
n = p/(k*T)
n = 610/(1,38^10(-23)*273)
Все величины подставлены в СИ, значит и ответ получится в СИ – 1/м³.
n = 610/(1,38^10(-23)*273)
n ≈ 1,62*10^23 (1/м³)
То есть в среднем столько молекул водяного пара содержится в каждом кубическом метре.
Средняя квадратичная скорость движения молекул Vср.кв. определяется формулой:
Vср.кв. = √(3*R*T/μ), где
μ = 0,018 кг/моль – молярная масса воды;
R = 8,314 Дж/(моль*К) – универсальная газовая постоянная.
Vср.кв. = √(3*8,314*273/0,018).
Все величины подставлены в СИ, значит и ответ получится в СИ – м/с.
Vср.кв. ≈ 615 м/с.
Пояснение.
Молярная масса воды определяется так:
Молекула воды состоит из 2х атомов водорода и одного атома кислорода (H₂O). Значит масса молекулы воды равна сумме масс атома кислорода и двух атомов водорода. По таблице Менделеева масса атома водорода равна 1 а.е.м. (атомные единицы массы), масса атома кислорода равна 16 а.е.м. Значит масса молекулы воды равна 2*1+16=18 а.е.м.
Молярная масса вещества в «г/моль» численно совпадает с массой молекулы в «а.е.м.». То есть молярная масса воды равна 18 г/моль = 0,018 кг/моль.
-
Комментариев (0)
-
- 0
-
T=0°C=273 K
p=0,61 кПа=610 Па.
Средняя квадратичная скорость равна:
v=(3RT/M)^0.5=(3*8.31*273/0.018)^0.5=614.9 м/с,
где М — молярная масса водяного пара
Т.к. давление газа в сосуде равно:
р=nkT, то концентрация молекул равна:
n=p/kT=610/1.38*10^-23*273=1.62*10^23 част/м3
-
Комментариев (0)
Ваш ответ
Насыщенный пар
-
Темы кодификатора ЕГЭ: насыщенные и ненасыщенные пары, влажность воздуха.
-
Испарение и конденсация
-
Динамическое равновесие
-
Свойства насыщенного пара
-
Влажность воздуха
Автор статьи — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев
Темы кодификатора ЕГЭ: насыщенные и ненасыщенные пары, влажность воздуха.
Если открытый стакан с водой оставить на долгое время, то в конце концов вода полностью улетучится. Точнее — испарится. Что такое испарение и почему оно происходит?
Испарение и конденсация
При данной температуре молекулы жидкости обладают разными скоростями. Скорости большинства молекул находятся вблизи некоторого среднего значения (характерного для этой температуры). Но попадаются молекулы, скорости которых значительно отличаются от средней как в меньшую, так и большую сторону.
На рис. 1 изображён примерный график распределения молекул жидкости по скоростям. Голубым фоном показано то самое большинство молекул, скорости которых группируются около среднего значения. Красный «хвост» графика — это небольшое число «быстрых» молекул, скорости которых существенно превышают среднюю скорость основной массы молекул жидкости.
Рис. 1. Распределение молекул по скоростям
Когда такая весьма быстрая молекула окажется на свободной поверхности жидкости (т.е. на границе раздела жидкости и воздуха), кинетической энергии этой молекулы может хватить на то, чтобы преодолеть силы притяжения остальных молекул и вылететь из жидкости. Данный процесс и есть испарение, а молекулы, покинувшие жидкость, образуют пар.
Итак, испарение — это процесс превращения жидкости в пар, происходящий на свободной поверхности жидкости (при особых условиях превращение жидкости в пар может происходить по всему объёму жидкости. Данный процесс вам хорошо известен — это кипение).
Может случиться, что через некоторое время молекула пара вернётся обратно в жидкость.
Процесс перехода молекул пара в жидкость называется конденсацией. Конденсация пара — процесс, обратный испарению жидкости.
к оглавлению ▴
Динамическое равновесие
А что будет, если сосуд с жидкостью герметично закрыть? Плотность пара над поверхностью жидкости начнёт увеличиваться; частицы пара будут всё сильнее мешать другим молекулам жидкости вылетать наружу, и скорость испарения станет уменьшаться. Одновременно начнёт увеличиваться скорость конденсации, так как с возрастанием концентрации пара число молекул, возвращающихся в жидкость, будет становиться всё больше.
Наконец, в какой-то момент скорость конденсации окажется равна скорости испарения. Наступит динамическое равновесие между жидкостью и паром: за единицу времени из жидкости будет вылетать столько же молекул, сколько возвращается в неё из пара. Начиная с этого момента количество жидкости перестанет убывать, а количество пара — увеличиваться; пар достигнет «насыщения».
Насыщенный пар — это пар, который находится в состоянии динамического равновесия со своей жидкостью. Пар, не достигший состояния динамического равновесия с жидкостью, называется ненасыщенным.
Давление и плотность насыщенного пара обозначаются и
. Очевидно,
и
— это максимальные давление и плотность, которые может иметь пар при данной температуре. Иными словами, давление и плотность насыщенного пара всегда превышают давление и плотность ненасыщенного пара.
к оглавлению ▴
Свойства насыщенного пара
Оказывается, что состояние насыщенного пара (а ненасыщенного — тем более) можно приближённо описывать уравнением состояния идеального газа (уравнением Менделеева — Клапейрона). В частности, имеем приближённое соотношение между давлением насыщенного пара и его плотностью:
(1)
Это весьма удивительный факт, подтверждаемый экспериментом. Ведь по своим свойствам насыщенный пар существенно отличается от идеального газа. Перечислим важнейшие из этих отличий.
1. При неизменной температуре плотность насыщенного пара не зависит от его объёма.
Если, например, насыщенный пар изотермически сжимать, то его плотность в первый момент возрастёт, скорость конденсации превысит скорость испарения, и часть пара конденсируется в жидкость — до тех пор, пока вновь не наступит динамическое равновесие, в котором плотность пара вернётся к своему прежнему значению.
Аналогично, при изотермическом расширении насыщенного пара его плотность в первый момент уменьшится (пар станет ненасыщенным), скорость испарения превысит скорость конденсации, и жидкость будет дополнительно испаряться до тех пор, пока опять не установится динамическое равновесие — т.е. пока пар снова не станет насыщенным с прежним значением плотности.
2. Давление насыщенного пара не зависит от его объёма.
Это следует из того, что плотность насыщенного пара не зависит от объёма, а давление однозначно связано с плотностью уравнением (1).
Как видим, закон Бойля — Мариотта, справедливый для идеальных газов, для насыщенного пара не выполняется. Это и не удивительно — ведь он получен из уравнения Менделеева — Клапейрона в предположении, что масса газа остаётся постоянной.
3. При неизменном объёме плотность насыщенного пара растёт с повышением температуры и уменьшается с понижением температуры.
Действительно, при увеличении температуры возрастает скорость испарения жидкости.
Динамическое равновесие в первый момент нарушается, и происходит дополнительное испарение некоторой части жидкости. Пара будет прибавляться до тех пор, пока динамическое равновесие вновь не восстановится.
Точно так же при понижении температуры скорость испарения жидкости становится меньше, и часть пара конденсируется до тех пор, пока не восстановится динамическое равновесие — но уже с меньшим количеством пара.
Таким образом, при изохорном нагревании или охлаждении насыщенного пара его масса меняется, поэтому закон Шарля в данном случае не работает. Зависимость давления насыщенного пара от температуры уже не будет линейной функцией.
4. Давление насыщенного пара растёт с температурой быстрее, чем по линейному закону.
В самом деле, с увеличением температуры возрастает плотность насыщенного пара, а согласно уравнению (1) давление пропорционально произведению плотности на температуру.
Зависимость давления насыщенного пара от температуры является экспоненциальной (рис. 2). Она представлена участком 1–2 графика. Эту зависимость нельзя вывести из законов идеального газа.
Рис. 2. Зависимость давления пара от температуры
В точке 2 вся жидкость испаряется; при дальнейшем повышении температуры пар становится ненасыщенным, и его давление растёт линейно по закону Шарля (участок 2–3).
Вспомним, что линейный рост давления идеального газа вызван увеличением интенсивности ударов молекул о стенки сосуда. В случае нагревания насыщенного пара молекулы начинают бить не только сильнее, но и чаще — ведь пара становится больше. Одновременным действием этих двух факторов и вызван экспоненциальный рост давления насыщенного пара.
к оглавлению ▴
Влажность воздуха
Воздух, содержащий водяной пар, называется влажным.Чем больше пара находится в воздухе, тем выше влажность воздуха.
Абсолютная влажность — это парциальное давление водяного пара, находящегося в воздухе (т. е. давление, которое водяной пар оказывал бы сам по себе, в отсутствие других газов). Иногда абсолютной влажностью называют также плотность водяного пара в воздухе.
Относительная влажность воздуха — это отношение парциального давления водяного пара в нём к давлению насыщенного водяного пара при той же температуре. Как правило, это отношение выражают в процентах:
Из уравнения Менделеева-Клапейрона (1) следует, что отношение давлений пара равно отношению плотностей. Так как само уравнение (1), напомним, описывает насыщенный пар лишь приближённо, мы имеем приближённое соотношение:
Одним из приборов, измеряющих влажность воздуха, является психрометр. Он включает в себя два термометра, резервуар одного из которых завёрнут в мокрую ткань. Чем ниже влажность, тем интенсивнее идёт испарение воды из ткани, тем сильнее охлаждается резервуар «мокрого» термометра, и тем больше разность его показаний и показаний сухого термометра. По этой разности с помощью специальной психрометрической таблицы определяют влажность воздуха.
Спасибо за то, что пользуйтесь нашими публикациями.
Информация на странице «Насыщенный пар» подготовлена нашими авторами специально, чтобы помочь вам в освоении предмета и подготовке к экзаменам.
Чтобы успешно сдать необходимые и поступить в ВУЗ или техникум нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими статьями из данного раздела.
Публикация обновлена:
08.05.2023
Водяной пар.
Водяной пар – газообразное агрегатное состояние воды. Не имеет цвета, вкуса и запаха.
Водяной пар в воздухе, плотность водяного пара
Насыщенный и ненасыщенный водяной пар. Влажный и сухой пар. Пересыщенный и перегретый пар
Образование водяного пара. Конденсация водяного пара
Использование водяного пара
Водяной пар в воздухе, плотность водяного пара:
Водяной пар – газообразное агрегатное состояние воды.
Водяной пар не имеет цвета, вкуса и запаха.
Водяной пар, как и вода, – это бинарное неорганическое соединение с химической формулой H2O.
Молекула водяного пара, как и молекула воды, состоит из двух атомов водорода и одного – кислорода, которые соединены между собой ковалентной связью.
Водяной пар содержится в воздухе – в атмосфере Земли (в основном в тропосфере). Концентрация водяного пара в воздухе (в атмосфере Земли) составляет в среднем 0,25 % по массе от массы всей атмосферы Земли. Концентрация водяного пара в воздухе (в атмосфере Земли) по объему (в пересчете на сухой воздух) значительно варьируется от примерно 0,0001 % по объему в самых холодных частях атмосферы до 5% по объему в горячих, влажных воздушных массах.
Водяной пар легче и менее плотный, чем сухой воздух. Так, плотность сухого воздуха при нормальном атмосферном давлении (101 325 Па или 1 атм.) и температуре 0 °C составляет 1,292 кг/м3 (или 0,001292 г/см3), при температуре 20 °C – 1,2041 кг/м3 (или 0,0012041 г/см3). Плотность водяного пара при нормальном атмосферном давлении (101 325 Па или 1 атм.) и температуре 0 °C составляет 0,803 кг/м3 (или 0,000803 г/см3), при температуре 20 °C – 0,749 кг/м3 (или 0,000749 г/см3).
Плотность водяного пара (m/V) находится с использованием уравнения Клайперона – Менделеева (уравнения состояния идеального газа):
где
p – давление газа,
V – объём газа,
R – универсальная газовая постоянная, R ≈ 8,314 Дж/(моль⋅К),
T – термодинамическая температура газа, К,
m – масса газа,
M – молярная масса газа,
m/V – плотность газа.

Насыщенный и ненасыщенный водяной пар. Влажный и сухой пар. Пересыщенный и перегретый пар:
Над поверхностью воды всегда есть водяные пары, которые образуются в результате ее испарения испарения. При этом из-за диффузии часть молекул пара возвращается обратно в жидкость.
Процесс испарения жидкости еще называется парообразованием. А обратный процесс превращения пара в жидкость – конденсацией. Эти два процесса иллюстрируют фазовый переход – процесс перехода веществ из одного агрегатного состояния в другое: из жидкого в газообразное и наоборот.
Если число молекул водяного пара, покидающих жидкость за единицу времени, больше числа молекул водяного пара, возвращающихся в жидкость обратно за тот же промежуток времени, то пар называется ненасыщенным.
Иными словами, ненасыщенный водяной пар – водяной пар, не достигший динамического равновесия (не термодинамического!) со своей жидкостью. При данной температуре давление ненасыщенного пара всегда меньше давления насыщенного пара. При наличии над поверхностью жидкости ненасыщенного пара процесс парообразования преобладает над процессом конденсации, и потому жидкости в сосуде с течением времени становится все меньше и меньше.
Если число молекул водяного пара, покидающих жидкость за единицу времени, равно числу молекул водяного пара, возвращающихся в жидкость за тот же промежуток времени, то пар называется насыщенным.
Иными словами, насыщенный водяной пар – водяной пар, находящийся в динамическом равновесии со своей жидкостью: скорость испарения водяного пара равна скорости его конденсации. Такая ситуация возможна, если, например, ограничить объем над поверхностью воды.
Таким образом, в условиях динамического равновесия при определенной температуре в определенном объёме может находиться только определенное количество молекул пара. Во-вторых, в условиях динамического равновесия давление пара постоянно. Т.е. у насыщенного пара при одной и той же температуре большего давления и большей концентрации молекул пара достичь невозможно. Давление насыщенного пара имеет единственное значение, зависящее только от его температуры. Его значение при различных температурах можно найти в справочных таблицах.
Водяной пар обладает особенностью, заключающейся в том, что давление водяного пара не может превышать давление насыщенного водяного пара.
Для водяного пара вводится понятие относительной влажности φ, являющееся степенью его насыщенности. Чем ближе пар к насыщению, тем ближе к единице его относительная влажность. Для ненасыщенного пара φ < 1, для насыщенного φ = 1.
Насыщенный пар в свою очередь подразделяется на насыщенный сухой и насыщенный влажный пар. Насыщенный влажный пар состоит из виде взвешенных мелкодисперсных частиц воды, температура которых находится на уровне кипения, и соответственно самого пара, а насыщенный сухой пар не содержит капелек воды.
Существуют также перегретый пар и пересыщенный пар.
Пересыщенный пар (перенасыщенный пар, переохлажденный пар) – пар, давление которого превышает давление насыщенного пара при данной температуре. Пересыщенный пар может быть получен путём увеличения давления пара в объёме, свободном от центров конденсации (пылинок, ионов, капелек жидкости малых размеров и т. д.) либо путём охлаждения насыщенного пара при тех же условиях.
Состояние пересыщенного пара является метастабильным, то есть такое состояние пара способно существовать длительное время, однако оно является термодинамически неустойчивым. Так, при появлении каких-либо центров конденсации часть пара конденсируется, давление оставшегося пара падает, и он переходит в устойчивое состояние насыщенного пара над сконденсировшейся жидкостью. Устанавливается динамическое равновесие между жидкой и газообразной фазами.
Перегретый пар – пар, нагретый до температуры, превышающей температуру кипения при данном давлении.
Его получают путём нагрева насыщенного пара выше точки насыщения (температуры кипения при данном давлении) в специальных устройствах – пароперегревателях.
Использование перегретого пара позволяет значительно поднять КПД паровой установки, в которой он используется.
Перегретый пар обладает следующими основными свойствами и преимуществами:
– при одинаковом давлении с насыщенным паром имеет значительно бо́льшую температуру и теплосодержание;
– имеет больший удельный объём в сравнении с насыщенным паром, то есть объём 1 кг перегретого пара при том же давлении больше объема 1 кг насыщенного пара. Поэтому в паровых машинах для получения необходимой мощности перегретого пара по массе потребуется меньше, что даёт экономию в расходе воды и топлива;
– перегретый пар при охлаждении не конденсируется; конденсация при охлаждении наступает лишь тогда, когда температура перегретого пара станет ниже температуры насыщенного пара при данном давлении.
Образование водяного пара. Конденсация водяного пара:
Водяной пар может быть получен в результате испарения или кипения жидкой воды, а также в результате сублимации льда. При испарении пар образуется только на поверхности вещества, при кипении же пар образуется по всему объему жидкости.
В обычных атмосферных условиях водяной пар непрерывно образуется в результате испарения и конденсируется в жидкое состояние.
Кипение воды происходит при температурах, которые зависят от химического состава водного раствора и атмосферного давления.
При нормальном давлении окружающей среды 1 атм. (101,325 кПа) вода кипит при 100 °C. Температура кипения остается неизменной на протяжении всего процесса. Так, если в оставшуюся воду подается энергия (тепло), она испаряется без дальнейшего повышения температуры. Из 1 литра (соответственно 1 кг) воды образуется 1673 литра водяного пара (в нормальных условиях), для чего требуются затраты энергии 2257 кДж.
При поступлении водяного пара в воздух он, как и все другие газы, создаёт определённое давление, называемое парциальным. Парциальное давление (лат. partialis – «частичный» от pars – «часть») – давление отдельно взятого компонента газовой смеси. Общее давление газовой смеси является суммой парциальных давлений её компонентов.
Обратные образованию водяного пара процессы именуются конденсацией и десублимацией. Водяной пар будет конденсироваться на другую поверхность только тогда, когда эта поверхность будет более холодной, чем температура точки росы, или когда равновесие водяного пара в воздухе будет превышено.
В атмосфере конденсация водяного пара приводит к образованию облаков, тумана и осадков, а десублимация – снега.
Использование водяного пара:
Благодаря своим уникальным свойствам, водяной пар получил широкое распространение в разнообразной деятельности человека:
– в промышленности в качестве теплоносителя, рабочего тела в паровых машинах и турбинах,
– как очистительный агент при паровой очистке;
– в качестве огнетушащего вещества в системах паротушения;
– в кулинарии для приготовления блюд «на пару»;
– для стерилизации медицинских и микробиологических инструментов так называемым методом автоклавирования.
Примечание: © Фото https://www.pexels.com, https://pixabay.com
Коэффициент востребованности
1 890
Молекулярная физика. Термодинамика Основные законы и формулы
|
Уравнение |
pV |
|
Масса молекулы |
m0 |
|
Количество |
ν |
|
Средняя кинетическая |
|
|
Основное |
|
|
Внутренняя |
|
|
Наиболее вероятная |
|
|
Средняя |
|
|
Средняя |
|
|
Количество |
Q |
|
Удельная |
|
|
Удельная |
|
|
Среднее |
|
|
Средняя |
|
|
Закон диффузии |
|
|
Закон |
|
|
Работа |
|
|
Работа |
|
|
Работа |
|
|
Уравнения |
|
|
Изменение энтропии |
|
|
Термический |
η |
|
Термический |
η |
|
Высота |
|
Примеры решения задач
Пример
1.
Определить число атомов N,
содержащихся в 1 кг гелия. Найти массу
m0
одного атома гелия.
|
Дано:
М
Найти: |
Решение:
Поскольку
гелий – одноатомный газ, то число атомов
в данной массе газа
,
(1)
где
= m
/М –
количество молей вещества, М
– молярная масса, m
– масса газа, NА
– число Авогадро.
Найдём
искомое число атомов
.
Для
определения массы m0
одного атома массу m
газа разделим на число атомов N
в нём:
.
Ответ:
N
= 1,5·1026;
m
= 6,67·10–26
кг.
Пример
2.
Считая водород в солнечной фотосфере
(внешней видимой оболочке Солнца)
идеальным газом, определить среднюю
кинетическую энергию
поступательного
движения атомов водорода. Концентрация
атомов водорода в фотосфере n
= 1,6∙1021
м–3,
давление
Р
= 1,25∙102
Па.
|
Дано:
Р
Найти: |
Решение:
Связь между давлением р
идеального газа, концентрацией n
и средней кинетической энергией
теплового
движения частиц
выражается
основным уравнением молекулярно-кинети-ческой
теории:
,
(1)
Отсюда
.
(2)
Следовательно,
.
Ответ:
=
1,2∙10–19
Дж.
Пример
3.
Найти наиболее вероятную υв,
среднюю арифметическую
и среднюю квадратичную
скорости молекул водорода при температуре
27 С.
|
Дано:
МН2
Найти: |
Р |
Решение:
В
газе, находящемся в состоянии равновесия,
устанавливается некоторое стационарное,
не меняющееся со временем распределение
молекул по скоростям, которое подчиняется
статистическому распределению Максвелла.
Распределение
Максвелла (рис. 1) позволяет определить
относительное число молекул ∆N(υ)/N,
скорости которых лежат в интервале от
υ
до υ+∆υ.
Скорость
υв,
которой соответствует максимум кривой
распределения Максвелла, называют
наиболее
вероятной скоростью.
Этой скоростью и близкой к ней при данной
температуре обладает наибольшее число
молекул.
Наиболее
вероятную скорость найдем по формуле
,
(1)
где
R
– молярная газовая постоянная, Т
– абсолютная температура,
М
– масса одного моля газа.
Произведём
вычисления:
.
Средняя
арифметическая скорость
по
определению равна отношению суммы
скоростей всех молекул к числу молекул:
. (2)
Из
закона распределения Максвелла средняя
арифметическая скорость молекул
определяется следующим образом:
.
(3)
Следовательно,
.
Если
газ в объёме V
содержит
N
молекул, движущихся со скоростями 1,
2,
…, N,
то средняя квадратичная скорость
.
(4)
Средняя
квадратичная скорость
определяет среднюю кинетическую энергию
движения молекулы. Средняя кинетическая
энергия поступательного движения
связана с температурой Т
формулой
. (5)
С
другой стороны
может быть определена по формуле
.
(6)
Сравнивая
(5) и (6), находим
:
.
(7)
Отсюда
.
Ответ:
υв
= 1,58 км/с;
=
1,94 км/с.
Пример
4.
Считая водяной пар массой m
=
180 г при температуре
t
= 127 oС
идеальным газом, определить: энергию,
приходящуюся на одну степень свободы
молекулы
;
среднюю кинетическую энергию
поступательного
и среднюю кинетическую энергию
вращательного движения
одной молекулы водяного пара, а также
кинетическую энергию W
всех молекул водяного пара и его
внутреннюю энергию U
.
|
Дано:
t
М Найти: |
Решение:
По закону Больцмана энергия равномерно
распределяется по степеням свободы. На
одну степень свободы приходится энергия
,
(1)
где
k
– постоянная Больцмана.
Отсюда
.
Для
идеальных одноатомных газов (атомарного
кислорода, атомарного азота, атомарного
водорода, гелия) учитываются только три
степени поступательного движения (i
= 3). Для двухатомных газов (например,
молекулярного кислорода, молекулярного
водорода) учитываются три степени
поступательного движения и две степени
вращательного движения (i
= 5).
Для газов, молекулы которых состоят из
трёх и более атомов, учитываются три
степени поступательного движения и три
степени вращательного движения молекул
(i
= 6).
Так
как молекула водяного пара является
трёхатомной, то обладает тремя степенями
свободы поступательного движения и
тремя степенями свободы вращательного
движения.
Следовательно,
средняя энергия поступательного движения
одной молекулы водяного пара
.
(2)
Произведя вычисления,
получим:
.
Средняя
кинетическая энергия вращательного
движения одной молекулы водяного пара
.
(3)
Отсюда
.
Полная
энергия одной молекулы водяного пара
равна сумме энергий поступательного и
вращательного движения:
.
(4)
Поэтому
.
Полная
кинетическая энергия всех N
молекул водяного пара выражается
соотношением:
.
(5)
Если
учесть, что число молекул N
системы равно произведению постоянной
Авогадро NA
на количество вещества ν,
то равенство (5) можно записать в виде:
. (6)
Отсюда
.
По
определению, внутренняя энергия
идеального газа равна полной кинетической
энергии всех его молекул, то есть U
= 99,7 Дж.
Ответ:
‹1›=
2,76∙10-21
Дж;
‹П›=
8,28·10-21
Дж;
‹вр›=
8,28·10-21
Дж;
W
= U
=99,7
кДж.
Пример
5.
Определить плотность смеси газов,
состоящей из
5 моль азота и 10 моль
кислорода. Смесь содержится в баллоне
при температуре t
= 17 oС
и давлении Рсм
= 0,25 МПа.
|
Дано:
ν2
t
Рсм
Найти: |
Решение:
Согласно определению плотность газовой
смеси
ρ
=
(m1
+ m2)/
V, (1)
где
m1
и m2
–
массы азота
и кислорода соответственно,
V
–
объём баллона.
Выразим
массу каждого газа через количество
вещества
и молярную массу M
m1
= ν1M1,
m2
= ν2M2.
(2)
Для
определения объёма смеси в баллоне
воспользуемся уравнением Клапейрона–Менделеева
РсмV=
(ν1
+
ν2)RT
= (m1/M1+
m2/M2)RT,
где
R
–
молярная газовая постоянная; Т
–
термодинамическая температура.
Объём смеси в
баллоне
V
=
(ν1
+
ν2)RT
/ Рсм. (3)
Подставив выражения
(2) и (3) в (1), получим

(4)
Найдем
искомую плотность:
.
Ответ:
= 3,18 кг/м3.
Пример
6.
Определить среднюю длину свободного
пробега
и среднюю частоту столкновений
молекул
воздуха при температуре
t
= 0 °С и давлении р
= 1,01 Па. Принять эффективный диаметр
молекулы воздуха равным
d
= 2,9·10-8
см.
|
Дано:
р
d
Найти: |
Решение:
Средняя
длина свободного пробега молекулы
выражается формулой
,
(1)
где
п
–
концентрация молекул (отношение числа
молекул к объёму газа, в котором они
заключены).
Найдем
неизвестную концентрацию молекул,
используя основное уравнение
молекулярно-кинетической теории и
определение средней энергии поступательного
движения молекулы газа
:
,
(2)
,
(3)
где
р
–
давление газа, k
–
постоянная Больцмана, Т
–
термодинамическая температура газа.
С учётом уравнений
(2) и (3) формула (1) примет вид
. (4)
Отсюда
искомая длина свободного пробега
молекулы
.
Средняя
частота
столкновений
молекул
газа связана с длиной
свободного пробега
соотношением
,
(5)
где
– средняя
арифметическая скорость молекул.
Её
можно определить по формуле
,
(6)
где
R
–
молярная газовая постоянная, М
– молярная масса воздуха.
Подставив (6) в (5),
находим
. (7)
Вычислим
частоту столкновений
.
Ответ:
= 1 см;
= 4,46·104
с-1.
Пример
7. Найти,
при каком градиенте плотности углекислого
газа через каждый квадратный метр
поверхности почвы продиффундирует в
атмосферу в течение t
= 1 ч газ массой
m
= 720 мг, если коэффициент диффузии D
= 0,04 см2/с.
|
Дано:
m
D
t
Найти: |
Решение:
Масса газа, переносимая в результате
диффузии, определяется законом Фика:
,
(1)
где
D
–
коэффициент диффузии; ∆ρ/∆x
–
градиент плотности, т.е. изменение
плотности, приходящееся на 1 м толщины
слоя почвы;
S
– площадь поверхности слоя; t
– длительность процесса.
Из (1) выразим
искомый градиент плотности
. (2)
Произведём
вычисления:
.
Отрицательное
значение градиента плотности соответствует
сущности процесса диффузии: зависимость
плотности от расстояния в направлении
движения диффундирующей массы выражается
убывающей функцией, градиент которой
– отрицательная величина.
Ответ:
∆ρ/∆x
= –0,05 кг/м4.
Пример
8.
Определить
количество теплоты, теряемое через
бетонные стены склада площадью S
= 50 м2
за время t
= 1 мин, если в помещении температура
стены t1
= 15 °C,
а снаружи t2
=
–10 °С. Толщина стен ∆x
= 25 см.
|
Дано:
t
t1
t2
∆x
Найти: |
Решение:
Количество теплоты, передаваемое за
счёт теплопроводности стен, выражается
законом Фурье:
,
(1)
где
λ
– теплопроводность материала стены;
∆T/∆x
–
градиент температуры, т.е. изменение
температуры, приходящееся на 1м толщины
стены; S
– площадь
поверхности стены; t
– время процесса.
Подставим
числовые значения величин в формулу
(1) и вычислим теряемое количество
теплоты:
.
Ответ:
Q
= 245 кДж.
Пример
9. При
изобарном нагревании некоторого газа
массой
m
= 0,5 кг на ∆Т
= 10 К требуется на 1,48 кДж количества
теплоты больше, чем при изохорном
нагревании. Определить для этого газа
удельные теплоёмкости при постоянном
давлении
и
при постоянном объёме
.
Какой это газ?
|
Дано:
∆Т
∆Q
Найти: |
Решение:
В
соответствии с первым началом термодинамики
при изобарном нагревании газ получает
количество теплоты QР:
QР
=∆U
+ A,
(1)
где
∆U
– изменение внутренней энергии газа,
А
–
работа, совершённая газом.
При изобарном
расширении
А
= р ∆V,
(2)
где
р
– давление газа, ∆V
– изменение объёма газа.
Используя
уравнение Клапейрона–Менделеева
,
записываем:
,
(3)
где
R
–
молярная газовая постоянная.
При
изохорном нагревании газ работу не
совершает и полученное им количество
теплоты QV
расходуется только на увеличение
внутренней энергии газа ∆U,
поэтому
QV
= ∆U.
(4)
С
учётом выражений (2), (3) и (4) уравнение
(1) примет вид
.
(5)
По
условию задачи ∆Q
= QР
– QV
,
следовательно
. (6)
Выразим
молярную массу газа М:
. (7)
Рассчитываем
.
Данную
молекулярную массу имеет молекулярный
азот N2
(двухатомный газ, у которого число
степеней свободы i
= 5).
По определению
, (8)
. (9)
Следовательно,
,
.
Ответ: М = 28∙10–3 кг/моль (азот);
;
Пример
10.
Кислород занимает объём V1
= 1 м3
и находится под давлением р1
= 200 кПа. Его нагрели сначала при постоянном
давлении до объёма V2
= 3 м3,
а затем при постоянном объёме до
давления
р2
= 500 кПа. Построить график процесса и
найти: совершённую газом работу А;
изменение ∆U
внутренней энергии и количество теплоты
Q,
переданное газу.
|
Дано:
V2
р1
р2
М
Найти: |
Рис. |
Решение:
На
рис. 2 показан график перехода газа из
состояния 1 в состояние 3 при изобарном,
а затем при изохорном нагревании. На
графике точками 1, 2, 3 обозначены состояния
газа, характеризуемые параметрами (р1,
V1,
Т1),
(р2,
V2,
Т2),
(р3,
V3,
Т3).
Изменение
внутренней энергии газа при переходе
его из состояния 1 в состояние 3 выражается
формулой
, (1)
где
i
– число степеней свободы газа (для
кислорода, молекулы которого состоят
из двух атомов, i
= 5); m
– масса газа; М
– молярная масса газа;
R
– молярная газовая постоянная.
Температуры
Т1
и Т3
можно найти из уравнения Клапейрона–Менделеева
():
и
.
(2)
Следовательно,
равенство (1) примет вид:
.
(3)
Отсюда
.
Полная
работа, совершаемая газом,
А
= А12
+ А23, (4)
где
А12
– работа газа при изобарном нагревании
из состояния 1 в состояние 2; А23
– работа газа при изохорном переходе
газа из состояния 2 в состояние 3.
При
любом процессе работа может быть найдена
графически, как площадь под кривой
конкретного процесса в координатах Р,
V.
При переходе 1-2 работа А12
равна
площади прямоугольника (заштрихованная
часть графика на рис. 2):
А
= р1∆V
= p1(V2–
V1).
(5)
В
изохорном процессе объем газа не
изменяется, поэтому работа
А23
= 0. Таким образом,
А
= А12=
p1(V2
–
V1).
(6)
В
результате вычислений получим:
А
= 2∙105∙(3–1)
Дж = 4∙105
Дж = 0,4 МДж.
Согласно
первому началу термодинамики, количество
теплоты Q,
переданное газу, расходуется на изменение
внутренней
энергии ∆U
и на совершение газом работы
А:
Q
= ∆
U
+ А. (7)
Подставляя
в (7) значения величин, получим Q
= 3,65 МДж.
Ответ:
А
= 0,4 МДж;
∆U
=
3,25 МДж;
Q
= 3,65 МДж.
Пример
11.
Воздух,
взятый при температуре t1
= 0 °C, был адиабатно сжат так, что его
объём уменьшился в три раза. Определить
температуру t2
воздуха
после сжатия.
|
Дано:
Найти: |
Решение:
Зависимость между температурой и объёмом
при адиабатном сжатии выражается
уравнением Пуассона:
,
(1)
где
T1,V1
– термодинамическая температура и
объём до сжатия воздуха; T2,
V2
– те же величины после сжатия воздуха;
– коэффициент Пуассона.
По определению
,(2)
где
сP
и
сV
– удельные теплоёмкости газа при
постоянном давлении и объёме соответственно.
Из
теории теплоёмкостей газов известно,
что
(3)
и
. (4)
Подставив
(3) и (4) в (2), получим
=
(i
+ 2)/i, (5)
где
i
– число степеней свободы молекулы газа.
Сухой
воздух состоит в основном из молекулярных
кислорода (О2)
и азота (N2),
для которых i
= 5.
Следовательно,
=
(5 + 2)/5 = l,4.
Из формулы (1)
получим

Вычислим
температуру конечного состояния:
Т2
=
273∙31,4–1
К = 273∙30,4
К.
Прологарифмируем
обе части равенства (5):
lnT2
= ln273
+ 0,4∙ln3
= 5,61 + 0,4∙1,1 = 10,01.
Отсюда
T2
= 424 К или t2
= (Т2
– 273) С
= 151 С.
Ответ:
t2
=
151 С.
Пример
12.
Кислород массой m
= 0,45 г имеет в начальном состоянии объём
V1
= 2 л и температуру t1
= 10 C,
а в конечном – объём
V2
= 10 л и температуру t2
= 50 C.
Найти изменение энтропии ∆S
кислорода
при переходе из первого состояния во
второе.
|
Дано:
t1
t2
V1
V2
Найти: |
Решение:
Изменение энтропии
(приведённое количество теплоты)
определяется формулой
,
(1)
где
δQ
– элементарное количество теплоты,
сообщённое газу при данной температуре;
Т
– термодинамическая температура.
В
соответствии с первым началом термодинамики
для идеального газа элементарное
количество теплоты
δQ
=dU
+ δA,
(2)
где
dU
–
изменение внутренней энергии газа; δA
– элементарная работа газа.
Для идеального
газа
,
(3)
где
m
– масса газа; М
– молярная масса газа; R
– молярная газовая постоянная; i
– число степеней свободы (кислород –
двухатомный газ,
i
= 5).
Элементарная
работа расширения газа рассчитывается
по формуле
δA
= p
dV,
(4)
где
p
–
давление газа; dV
– элементарное изменение объёма газа.
Давление
p
можно найти из уравнения Клапейрона–Менделеева:
.
(5)
Подставив
(3), (4), (5) в (2), определяем количество
теплоты δQ,
полученное газом при переходе из
состояния 1 в состояние 2:
.
(6)
В
результате интегрирования изменение
энтропии

(7)
После
вычисления найдём
.
Ответ:
∆S
=
0,19 кДж/К.
Пример
13. Идеальный
двухатомный газ, содержащий 1 кмоль
количества вещества, совершает замкнутый
цикл, график которого приведён на рис.
3. Определить работу А,
совершаемую газом за цикл; термический
кпд
цикла
η;
количество теплоты Q2,
переданное холодильнику, если в процессах
1-2 и 2-3 газ получает количество теплоты
Q1
= 7,6 кДж.
|
Дано:
Q1
Найти: |
Р |
Решение:
Цикл
состоит из двух изохор (процессы 1-2, 3-4)
и двух изобар (процессы 2-3, 4-1). Общая
работа за цикл равна сумме работ,
совершаемых в каждом процессе цикла:
А
= А12
+ A23
+ А34
+ А41. (1)
При
изохорных процессах изменение объёма
газа ∆V
=
0, следовательно, работы
А12
= А34
= 0. (2)
При
изобарных процессах 2-3, 4-1 работы А23
и
А41
можно найти по формулам:
A23
= p2
∆V23
= p2(V3
– V2),
(3)
A41
= p1
∆V41
= p1(V1
– V4).
(4)
Числовые
значения давлений и объёмов определяем
из графика:
p1
=
12 кПа;
p2
=
16 кПа; V1
= V2
=
2 м3;
V3
= V4
= 3 м3.
Рассчитаем
работы A23
и
A41:
A23
= 16∙103
(3
– 2) Дж = 16 кДж, A41
= 12∙103
(2
– 3) Дж = –12 кДж.
Таким образом,
работа за цикл
А
=
( А23
–
А41)
= 4 кДж.
На
графике в координатах
р,
V
работа за цикл изображена заштрихованной
площадью.
По
определению термический коэффициент
полезного действия η
, (5)
где
Q1
– количество теплоты, переданное
нагревателю, Q2
– количество теплоты, переданное
холодильнику.
Подставляя
числовые значения, получим:
.
Количество
теплоты Q2,
переданное холодильнику, найдём из
формулы (5):
Q2
= (1– η)∙Q1,
(6)
отсюда
Q2
=
(1– 0,53)∙7,6∙103
Дж = 3,6∙103
Дж = 3,6 кДж.
Ответ:
А
=
4 кДж; η
= 53%; Q2
=
3,6 кДж.
Пример
14. На
какую высоту может подняться вода в
капиллярном канале диаметром d
= 0,08 мм в стебле ржи? Смачивание считать
полным.
|
Дано:
=
= Найти: |
Р |
Решение:
По условию задачи вода полностью
смачивает стебель. Со стороны стебля
на каждый бесконечно малый элемент
длины линии соприкосновения воды со
стеблем действует сила, направленная
вверх (рис. 4). Результирующая всех сил,
действующих на линию соприкосновения,
также направлена вверх и определяется
по формуле
F
= 2πr,
(1)
где
r
– радиус капилляра,
– коэффициент поверхностного натяжения
воды.
Сила
F
вызывает подъём воды в капилляре до тех
пор, пока не будет уравновешена силой
тяжести, действующей на весь поднятый
столб воды. Условием равновесия является
равенство
F
= mg.
(2)
Масса
поднятого столба воды
m
= V
= πr2h, (3)
где
–
плотность воды,
V
– объём поднятого слоя.
С
учётом (1) и (3) формула (2) примет вид:
2πr
= πr2hg.
(4)
Отсюда
.
(5)
Рассчитываем
высоту поднятия воды в стебле ржи:
.
Ответ:
h
= 36,5 см.
Соседние файлы в папке Физика_Шилова
- #
- #
- #
- #
- #
- #
- #
- #
- #
Содержание
- Что это за параметр?
- Формула и правила расчета
- Условия процесса парообразования
- Факторы, которые влияют
- Род жидкости
- Температура
- Площадь свободной поверхности
- Наличие ветра
- Атмосферное давление
- От чего скорость увеличится или уменьшится?
- Примеры, где применяют знания в быту
- Для сушки белья
- Для сбивания температуры
- В процессе приготовления пищи
- При уборке
- Промышленное использование
- Видео по теме статьи
- Заключение
Что это за параметр?
Скорость испарения – это количество образующегося пара за 1 секунду. Параметр зависит от физических свойств жидкости и внешних факторов – температуры, площади испарения и др. В единой системе СИ скорость испарения измеряется в г/(м2·с).
Формула и правила расчета

- u – скорость перехода жидкости в газ;
- m – количество испарившейся жидкости;
- S – испаряющая площадь;
- t – время.
Численно скорость определяется как отношение количества жидкости, превратившейся в пар, к площади испарения, умноженной на время, которое необходимо для завершения процесса.
Условия процесса парообразования
На скорость образования пара влияют:
- Вид раствора – чем более тяжелая жидкость, тем медленнее происходит парообразование.
- Температура – с увеличиением парообразование усиливается, с понижением — ослабевает.
- Размер зеркала жидкости – чем площадь больше, тем интенсивнее испарение.
- Движение воздуха (ветер).
Молекулы в растворах обладают разной энергией – есть более быстрые, которым хватит энергии выйти за пределы раствора, образуя пар. Количество таких молекул определяет скорость испарения.
При одинаковых условиях для различных типов жидкостей скорость улетучивания зависит от свойств вещества. Например, органические эфиры улетучиваются намного быстрее воды.
Факторы, которые влияют
Переход между фазами жидкость-газ происходит тем быстрее, чем больше в жидкости присутствует молекул с повышенной кинетической энергией.
Род жидкости
Скорость перехода из жидкости в пар зависит от свойств вещества: чем меньше плотность вещества, тем меньшая энергия требуется молекуле для выхода за границу жидкости и быстрее происходит процесс испарения.
Если в одну емкость налить воду, а в другую такую же – эфир, можно увидеть разницу в скорости испарения. Количество эфира в емкости будет уменьшаться на глазах, а чтобы заметить изменение объема воды потребуется время.
Жидкости со слабыми связями между молекулами называют летучими, настолько быстро они испаряются. К ним относят эфиры, кетоны, спирты, фенолы, растворители, бензин и др.
Имеющие в сравнении с водой больший удельный вес кислоты, щелочи, молоко, масла, мед улетучиваются значительно медленнее. Это связано с увлечением плотности, как результат – ближе расположенные друг к другу молекулы сильнее притягиваются и труднее отрываются.
Самой тяжелой жидкостью является ртуть – единственный металл, являющийся жидкостью при комнатной температуре. Скорость испарения ртути незначительна – чтобы небольшая горошина вещества, массой в 1 г, превратилась в пар, потребуется 3 года.
Температура
Наибольшая скорость испарения – перед кипением, наименьшая – перед замерзанием. Если воду комнатной температуры налить в одну емкость, а в другую такую же – очень горячую, то над горячей можно увидеть пар. Это быстрые молекулы жидкости улетучиваются в воздух.
С ростом температуры количество быстрых молекул жидкости увеличивается, и число переходов в воздух возрастает. Со снижением температуры скорость молекул снижается и уменьшается количество переходов.
По достижении точки замерзания жидкость переходит в твердое состояние, имеющее кристаллическую решетку. В нем испарения из-за прочных связей молекул не происходит.
Площадь свободной поверхности
Скорость испарения зависимость от площади – чем больше зеркало, тем быстрее она улетучивается. Если в широкий и узкий сосуд налить воду, то уровень жидкости в широком будет понижаться быстрее.
Испарение – это улетучивание молекул из жидкого состояния. С ростом площади перехода увеличивается число молекул, способных покинуть жидкость. Пример: из тарелки вода испаряется быстрее, чем из стакана – разная площадь поверхности.
Наличие ветра
Движение воздуха над жидкостью ускоряет переход молекул в воздух и не позволяет беспорядочно двигающимся частицам пара вернуться в жидкость.
Движение воздушных потоков помогает быстрым молекулам покинуть жидкость и не дает вернуться обратно. Так быстро освобождается доступ к поверхности для следующих молекул, способных перейти в воздух.
Если ветер имеет более высокую температуру, чем обдуваемая им жидкость, то процесс парообразования протекает еще быстрее.
Пример: мокрые волосы высушиваются горячим воздухом из фена в считанные минуты. Если обдувать холодным воздухом – будет медленнее. Без обдува сушка волос затянется на час.
Атмосферное давление
Воздух атмосферы давит на зеркало жидкости. Чем меньше такое давление, тем больше молекул отрываются от поверхности и выше скорость испарения. В сравнении с поверхностью земли, в высокогорной местности, где давление меньше, процесс идет быстрее
От чего скорость увеличится или уменьшится?
Жидкость будет испаряться быстрее:
- с увеличением зеркала жидкости;
- с повышением температуры воды;
- с ростом температуры окружающего воздуха;
- при обдувании ветром;
- от обдувания горячим воздухом.
Действия, приводящие к уменьшению количества быстрых молекул, снижают интенсивность испарения.
Факторы, снижающие скорость испарения:
- уменьшение площади жидкости;
- охлаждение раствора (уменьшение температуры);
- понижение температуры окружающей среды;
- отсутствие ветра над водой.
При равных условиях, статическое испарение всегда меньше динамического.
Примеры, где применяют знания в быту
Человек сталкивается с жидкостями постоянно и использует процесс испарения в самых разных сферах.
Для сушки белья

Процесс испарения влаги с поверхности расправленного белья ускоряют воздействие температуры (солнце) и горячего ветра.
К тому же у расправленного белья больше площадь испарения.
Для сбивания температуры
Бабушкин метод сбивать температуру маленьким детям и взрослым, если нежелательно пить лекарства. Влажную холодную салфетку кладут на лоб, держат до ее согревания и меняют на холодную.
Так как процесс испарения идет с потреблением энергии, температура тела понижается. Можно обтирать больного водой с уксусом или водкой – у этих веществ скорость испарения выше, и охлаждающий эффект будет больше.
В процессе приготовления пищи
Чтобы остудить горячий суп его достаточно налить в тарелку – испаряясь, вода отбирает некоторое количество теплоты у основной массы и еда охлаждается.
Чтобы получить густой соус блюдо подогревают на слабом огне, что позволяет выпарить излишнюю воду. При приготовлении грибов и овощей – жарят на среднем огне, выпаривая избыток воды. При варке варенья – варят до загустения, выпаривая излишки влаги.
При уборке
Появившуюся лужу вытирают и увеличивают влажную площадь – так быстрее остатки жидкости улетучатся. В зимнее время года в помещениях воздух пересушен системами обогрева. Его увлажняют, поставив в удобном месте емкость с водой.
Если нужно медленное испарение – используют неширокую и глубокую емкость, для быстрого увлажнения следует поставить несколько широких плоских мисок, увеличив этим площадь испарения.
Промышленное использование
Процесс применяют:
- В оборотных системах водоснабжения.
- Для высушивания деталей и материалов.
- Для очищения изделий.
- При разделении сложных многокомпонентных жидких составов.
- В процессе кондиционирования помещений.
- Для создания системы охлаждения ядерных реакторов и др.
Видео по теме статьи
Факторы, влияющие на скорость испарения жидкости, рассмотрены в видео:
Заключение
На скорость испарения жидких соединений влияют природа вещества и воздействия внешних факторов.
Выводы:
- Переход в воздух быстрых молекул жидкости осуществляется при любом температурном режиме. Энергию для перехода молекулы получают при столкновении друг с другом.
- Чем больше площадь испарения, тем выше скорость образования пара.
- С ростом температуры увеличивается скорость испарения.
- Испарение под действием потока воздуха проходит быстрее.
- При испарении жидкости из окружающей среды поглощается энергия.




 ис.
ис.
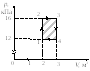 ис.
ис. ис.
ис.



