Radioactive decay is the release of alpha, beta, and gamma particles from unbalanced atoms known as radionuclides. Some substances, like uranium, have no stable forms and are therefore always radioactive. Radioactive substances are referred to as radionuclides. Rate of Decay is calculated to tell the exact amount of radioactive material that is being radiated. In this article, we will learn about the rate of decay formula and its examples in detail.
Half-Life of Radioactive Substances
A radionuclide decays into a different atom known as a decay product. Until the atoms achieve a stable state and stop being radioactive, they continue to change into new decay products. Most radionuclides only undergo one decay before stabilizing. Series radionuclides are those that decay in more than one step. The decay chain is the collection of decay products produced to achieve this equilibrium.
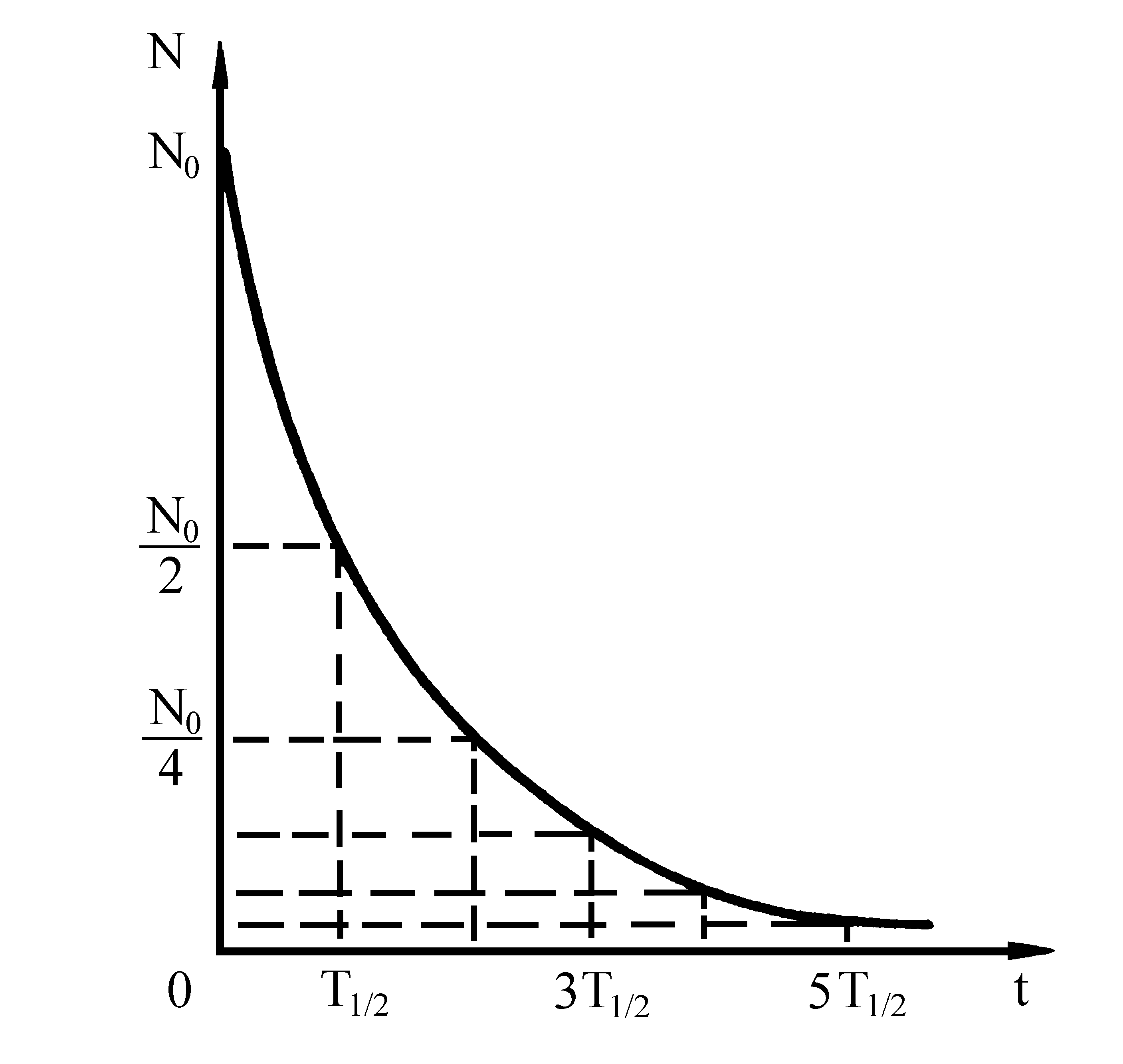
Each radionuclide has a unique decay rate that is measured by its “half-life.” The amount of time it takes for half of the radioactive atoms present to decay is known as the radioactive half-life. Others have half-lives of hundreds, millions, or billions of years. Some radionuclides have half-lives of just a few seconds.
The time it takes for the activity of a specific quantity of a radioactive substance to decay to half of its initial value is known as the half-life (t1/2).
t1/2 = ln(2) / λ = τ ln(2)
where,
t1/2 is the half-life of a radioactive substance.
λ is the mean lifetime of a radioactive substance.
τ is the average lifetime of a radioactive substance before decay.
Rate of Decay Formula
The breakdown of radioactive particles into new types of particles from the parent radionuclide is known as radioactive decay. There are three types of radioactive decay, alpha, beta, and gamma decay, and the half-lives of each type of decay have different values depending on the type of ionization. Due to the emission of many particle kinds, the decay rate differs for each type of decay.
It’s been observed that radioactive disintegration only happens when the nucleus is unstable. Alpha, beta, and gamma radiations are released by the unstable nucleus along with other ionizing particles and radiations as it loses energy. A radioactive element is one that has a nucleus that is unstable. Usually, the radioactive substance splits into two parts.
The term “Parent nuclide” denotes to one component of a radioactive element. The other component disintegrates into a “Daughter nuclide,” a modified atom that differs from the parent radionuclide as a result of the bombardment. The decay product is another name for the daughter nuclide. This is due to the fact that the parent nuclide’s atoms continue to decay and transform into new decay products. The decay product stops decaying when it reaches a stable state where its radioactivity disappears.
A first-order decay process determines the rate of radioactive particle decay. This indicates that it exhibits an exponential decline pattern, which is simple to calculate.
Nt = N0 e-λt
where,
Nt is the amount of radioactive particles at time (t)
N0 is the amount of radioactive particles at time (0)
λ is the rate of decay constant
t is time
Since this decay rate is exponential, taking the natural log on both sides of the equation will result in:
ln (Nt /N0) = -λt
Read, More
- Radioactivity
- Types of Radioactivity
- Radioactive Isotopes
Solved Examples on Rate of Decay Formula
Example 1: If U-238 has a half-life of 4.468 × 109 years, determine its rate of decay constant.
Solution:
The problem refers to half life of U-238, Half of the original sample has already decayed. Hence the ratio N0/Nt = 0.5.
ln (Nt /N0) = -λt
ln 0.5 = -λ × 4.468 × 109
λ = 1.55 x 10-10 years-1
Rate of decay constant (λ) is 8.38 x 10-11 years-1
Example 2: If U-238 has a 35% life of 5.142 × 109 years, determine its rate of decay constant.
Solution:
35% half life of U-238 has already decayed, Hence the ratio N0/Nt = 0.65 as 65 percent of original sample remains.
ln (Nt /N0) = -λt
ln 0.65 = -λ × 5.142 × 109
λ = 0.838 x 10-10 years-1
Rate of decay constant (λ) is 8.38 x 10-11 years-1
Example 3: Determine the amount of time it will take for 25% of a sample of U-238 to radioactively decay with a decay constant of 1.55 x 10-10 years-1.
Solution:
Since 75% of the original sample is still present, the ratio Nt/N0 = 0.75. Where 25% of the sample has undergone radioactive decay.
Rate of decay constant (λ) = 1.55 × 10-10 years-1
ln (Nt /N0) = -λt
ln 0.75 = -1.55 × 10-10 years-1 × t
t = 1.86 x 109 years
The amount of time for 25% radioactive U-238 decay is 1.86 x 109 years
Example 4: Determine the amount of time it will take for 45% of a sample of U-238 to radioactively decay with a decay constant of 1.55 x 10-10 years-1.
Solution:
Since 55% of the original sample is still present, the ratio Nt/N0 = 0.75. Where 45% of the sample has undergone radioactive decay.
Rate of decay constant (λ) = 1.55 × 10-10 years-1
ln (Nt /N0) = -λt
ln 0.55 = -1.55 × 10-10 years-1 × t
t = 3.86 x 109 years
The amount of time for 45% radioactive U-238 decay is 3.86 x 109 years
Example 5: The half-life of PD-100 is 3.6 days. How many atoms will remain after 20.0 days, if one has 6.02 x 1023 at the beginning?
Solution:
Time = 20 days
Half-life = 3.6 days
Initial atoms = 6.02 ×1023 atoms
Formula used to determine number of atoms after 20 days.
N = N0 × 1/2 × t/t1/2
N = 6.02 ×1023 × 1/2 × 20/3.6
= 1.28 × 1022
The number of atoms present is 1.28 × 1022
FAQs on Rate of Decay
Question 1: What is radioactive decay?
Answer:
The radioactive atom (radionuclide) changes into another nuclide as the nucleus releases radiation or breaks down. It is known as radioactive decay.
Question 2: What are the different types of radioactive decay?
Answer:
Alpha, beta, and gamma decay are the three main types of radioactive decay. The number of protons in an atom’s nucleus can change by alpha and beta decay, which transforms the atom into a different element. The atom does not convert into a different element due to gamma decay because it does not alter the proton number.
Question 3: What are examples of radioactive decay?
Answer:
Alpha decay, proton emission, double proton emission, beta decay, gamma decay, electron capture, and neutron emission are common examples of radioactive decay.
Question 4: What is the importance of radioactive decay?
Answer:
Radioactive decay is useful for many aspects of human life, including health, the creation of electricity, and astronomy, etc.
Question 5: What are the effects of radioactive decay on humans?
Answer:
The energy released into the environment as radioactive material decays or breaks down can injure a body in two different ways. It has the potential to directly destroy cells or to alter DNA. The cell may develop cancer if certain mutations are not fixed.
Question 6: What is the importance of radioactive half-life?
Answer:
Because long-lived radionuclides persist longer after release than shorter-lived species, the radiological half-life is essential for radiation control. Radionuclides with longer half-lives will remain in the environment longer than those with shorter half-lives.
Last Updated :
17 Apr, 2023
Like Article
Save Article
Скорость радиоактивного распада — число распадов в единицу времени
В общем виде скорость радиоактивного распада записывается, как :
Для того, чтоб нам стало более понятно, продифференцируем выражение для зависимости числа атомов от времени и получим:
И тогда у нас получается, что скорость радиоактивного распада
Таким образом, зависимость от времени числа не распавшихся радиоактивных атомов и скорости распада описывается одной и той же постоянной
Таблица некоторых значений постоянных распада:
В Формуле мы использовали :
— Скорость распада
— Период полураспада
— Время распада
— Начальное число радиоактивных ядре при t=0
— Постоянная распада, которая характеризует вероятность радиоактивного распада за единицу времени
— Скорость распада в начальный момент времени t = 0
Активность и
единицы ее измерения.
Закон
радиоактивного распада
для любых превращений ядер устанавливает,
что за единицу времени распадается
всегда одна и та же доля нераспавшихся
ядер данного радионуклида. Эту долю
называют постоянной
распада
и обозначают l.
В общем виде этот закон выражается
экспоненциальной зависимостью:
,
(2.1)
где
N – число ядер, распавшихся за время t;
N0
– начальное число ядер радионуклида;
е = 2,718; l
– постоянная распада и соответствующий
ей период полураспада зависят только
от устойчивости ядер.
Этот закон,
выражающий уменьшение количества ядер
атомов радиоактивного вещества во
времени, называется законом радиоактивного
распада (рис. 4).
Для любого момента времени
,
(2.2)
,
(2.3)
где N1 и N2
– число ядер материнского и дочернего
радионуклидов; N0 –
число ядер материнского радионуклида
в начальный момент времени; l1
и l2 – постоянные
распада материнского и дочернего
радионуклидов.
Для
характеристики устойчивости ядер
радиоактивного вещества относительно
распада используется понятие период
полураспада,
т.е.–
промежуток времени, в течение которого
в результате радиоактивного распада
количество ядер данного радиоактивного
вещества уменьшается в два раза.
.
(2.4)
Рис. 4. График радиоактивного распада:
N0
– исходное количество радиоактивного
вещества; Т1/2
– период
полураспада вещества
Величина,
обратная постоянной распада, называется
средним
временем жизни
t
радиоактивного ядра:
.
(2.5)
Период полураспада
для различных радионуклидов имеет
протяженность от долей секунды до
миллиардов лет. Соответственно и
радиоактивные вещества разделяют на
короткоживущие (часы, дни) и долгоживущие
(многие годы).
Например:
Po
имеет Т1/2
= 1,6´10-4с;
U
имеет Т1/2
= 4,47´1010
лет.
Период
полураспада – одна из основных
характеристик радиоактивных веществ,
которую учитывают при их практическом
применении. Так при гамма-терапии
предпочтение отдают радиоактивным
веществам с большим периодом полураспада,
например
Cs
(Т1/2 = 30 лет),
Co
(Т1/2 = 5,25
года). При введении радиоактивных веществ
в организм с диагностической целью
стремятся свести к минимуму дозу
облучения органов и тканей, поэтому
используют радиоактивные вещества,
период полураспада которых невелик,
например
Na
(Т1/2
=
14,9 ч),
I
(Т1/2
=
2,3 ч).
Активность и единицы измерения
Активность
есть мера интенсивности распада
радионуклида и определяется как
количество распадов ядер атомов
радиоактивного вещества в единицу
времени, т.е. как скорость распада ядер.
Если
радиоактивное вещество содержит N атомов
и его постоянная распада, выражающая
долю распадающихся атомов в единицу
времени, l,
то активность будет равна
Аn.
(2.6)
Известно,
что постоянная радиоактивного распада
и период полураспада Т1/2
связаны соотношением
.
(2.7)
Моль
вещества содержит 6,02´1023
атомов. В массе m вещества с массовым
числом А число атомов
.
(2.8)
Тогда активность
источника выражается формулой
Аn
,
(2.9)
где
Аn
– активность радионуклида, Бк; m
– масса радионуклида, г; А – массовое
число радионуклида; Т – период полураспада
радионуклида, с.
Активность
источника,
в котором содержатся радиоактивные
ядра одного вида, уменьшается во времени
по экспоненциальному закону:
Аn
= А0,
(2.10)
где
А0
– активность источника в начальный
момент времени (t = 0); t – текущее время,
которому соответствует активность
вещества An.
Чем меньше период
полураспада, тем большая доля ядер
атомов радионуклида распадается в
единицу времени.
Число
распадов в единицу времени в данном
количестве радиоактивного вещества
выражает активность
вещества. Поэтому количество радиоактивного
вещества удобнее выражать не в весовых
единицах, а в единицах активности.
Единицей измерения активности в
Международной системе единиц (СИ)
является Беккерель
(Бк).
Беккерель равен активности нуклида в
радиоактивном
источнике, в котором за время 1 с происходит
1 распад, т.е. 1 Бк = 1 расп./с.
В практике большое
применение получила внесистемная
единица измерения активности –
Кюри (Ки).
Кюри равен активности нуклида в
радиоактивном источнике, в котором за
время 1 с происходит 3,7´1010
распадов, т.е. 1 Ки = 3,7´1010
Бк, такой активностью обладает 1 г радия
и радиоактивность 1 г Rа
была принята за единицу измерения Кюри.
1
Бк =
1 расп./с = 2,703´10-11
Ки.
Вес радионуклида
активностью 1 Ки тем больше, чем медленнее
распадается вещество, т.е. чем больше
период его полураспада. Так для
Nа
(Т1/2
= 15 ч) масса = 0,1 г; для
Рu
(Т1/2
= 24,4 тыс. лет) масса = 16 г; для
U
(Т1/2 =
4,5 млрд. лет) масса = 3 т.
Для характеристики
загрязненности продуктов питания, воды,
строительных материалов, почвы и т.д.
используется: удельная активность Аm
= Аn/m,
объемная активность Аv
= Аn/V
и поверхностная активность Аs
= Аn/S,
где m
и V соответственно масса и объем препарата
пробы с активностью Аn,
а S – площадь загрязненной поверхности.
Удельная активность
Аm
измеряется в единицах СИ в Бк/кг, объемная
активность Аv
– в Бк/м3,
поверхностная активность в Бк/м2.
На практике также используются
внесистемные единицы активности (табл.
1).
Выбор единиц этих величин определяется
конкретной задачей.
Например, допустимую
концентрацию радионуклидов в воде
(объемную активность) удобнее выражать
Бк/л, а в воздухе в Бк/м3.
Если плотность пробы
r
= 1 кг/л например воды, измеренные значения
объемной активности Аv,
Бк/л численно совпадают с удельной
активностью Аm,
Бк/кг. Если плотность пробы отличается
от 1кг/л, удельную активность пробы можно
найти по формуле
Аm
= Аv/r.
(2.11)
Таблица
1. Единицы
измерения радиоактивности
|
Величина |
Название и |
Соотношение единицами |
|||
|
единица СИ |
внесистемная |
||||
|
Активность |
А |
Бк |
А |
Ки |
1 Бк = 1расп./с =
=
1 |
|
Удельная Активность |
Аm |
Бк/кг |
Ауд |
Ки/кг |
1
1 |
|
Объемная Активность |
Аv |
Бк/м3 |
Аоб |
Ки/л |
1
1 |
|
Поверхностная |
Аs |
Бк/м2 |
Апов |
Ки/км2 |
1
=
1
= |
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
|
При всем разнообразии реакций самопроизвольного (спонтанного) распада ядер в этом процессе наблюдается общая закономерность, которую можно описать математически. Интересно, что зависимость количества распавшихся ядер от времени задается одной и той же функцией для различных ядер, участвующих в распаде. Перейдем к количественному описанию процессов радиоактивного распада. |
Большинство изотопов любого химического элемента превращается в более устойчивые изотопы путем радиоактивного распада. Каждый радиоактивный элемент распадается со своей, присущей только ему «скоростью». При этом для каждого радиоактивного ядра существует характерное время, называемое периодом полураспада , спустя которое в исходном состоянии остается половина имевшихся ядер. Таким образом, периодом полураспада
называется промежуток времени, за который распадается половина начального количества
радиоактивных ядер. Другая половина ядер превращается в более устойчивые изотопы посредством распада.
Отметим, что период полураспада не зависит от того, в каком состоянии находится вещество: твердом, жидком или газообразном. Кроме того, период полураспада радиоактивного вещества не зависит от его количества, от времени, места и условий, в которых оно находится. Поэтому количество радиоактивных ядер «тогда» и «сейчас»
непосредственно определяет промежуток времени
, прошедший с момента уменьшения числа ядер от
до
.
Невозможно точно предсказать, когда произойдет распад данного ядра. Однако можно оценить среднее число ядер, которые распадутся за данный промежуток времени. Таким образом, закон радиоактивного распада является статистическим и он справедлив только при достаточно большом количестве радиоактивных ядер.
Для записи закона радиоактивного распада будем считать, что в начальный момент времени () число радиоактивных ядер
. Через промежуток времени, равный периоду полураспада, это число будет
, еще через такой же промежуток времени —
(рис. 218). Спустя промежуток времени, равный n периодам полураспада
, радиоактивных ядер останется:
|
|
(1) |
Это соотношение выражает закон радиоактивного распада, который можно сформулировать следующим образом:
число нераспавшихся радиоактивных ядер убывает с течением времени по закону, представленному соотношением (1).
Закон радиоактивного распада позволяет найти число нераспавшихся ядер в любой момент времени. Полученное выражение хорошо описывает распад радиоактивных ядер, если их количество достаточно велико.
Приведем экспериментальные результаты, которые показывают, что при малом количестве радиоактивных ядер это выражение неприменимо. На рисунке 219 изображен график распада 47 ядер изотопа фермия , период полураспада которого
. Из рисунка 219 видно, что пока ядер было достаточно много — от 47 до 12, то показательная функция хорошо описывала закон распада. Однако при меньшем числе ядер истинная зависимость существенно отличается от показательной функции.
Периоды полураспада некоторых радиоактивных изотопов веществ приведены в таблице 11.
| Таблица 11. Периоды полураспада радиоактивных изотопов веществ | |
| Вещество | Период полураспада |
| 30,17 лет | |
| 5,3 года | |
| 8,04 суток | |
| 24 390 лет | |
| 1600 лет | |
| 3,8 суток | |
| 700 млн лет | |
| 4,5 млрд лет |
|
Впервые процесс радиоактивного распада для измерения промежутков времени был использован в 1904 г. Резерфордом. По отношению концентрации урана и его дочернего продукта распада (гелия) он определил возраст урановой породы. Эта работа положила начало ядерной геохронологии — определению возраста различных минералов Земли по радиоактивным долгоживущим веществам. В дальнейшем исследование процессов ядерного синтеза позволило перейти к ядерной космохронологии, т.е. к определению продолжительных промежутков времени, прошедших с момента образования элементов в масштабах Галактики и Вселенной. В основу ядерной космохронологии положена неизменность «скорости» радиоактивного распада. В 1927 г. американский ученый Г. Блюмгарт, используя изотоп В 1934 г. венгерский ученый Дьердь фон Хевеши, используя дейтерий, впервые установил, что в организме человека вода полностью обновляется в течение 14 суток. В 1943 г. Дьердь фон Хевеши была присуждена Нобелевская премия по химии «за работу по использованию изотопов в качестве меченых атомов при изучении химических процессов». |
 |