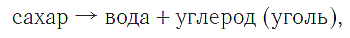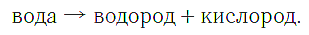Как определять простые и сложные вещества
Задания на классификацию простых и сложных веществ имеют место быть не только в курсе химии, но и в школьной программе по природоведению. Помимо этого, такие вопросы иногда могут задавать дети даже младшего школьного возраста, которым приходится давать доступный для их восприятия ответ.
Инструкция
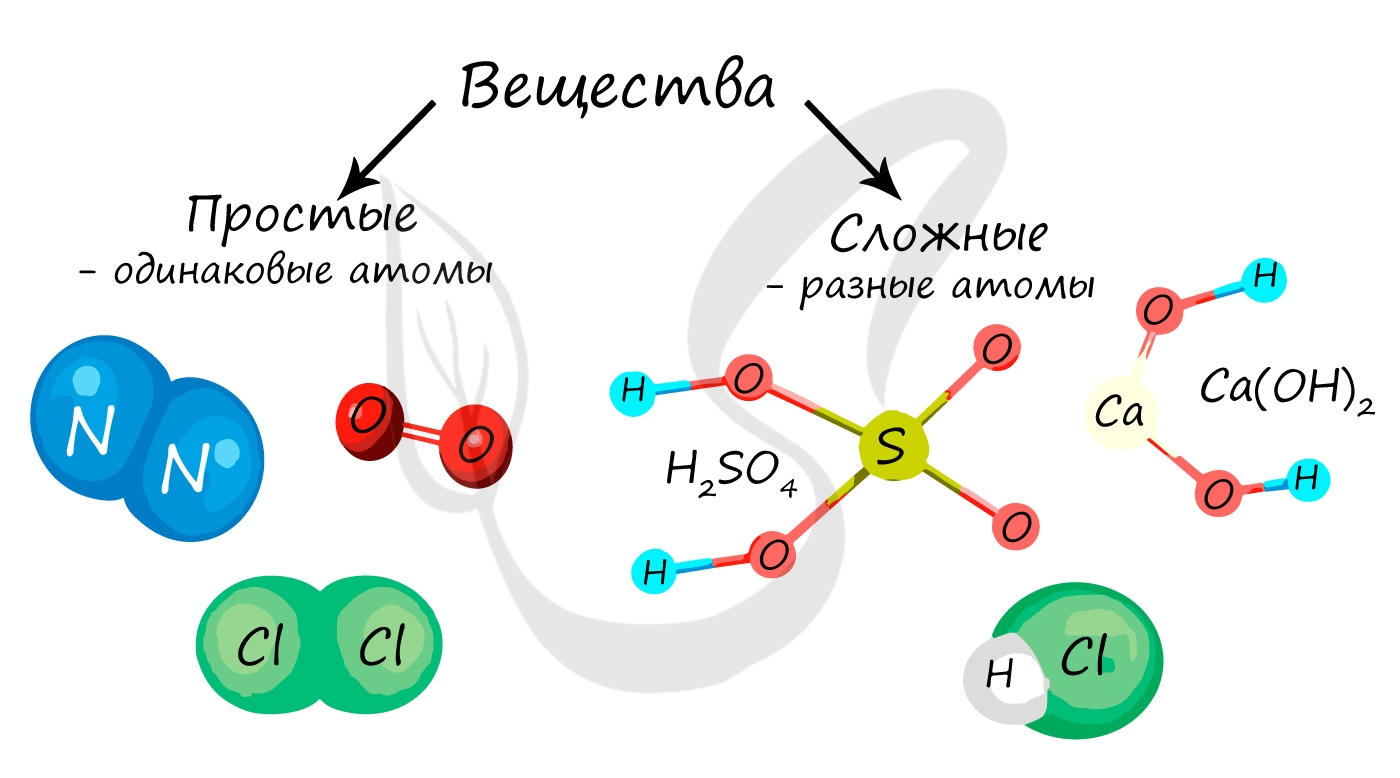
Вещество – это то, из чего состоит физическое тело. То есть, например, мел состоит из известняка, золотое кольцо имеет в составе золото, а гвоздь сделан из металла – железа. Все вещества разделяются на сложные и простые, которые достаточно легко классифицировать по химической формуле.
Каждое соединение имеет собственную формулу, которая состоит из химических символов и индексов. Индексы показывают число атомов данного элемента, входящего в состав простого или сложного соединения. Некоторые вещества состоят из одного вида атомов и не имеют индексов, например натрий Na, сера S, кремний Si. Другие вещества – напротив, состоят из нескольких разных элементов, причем их число, определяемое с помощью индексов, может быть различным. Например, карбонат кальция CaСO3, нитрат меди Cu(NO3)2, сульфат алюминия Al2(SO4)3.
Чтобы распознать, какое вещество – простое или сложное, необходимо проанализировать его химическую формулу. Если она состоит только из одного вида атомов какого-либо химического элемента, то это вещество простое. Количество атомов может быть различным. Например, вещества, состоящие из одного вида химического элемента и имеющие один атом (индексы отсутствуют) – это литий Li, натрий Na, кальций Ca, железо Fe, марганец Mn. К соединениям, имеющим в своем составе один вид химического элемента, но несколько его атомов (справа стоит индекс, показывающий это число), можно отнести азот N2, кислород O2, озон O3, водород H2, хлор Cl2.
Сложными называются вещества, которые состоят из нескольких видов химических элементов. Причем у некоторых соединений нет индексов, например у таких как, бромоводородная кислота HBr, хлорид натрия (поваренная соль) NaCl, оксид бария BaO. У других сложных соединений имеются разные индексы. К ним можно отнести: азотную кислоту HNO3, гидроксид меди Cu(OН)2, ортофосфат калия K3PO4 и подавляющее большинство веществ в природе.
Видео по теме
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
В уроке 4 «Сложные вещества» из курса «Химия для чайников» дадим определение химическим соединениям, рассмотрим различия органических и неорганических соединений, а также выясним, что означает качественный и количественный состав. Напоминаю, что в прошлом уроке «Молекулы и простые вещества» мы рассмотрели, что такое молекулы, простые вещества, а также металлы и неметаллы.
Химические элементы существуют не только в виде свободных атомов и простых веществ. Они также могут входить в состав самых различных химических соединений.
Вещества, состоящие из атомов разных химических элементов, называются сложными веществами или химическими соединениями.
Содержание
- Органические и неорганические вещества
- Органические вещества
- Неорганические вещества
- Качественный и количественный состав веществ
- Отличия между сложными веществами и смесями веществ
Органические и неорганические вещества
Подавляющее большинство химических веществ — это сложные вещества. Вы уже знаете некоторые из них. Вода, метан, сахар, поваренная соль — сложные вещества. Сложные вещества делятся на две группы — неорганические и органические.
Органические вещества
Все органические вещества объединяет главный признак: в их состав обязательно входят атомы углерода. Кроме углерода, в состав органических веществ чаще всего входят атомы водорода, кислорода, а также азота, фосфора, серы. Почти все органические вещества горючи и легко разлагаются при нагревании. Практически все они имеют молекулярное строение (рис. 41).
Простейшим органическим веществом является природный газ метан. Но вам, наверное, знакомы и такие органические вещества, как сахар (сахароза), уксусная и лимонная кислоты, спирт, крахмал, белки, жиры, пластмассы и т. д. Органических веществ миллионы. Они содержатся во всех животных и растительных организмах (откуда и произошло их название), входят в состав пищи, топлива, лекарств, красителей, самых разнообразных материалов.
Неорганические вещества
Неорганические вещества являются соединениями всех остальных элементов. К неорганическим традиционно относят также несколько веществ, содержащих углерод: углекислый и угарный газы, мел, соду и некоторые другие. Неорганических веществ около 700 тыс., но их общая масса многократно превышает массу органических веществ. Почти все они — твердые вещества немолекулярного строения (рис. 42), входят в состав минералов, почв, горных пород.
Качественный и количественный состав веществ
Каждое вещество характеризуется определенным качественным и количественным составом.
Качественный состав вещества показывает, из атомов каких элементов оно состоит. Например, вода состоит из атомов водорода и кислорода, а метан— из атомов углерода и водорода. Число атомов каждого элемента в составе мельчайшей частицы вещества характеризует его количественный состав. Например, молекула воды состоит из двух атомов водорода и одного атома кислорода, а молекула метана — из одного атома углерода и четырех атомов водорода.
Сложное вещество можно с помощью различных химических методов разложить на несколько новых веществ, и так до тех пор, пока не получатся вещества, каждое из которых будет являться простым. Например, сахар при нагревании разлагается на воду и уголь (углерод):
а воду можно разложить с помощью электрического тока на водород и кислород:
Свойства простых веществ, которые при этом получаются (углерода, кислорода и водорода), совершенно не похожи на свойства сложных веществ — сахара и воды. Это разные вещества с разными свойствами. Свойства сложного вещества не являются суммой свойств простых веществ, которые образуются при его разложении.
Сложные вещества, как и простые, имеют либо молекулярное, либо немолекулярное строение. При этом вещества молекулярного строения могут существовать при обычных условиях в различных агрегатных состояниях. Например, метан — газ, вода — жидкость, сахар — твердое вещество.
Вещества немолекулярного строения при обычных условиях — твердые кристаллы, например поваренная соль, мел. Конечно, при нагревании (иногда до нескольких тысяч градусов) такие вещества плавятся, а затем переходят и в парообразное состояние.
Отличия между сложными веществами и смесями веществ
Необходимо различать сложные вещества и смеси веществ:
| Сложное вещество (химическое соединение) | Смесь веществ |
| Образуется в результате соединения атомов различных элементов между собой (химический процесс) | Образуется в результате смешивания различных веществ (физический процесс) |
| Свойства сложного вещества отличаются от свойств простых веществ, из которых оно получено | Свойства веществ, из которых составлена смесь, не изменяются |
| Имеет определенный качественный и количественный состав | Состав произвольный |
| Разлагается на составные части только в результате химических процессов | Разделяется на составные части с помощью различных физических методов |
Краткие выводы урока:
- Сложными называются вещества, состоящие из атомов разных химических элементов.
- Каждое чистое вещество имеет определенный качественный и количественный состав.
- Свойства сложного вещества отличаются от свойств простых веществ, из которых оно получено.
- Сложные вещества имеют молекулярное или немолекулярное строение.
- Все сложные вещества делятся на органические и неорганические.
Надеюсь урок 4 «Сложные вещества» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Об атомах и химических элементах
Другого ничего в природе нет
ни здесь, ни там, в космических глубинах:
все — от песчинок малых до планет —
из элементов состоит единых.
С. П. Щипачев, «Читая Менделеева».
В химии кроме терминов “атом” и “молекула” часто употребляется понятие “элемент”.
Химический элемент – это атомы одного и того же вида.
Так, например, атом водорода – это химический элемент водород; атомы кислорода и ртути – соответственно химические элементы кислорода и ртути.
К середине XIX века были открыты 63 химических элемента.
В настоящее время известно 118 химических элементов, т.е. 118 видов атомов.
Простые и сложные вещества
По элементному составу различают простые вещества, состоящие из атомов одного элемента (H2, O2, Cl2, P4, Na, Cu, Au), и сложные вещества, состоящие из атомов разных элементов (H2O, NH3, OF2, H2SO4, MgCl2, K2SO4).
Простые вещества – вещества, молекулы которых состоят из атомов одного вида (атомов одного химического элемента).
Сложные вещества (или химические соединения) – вещества, молекулы которых состоят из атомов разного вида (атомов различных химических элементов).
Химические элементы образуют около 500 простых веществ, которые условно классифицируют на металлы и неметаллы по их основным физическим свойствам.
Различие понятий «химический элемент» и «простое вещество»
Каждое простое вещество характеризуется определенными физическими и химическими свойствами.
Когда какое-нибудь простое вещество вступает в химическую реакцию и образует новое вещество, то оно при этом утрачивает большинство своих свойств.
Например, железо, соединяясь с серой, теряет металлический блеск, ковкость, магнитные свойства и др., следовательно, в сульфиде железа нет железа, каким мы знаем его в виде простого вещества. Но так как из сульфида железа при помощи химических реакций можно снова получить металлическое железо, то химики говорят, что в состав сульфида железа входит элемент железо, понимая под этим тот материал, из которого состоит металлическое железо.
Подобно железу, и сера находится в сульфиде железа не в виде хрупкого желтого горючего вещества серы, а в виде элемента серы.
Точно так же водород и кислород, входящие в состав воды, содержатся в воде не в виде газообразных водорода и кислорода с их характерными свойствами, а в виде элементов — водорода и кислорода.
Если же эти элементы находятся в «свободном состоянии», т. е. не связаны химически ни с каким другим элементом, то они образуют простые вещества.
Химический элемент можно определить, как вид атомов, характеризующийся определенной совокупностью свойств. При соединении друг с другом атомов одного и того же элемента образуются простые вещества, сочетание же атомов различных элементов дает или смесь простых веществ, или сложное вещество.
Различие между простым веществом и элементом становится особенно ясным, когда мы встречаемся с несколькими простыми веществами, состоящими из одного и того же элемента.
Возьмем, например, кусок фосфора. Это — белое, полупрозрачное вещество, очень ядовитое; на воздухе в темноте фосфор светится и может самовоспламеняться. Фосфор — простое вещество, он не может быть разложен на другие вещества. Однако, если нагреть фосфор без доступа воздуха, то через некоторое время его свойства изменятся: фосфор приобретает красно-фиолетовый цвет, перестает светиться в темноте, делается неядовитым и не самовоспламеняется на воздухе, причем эти новые свойства не исчезают по прекращении нагревания. Таким образом, несомненно происходит превращение одного вещества в другое, но превращение особое: взятое нами вещество не разлагается, и к нему ничего не присоединяется. Это заставляет признать оба вещества, как первоначально взятое, так и полученное после нагревания, лишь различными формами существования одного и того же элемента фосфора в свободном состоянии; первое из них называется белым, а второе — красным фосфором.
Доказательством того, что белый и красный фосфор действительно представляют собой различные формы одного и того же элемента и состоят из одинаковых атомов, служит их отношение к кислороду: при нагревании в кислороде как белый, так и красный фосфор взаимодействуют с ним, образуя одно и то же вещество — фосфорный ангидрид. Следовательно, элемент фосфор в свободном состоянии может существовать в виде различных простых веществ.
Подобно фосфору, и многие другие элементы в свободном состоянии существуют в виде нескольких различных простых веществ.
Аллотропия
Способность одного элемента существовать в виде различных простых веществ, отличающихся по свойствам, называется аллотропией.
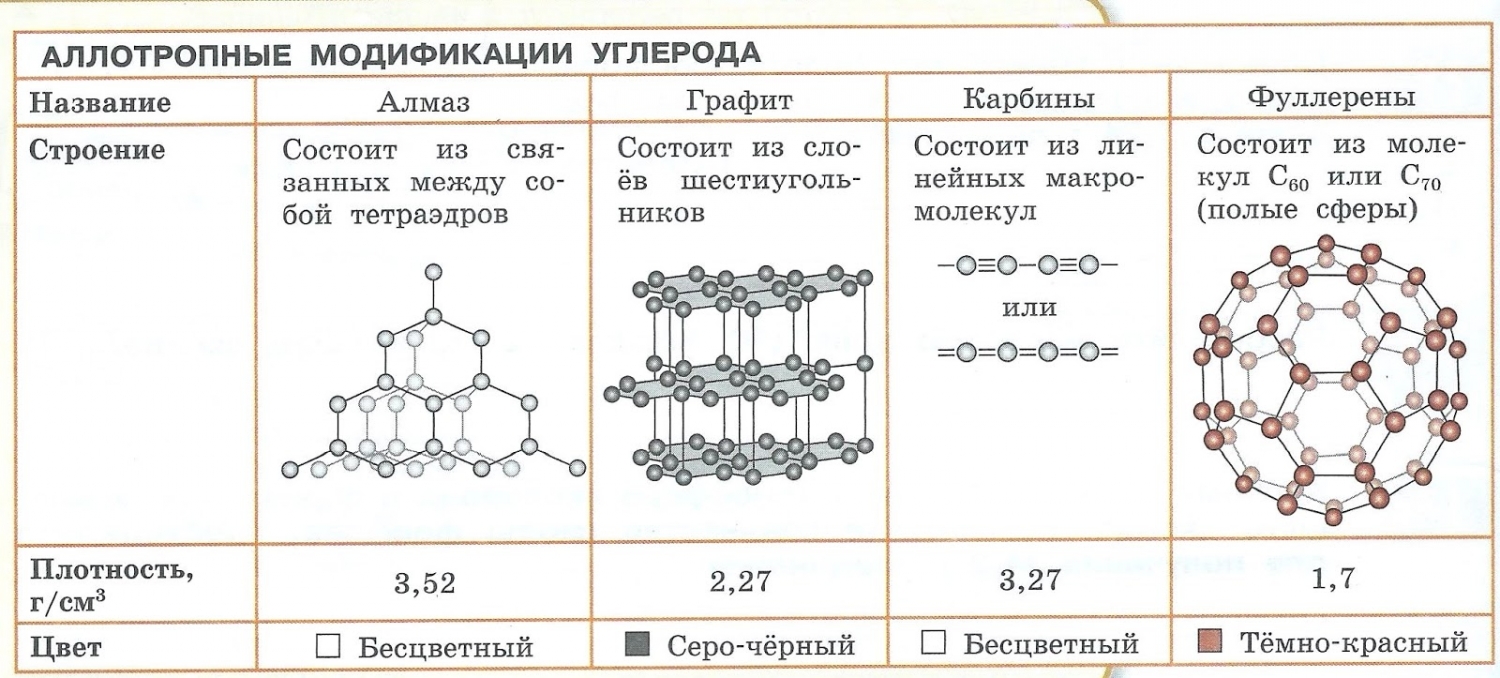
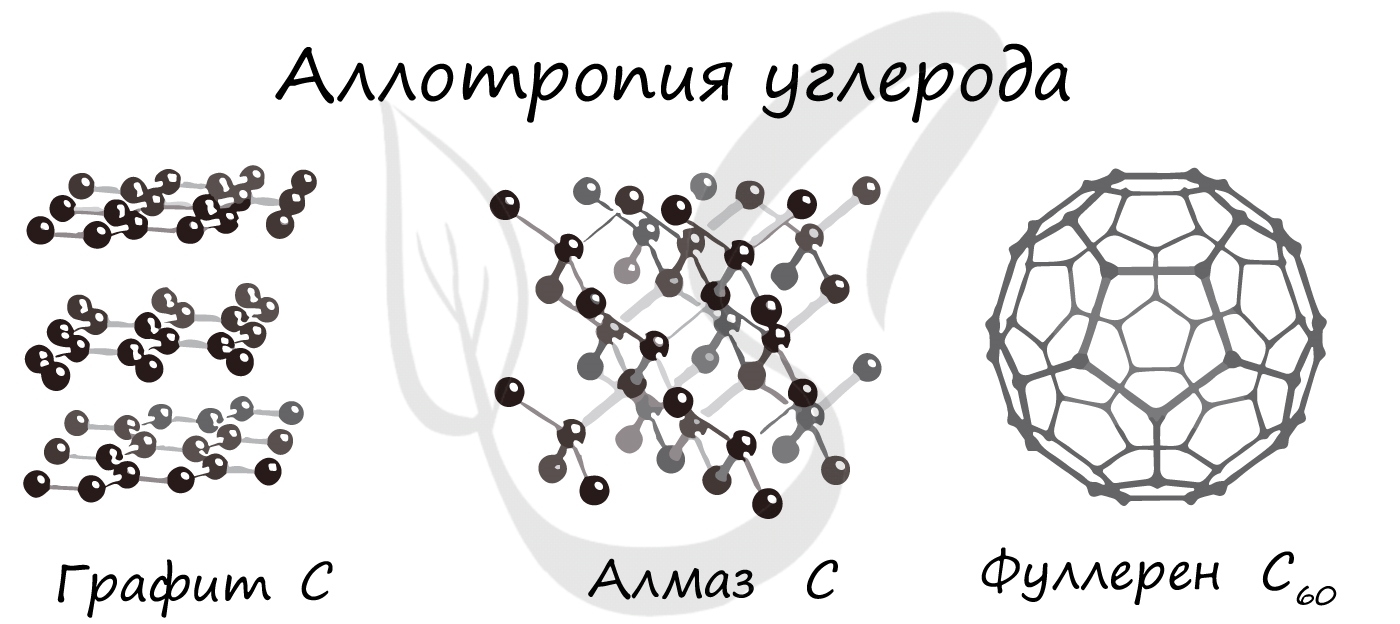
Углерод – С – алмаз, графит, карбин, фуллерен.
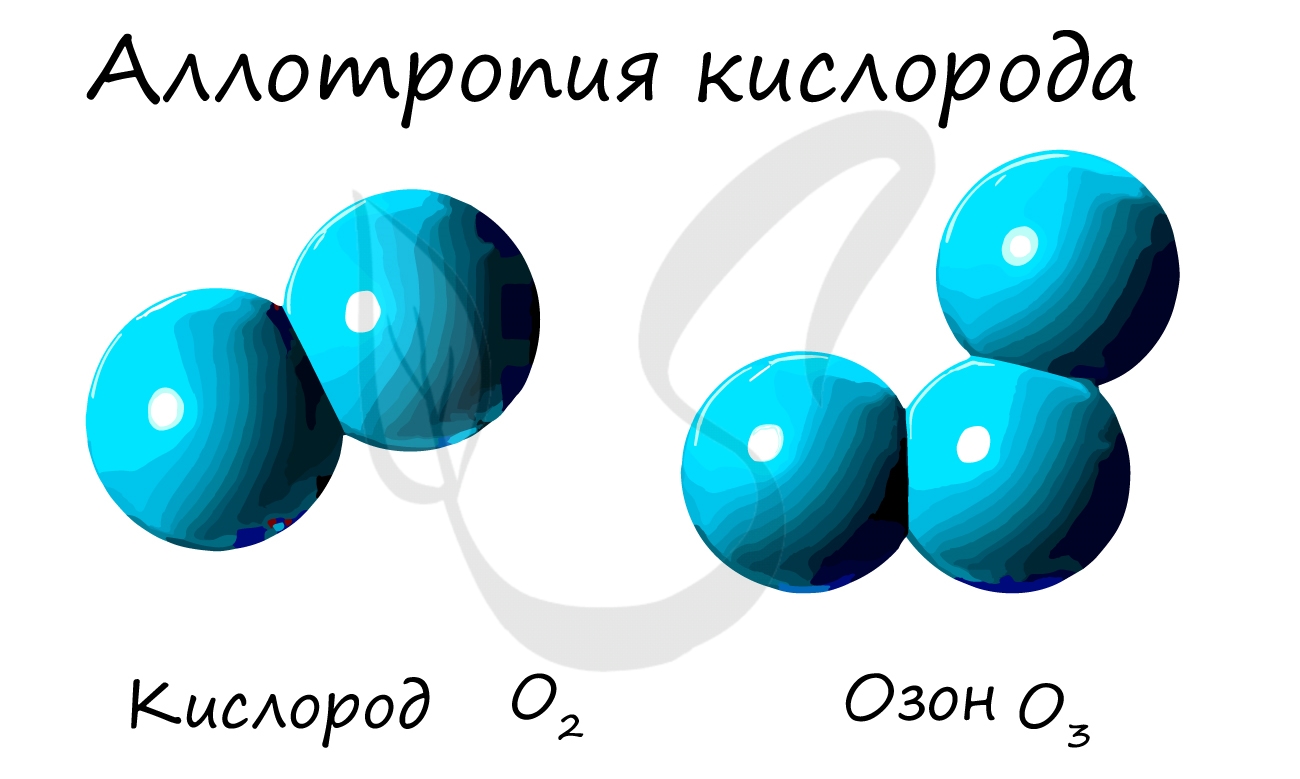
Кислород – O – кислород (O2), озон (O3).
Сера – S – ромбическая, моноклинная, пластическая.
Фосфор – P – белый, красный, чёрный.
Например, аллотропные формы химического элемента углерода – алмаз и графит – отличаются строение их кристаллов.
Задания для закрепления
№1. Из предложенного списка веществ выпишите отдельно простые и сложные вещества:
NaCl, H2SO4, K, S8, CO2, O3, H3PO4, N2, Fe.
Объясните ваш выбор, в каждом из случаев.
№2. Ответьте на вопросы:
а. Сколько простых веществ записано в ряду формул:
H2O, N2, O3, HNO3, P2O5, S, Fe, CO2, KOH.
б. К сложным относятся оба вещества:
1) С (уголь) и S (сера);
2) CO2 (углекислый газ) и H2O (вода);
3) Fe (железо) и CH4 (метан);
4) H2SO4 (серная кислота) и H2 (водород).
№3. Выберите правильное утверждение:
Простые вещества состоят из атомов одного вида.
а) Верно; б) Неверно
№4. Для смесей характерно то, что
а) Они имеют постоянный состав;
б) Вещества в составе «смеси» не сохраняют свои индивидуальные свойства;
в) Вещества в «смесях» можно разделить физическими свойствами;
г) Вещества в «смесях» можно разделить при помощи химической реакции.
№5. Для «химических соединений» характерно следующее:
а) Переменный состав;
б) Вещества, в составе «химического соединения «можно разделить физическими способами;
в) Об образовании химического соединения можно судить по признакам химических реакций;
г) Постоянный состав.
№6. В каком случае идёт речь о железе как о химическом элементе?
а) Железо — это металл, который притягивается магнитом;
б) Железо входит с состав ржавчины;
в) Для железа характерен металлический блеск;
г) В состав сульфида железа входит один атом железа.
№7. В каком случае идёт речь о кислороде как о простом веществе?
а) Кислород — это газ, поддерживает дыхание и горение;
б) Рыбы дышат кислородом, растворённым в воде;
в) Атом кислород входит в состав молекулы воды;
г) Кислород входит в состав воздуха.
Простые вещества: молекулы состоят из атомов одного вида (атомов одного элемента).
Пример: H2, O2,Cl2, P4, Na, Cu, Au.
Сложные вещества (или химические соединения): молекулы состоят из атомов разного вида (атомов различных химических элементов).
Пример: H2O, NH3, OF2, H2SO4, MgCl2, K2SO4.
Аллотропия — способность одного химического элемента образовывать несколько простых веществ, различающихся по строению и свойствам.
Пример:
- С — алмаз, графит, карбин, фуллерен.
- O — кислород, озон.
- S — ромбическая, моноклинная, пластическая.
- P — белый, красный, чёрный.
Явление аллотропии вызывается двумя причинами:
- Различным числом атомов в молекуле, например кислород O2 и озон O3.
- Образованием различных кристаллических форм, например алмаз, графит, карбин и фуллерен (смотри рисунок выше).
Основные классы неорганических веществ
Бинарные соединения
Вещества, состоящие из двух химических элементов называются бинарными (от лат. би – два) или двухэлементными.
Названия бинарных соединений образуют из двух слов – названий входящих в их состав химических элементов.
Первое слово обозначает электроотрицательную часть соединения – неметалл, его латинское название с суффиксом –ид стоит всегда в именительном падеже.
Второе слово обозначает электроположительную часть – металл или менее электроотрицательный элемент, его название стоит в родительном падеже, затем указывается степень окисления (только в том случае, если она переменная):
Запомни!
BH3 — боран
B2H6 — диборан
CH4 — метан
SiH4 — силан
NH3 — аммиак
PH3 — фосфин
AsH3 — арсин
Оксиды
Оксиды — сложные вещества, состоящие из двух химических элементов, один из которых кислород в степени окисления -2.
Общая формула оксидов: ЭхОу
Основные оксиды
Основные оксиды — оксиды, которым соответствуют основания.
Основные оксиды образованы металлом со степенью окисления +1, +2.
Пример
Соответствие основных оксидов и оснований
- Na2O — Na2(+1)O(-2) — NaOH
- MgO — Mg(+2)O(-2) — Mg(OH)2
- FeO — Fe(+2)O(-2) — Fe(OH)2
- MnO — Mn(+2)O(-2) — Mn(OH)2
Амфотерные оксиды
Амфотерные оксиды — оксиды, которые в зависимости от условий проявляют либо основные, либо кислотные свойства.
Амфотерные оксиды образованы металлом со степенью окисления +3, +4, а также некоторыми металлами (Zn, Be) со степенью окисления +2.
Пример
Al2(+3)O3(-2), Fe2(+3)O3(-2), Mn(+4)O2(-2), Zn(+2)O(-2), Be(+2)O(-2)
Кислотные оксиды
Кислотные оксиды — оксиды, которым соответствуют кислоты.
Кислотные оксиды образованы неметаллом, а также металлом со степенью окисления +5, +6, +7.
Пример
Соответствие кислотных оксидов и кислот
- SO3 — S(+6)O3(-2) — H2SO4
- N2O5 — N2(+5)O5(-2) — HNO3
- CrO3 — Cr(+6)O3(-2) — H2CrO4
- Mn2O7 — Mn2(+7)O7(-2) — HMnO4
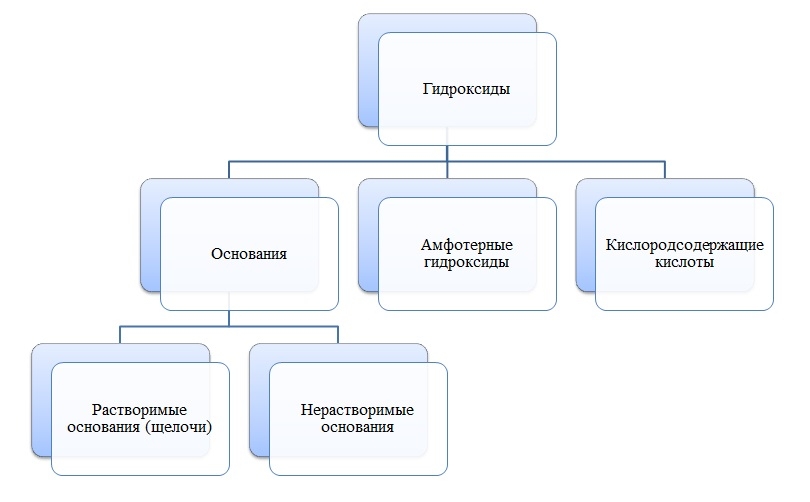
Гидроксиды
Гидроксиды — сложные вещества, состоящие из трех элементов, два из которых водород со степенью окисления +1 и кислород со степенью окисления -2.
Общая формула гидроксидов: ЭхОуНz
Основания
Основания — сложные вещества, состоящие из ионов металла и одной или нескольких гидроксо-групп (ОН-).
В основаниях металл имеет степень окисления +1, +2 или вместо металла стоит ион аммония NH4+
Пример
NaOH, NH4OH, Ca(OH)2
Амфотерные гидроксиды
Амфотерные гидроксиды — сложные вещества, которые в зависимости от условий проявляют свойства оснований или кислот.
Амфотерные гидроксиды имеют металл со степенью окисления +3, +4, а также некоторые металлы (Zn, Be) со степенью окисления +2.
Пример
Zn(OH)2, Be(OH)2, Al(OH)3, Cr(OH)3
Кислоты
Кислоты — сложные вещества, состоящие из атомов водорода и кислотных остатков.
В состав кислот входит неметалл или металл со степенью окисления +5, +6, +7.
Пример
H2SO4, HNO3, H2Cr2O7, HMnO4
Соли
Соли- соединения, состоящие из катионов металлов (или NH4+) и кислотных остатков.
Общая формула солей: MexAcy
- Me — металл
- Ac — кислотный остаток
Пример
KNO3 — нитрат калия
(NH4)2SO4 — сульфат аммония
Mg(NO3)2 — нитрат магния
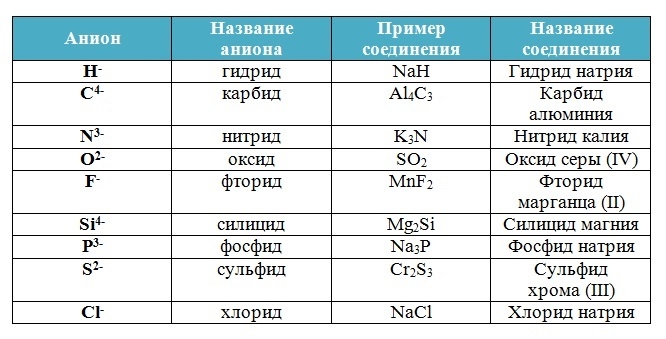
Названия кислот и кислотных остатков
| Кислота | Кислотный остаток | ||
| Название | Формула | Название | Формула |
|
Соляная (хлороводородная) |
HCl | Хлорид | Cl(-) |
|
Плавиковая (фтороводородная) |
HF | Фторид | F(-) |
| Бромоводородная | HBr | Бромид | Br(-) |
| Иодоводородная | HI | Иодид | I(-) |
| Азотистая | HNO2 | Нитрит | NO2(-) |
| Азотная | HNO3 | Нитрат | NO3(-) |
| Сероводородная | H2S |
Сульфид Гидросульфид |
S(2-) HS(-) |
| Сернистая | H2SO3 |
Сульфит Гидросульфит |
SO3(2-) HSO3(-) |
| Серная | H2SO4 |
Сульфат Гидросульфат |
SO4(2-) HSO4(-) |
| Угольная | H2CO3 |
Карбонат Гидрокарбонат |
СО3(2-) НСО3(-) |
| Кремниевая | H2SiO3 | Силикат | SiO3(2-) |
| Ортофосфорная | H3PO4 |
Ортофосфат Гидроортофосфат Дигидроортофосфат |
РО4(3-) НРО4(2-) Н2РО4(-) |
| Муравьиная | НСООН | Формиат | НСОО(-) |
| Уксусная | СН3СООН | Ацетат | СН3СОО(-) |
Полезные ссылки
Источник материала
Классификация неорганических веществ (видео)
Классификация неорганических веществ. Сложные вопросы (видео)
Кислотные оксиды (видео)
Основные оксиды (видео)
Основания (видео)
Характеристика солей (видео)
Дополнительные материалы
Классификация и номенклатура неорганических веществ (видео)
Классификация соединений (видео)
Аллотропные формы углерода (видео)
Вещество в химии — любая совокупность атомов и молекул. Вещества в химии подразделяются на простые и сложные.
Простые и сложные вещества
Простые вещества состоят из атомов одного химического элемента, то есть их образуют два и более одинаковых атома:
H2, N2, O2, O3(озон), Mn, Fe.
Сложные вещества состоят из атомов двух и более видов: KMnO4, H2SO4, HCl.
Предмет химии (греч. chymos — сок)
У любой науки есть предмет изучения и методами, с помощью которых изучается предмет. Химия — наука о веществах,
их превращениях и явлениях, которые сопровождают эти превращения.
Хочу заметить важную деталь: необходимо четко разделять химические и физические реакции. При химических реакциях
происходят изменения в составе молекул: одни атомы сменяются другими, молекулы рвутся на части и собираются снова
в обновленном виде.
При физических реакциях молекулы неизменны, связи атомов внутри них не подвергается изменениям.

К признакам химических реакций относится ряд критериев:
- Выделение газа
- Появление запаха
- Изменение окраски раствора или реагирующих веществ
- Выпадение осадка
- Образование воды
- Выделение тепла
- Поглощение тепла

Аллотропия
Аллотропия (греч. allos — иной + tropos образ) — свойство некоторых химических элементов принимать различные физические формы,
существовать в виде двух и более простых веществ.
Такие уникальные способности имеются у углерода. Его известнейшие аллотропные модификации: алмаз, графит и фуллерен. В разделе
химических связей мы вернемся к ним, однако будет хорошо, если вы уже сейчас запомните: алмаз и графит имеют атомное строение,
фуллерен — молекулярное.
Обратите внимание: вы можете догадаться о строении веществ по их формуле. У фуллерена молекулу составляют 60 атомов углерода.
Мы изучали, что молекула — это как минимум два атома, соединенных вместе. Таким образом, уже по формуле, очевидно, что строение
фуллерена молекулярное.
Среди аллотропных модификаций фосфора выделяют: белый, красный и черный фосфор. Белый (P4) фосфор имеет молекулярное
строение, а красный и черный (P∞) — атомное.

Аллотропные модификации серы включают ромбическую, моноклинную, и пластическую серу. Ромбическая (S8) и моноклинная
сера (S8) имеют молекулярное строение. Пластическая сера (S∞) представляет собой длинные цепочки атомов,
тем не менее также характеризуется молекулярным строением.
Надо заметить, что с течением времени, пластическая и моноклинная модификации серы, неустойчивые, превращаются в ромбическую, наиболее устойчивую.

Из аллотропных модификаций кислорода наиболее известен озон (греч. ozo — иметь сильный запах). Озон — неустойчивая модификация
кислорода, образуется в озоновом слое под действием ультрафиолетового излучения. Имеет молекулярное строение и формулу — O3.
Озон — ядовитый газ. Применяется как окислитель при отбеливании, при очистке воды и кондиционировании воздуха. В медицине существует
целое направление, посвященное лечению с применение озона — озонотерапия.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.