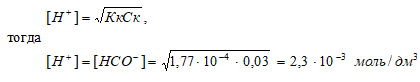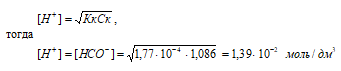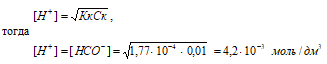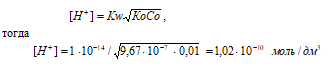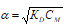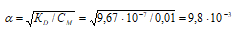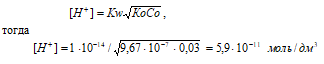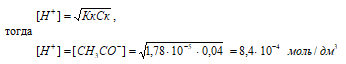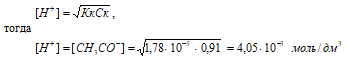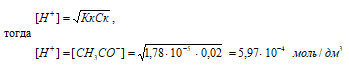Расчет концентрации ионов в растворе одного вещества
Концентрация
ионов определяется степенью диссоциации
()
и молярной концентрацией вещества (См).
Случай
А. Сильные электролиты
Здесь
достаточно хорошим приближением является
= 1, т.е. все молекулы полностью диссоциированы
на ионы.
Пример
1
Рассчитать
концентрацию всех ионов в 1 М растворе
Al2(SO4)3.
Решение
Al2(SO4)3
— соль, т. е. сильный электролит. Она
диссоциирует в одну ступень нацело и
необратимо:
Al2(SO4)3
2Al3+
+ 3SO42-.
Из
уравнения диссоциации видно, что из
одной молекулы соли образуются 2 иона
алюминия и 3 сульфат-иона
[Al3+]=2Cм
= 2 моль/л; [SO42-]=
3См
= 3 моль/л.
Пример
2
Рассчитать
рН 0.1 М раствора NaOH.
Решение
Гидроксид
натрия — щелочь (сильное основание),
следовательно, диссоциирует необратимо
и полностью:
NaOH
Na++OH—
;
при
диссоциации из его одной молекулы
образуется один гидроксид-ион,
следовательно,
[OH—]=
См = 0.1 моль/л,
рОН
= — lg
[OH—]=
1,
pH=
14- рОН = 13.
Случай
В. Несильные электролиты
Соли,
как правило, являются сильными
электролитами, поэтому этот случай
относится к несильным кислотам и
основаниям.
Пример
3
Рассчитать
концентрацию всех ионов в 0.2 М растворе
сернистой кислоты и ее степень диссоциации
по первой и второй ступеням.
Решение
Здесь
,
диссоциация обратима:
первая
ступень H2SO3
HSO3—
+ H+,
Ка1=
[HSO3—][H+]/[H2SO3]=
1.610-2
; (1)
вторая
ступень HSO3—
SO32-
+ H+,
Ka2=
[SO32-][H+]/[HSO3—]=
6.310-8
. (2)
Из
уравнений диссоциации следует, что
образование одного иона HSO3—
сопровождается образованием одного
иона H+,
а образование одного иона SO32-
сопровождается образованием двух H+,
следовательно, концентрации всех ионов
связаны уравнением
[HSO3—]+
2[SO32-]=
[H+],
(3)
а
равновесная концентрация кислоты
определяется уравнением
[H2SO3]=
Cм
— [HSO3—]-
[SO32-].
(4)
Решая
систему уравнений (1)-(4) можно рассчитать
концентрации всех ионов, однако следует
обратить внимание на то, что Ka1Ka2.
Отсюда следует, что концентрации ионов
Н+
и HSO3—
определяются, главным образом, диссоциацией
по первой ступени. Вторая ступень
диссоциации играет главную роль лишь
в образовании ионов SO32-.
Расчет
[Н+],
[HSO3—]
и [H2
SO3]
Из
уравнения (1) следует, что при распаде
одной молекулы кислоты образуется один
ион Н+
и один ион HSO3—,
следовательно, концентрации этих ионов
равны х = [Н+]
= [HSO3-2],
а равновесная концентрация [H2
SO3]=
См — х.. Подставляя эти выражения в закон
действия масс для первой ступени, получим
Ка1=
х2
/(См — х)= 1.610-2
или
х2
/(0.2- х)= 1.610-2,
откуда
х1
= -6.510-2
и х2
= 4.910-2.
Концентрация не может быть отрицательной
величиной, поэтому решением является
второй корень уравнения. Окончательно
можно записать
[Н+]
= [HSO3—]
= 4.910-2
моль/л, [H2
SO3]=
0.151 моль/л,
1
= [Н+]/См
= 4.910-2
моль/л/0.2 моль/л = 0.245, или 24.5%.
Расчет
[SO32-]
Из
равенства значений [Н+]
и [HSO3—]
в соответствии с уравнением (2) следует
[SO32-][H+]/[HSO3—]=
[SO32-]
= Ка2
= 6.310-8
моль/л,
2
= [SO32-]/[HSO3—]=
6.310-8
моль/л./ 4.910-2
моль/л = 1.29 10-6.
ВЫВОД:
при расчете рН растворов слабых
электролитов достаточно рассмотреть
первую ступень диссоциации.
Пример
4
Рассчитать
степень диссоциации гидроксида аммония
и рН его 5%- раствора (плотность раствора
=0.97
г/мл).
Решение
1).
Для решения задачи необходимо знать
молярную концентрацию вещества. Для ее
расчета удобно исходить из 1 литра
раствора:
его
масса mp=
V
= 1000 мл0.97
г/мл = 970 г;
масса
растворенного вещества m=
mp
= 970 г0.05
= 48.5 г;
количество
растворенного вещества =
m/М
= 48.5 г/35г/моль =1.39 моль;
молярная
концентрация См=/
V=
1.39 моль/1 л = 1.39 моль/л.
2).
Рассмотрим равновесие:
NH4OH
NH4+
+
OH—.
Кв=
[NH4+][OH—]/[NH4OH]=
1.810-5
.
Воспользуемся
законом разбавления Оствальда
=
(К/См)
= =(1.810-5
/1.39) = 3.6 10-3
;
1,
следовательно, применение этого закона
допустимо. При диссоциации одной молекулы
исходного вещества образуется 1 ион
ОН—;
в одном литре раствора диссоциирует
См
молекул, следовательно, образуется
столько же ионов ОН—,
тогда
[ОН—]=
См
=3.6 10-3
1.39 моль/л = 5.0010-3
моль/л,
рОН
= — lg[ОН—]
= — lg
5.0010-3
= 2.30,
pH
= 14-pOH=
14 -2.30 = 11.70.
Замечание:
если результатом расчета по закону
разбавления оказывается, что
0.1, то для расчета
необходимо воспользоваться более точным
уравнением К=2См/(1-)
или сначала рассчитать равновесные
концентрации ионов (см. пример 3), а затем
..
Соседние файлы в предмете Химия
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Как определить число ионов
Ион – это электрически заряженная частица. Она образуется, когда атом или молекула притягивает к себе дополнительные электроны или же отдает свои. Положительно заряженные ионы называются катионами, а отрицательно заряженные – анионами. Частицы образуются в растворах в ходе процесса, который называется электролитической диссоциацией. Но это может происходить и при воздействии высокой температуры, электрического тока и т.д. При диссоциации даже крохотного количества вещества образуется определенное число ионов.

Инструкция
Поставлена следующая задача: имеется 40 г поваренной соли. Ее растворили в воде. Сколько ионов при этом образовалось, если допустить, что все атомы поваренной соли подверглись диссоциации?
Напишите формулу этого вещества: NaCl. Посчитайте его молекулярную массу, сложив атомные веса натрия и хлора: 23 + 35,5 = 58,5 а.е.м. (атомных единиц массы). Поскольку молярная масса любого вещества численно равна его молекулярной массе, только выражается в другой размерности (г/моль), то 1 моль поваренной соли (хлористого натрия) будет весить приблизительно 58,5 г.
Вычислить, сколько молей хлористого натрия содержится в 40 г. Произведите деление: 40/58,5 = 0,6838 , или 0,68 моля.
Воспользуйтесь универсальным числом Авогадро, которое равно 6,022*10^23. Это количество элементарных частиц – молекул, атомов или ионов, содержащихся в одном моле любого вещества. В вашем случае до диссоциации хлористый натрий состоял из молекул. Следовательно, в 1 моле этого вещества содержится примерно 6,022*10^23 его молекул. Но у вас 0,68 моля. Произведите умножение: 0,68*6,022*10^23 = 4,095*10^23. Вот столько молекул содержится в 40 г хлористого натрия.
При диссоциации каждая молекула поваренной соли образует два иона: положительно заряженный ион натрия и отрицательно заряженный ион хлора. Поэтому, умножьте полученный результат на 2: 2*4,095*10^23 = 8,19*10^23. Вот столько ионов образовалось при диссоциации 40 г поваренной соли. Задача решена.
Полезный совет
По точно такому же алгоритму можно определить количество ионов любого вещества, принимая во внимание следующие условия:
— вещество должно быть растворимым;
— учитывайте индексы катионов и анионов. Например, при подсчете количества ионов сульфата калия – К2SO4, помните, что каждая его молекула образует три иона.
Источники:
- молекула поваренной соли
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Как вычислить концентрацию ионов в растворе электролита и рН раствора
Задача 73.
Вычислите концентрацию ионов НСОО–, Н+ и рН в: а) 0,03 М НСООН; б) растворе (w% = 5,0%); в) растворе, содержащем 4,6 г/дм3 НСООН.
Решение:
KD(НСООН) = 1,77 · 10–4;
CM(HCOOH) = 0,03 M;
w%(HCOOH) = 5,0%;
M(НСООН) = 46,03 г/моль.
а) 0,03 М НСООН
Диссоциация муравьиной кислоты: HCOOH = Н+ + НСОО–;
[H+] = [HCOO–].
НСООН – слабая кислота. Для слабых кислот [H+] вычисляется по формуле:
рН = –lg[H+] = –lg2,3 · 10–3 = 3 – lg2,3 = 2,64.
Ответ: [H+] = [HCOO–] = 2,3 · 10–3 моль/ дм3; рН = 2,64.
б) растворе (w% = 5,0%)
Концентрацию кислоты находим из вычисления: CM(HCOOH) = [(w% · 1000г)/100%]/M(НСООН); CM(HCOOH) = [(5% · 1000г)/100%]/46,03 г/моль = 1,086 моль.
Рассчитаем [H+] и [HCOO–]
рН = –lg[H+] = –lg1,39 · 10–2 = 2 – lg1,39 = 1,86.
Ответ: [H+] = [HCOO–] = 1,39 · 10–2 моль/дм3; рН = 1,86.
в) растворе, содержащем 4,6 г/дм3 НСООН
Концентрацию кислоты находим из вычисления: CM(HCOOH) = m(HCOOH)/М(HCOOH) = 4,6/46,03 = 0,01 M.
Рассчитаем [H+] и [HCOO–]
рН = –lg[H+] = –lg4,2 · 10–3 = 3 – lg4,2 = 2,38.
Ответ: [H+] = [HCOO–] = 4,2 · 10–3 моль/дм3; рН = 2,38.
Задача 74.
Вычислите концентрацию ионов ОН–, Н+ и рН в: а) 0,01 М NH2OH; б) растворе NH2OH (w% = 0,1%).
Решение:
KD(NH2OH) = 9,67 · 10–7;
CM(NH2OH) = 0,01 M;
w%(NH2OH) = 0,1%;
M(NH2OH) = 33 г/моль. NH2OH + H2O = NH3OH+ + OH–
а) 0,01 М NH2OH
Диссоциация гидроксиламина: NH2OH + H2O = NH3OH+ + OH–
[OH–] = СМ(NH2OH) = 1 · 10–2 моль/дм3.
NH2OH – слабое основание. Для слабых оснований [H+] вычисляется по формуле:
рН = –lg[H+] = –lg1,02 · 10–10 = 10 – lg1,02 = 9,99.
Так как гидроксиламин (NH2OH) является слабым электролитом, то для расчета применяют упрощенную формулу закона разбавления Оствальда:
где: α – степень диссоциации; KD – константа диссоциации; CM – молярная концентрация электролита.
Подставим данные задачи в уравнение Оствальда, получим:
Теперь рассчитаем концентрацию гидроксид ионов, получим:
[OH–] = СМ · α = 0,01 · (9,80 · 10–3) = 9,80 · 10–5 моль/дм3.
Ответ: а) [H+] = 1,02 · 10–10 моль/дм3; [ОН–] = 9,80 · 10–5 моль/дм3; рН = 9,99.
б) растворе NH2OH (w% = 0,1%)
Концентрацию гидроксиламина находим из вычисления:
СМ(NH2OH) = [(w% . 1000г)/100%]/M(NH2OH); СМ(NH2OH) = [(0,1% . 1000г)/100%]/33 г/моль = 0,03 моль.
Рассчитаем [H+], получим:
рН = –lg[H+] = –lg5,9 · 10-11 = 11 – lg5,9 = 10,24.
Ответ: [H+] = 5,9 · 10-11 моль/дм3; рН = 10,24.
Задача 75.
Вычислите концентрацию ионов СН3СОО–, Н+ и рН в: а) 0,04 М СН3СООН; б) растворе (w% = 5,5%); в) растворе, содержащем 1,2 г/дм3 CН3СООН.
Решение:
KD(СН3СООН) = 1,78 · 10–5;
CM(СH3COOH) = 0,04 M;
w%(СH3COOH) = 5,5%;
M(СН3СООН) = 60 г/моль.
а) 0,04 М СН3СООН
Диссоциация уксусной кислоты: СH3COOH ⇔ Н+ + СН3СОО–;
[H+] = [СH3COO–].
СН3СООН – слабая кислота. Для слабых кислот [H+] вычисляется по формуле:
рН = –lg[H+] = –lg8,4 · 10–4 = 4 – lg8,4 = 3,08.
Ответ: [H+] = [HCOO–] = 8,4 · 10–4 моль/ дм3; рН = 3,08.
б) растворе (w% = 5,5%)
Концентрацию кислоты находим из вычисления:
СМ(СH3COOH) = [(w% . 1000г)/100%]/M(СН3СООН); СМ(СH3COOH) = [(5,5% . 1000г)/100%]/60 г/моль = 0,92 моль.
Рассчитаем [H+] и [СH3COO–]
рН = –lg[H+] = –lg4,05 · 10–3 = 3 – lg4,05 = 2,39.
Ответ: [H+] = [СH3COO–] = 4,05 · 10–3 моль/дм3; рН = 2,39.
в) растворе, содержащем 1,2 г/дм3 CН3СООН
Концентрацию кислоты находим из вычисления: (CM(СH3COOH) = m(СH3COOH)/М(СH3COOH) = 1,2/60 = 0,02 M.
Рассчитаем [H+] и [СH3COO–]
рН = –lg[H+] = –lg5,97 · 10–4 = 4 – lg5,97 = 3,22.
Ответ: [H+] = [СH3COO–] = 5,97 · 10–4 моль/дм3; рН = 3,22.