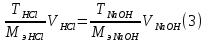Как определить концентрацию кислоты
Концентрация — размерная величина, посредством которой выражается состав раствора (в частности, содержание в нем растворенного вещества). Порой случается такое, что эта самая величина неизвестна. К примеру, в лаборатории среди множества бутылей может оказаться один, подписанный просто — HCl (соляная кислота). Для проведения же многих опытов информации требуется гораздо больше, нежели только название. Поэтому приходится задействовать экспериментальные методы, такие как титрование или определение плотности.

Вам понадобится
- -раствор щелочи точной коцентрации
- -бюретка
- -конические колбы
- -мерные пипетки
- -индикатор
- -набор ареометров
Инструкция
Одним из наиболее простых способов определения концентрации кислоты является прямое титрование (процесс постепенного добавления раствора с известной концентрацией(титранта) к раствору определяемого вещества с целью зафиксировать точку эквивалентности (конец реакции)). В данном случае удобно использовать нейтрализацию щелочью. Завершение ее можно легко определить с помощью добавления индикатора (к примеру, в кислоте фенолфталеин прозрачен, а при добавлении щелочи становится малиновым; метиловый оранжевый в кислой среде — розовый, а в щелочной — оранжевый).
Возьмите бюретку (объемом 15-20 мл), установите ее в штативе с помощью лапки. Она должна быть четко зафиксирована, иначе с раскачивающего кончика могут упасть несколько лишних капель, которые испортят вам весь процесс. Порой одна капелька меняет цвет индикатора. Этот момент необходимо засечь.
Запаситесь посудой и реактивами: коническими колбами для титрования (4-5 штук небольшого объема), несколькими пипетками (как Мора — без делений, так и размерными), мерной колбой на 1 л, фиксаналом щелочи, индикатором, дистиллированной водой.
Приготовьте раствор щелочи точной концентрации (к примеру, NaOH). Для этого лучше используйте фиксанал (ампула с запаянным в нее веществом, при разведении которого в 1л воды получается 0,1 нормальный раствор). Конечно, можно пустить в ход точную навеску. Но первый вариант точнее и надежнее.
Далее заполните бюретку раствором щелочи. В коническую колбу поместите 15 мл кислоты неизвестной концентрации (возможно, HCl), в нее же добавьте 2-3 капли индикатора. И приступайте непосредственно к титрованию. Как только индикатор изменит цвет и примерно 30 с будет таким оставаться, прекращайте процесс. Запишите, сколько ушло щелочи (к примеру, 2,5 мл).
Затем выполните данный ход работы еще 2-3 раза. Это делается для получения белее точного результата. После подсчитайте средний объем щелочи. Vср = (V1+V2+V3)/3, V1 — результат первого титрования, мл, V2 — результат второго, мл, V3 — объем третьего, мл, 3 — количество проделанных реакций. Например, Vср = (2,5+2,7+2,4)/3 = 2,53 мл.
После проведения эксперимента, можно приступить к основным подсчетам. В данной ситуации справедливо соотношение: C1*V1 = C2*V2, где C1 — концентрация раствора щелочи, нормальная (н), V1 — средний объем израсходованной на реакцию щелочи, мл, С2 — концентрация раствора кислоты, н, V2 — объем кислоты, участвующей в реакции, мл. С2 — величина неизвестная. Значит, ее необходимо выразить через известные данные. С2 = (C1*V1)/V2, т.е. С2 = (0,1 * 2,53)/ 15 = 0,02 н. Вывод: при титровании HCl раствором 0,1 н NaOH, была выяснена концентрация кислоты — 0,02 н.
Еще одним распространненым способом выяснить концентрацию кислоты — это, для начала, узнать ее плотность. Для этого приобретите набор ареометров (в специализированном химическом или магазине, также можно заказать по интернету или посетить точки торговли принадлежностей для автомобилистов).
Налейте кислоту в химический стакан и помещайте в него ареометры до тех пор, пока они не престанут тонуть или выталкиваться на поверхность. Когда же прибор станет, как поплавок, отметьте числовое значение на нем. Данная цифра и есть плотность кислоты. Далее, используя соответствующую литературу (можно справочник Лурье), не составит труда определить по таблице нужную концентрацию.
В независимости от того, какой способ вы выберите, не забывайте про соблюдение техники безопасности.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Растворы
– гомогенные системы, состоящие из двух
или нескольких компонентов. Растворенноевеществов виде атомов, молекул или
ионов равномерно распределено врастворителе. В случае водных
растворов растворителем является вода.
Основной
количественной характеристикой раствора
является концентрация– величина,
показывающая, сколько вещества растворено
в определенном количестве (массе или
объеме) растворителя. Существует
несколько способов выражения концентрации
растворов.
-
Массоваядолярастворенного вещества ()
– отношение массы растворенного
вещества к массе раствора:
Массовая
доля выражается в долях единицы либо в
процентах. В последнем случае используют
формулу:
-
Молярнаяконцентрация(молярность) (См)
– количество молей растворенного
вещества в 1 л раствора.
где n– количество вещества, равное отношению
массы вещества к молярной массе:
Единица
измерения молярной концентрации [Cм]
= моль/л.
-
Моляльнаяконцентрация– количество молей
растворенного вещества в 1 кг растворителя.
Единица
измерения моляльной концентрации [Cm]
= моль/кг.
-
Титр– масса растворенного вещества (г) в
1 мл раствора.
Единица
измерения титра [Т] = г/мл.
-
Эквивалентная(нормальная)концентрация(Сн)
– число молей эквивалентов растворенного
вещества в 1 л раствора.
Единица
измерения нормальной концентрации
[Cн]= моль экв/л.
Эквивалентомвещества называют реальную или условную
частицу вещества, которая в данной
обменной реакции вступает в реакцию с
одним протоном Н+(или сама содержит
один протон).
Рассмотрим
реакцию нейтрализации:
NaOH+HCl=NaCl+H2O
В этой
реакции с одним протоном (т.е. с одной
молекулой HCl) реагирует
одна молекулаNaOH.
Следовательно, эквивалентомNaOHбудет одна молекулаNaOH(реальная частица).
В реакции
Ba(OH)2+ 2HCl=BaCl2+H2O
на одну
молекулу HClприходится ½
молекулыBa(OH)2,
поэтому эквивалентомBa(OH)2является условная частица, равная
половине молекулыBa(OH)2.
Одно и то
же вещество может иметь несколько
эквивалентов. Определить эквивалент
можно, исходя из конкретной химической
реакции.
Например,
в реакции H2S+NaOH=NaHS+H2Oэквивалентом Н2Sявляется 1 молекулаH2S.
А в реакции
H2S+
2NaOH=Na2S+2H2OэквивалентH2S– ½ молекулыH2S.
Для расчетов
необходимо определять молярную массу
эквивалентов различных веществ.
Молярная
масса эквивалента кислоты(при
условии, что в реакции произошла замена
всех ионов водорода) будет равна молярной
массе кислоты, деленной на основность
этой кислоты (т.е. число протонов в
молекуле кислоты):
Молярная
масса эквивалента основанияравна
отношению молярной массы основания к
кислотности основания (т.е. числу
гидроксильных групп):
Молярная
масса эквивалента соли– отношение
молярной массы соли к произведению
валентности металла и числа ионов
металла
Очевидно,
что используя понятие эквивалент, вместо
понятия молекула, можно рассчитать
количество молей эквивалентов как
отношение массы вещества к молярной
массе эквивалента:
В количественных
расчетах используют закон эквивалентов.
Его формулировка проста: вещества
реагируют в эквивалентных количествах.
Это значит, что для двух веществ (1) и
(2), вступающих в реакцию, количества
молей эквивалентов равны:

Т.к.
Сн=nЭ/V,
то можем переписать закон эквивалентов
в следующем виде:

На
законе эквивалентов основан титриметрическийметоданализа, который заключается
в точном измерении количества реактива,
израсходованного на реакцию с определяемым
веществом. Если имеется определенный
объем раствора вещества (1) неизвестной
концентрации Сн1, то, проведя
реакцию с веществом (2) (концентрация
раствора Сн2известна) и измерив
объем раствораV2,
можно определить концентрацию Сн1.
Чтобы
зафиксировать конец реакции, раствор
вещества известной концентрации (его
называют титрантом) постепенно,
небольшими порциями, добавляют к раствору
определяемого вещества. Этот процесс
называетсятитрованием. Окончание
титрования определяют с помощью
индикаторов (обычно применяют фенолфталеин
и метиловый оранжевый).
В
данной работе проводится определение
концентрации раствора соляной кислоты
титрованием раствором щелочи NaOH.
К определенному объему раствора соляной
кислоты неизвестной концентрации
постепенно добавляют раствор щелочи
(титр его известен) до полной нейтрализации.
Конец титрования, т.е. момент нейтральности
раствора, устанавливают по изменению
окраски фенолфталеина. Этот индикатор
бесцветен в кислой и нейтральной средах
и окрашен в малиновый цвет в щелочной
среде. Объем раствора щелочи,
израсходованного на нейтрализацию,
определяют с помощью бюретки.
Результатом
эксперимента является определение
эквивалентной концентрации и титра
соляной кислоты.
Выведем
формулу связи эквивалентной концентрации
и титра.
Получим
закон эквивалентов, выраженный через
титры реагирующих веществ:
Формула
(3) используется для расчета титра соляной
кислоты по экспериментальным данным.
Порядок
работы:
1. Подготовить
колбочку для титрования: промыть ее
водопроводной водой, затем ополоснуть
дистиллированной.
2. Подготовить
к работе бюретки с растворами соляной
кислоты и щелочи: из носиков бюреток
удалить воздух, уровни растворов
установить на нулевые отметки (или на
любую отметку ниже нулевой). Избыток
раствора из бюретки слить в пробирку.
Показания бюреток записать в лабораторный
журнал.
3. Получить
у преподавателя задание. В колбочку
прилить из бюретки заданный объем
соляной кислоты и добавить 2 капли
раствора фенолфталеина. Показания
бюретки записать в лабораторный журнал.
4. Соляную
кислоту титровать раствором щелочи. В
конце титрования раствор щелочи
прибавлять в колбочку по каплям до
появления неисчезающего в течение 1-2
минут слабо-розового окрашивания. В
ходе титрования жидкость в колбочке
осторожно перемешивать круговыми
движениями. Записать показание бюретки
по окончании титрования.
5. Вычислить
объем раствора щелочи по показаниям
бюретки до и после титрования. Используя
полученное у преподавателя значение
титра щелочи, рассчитать титр, молярность
и нормальность раствора соляной кислоты.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Не понял. Вы вероятно хотели сказать, если неизвестна кислота, плотность Вам ничего не даст.
Ну так это примерно то же самое. Перефразируя, если неизвестны кислоты, то сравнительный набор плотностей не позволит их идентифицировать при отсутствии сведений о концентрациях.
Там же не только неизвестно, что где — там и концентрации неизвестны. Если бы, скажем, было точно известно, что они все 30%, тогда по плотности можно было бы определить.
Не известна ни плотность, ни концентрация. Как узнать?