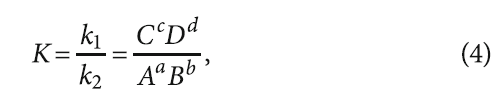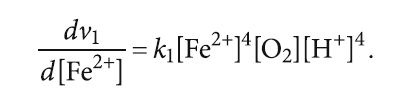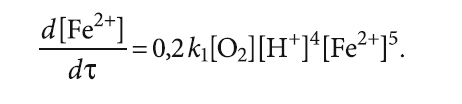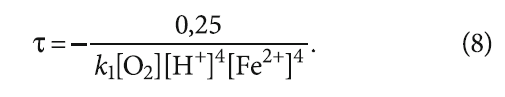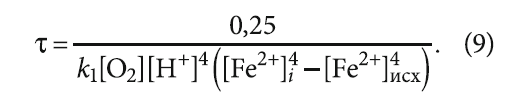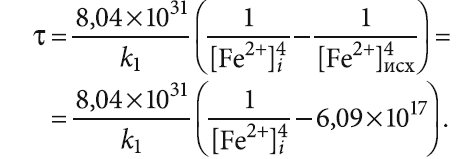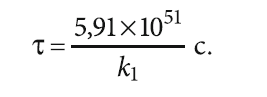Массовое соотношение железа (Fe) и кислорода (O) в некотором бинарном соединении составляет 21:8.
Определите формулу соединения.
Решение задачи
Напомню то, что бинарные соединения – сложные вещества, состоящие из двух элементов.
Исходя из отношения масс, найдем атомное отношение элементов. Для этого, учитывая молярные массы железа (Fe) и кислорода (O) (смотри таблицу Менделеева):
M (Fe) = 56 (г/моль)
M (O) = 16 (г/моль)
Массы железа (Fe) и кислорода (O) разделим на соответствующие молярные массы этих элементов. То есть, используя формулу нахождения химического количества вещества:
найдем отношение числа молей железа (Fe) и кислорода (O) и соответственно отношение числа атомов этих элементов:
Следовательно, искомая формула соединения – FeO (оксид железа (II)).
Ответ:
формула соединения FeO.
Железо Fe: химические свойства, способы получения железа, взаимодействие с простыми веществами (кислород, сера) и со сложными веществами (кислоты, вода, сильные окислители). Оксид железа (II) FeO, оксид железа (III) Fe2O3, железная окалина (Fe3O4) — способы получения и химические свойства. Гидроксид железа (II) Fe(OH)2, гидроксид железа (III) Fe(OH)3 — способы получения и химические свойства.
Положение железа в периодической системе химических элементов
Электронное строение железа
Физические свойства
Нахождение в природе
Способы получения
Качественные реакции
Химические свойства
1. Взаимодействие с простыми веществами
1.1. Взаимодействие с галогенами
1.2. Взаимодействие с серой
1.3. Взаимодействие с фосфором
1.4. Взаимодействие с азотом
1.5. Взаимодействие с углеродом
1.6. Горение
2. Взаимодействие со сложными веществами
2.1. Взаимодействие с водой
2.2. Взаимодействие с минеральными кислотами
2.3. Взаимодействие с серной кислотой
2.4. Взаимодействие с азотной кислотой
2.5. Взаимодействие с сильными окислителями
2.6. Взаимодействие с оксидами и солями
Оксид железа (II)
Способы получения
Химические свойства
1. Взаимодействие с кислотными оксидами
2. Взаимодействие с кислотами
3. Взаимодействие с водой
4. Взаимодействие с окислителями
5. Взаимодействие с кислотами
6. Взаимодействие с восстановителями
Оксид железа (III)
Способы получения
Химические свойства
1. Взаимодействие с кислотными оксидами и кислотами
2. Взаимодействие с щелочами и основными оксидами
3. Взаимодействие с водой
4. Взаимодействие с окислителями
5. Окислительные свойства оксида железа (III)
6. Взаимодействие с солями более летучих кислот
Оксид железа (II, III)
Способы получения
Химические свойства
1. Взаимодействие с кислотными оксидами и кислотами
2. Взаимодействие с сильными кислотами-окислителями
3. Взаимодействие с водой
4. Взаимодействие с окислителями
5. Окислительные свойства оксида железа (II, III)
Гидроксид железа (II)
Способы получения
Химические свойства
1. Взаимодействие с кислотами
2. Взаимодействие с кислотными оксидами
3. Восстановительные свойства
4. Разложение при нагревании
Гидроксид железа (III)
Способы получения
Химические свойства
1. Взаимодействие с кислотами
2. Взаимодействие с кислотными оксидами
3. Взаимодействие с щелочами
4. Разложение при нагревании
Соли железа
Железо
Положение в периодической системе химических элементов
Элемент железо расположен в побочной подгруппе VIII группы (или в 8 группе в современной форме ПСХЭ) и в четвертом периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение атома железа
Электронная конфигурация железа в основном состоянии:
+26Fe 1s22s22p63s23p64s23d6
Железо проявляет ярко выраженные магнитные свойства.
Физические свойства
Железо – металл серебристо-белого цвета, с высокой химической активностью и высокой ковкостью. Обладает высокой тепло- и электропроводностью.

Температура плавления 1538оС, температура кипения 2861оС.
Нахождение в природе
Железо довольно распространено в земной коре (порядка 4% массы земной коры). По распространенности на Земле железо занимает 4-ое место среди всех элементов и 2-ое место среди металлов. Содержание в земной коре — около 8%.
В природе железо в основном встречается в виде соединений:
Красный железняк Fe2O3 (гематит).

Магнитный железняк Fe3O4 или FeO·Fe2O3 (магнетит).
(изображение с портала emchi-med.ru)
В природе также широко распространены сульфиды железа, например, пирит FeS2.

Встречаются и другие минералы, содержащие железо.
Способы получения
Железо в промышленности получают из железной руды, гематита Fe2O3 или магнетита (Fe3O4или FeO·Fe2O3).
1. Один из основных способов производства железа – доменный процесс. Доменный процесс основан на восстановлении железа из оксида углеродом в доменной печи.
В печь загружают руду, кокс и флюсы.
Шихта – смесь исходных материалов, а в некоторых случаях и топлива в определённой пропорции, которую обрабатывают в печи.
Каменноугольный кокс – это твёрдый пористый продукт серого цвета, получаемый путем коксования каменного угля при температурах 950—1100 °С без доступа воздуха. Содержит 96—98 % углерода.
Флюсы – это неорганические вещества, которые добавляют к руде при выплавке металлов, чтобы снизить температуру плавления и легче отделить металл от пустой породы.
Шлак – расплав (а после затвердевания – стекловидная масса), покрывающий поверхность жидкого металла. Шлак состоит из всплывших продуктов пустой породы с флюсами и предохраняет металл от вредного воздействия газовой среды печи, удаляет примеси.
В печи кокс окисляется до оксида углерода (II):
2C + O2 → 2CO
Затем нагретый угарный газ восстанавливает оксид железа (III):
3CO + Fe2O3 → 3CO2 + 2Fe
Процесс получения железа – многоэтапный и зависит от температуры.
Наверху, где температура обычно находится в диапазоне между 200 °C и 700 °C, протекает следующая реакция:
3Fe2O3 + CO → 2Fe3O4 + CO2
Ниже в печи, при температурах приблизительно 850 °C, протекает восстановление смешанного оксида железа (II, III) до оксида железа (II):
Fe3O4 + CO → 3FeO + CO2
Встречные потоки газов разогревают шихту, и происходит разложение известняка:
CaCO3 → CaO + CO2
Оксид железа (II) опускается в область с более высоких температур (до 1200oC), где протекает следующая реакция:
FeO + CO → Fe + CO2
Углекислый газ поднимается вверх и реагирует с коксом, образуя угарный газ:
CO2 + C → 2CO

2. Также железо получают прямым восстановлением из оксида водородом:
Fe2O3 + 3H2 → 2Fe + 3H2O
При этом получается более чистое железо, т.к. получаемое железо не загрязнено серой и фосфором, которые являются примесями в каменном угле.
3. Еще один способ получения железа в промышленности – электролиз растворов солей железа.
Качественные реакции
Качественные реакции на ионы железа +2.
– взаимодействие солей железа (II) с щелочами. При этом образуется серо-зеленый студенистый осадок гидроксида железа (II).
Например, хлорид железа (II) реагирует с гидроксидом натрия:
2NaOH + FeCl2 → Fe(OH)2 + 2NaCl
Видеоопыт взаимодействия раствора сульфата железа (II) с раствором гидроксида натрия (качественная реакция на ионы железа (II)) можно посмотреть здесь.
Гидроксид железа (II) на воздухе буреет, так как окисляется до гидроксида железа (III):
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3
– ионы железа +2 окрашивают раствор в светлый желто-зеленый цвет.
– взаимодействие с красной кровяной солью K3[Fe(CN)6] – также качественная реакция на ионы железа +2. При этом образуется синий осадок «турнбулева синь».
Видеоопыт взаимодействия раствора хлорида железа (II) с раствором гексацианоферрата (III) калия (качественная реакция на ионы железа (II)) можно посмотреть здесь.
Качественные реакции на ионы железа +3
– взаимодействие солей железа (III) с щелочами. При этом образуется бурый осадок гидроксида железа (III).

Например, хлорид железа (III) реагирует с гидроксидом натрия:
3NaOH + FeCl3 → Fe(OH)3 + 3NaCl
Видеоопыт взаимодействия раствора хлорида железа (III) с раствором гидроксида натрия (качественная реакция на ионы железа (III)) можно посмотреть здесь.
– ионы железа +3 окрашивают раствор в светлый желто-оранжевый цвет.
– взаимодействие с желтой кровяной солью K4[Fe(CN)6] ионы железа +3. При этом образуется синий осадок «берлинская лазурь».
Видеоопыт взаимодействия раствора хлорида железа (III) с раствором гексацианоферрата (II) калия (качественная реакция на ионы железа (III)) можно посмотреть здесь.
В последнее время получены данные, которые свидетельствуют, что молекулы берлинской лазури идентичны по строению молекулам турнбулевой сини. Состав молекул обоих этих веществ можно выразить формулой Fe4[Fe2(CN)6]3.
– при взаимодействии солей железа (III) с роданидами раствор окрашивается в кроваво-красный цвет.
Например, хлорид железа (III) взаимодействует с роданидом натрия:
FeCl3 + 3NaCNS → Fe(CNS)3 + 3NaCl
Видеоопыт взаимодействия раствора хлорида железа (III) с раствором роданида калия (качественная реакция на ионы железа (III)) можно посмотреть здесь.
Химические свойства
1. При обычных условиях железо малоактивно, но при нагревании, в особенности в мелкораздробленном состоянии, оно становится активным и реагирует почти со всеми неметаллами.
1.1. Железо реагирует с галогенами с образованием галогенидов. При этом активные неметаллы (фтор, хлор и бром) окисляют железо до степени окисления +3:
2Fe + 3Cl2 → 2FeCl3
Менее активный йод окисляет железо до степени окисления +2:
Fe + I2 → FeI2
1.2. Железо реагирует с серой с образованием сульфида железа (II):
Fe + S → FeS
1.3. Железо реагирует с фосфором. При этом образуется бинарное соединения – фосфид железа:
Fe + P → FeP
1.4. С азотом железо реагирует в специфических условиях.
1.5. Железо реагирует с углеродом и кремнием с образованием карбида и силицида.
1.6. При взаимодействии с кислородом железо образует окалину – двойной оксид железа (II, III):
3Fe + 2O2 → Fe3O4
При пропускании кислорода через расплавленное железо возможно образование оксида железа (II):
2Fe + O2 → 2FeO
2. Железо взаимодействует со сложными веществами.
2.1. При обычных условиях железо с водой практически не реагирует. Раскаленное железо может вступать в реакцию при температуре 700-900оС с водяным паром:
3Fe0 + 4H2+O → Fe+33O4 + 4H20
В воде в присутствии кислорода или во влажном воздухе железо медленно окисляется (корродирует):
4Fe + 3O2 + 6H2O → 4Fe(OH)3
2.2. Железо взаимодействуют с минеральными кислотами (с соляной, фосфорной и разбавленной серной кислотой). При этом образуются соль железа со степенью окисления +2 и водород.
Например, железо бурно реагирует с соляной кислотой:
Fe + 2HCl → FeCl2 + H2↑
2.3. При обычных условиях железо не реагирует с концентрированной серной кислотой из-за пассивации – образования плотной оксидной пленки. При нагревании реакция идет, образуются оксид серы (IV), сульфат железа (III) и вода:
2Fe + 6H2SO4(конц.) → Fe2(SO4)3 + 3SO2 + 6H2O
2.4. Железо не реагирует при обычных условиях с концентрированной азотной кислотой также из-за пассивации. При нагревании реакция идет с образованием нитрата железа (III), оксида азота (IV) и воды:
Fe + 6HNO3(конц.) → Fe(NO3)3 + 3NO2↑ + 3H2O
С разбавленной азотной кислотой железо реагирует с образованием оксида азота (II):
Fe + 4HNO3(разб.гор.) → Fe(NO3)3 + NO + 2H2O
При взаимодействии железа с очень разбавленной азотной кислотой образуется нитрат аммония:
8Fe + 30HNO3(оч. разб.) → 8Fe(NO3)3 + 3NH4NO3 + 9H2O
2.5. Железо может реагировать с щелочными растворами или расплавами сильных окислителей. При этом железо окисляет до степени окисления +6, образуя соль (феррат).
Например, при взаимодействии железа с расплавом нитрата калия в присутствии гидроксида калия железо окисляется до феррата калия, а азот восстанавливается либо до нитрита калия, либо до аммиака:
Fe + 2KOH + 3KNO3 → 3KNO2 + K2FeO4 + H2O
2.6. Железо восстанавливает менее активные металлы из оксидов и солей.
Например, железо вытесняет медь из сульфата меди (II). Реакция экзотермическая:
Fe + CuSO4 → FeSO4 + Cu
Еще пример: простое вещество железо восстанавливает железо до степени окисления +2 при взаимодействии с соединениями железа +3:
2Fe(NO3)3 + Fe → 3Fe(NO3)2
2FeCl3 + Fe → 3FeCl2
Fe2(SO4)3 + Fe → 3FeSO4
Оксид железа (II)
Оксид железа (II) – это твердое, нерастворимое в воде вещество черного цвета.
Способы получения
Оксид железа (II) можно получить различными методами:
1. Частичным восстановлением оксида железа (III).
Например, частичным восстановлением оксида железа (III) водородом:
Fe2O3 + H2 → 2FeO + H2O
Или частичным восстановлением оксида железа (III) угарным газом:
Fe2O3 + CO → 2FeO + CO2
Еще один пример: восстановление оксида железа (III) железом:
Fe2O3 + Fe → 3FeO
2. Разложение гидроксида железа (II) при нагревании:
Fe(OH)2 → FeO + H2O
Химические свойства
Оксид железа (II) — типичный основный оксид.
1. При взаимодействии оксида железа (II) с кислотными оксидами образуются соли.
Например, оксид железа (II) взаимодействует с оксидом серы (VI):
FeO + SO3 → FeSO4
2. Оксид железа (II) взаимодействует с растворимыми кислотами. При этом также образуются соответствующие соли.
Например, оксид железа (II) взаимодействует с соляной кислотой:
FeO + 2HCl → FeCl2 + H2O
3. Оксид железа (II) не взаимодействует с водой.
4. Оксид железа (II) малоустойчив, и легко окисляется до соединений железа (III).
Например, при взаимодействии с концентрированной азотной кислотой образуются нитрат железа (III), оксид азота (IV) и вода:
FeO + 4HNO3(конц.) → NO2 + Fe(NO3)3 + 2H2O
При взаимодействии с разбавленной азотной кислотой образуется оксид азота (II). Реакция идет при нагревании:
3FeO + 10HNO3(разб.) → 3Fe(NO3)3 + NO + 5H2O
5. Оксид железа (II) проявляет слабые окислительные свойства.
Например, оксид железа (II) реагирует с угарным газом при нагревании:
FeO + CO → Fe + CO2
Оксид железа (III)
Оксид железа (III) – это твердое, нерастворимое в воде вещество красно-коричневого цвета.
Способы получения
Оксид железа (III) можно получить различными методами:
1. Окисление оксида железа (II) кислородом.
4FeO + O2 → 2Fe2O3
2. Разложение гидроксида железа (III) при нагревании:
2Fe(OH)3 → Fe2O3 + 3H2O
Химические свойства
Оксид железа (III) – амфотерный.
1. При взаимодействии оксида железа (III) с кислотными оксидами и кислотами образуются соли.
Например, оксид железа (III) взаимодействует с азотной кислотой:
Fe2O3 + 6HNO3 → 2Fe(NO3)3 + 3H2O
2. Оксид железа (III) взаимодействует с щелочами и основными оксидами. Реакция протекает в расплаве, при этом образуется соответствующая соль (феррит).
Например, оксид железа (III) взаимодействует с гидроксидом натрия:
Fe2O3 + 2NaOH → 2NaFeO2 + H2O
3. Оксид железа (III) не взаимодействует с водой.
4. Оксид железа (III) окисляется сильными окислителями до соединений железа (VI).
Например, хлорат калия в щелочной среде окисляет оксид железа (III) до феррата:
Fe2O3 + KClO3 + 4KOH → 2K2FeO4 + KCl + 2H2O
Нитраты и нитриты в щелочной среде также окисляют оксид железа (III):
Fe2O3 + 3KNO3 + 4KOH → 2K2FeO4 + 3KNO2 + 2H2O
5. Оксид железа (III) проявляет окислительные свойства.
Например, оксид железа (III) реагирует с угарным газом при нагревании. При этом возможно восстановление как до чистого железа, так и до оксида железа (II) или железной окалины:
Fe2O3 + 3СO → 2Fe + 3CO2
Также оксид железа (III) восстанавливается водородом:
Fe2O3 + 3Н2 → 2Fe + 3H2O
Железом можно восстановить оксид железа только до оксида железа (II):
Fe2O3 + Fe → 3FeO
Оксид железа (III) реагирует с более активными металлами.
Например, с алюминием (алюмотермия):
Fe2O3 + 2Al → 2Fe + Al2O3
Оксид железа (III) реагирует также с некоторыми другими сильными восстановителями.
Например, с гидридом натрия:
Fe2O3 + 3NaH → 3NaOH + 2Fe
6. Оксид железа (III) – твердый, нелетучий и амфотерный. А следовательно, он вытесняет более летучие оксиды (как правило, углекислый газ) из солей при сплавлении.
Например, из карбоната натрия:
Fe2O3 + Na2CO3 → 2NaFeO2 + CO2
Оксид железа (II, III)
Оксид железа (II, III) (железная окалина, магнетит) – это твердое, нерастворимое в воде вещество черного цвета.
Фото с сайта wikipedia.ru
Способы получения
Оксид железа (II, III) можно получить различными методами:
1. Горение железа на воздухе:
3Fe + 2O2 → Fe3O4
2. Частичное восстановление оксида железа (III) водородом или угарным газом:
3Fe2O3 + Н2 → 2Fe3O4 + H2O
3. При высокой температуре раскаленное железо реагирует с водой, образуя двойной оксид железа (II, III):
3Fe + 4H2O(пар) → Fe3O4 + 4H2
Химические свойства
Свойства оксида железа (II, III) определяются свойствами двух оксидов, из которых он состоит: основного оксида железа (II) и амфотерного оксида железа (III).
1. При взаимодействии оксида железа (II, III) с кислотными оксидами и кислотами образуются соли железа (II) и железа (III).
Например, оксид железа (II, III) взаимодействует с соляной кислотой. При это образуются две соли – хлорид железа (II) и хлорид железа (III):
Fe3O4 + 8HCl → FeCl2 + 2FeCl3 + 4H2O
Еще пример: оксид железа (II, III) взаимодействует с разбавленной серной кислотой.
Fe3O4 + 4H2SO4(разб.) → Fe2(SO4)3 + FeSO4 + 4Н2О
2. Оксид железа (II, III) взаимодействует с сильными кислотами-окислителями (серной-концентрированной и азотной).
Например, железная окалина окисляется концентрированной азотной кислотой:
Fe3O4 + 10HNO3(конц.) → NO2↑ + 3Fe(NO3)3 + 5H2O
Разбавленной азотной кислотой окалина окисляется при нагревании:
3Fe3O4 + 28HNO3(разб.) → 9Fe(NO3)3 + NO + 14H2O
Также оксид железа (II, III) окисляется концентрированной серной кислотой:
2Fe3O4 + 10H2SO4(конц.) → 3Fe2(SO4)3 + SO2 + 10H2O
Также окалина окисляется кислородом воздуха:
4Fe3O4 + O2(воздух) → 6Fe2O3
3. Оксид железа (II, III) не взаимодействует с водой.
4. Оксид железа (II, III) окисляется сильными окислителями до соединений железа (VI), как и прочие оксиды железа (см. выше).
5. Железная окалина проявляет окислительные свойства.
Например, оксид железа (II, III) реагирует с угарным газом при нагревании. При этом возможно восстановление как до чистого железа, так и до оксида железа (II):
Fe3O4 + 4CO → 3Fe + 4CO2
Также железная окалина восстанавливается водородом:
Fe3O4 + 4H2 → 3Fe + 4H2O
Оксид железа (II, III) реагирует с более активными металлами.
Например, с алюминием (алюмотермия):
3Fe3O4 + 8Al → 9Fe + 4Al2O3
Оксид железа (II, III) реагирует также с некоторыми другими сильными восстановителями (йодидами и сульфидами).
Например, с йодоводородом:
Fe3O4 + 8HI → 3FeI2 + I2 + 4H2O
Гидроксид железа (II)
Способы получения
1. Гидроксид железа (II) можно получить действием раствора аммиака на соли железа (II).
Например, хлорид железа (II) реагирует с водным раствором аммиака с образованием гидроксида железа (II) и хлорида аммония:
FeCl2 + 2NH3 + 2H2O → Fe(OH)2 + 2NH4Cl
2. Гидроксид железа (II) можно получить действием щелочи на соли железа (II).
Например, хлорид железа (II) реагирует с гидроксидом калия с образованием гидроксида железа (II) и хлорида калия:
FeCl2 + 2KOH → Fe(OH)2↓ + 2KCl
Химические свойства
1. Гидроксид железа (II) проявляется основные свойства, а именно реагирует с кислотами. При этом образуются соответствующие соли.
Например, гидроксид железа (II) взаимодействует с соляной кислотой с образованием хлорида железа (II):
Fe(OH)2 + 2HCl → FeCl2 + 2H2O
Fe(OH)2 + H2SO4 → FeSO4 + 2H2O
Fe(OH)2 + 2HBr → FeBr2 + 2H2O
2. Гидроксид железа (II) взаимодействует с кислотными оксидами сильных кислот.
Например, гидроксид железа (II) взаимодействует с оксидом серы (VI) с образованием сульфата железа (II):
Fe(OH)2 + SO3 → FeSO4 + 2H2O
3. Гидроксид железа (II) проявляет сильные восстановительные свойства, и реагирует с окислителями. При этом образуются соединения железа (III).
Например, гидроксид железа (II) взаимодействует с кислородом в присутствии воды:
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3↓
Гидроксид железа (II) взаимодействует с пероксидом водорода:
2Fe(OH)2 + H2O2 → 2Fe(OH)3
При растворении Fe(OH)2 в азотной или концентрированной серной кислотах образуются соли железа (III):
2Fe(OH)2 + 4H2SO4(конц.) → Fe2(SO4)3 + SO2 + 6H2O
4. Гидроксид железа (II) разлагается при нагревании:
Fe(OH)2 → FeO + H2O
Гидроксид железа (III)
Способы получения
1. Гидроксид железа (III) можно получить действием раствора аммиака на соли железа (III).
Например, хлорид железа (III) реагирует с водным раствором аммиака с образованием гидроксида железа (III) и хлорида аммония:
FeCl3 + 3NH3 + 3H2O = Fe(OH)3 + 3NH4Cl
2. Окислением гидроксида железа (II) кислородом или пероксидом водорода:
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3↓
2Fe(OH)2 + H2O2 → 2Fe(OH)3
3. Гидроксид железа (III) можно получить действием щелочи на раствор соли железа (III).
Например, хлорид железа (III) реагирует с раствором гидроксида калия с образованием гидроксида железа (III) и хлорида калия:
FeCl3 + 3KOH → Fe(OH)3↓ + 3KCl
Видеоопыт получения гидроксида железа (III) взаимодействием хлорида железа (III) и гидроксида калия можно посмотреть здесь.
4. Также гидроксид железа (III) образуется при взаимодействии растворимых солей железа (III) с растворами карбонатов и сульфитов. Карбонаты и сульфиты железа (III) необратимо гидролизуются в водном растворе.
Например: бромид железа (III) реагирует с карбонатом натрия. При этом выпадает осадок гидроксида железа (III), выделяется углекислый газ и образуется бромид натрия:
2FeBr3 + 3Na2CO3 + 3H2O = 2Fe(OH)3↓ + CO2↑ + 6NaBr
Но есть исключение! Взаимодействие солей железа (III) с сульфитами в ЕГЭ по химии — окислительно-восстановительная реакция. Соединения железа (III) окисляют сульфиты, а также сульфиды и иодиды.
Взаимодействие хлорида железа (III) с сульфитом, например, калия — очень интересная реакция. Во-первых, в некоторых источниках указывается, что в ней таки может протекать необратимый гидролиз. Но для ЕГЭ лучше считать, что при этом протекает ОВР. Во-вторых, ОВР можно записать в разных видах:
2FeCl3 + Na2SO3 + H2O = 2FeCl2 + Na2SO4 + 2HCl
Также допустима такая запись:
2FeCl3 + Na2SO3 + H2O = FeSO4 + 2NaCl + FeCl2 + 2HCl
Химические свойства
1. Гидроксид железа (III) проявляет слабовыраженные амфотерные свойства, с преобладанием основных. Как основание, гидроксид железа (III) реагирует с растворимыми кислотами.
Например, гидроксид железа (III) взаимодействует с азотной кислотой с образованием нитрата железа (III):
Fe(OH)3 + 3HNO3 → Fe(NO3)3 + 3H2O
Fe(OH)3 + 3HCl → FeCl3 + 3H2O
2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 6H2O
Fe(OH)3 + 3HBr → FeBr3 + 3H2O
2. Гидроксид железа (III) взаимодействует с кислотными оксидами сильных кислот.
Например, гидроксид железа (III) взаимодействует с оксидом серы (VI) с образованием сульфата железа (III):
2Fe(OH)3 + 3SO3 → Fe2(SO4)3 + 3H2O
3. Гидроксид железа (III) взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли—ферриты, а в растворе реакция практически не идет. При этом гидроксид железа (III) проявляет кислотные свойства.
Например, гидроксид железа (III) взаимодействует с гидроксидом калия в расплаве с образованием феррита калия и воды:
KOH + Fe(OH)3 → KFeO2 + 2H2O
4. Гидроксид железа (III) разлагается при нагревании:
2Fe(OH)3 → Fe2O3 + 3H2O
Видеоопыт взаимодействия гидроксида железа (III) с соляной кислотой можно посмотреть здесь.
Соли железа
Нитраты железа
Нитрат железа (II) при нагревании разлагается на оксид железа (III), оксид азота (IV) и кислород:
4Fe(NO3)2 → 2Fe2O3 + 8NO2 + O2
Нитрат железа (III) при нагревании разлагается также на оксид железа (III), оксид азота (IV) и кислород:
4Fe(NO3)3 → 2Fe2O3 + 12NO2 + 3O2
Гидролиз солей железа
Растворимые соли железа, образованные кислотными остатками сильных кислот гидролизуются по катиону. Гидролиз протекает ступенчато и обратимо, т.е. частично:
I ступень: Fe3+ + H2O ↔ FeOH2+ + H+
II ступень: FeOH2+ + H2O ↔ Fe(OH)2+ + H+
III ступень: Fe(OH)2+ + H2O ↔ Fe(OH)3 + H+
Однако сульфиты и карбонаты железа (III) и их кислые соли гидролизуются необратимо, полностью, т.е. в водном растворе не существуют, а разлагаются водой:
Fe2(SO4)3 + 6NaHSO3 → 2Fe(OH)3 + 6SO2 + 3Na2SO4
2FeBr3 + 3Na2CO3 + 3H2O → 2Fe(OH)3↓ + CO2↑ + 6NaBr
2Fe(NO3)3 + 3Na2CO3 + 3H2O → 2Fe(OH)3↓ + 6NaNO3 + 3CO2↑
2FeCl3 + 3Na2CO3 + 3H2O → 2Fe(OH)3↓ + 6NaCl + 3CO2↑
Fe2(SO4)3 + 3K2CO3 + 3H2O → 2Fe(OH)3↓ + 3CO2↑ + 3K2SO4
При взаимодействии соединений железа (III) с сульфидами протекает ОВР:
2FeCl3 + 3Na2S → 2FeS + S + 6NaCl
Более подробно про гидролиз можно прочитать в соответствующей статье.
Окислительные свойства железа (III)
Соли железа (III) под проявляют довольно сильные окислительные свойств. Так, при взаимодействии соединений железа (III) с сульфидами протекает окислительно-восстановительная реакция.
Например: хлорид железа (III) взаимодействует с сульфидом натрия. При этом образуется сера, хлорид натрия и либо черный осадок сульфида железа (II) (в избытке сульфида натрия), либо хлорид железа (II) (в избытке хлорида железа (III)):
2FeCl3 + 3Na2S → 2FeS + S + 6NaCl
2FeCl3 + Na2S → 2FeCl2 + S + 2NaCl
По такому же принципу соли железа (III) реагируют с сероводородом:
2FeCl3 + H2S → 2FeCl2 + S + 2HCl
Соли железа (III) также вступают в окислительно-восстановительные реакции с йодидами.
Например, хлорид железа (III) взаимодействует с йодидом калия. При этом образуются хлорид железа (II), молекулярный йод и хлорид калия:
2FeCl3 + 2KI → 2FeCl2 + I2 + 2KCl
Интерес представляют также реакции солей железа (III) с металлами. Мы знаем, что более активные металлы вытесняют из солей менее активные металлы. Иначе говоря, металлы, которые стоят в электрохимическом ряду левее, могут взаимодействовать с солями металлов, которые расположены в этом ряду правее. Исходя из этого правила, соли железа могут взаимодействовать только с металлами, которые расположены до железа. И они взаимодействуют.
Однако, соли железа со степенью окисления +3 в этом ряду являются небольшим исключением. Ведь для железа характерны две степени окисления: +2 и +3. И железо со степенью окисления +3 является более сильным окислителем. Таким образом, условно говоря, железо со степенью окисления +3 расположено в ряду активности после меди. И соли железа (III) могут реагировать еще и с металлами, которые расположены правее железа! Но до меди, включительно. Вот такой парадокс.
И еще один момент. Соединения железа (III) с этими металлами реагировать будут, а вот соединения железа (II) с ними реагировать не будут. Таким образом, металлы, расположенные в ряду активности между железом и медью (включая медь) при взаимодействии с солями железа (III) восстанавливают железо до степени окисления +2. А вот металлы, расположенные до железа в ряду активности, могут восстановить железо и до простого вещества.
Например, хлорид железа (III) взаимодействует с медью. При этом образуются хлорид железа (II) и хлорид меди (II):
2FeCl3 + Cu → 2FeCl2 + CuCl2
А вот реакция нитрата железа (III) с цинком протекает уже по привычному механизму. И железо восстанавливается до простого вещества:
2Fe(NO3)3 + 3Zn → 2Fe + 3Zn(NO3)2
поделиться знаниями или
запомнить страничку
- Все категории
-
экономические
43,663 -
гуманитарные
33,654 -
юридические
17,917 -
школьный раздел
611,987 -
разное
16,906
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Во-первых, глубина окисления Fe3+/Fe2+ является расчётной величиной, показывающей предельное теоретическое соотношение трёхи двухвалентного железа при конкретных условиях. Назовём её Fe3+/Fe2+пред. По расчётным данным (на основе имевшихся у автора результатов анализов воды), отношение Fe3+/Fe2+пред после фильтров обезжелезивания должно находиться в диапазоне от 0,4 до 3000. Однако натурные наблюдения показывают, что после стадии фильтрации Fe3+/Fe2+ редко составляет более 10, а чаще находится в пределах 1,5–2,0. Во-вторых, следует разъяснить роль кислорода в протекании процесса, учитывая, что с ростом его концентрации глубина окисления снижается.
По мнению автора, оба замечания связаны со временем протекания процесса окисления в сооружениях водоподготовки, о чём дальше и пойдёт речь.
Скорость химической реакции (измеряемая обычно в [моль·л/с]) определяется законом действующих масс (законом Гульдберга — Вааге), согласно которому скорость прямо пропорциональна концентрациям действующих веществ, возведённым в стехиометрические коэффициенты. Учитывая, что в системе протекают как прямая, так и обратная реакции, то скорости прямой v1 и обратной v2 реакций для химического уравнения
Аа + Bb = Cc + Dd (1)
будут равны
v1 = k1AaBb и v2 = k2CcDd, (2)
где k1 и k2 — константы скоростей прямой и обратной реакций.
При равенстве скоростей v1 и v2 наступает динамическое равновесие, и тогда
k1AaBb = k2CcDd. (3)
Выражение (3) можно представить в виде
где K — константа химического равновесия данной реакции.
Из уравнения (2) нетрудно заметить, что по ходу реакции количество исходных веществ уменьшается, следовательно, снижается и скорость прямой реакции, а обратной, наоборот, возрастает.
Для реакции окисления двухвалентного железа до трёхвалентного
4Fe2+ + O2 + 4H+ = 4Fe3+ + 2H2O (5)
константа химического равновесия составляет K = 1,05×1031, что свидетельствует о смещении химического равновесия вправо настолько, что обратной реакцией можно пренебречь, то есть обратного процесса восстановления двухвалентного железа из трёхвалентного практически не происходит.
Скорость прямой реакции при этом будет выражена как
v1 = k1[Fe2+]4[O2][H+]4. (6)
Следует заметить, что в реакции (5) один моль кислорода взаимодействует с четырьмя молями двухвалентного железа, то есть на окисление 1 мг двухвалентного железа расходуется 0,29 мг кислорода. Поскольку, по данным наблюдений, содержание кислорода даже в неаэрированной исходной подземной воде составляло не менее 1,2 мг/л, то можно считать, что кислорода практически всегда достаточно для полного прохождения реакции, особенно после аэрирования воды. Хотя, если говорить строго, малое содержание кислорода соответствует малой скорости протекания реакции, что и следует из уравнения (6). Также отмечено, что рН воды при протекании реакции существенно не меняется. Следовательно, примем, что скорость прямой реакции v1 зависит исключительно от содержания двухвалентного железа Fe2+.
Реакцию (5), по мнению автора, можно рассматривать как гомогенную (полагая, что реагируют растворённые вещества) или гетерогенную (полагая, что реагируют растворённые вещества в ионной форме с газом). Порядок химической реакции должен определяться опытным путём.
Простое вещество железо — ковкий металл серебристо-белого цвета с высокой химической реакционной способностью. Химически чистое железо получают электролизом его солей
Продифференцируем выражение (6) по времени:
Решением данного уравнения будет
k1[O2][H+]4[Fe2+]5. (7)
В свою очередь, скорость окисления v1 является частным от деления d[Fe2+]/dτ, где τ — время. Тогда
Отсюда
Выражение (8) показывает, что окисление двухвалентного железа наступает быстрее при более низких значениях рН и при росте содержания кислорода, хотя при этом глубина окисления снижается, как было показано ранее.
Следует заметить, что содержание кислорода [O2] при принудительной аэрации с помощью эжектора или компрессора в точке подачи воздуха может быть выше, чем показывают анализы очищенной (обезжелезенной) воды, поскольку, согласно уравнению Генри — Дальтона, растворимость газов (в нашем случае кислорода) прямо пропорциональна давлению подаваемого газа.
Знак «минус» в формуле (8) смущать не должен, так как содержание двухвалентного железа [Fe]i изменяется от [Fe]исх до [Fe]пред, определяемого соотношением Fe3+/Fe2+.
Подставив [Fe]исх и [Fe]i в (7), получим следующее выражение
В выражении (9) известны (определяются анализами воды) значения всех параметров, кроме константы скорости прямой реакции k1.
В рассмотренном в [1] примере заданы следующие показатели качества воды (после устройств аэрации): [O2] = 2,5 мг/л, рН = 7,1, исходное содержание [Fe2+]исх примем равным содержанию общего железа на входе в сооружения — 1,0 мг/л. Концентрации тех же веществ, выраженные в [моль/л], будут следующими: [O2] = 7,81×10–5 моль/л, [H+] = 10–7,1 моль/л, [Fe2+]исх = 3,58×10–5 моль/л. Тогда
Конечное значение [Fe2+]i можно принять равным 0,3 мг/л (1,08×10–5 моль/л), как предельно допустимое содержание железа согласно СанПиН 2.1.3684–21, предполагая при этом, что трёхвалентное железо будет почти полностью гидролизировано и выделится в виде малорастворимого осадка. И тогда
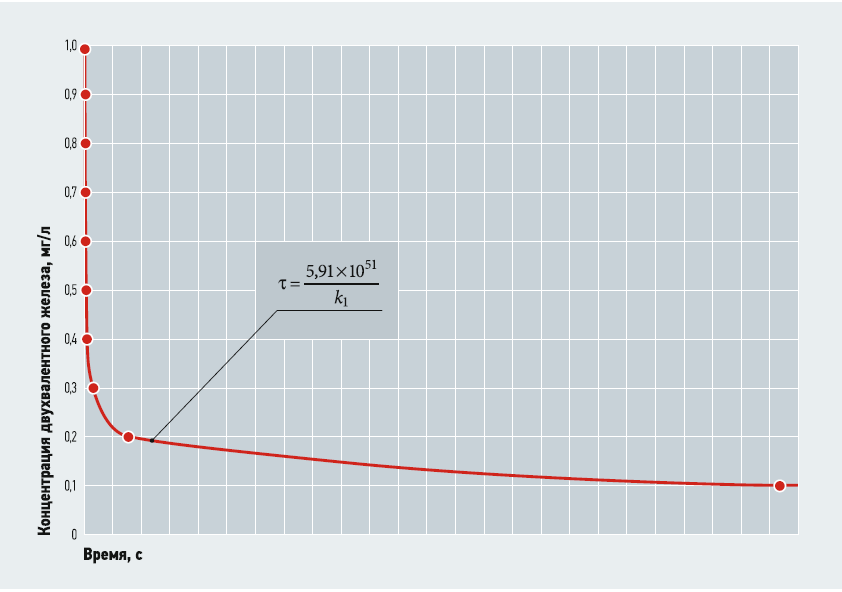
В данном выражении неизвестным является значение константы скорости химической (в данном случае прямой) реакции k1. Изменение концентрации двухвалентного железа во времени (без учёта значения k1) показано на рис. 1. Из рис. 1 видно, что сначала концентрация двухвалентного железа быстро снижается, а затем, примерно с 0,3–0,4 мг/л, это снижение резко замедляется. Для достижения [Fe2+] = 0,1 мг/л требуется уже весьма значительное время. Видимо, это одна из причин того, что уменьшить содержание одного из исходных веществ реакции ниже определённого предела бывает крайне затруднительно.
Рис. 1. Изменение концентрации двухвалентного железа во времени (без учёта значения k1)
Оценить непосредственно время окисления до некого [Fe2+]i не представляется возможным вследствие отсутствия достоверных значений k1.
Как известно, константа скорости реакции не зависит от концентрации веществ, а зависит от температуры. Эта зависимость выражается уравнением Аррениуса, которое имеет следующий вид:
где А — предэкспоненциальный множитель, который характеризует частоту столкновений реагирующих молекул (ионов); Ea — энергия активации — минимальная энергия частиц (молекул, атомов, ионов), достаточная для того, чтобы они вступили в реакцию, преодолев потенциальный энергетический барьер; R — универсальная газовая постоянная; Т — абсолютная температура.
Собственно, уравнение Аррениуса для наших изысканий ничего не даёт, так как величины А и Еа определяются опытным путём, что невозможно, имея только данные наблюдений за работой сооружений водоподготовки. С другой стороны, уравнение Аррениуса позволяет понять некоторые закономерности процесса на качественном уровне.
При насыщении обрабатываемой воды кислородом воздуха увеличиваются глубина окисления двухвалентного железа (за счёт роста Eh) и скорость процесса. Если процесс происходит в свободном объёме вне какой-либо фильтрующей загрузки, то скорость прямой реакции определяется константой k1, зависящей от температуры. Однако окисление двухвалентного железа до трёхвалентного в большей степени происходит не в устройствах аэрации, а в слое фильтрующей загрузки, которая может обладать каталитическими свойствами, либо, что ещё важнее, приобретает каталитические свойства за счёт образования плёнки из ранее выпавшего осадка, то есть процесс становится «автокаталитическим».
Одним из свойств катализатора является способность изменять механизм реакции на энергетически более выгодный, то есть снижать энергию активации Еа. При этом, в соответствии с уравнением Аррениуса, повышается константа скорости прямой реакции k1. С другой стороны, растёт и константа обратной реакции, но для случая обезжелезивания воды это не имеет существенного значения, так как реакция (4) сильно смещена влево, а трёхвалентное железо, по-видимому, легко подвергается гидролизу уже при рН более 4,7 и щёлочности 1 ммоль/л и более (см. [2]) с образованием малорастворимого осадка. Поскольку состояние фильтрующей загрузки при обезжелезивании постоянно меняется, то следует предположить и постоянное изменение значения k1, что объясняет, по-видимому, нестабильную эффективность обезжелезивания во время фильтроцикла: сначала рост эффективности, затем стабилизация качества воды, а далее падение эффективности вплоть до «проскока» повышенных концентраций железа. Изменение значения k1 в ходе процесса фильтрации и, соответственно, скорости окисления двухвалентного железа предполагает куда более сложный характер изменения концентрации двухвалентного (не окислённого) железа по времени, чем показывает рис. 1.
Здесь не рассматривается другая важнейшая составляющая процесса — работа самой загрузки в процессе фильтрации по задержанию и накоплению взвеси. Следует отметить, что изучение процесса фильтрования в течение многих десятилетий не дало существенных результатов для описания процесса с точки зрения практических расчётов (в частности, диссертация автора была посвящена теме фильтрации воды через зернистые загрузки).
Таким образом, изучение и расчёт значений k1 для различных технологических режимов работы сооружений обезжелезивания может быть отдельной интересной и полезной задачей для специалистов по химии воды и водоподготовке.
Если сравнить химический состав Земли с составом Вселенной, то, казалось бы, между ними не должно быть существенных различий, за исключением, пожалуй, водорода, который легко уходит из атмосферы в межпланетное пространство. К сожалению, судить о составе Земли можно лишь по составам атмосферы, гидросферы и земной коры, изученной в глубину не более чем на 20 км. Главная химическая особенность этих трех сфер — необычайно высокое содержание кислорода, что объясняется уже не строением ядер его атомов, а его химическими свойствами. Атомы кислорода способны образовывать прочные химические связи с атомами многих элементов, в том числе кремния и алюминия. В процессе образования земной коры эти элементы накапливались в ней благодаря легкоплавкости их соединений со щелочами. В итоге на поверхности нашей планеты выкристаллизовалась твердая кремнекислородная оболочка. Кислород, не считая воды, входит в состав 1364 минералов. В атмосфере кислород появился около 1,8 млрд. лет назад в результате действия на минералы микроорганизмов. В настоящее время выделение кислорода растениями за счет фотосинтеза возмещает его убыль в атмосфере в ходе процессов окисления, горения, гниения, дыхания. По числу известных природных соединении (432) второе место занимает кремний. Далее по распространенности атомов в земной коре следуют алюминий, натрий, железо, кальций, магний и калий [c.201]
Биоразложение пролитого масла. В зависимости от химической структуры (ароматические углеводороды, нафтены, парафины), содержания гетероорганических соединений и присадок, молекулярной массы и т д., на минеральные масла по-разному воздействуют кислород и микроорганизмы (бактерии, грибки). В аэробных условиях скорость разложения зависит от содержания минеральных солей и микроэлементов, температуры и величины pH. В случае углеводородов, растворенных в воде, скорость их разложения определяется химической структурой и содержанием кислорода в воде. Олефины и ароматические соединения окисляются до кислородосодержащих соединений (спиртов, кетонов, фенолов, карбоновых кислот) в сравнительно короткий срок. На биологическое разложение углеводородов расходуется кислород с образованием аммиака, сероводорода и соли двухвалентного железа и марганца в сложившихся восстановительных условиях. [c.229]
Катализатор представляет со бой пылеобразную окись железа. Содержание кислорода в регенеративной окиси железа поддерживают в пределах 18—23% [c.111]
В каком из оксидов железа содержание кислорода наибольшее Ответ подтвердите расчетом. [c.127]
Водород. Влияние водорода (0,03 0,06 и 0,085 ат.%) на свободную поверхностную энергию сг карбонильного железа (содержание кислорода — 0,002%, серы — 0,0018%) исследовали в работе [41. При замене гелия водородом, независимо от давления последнего, а железа оставалась неизменной. Таким образом, водород не влияет на о жидкого железа. Такой же вывод сделан в работах [c.28]
Таким образом, обычно находящаяся в высокотемпературной окалине фаза FeO находится в метастабильном (переохлажденном) состоянии. Температура плавления закиси железа 1377°, т. е. ниже температуры плавления железа. В этом окисле железа содержание кислорода, как правило, превышает стехиометрическое, т. е. оказывается большим, чем 50 атомн. %. [c.76]
Судить о типе нестехиометрии можно только на основании результатов многостороннего изучения кристалла. Так, вюстит FeO можно рассматривать как кристалл с нестехиометрией третьего или четвертого типа. Химический анализ показывает, что вюстит содержит избыток кислорода по отношению к железу. Измерения плотности р кристаллов вюстита различной нестехиометрии показали, что она уменьшается при увеличении содержания кислорода в твердой фазе рентгенографические измерения периода решетки а вюстита позволили установить, что она также понижается при увеличении содержания избыточного кислорода [c.177]
Весовые методы. Определенный объем воздуха пропускался через соответствующий поглотитель, вес которого точно был установлен. Содержание кислорода определялось по увеличению веса поглотителя. Оставшийся азот связывался другим реактивом. В качестве поглотителя кислорода в этом случае применяли фосфор, медь или железо. Для поглощения азота употребляли магний, кальций и др. [c.516]
Скорость потока зависит также от содержания кислорода в газе и температуры процесса. Если в газе нет кислорода, то при реакции превращения сероводорода в сульфид железа выделяется 145,555 ккал тепла на 1 кг сероводорода. При этом, если температура слоя ниже 45,6° С, то кристаллизационная влага не удаляется из поглотителя и в целом процесс очистки происходит со скоростью, [c.282]
Газовая фаза НзО — На, равновесная при 1873 К с раствором кислорода в железе (объемное содержание кислорода 0,1200%), со-деря ит 72,1 % Нг. Определите изменение химического потенциала кислорода при переходе из газовой фазы, в которой Ро, = 10 Па, в раствор указанного состава. Константа равновесия реакции На + + А = НаО при 1873 К [c.180]
Хром, получаемый из растворов хромового ангидрида, содержит значительные количества водорода (порядка ЮО— 300 сж ЮО г), придающего хрому высокую твердость . Водород легко удаляется в вакууме при нагревании в интервале 100— 00 . Чистота хрома зависит от чистоты исходных соЛей. Удается получать осадки, содержащие менее 0,0001%) железа и меди, однако содержание кислорода в нем может достигнуть 0,5%- [c.538]
Распростракенность всех элементов сравнивается в таблице с распространенностью кислорода дается логарифм количества атомов соответствующего элемента, которое приходится на каждые 10 атомов кислорода. Сведения о содержании кислорода в хондритах и железных метеоритах отсутствуют, и данные о распространенности элементов в этих объектах градуированы по железу (логарифм относительной распространенности Ре принят равным 8,0, как н в солнечной атмосфере), —порядковый номер соответствующего элемента в Периодической системе Д. И. Менделеева. [c.28]
Скорость коррозии железоуглеродистых сплавов в растворах нейтральных солей зависит от многих факторов, к числу которых относятся концентрация раствора, природа анионов и катионов, содержание кислорода и др. При очень малых концентрациях солей скорость коррозии железа с возрастанием концентрации солей сначала быстро растет, проходит через максимум (при концентрациях порядка 0,1., .0,2 — Н), а затем сравнительно медленно снижается (рнс. 4), [c.10]
Объем осадка при нарушении карбонатного равновесия становится заметным при содержании в воде НСО-3 более 200 мг-ион- л при снижении давления до 0,4 МПа. При выходе воды на поверхность и контакте ионов железа с кислородом воздуха образуются закись и окись железа, которые, гидроли-зуясь, образуют коллоидную гидроокись Ре(ОН)з в виде хлопьевидной суспензии, выпадающей в осадок. В сероводородсодержащих водах взвеси представлены в основном сернистым железом. [c.151]
Редкоземельные элементы. Введение в железо при 1550° С 0,76 мас.% V уменьшает а железа с 1800 до 1240 эpг/ J г [103]. Согласно [100], лантан (до 0,1 мае. %) и церий (до 0,092 мас.%) не оказывают влияния на а железа. По данным [6, 17], лантан и церий понижают о железа. В работе [57] присадки Се и Ьа производили в карбонильное железо, содержащее после расплавления 0,08% кислорода. С увеличением количества вводимого церия или лантана ст железа возрастает от 1240 до 1850—1900 эрг/сж . Добавки лантана к железу способствуют более интенсивному возрастанию сг, чем присадки церия. При введении церия в количестве 0,8 мас.% и лантана 0,5 мае. % а достигает максимальных значений. При дальнейшем увеличении количества присаживаемых РЗЭ до 1—1,2% а расплавов снижается. Повышение а происходит одновременно с понижением содержания кислорода в металле вследствие раскисления его РЗЭ. В [10] приведены рассчитанные изотермы а железа со скандием, иттрием, лантаном и неодимом. [c.30]
Результаты работ [37, 59, 100] показывают, что в присутствии кислорода а расплавов при введении ванадия до 6,5 ат. % значительно понижается. В условиях, когда содержание кислорода невелико, ванадий незначительно влияет на ст жидкого железа (наблюдалось увеличение ст расплавов с 1730 до 1770 эрг см ). [c.34]
Различают химическую, электрохимическую, а также микробиологическую коррозию. Последняя обусловлена действием различных микроорганизмов, которые в процессе жизнедеятельности выде.1яют продукты, разрушающие металл. При. этом может протекать в зависимости от характера среды химическая или электрохимическая коррозия. Химическая коррозия происходит в растворах неэлектролитов и в газовой фазе при высокой температуре. В растворах неэлектролитов и в чистых неполярных жидкостях металл разрушается в результате обычной гетерогенной химической реакции, происходящей на границе раздела металл — жидкость. В газовой фазе при высоких температурах, например при взаимодействии железа с кислородом воздуха, на поверхности железа образуется оксидная пленка, которая постепенно утолщается, благодаря диффузии кислорода через пленку к металлу и диффузии атомов металла через пленку к ее поверхности. Б результате состав пленки непрерывно изменяется по толщине, содержание железа в ней убывает от ее границы с металлом до границы с воздухом, а содержание кислорода убывает от границы пленки [c.370]
Результаты определения а жидкого железа с различным содержанием кислорода сильно отличаются по абсолютным значениям [12, 68, 79, 83, 89, 91, 95, 99, 56]. Однако во всех работах обнаружено, что кислород является сильно поверхностно-активным компонентом и уже малые его количества резко понижают а жидкого железа. [c.35]
Проведены опытно-промышленные испытания производства битумов в колонне в присутствии хлорида железа [99]. Кристаллогидрат хлорида железа РеСЦ-бИзО предварительно расплавляли при температуре 40—80 °С в барабане, обогреваемом водяным паром. Затем расплав разбавляли водой и 80 /о-й раствор хлорида железа плунжерным насосом подавали в окислительную колонну. Расход раствора — 0,1% (масс.) на сырье температура окисления составляла 265—270 °С, расход воздуха 2700 м /ч. В качестве сырья использовали гудрон с температурой размягчения 30—31°С. Опыты показали, что при получение битума с температурой размягчения 47—50 °С производительность увеличивается с 30 до 40 м /ч, а содержание кислорода в газах окисления снижается с 8 до 7% (об.). При сохранении одинаковой производительности 35 м /ч добавка хлорида железа позволяет повысить температуру размягчения битума с 43 до 54 °С, содержание кислорода в газах при этом также снижается с 8 до 7% (об.). Таким образом, применение хлорида железа способствует повышению степени использования кислорода воздуха и ускоряет процесс окисления. Однако, поскольку проблемы коррозии не решены, положительное заключение о целесообразности каталитического окисления не может быть сделано. [c.73]
Авторы [83] определили влияние кислорода на о железа при различных температурах. Оказалось, что с повышением содержания кислорода в железе от 0,003 до 0,19 мас.% о уменьшается при 1550° С от 1760 до 815 эрг см а при 1850° С—от 1670 до 1430 эрг см . Изотерма а при 1850° С близка к прямой, тогда как при 1550° С она сильно искривлена. По данным [29], изотерма а при 1600° С для сплавов, содержащих кислород от 0,002 до 0,065%, с точностью до 25 эрг см описывается уравнением [c.35]
Для того чтобы однозначно определить активен ли или инактивен никель на поверхности жидкого железа, необходимо определять а сплавов и чистых компонентов с минимальным содержанием кислорода и серы. По нашему мнению, именно эти микропримеси могут искажать истинную картину. Пока, по имеющимся данным, нельзя сказать с уверенностью а какого элемента больше — железа или никеля. Уточнить это можно уже сейчас на современном уровне экспериментальной техники и на тех особочистых материалах (N1 и Ре), которые выпускаются промышленностью. Вернуться к исследованию аир системы Ре — N1 необходимо еще и потому, что, как уже указывалось выше, разными исследователями получены качественно отличающиеся результаты. [c.40]
Для сохранения образовавшегося карбонатного осадка следует поддерживать индекс насыщения близким к нулю. Обработку следует проводить непрерывно, поскольку в нестабильной воде возможно растворение карбонатного осадка и протекание коррозии с образованием рыхлых продуктов, что значительно снизит эффективность дальнейшей стабилизационной обработки. При обработке воды необходимо стремиться к образованию карбонатного осадка на самых удаленных от места обработки участках системы. Для образования осадка с высокими защитными свойствами необходимо содержание кислорода в воде 4—6 мг/л и невысокое содержание хлоридов и сульфатов. В плотном защитном слое соотношение карбоната кальция и гидроксида железа составляет от 1 9 до 3 7. Сульфаты и хлориды ухудшают сцепление защитного слоя с поверхностью трубы, увеличивают его пористость и способствуют образованию рыхлых пористых осадков. Образующийся в этих условиях осадок приводит к язвенной коррозии труб. В растворах с положительным индексом насыщения защитное действие карбонатных осадков ухудшается при концентрации сульфат-ионов более 100 мг/л. [c.142]
В случае изготовления пригодных для испытания образцо з им мо>жно пользоваться и для определения содержания кислорода в поверхностных пленках. Однако оборудование и методика Настолько специфичны, что в обычных условиях они не применимы для определения скорости окисления, хотя весьма высокая точность этого способа делает его пригодным для проверки спорных результатов, полученных другими методам и. Как раз е этой овя-3 его и при.менял Сломен [533] для определения содержания кислорода в пленке, образующейся на поверхности полосо1к очень чистого железа и карбонильного железа. Содержание кислорода определяли в компактном материале после осторожной прокатки последнего в холодно.м виде в полоску, обработки шлифовальной бумагой и окисления при 275° С. Материал в компактном виде имел по сравнению с поверхностью прокатанной из него полоски незначительную площадь, так что кислород, первоначально содержавщийся в материале, можно было считать внутренним , а увеличение количества кислорода на последующих стадиях обработки относить за счет поверхностного поглощения. Образцы изготовляли в виде полосок толщиной около 0,007 см, слегка свернутых и имеющих общую площадь поверхности около 2000 м . [c.274]
На рис. 2.21 представлены кинетические кривые изменения массы за-углероженных оксидов железа, кобальта и никеля аргонокислородной смесью (содержание кислорода в смеси 0,5% об.) при 650 и 450 °С. При 650 °С для исследованных оксидов форма кривых идентична. Однако время выгорания углерода существенно зависит от природы металла оксвда. Снижение температуры регенерации до 450 °С приводит к разному изменению соотношения скоростей выгорания углерода и окисле- [c.40]
Опасения повышенной коррозии, которые обычно вызывает применение хлорного железа при гидрогенолизе, являются преувеличенными. Как указывает Тодт, коррозия в любом случае происходит только в растворах, действующих как окислители [58, т. И, с. 20, 48], а растворы моносахаридов являются восстанавливающими. Тодт также замечает [58, т. I, с. 93], что ионы трехвалентного железа, присутствующие в растворе, пассивируют легированные стали, и содержание кислорода в растворе при этом не столь важно действие пассивации основано на адсорбции. Впрочем, после смешения сырья с водородом в присутствии никелевого катализатора из раствора должны исчезнуть (прогидрироваться) содержащиеся в нем следы кислорода. Известно, что в обычных условиях слабые растворы хлорного железа вызывают сильную коррозию никеля [58, т. I, с. 390], однако никелевый катализатор успешно проводит гидрогенолиз в присутствии хлорного [c.123]
Обогащение воздушного дутья кислородом увеличивает скорость горения топлива и последующих процессов образования восстановителей восстановления оксидов железа, уменьшает количество тепла, выносимого из печи с балластным азотом воздуха. Тбис, при повышении содержбшия кислорода в дутье с 21 до 30% об. УРК снижается на 9%, а производительность печи увеличивается на 10%. При более высоком содержании кислорода в печи развиваются излишне высокие температуры, что может вызвать подвисание шихты и замедление плавки. [c.72]
Потерявший активность катализатор содержит сульфиды металлов и углистые отложения. Если сульфид железа накапливается в верхней части слоя, он может быть пирофорньп л, и поэтому необходимо соблюдать соответствующие меры предосторожности. Сначала катализатор продувают водяным паром или инертным газом. Регенерация осуществляется воздухом, разбавленным водяным паром или инертньпи газом так, чтобы содержание кислорода составляло 0,5-1%, а давление — 2-10 атм. Сгорание начинается при 300- 350°С и характер- [c.253]
Смолы и осадки, образующиеся при окислении прямогонных реактивных и дизельных топлив, характеризуются высоким содержанием кислорода 45-50, серы 7-9, азота 0,5-2,0, зольных элементов (металлов) 7-9%. Среди зольных элементов обычно преобладают медь 1-3, цинк — до 1,0, кальций -до 1,0, железо, алюминий, олове и др. до 0,1%. Эти данные подтверждают активное участие в термохимических превращениях в топливах гетероатомных соединений, каталитическое н.ч. » кке металлов (медь, бронза) и химическое взаимодействие продуктов окисления с металлами. Зависимости осадкообразования в реактивных топливах от темперзт) . приведены на рис. 8. Снижение массы осадка при температ1 р2. 130- 90 С связано с повышением давления насыщенных паров (уменьшением доступа кислорода к поверхности топлива) и увеличением растворимости продуктов окисления в топливе. [c.87]
Упрощенная аэрация осуществляется при высоте излива 0,5— 0,6 м над уровнем воды в фильтре. Ее рационально применять при содержании общего железа до 10 мг/л, в том числе закисного должно быть не менее 70%, так как в его отсутствие пленка на загрузке не образуется. Процессу обезжелезивания этим методом мешают сероводород и углекислота, низкое значение pH, высокая окисляе-мо сть. Содержание кислорода должно быть оптимальным (для некоторых вод около 0,6 мг/л), так как излишек и недостаток его в воде ухудшают процесс обезжелезивания. При содержании в воде свободной углекислоты выше 50 мг/л железистая пленка на зернах загрузки не образуется, потому что все закисное железо будет находиться в виде растворимой соли Ре (НСОз) 2- Наличие в воде НгЗ связывает растворенный в воде кислород, что также не способствует образованию пленки. При низком значении pH происходит быстрое окисление двухвалентного железа в трехвалентное. [c.205]
Тепловой эффект реакции РеО Ре +V2O2 равен —270,67 кДж/моль. До какой температуры надо нагреть оксид железа (II) на воздухе, чтобы он разложился на металлическое железо и кислород, если упругость диссоциации РеО при 727° С 4,13-10- Па (Принять содержание кислорода в воздухе равным 20%.) [c.126]
Оксид железа (II) черного цвета. При нагревании на воздухе до 200—250 С он окисляется с выделением теплоты. При температуре ниже 572 °С оксид железа (II) постепеигю разлагается, превращаясь в металлическое железо и оксид железа (II, III). Максимальная скорость превращения наблюдается при 430 °С. Содержание кислорода В оксиде железа (II) может колебаться в некоторых пределах обычно оно несколько меньше, чем это соответствует формуле. На воздухе оксид устойчив. [c.257]
Так же, как и при электролизе цинка, первой стадией очистки марганцевого электролита является гидролитическая очистка. Раствор после выщелачивания нейтрализуют аммиаком или избытком огарка до pH = 6,5. При этом сульфаты железа и алюминия, присутствующие в растворе, гидролизуются и дают осадок гидроокисей. Одновременно частично удаляются из раствора за счет адсорбции или образования основных солей ионы мышьяка и молибдена. Гидролиз соли марганца происходит при более высоком значении pH (>8,5), вследствие чего марганец в осадок не выпадает. После гидролиза электролит очищают от меди, никеля, кобальта и других тяжелых металлов. Для этого раствор обрабатывают газообразным сероводородом или сульфидом аммония. В осадок выделяются сульфиды этих металлов. Осадок отфильтровывают. В фильтрате содержится некоторое количество коллоидальной серы и сульфидов. Чтобы избавиться от этих примесей, в электролит добавляют железный купорос Ре304 до содержания в растворе 0,1 г л железа. При pH = 6,5—7,0 железо окисляется кислородом воздуха и выпадает в виде гидроокиси, адсорбируя коллоиды при этом удаляются также остатки мышьяка и молибдена. [c.103]
Так как растворимость кислорода в твердой стали существенно меньше, то при ее кристаллизации образуются окислы железа и содержащихся в нем примесей (FeO, Si02, MnO), которые выделяются по границам зерен, что сильно ухудшает качество металла. Поэтому перед окончанием плавки необходимо уменьшить содержание кислорода в стали, т.е. раскислить ее. С этой целью в сталь вводят металлы, отличающиеся большим сродством к кислороду и хорошо растворяющиеся в жидком железе. [c.103]
Закпсь железа, называемая вюститом, образуется в качестве промежуточного продукта при высокотемпературном (572° С) окислении железа на воздухе. Содержание кислорода в вюстите может колебаться в некоторых пределах обычпо оно несколько больше, чем это соответствует теоретпческо.му расчету. [c.126]
Для формирования прочности магнетитовой пленки обработку поверхности металла гидразином рационально вести при повышенных температурах, т. е. непосредственно после останова котла. Такой регламент позволяет также уменьшить концентрацию гидразина существенно сократить время формирования пленки. Ингибиторное действие N2H4, получающегося при протекании реакции между оксидом железа (1И) и гидразином, особенно эффективно в закрытых системах для сред с малым содержанием кислорода (не выше [c.78]
В природе аэробные и анаэробные бактерии существуют сов-/iie THo. В почве наиболее интенсивная коррозия наблюдается в болотистых местах (рЯ=6,8…7,8), насыщенных органическими /остатками с пониженным содержанием кислорода., Поверхность конструкций, имеющих значительную протяженность (трубопровод), становится анодной по отношению к участкам, контакти-/ рующим с более аэрированной почвой, и коррозия ускоряется, п В анодных зонах возможно окисление гидрозакиси железа железо-бактериями. [c.26]
Образование наиболее совершенных сплошных пленок можно ожидать нри силикатной обработке воды в тракте после деаэратора при низком содержании кислорода, т. е. в условиях, когда все поступающее в результате коррозии железо связывается на поверхности металла в ферросиликат. По тракту до деаэратора образование сплошных пленок (ферросиликатов) на металле маловероятно. [c.154]
Сульфидная коррозия в дымовых газах наблюдается при концентрациях сероводорода 0,01—0,2 %. Зондирование топочного пространства показало, что в неблагоприятных случаях вблизи поверхности экранов пылеугольных котлов содержание кислорода снижается с 2,0 до 0,2 %, а содержание оксида углерода и сероводорода увеличивается с 2,6 до 8,2 и с 0,013 до 0,066 % соответственно [21. При этом наблюдалось увеличение скорости коррозии труб из стали 12Х1МФ с нескольких десятых до 5—6 мм/год. В результате коррозии происходит существенное утонение стенки труб с огневой стороны, что приводит к их разрыву (из-за соответствующего роста напряжений) через 23—24 тыс. ч эксплуатации. Сероводородная коррозия сопровождается образованием на поверхности труб из перлитных сталей двухслойной пленки, наружная часть которой состоит из оксида железа РваОз, а внутренняя — из сульфида железа РеЗ. Влияние сероводорода увеличивается при повышении температуры до 550 °С, а затем уменьшается из-за его разложения (рис. 12.2). Скорость сероводородной коррозии возрастает линейно с увеличением концентрации сероводорода в дымовых газах (рис. 12.3). Экспериментально обнаружен линейный рост концентрации сероводорода в топочных газах при увеличении соотношения СО (СО + СО ). Отрицательное воздействие сероводорода проявляется не только в усилении коррозии металлических поверхностей, но и в постепенном разрушении защищающего их огнеупорного (в частности, хромитового) слоя, который наносится на экран нижней радиационной части (НРЧ) котлов. [c.222]
Слой окалины на углеродистой стали имеет сложное строение (рис. 2-26), зависящее от температуры, времени коррозии и состава газовой среды. Снарул и находится слой окиси железа РегОз — окисла с наибольшим содержанием кислорода к металлу прилегает слой закиси железа РеО — [c.67]