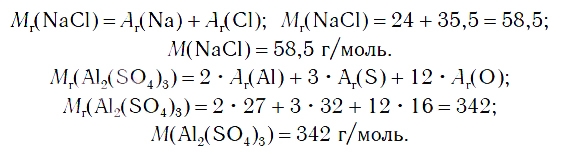Соли кальция
- Соли кальция, как хлорид CaCl2, бромид CaBr2, иодид CaI2 и нитрат Ca(NO3)2, хорошо растворимы в воде. Нерастворимы в воде фторид CaF2, карбонат CaCO3, сульфат CaSO4, ортофосфат Ca3(PO4)2, оксалат СаС2О4 и некоторые другие.
Источник: Википедия
Связанные понятия
Ортофосфа́т ка́льция (трикальцийфосфат) — неорганическое вещество, соль кальция и ортофосфорной кислоты с химической формулой Ca3(PO4)2. Существует в виде двух модификациях (α и β), отличающихся физическими свойствами. Содержится в костной ткани, входит в состав минералов. Широко применяется в сельском хозяйстве как удобрение, а также для подкормки скота, в промышленности для производства абразивов, керамики и стекла.
Рицинолевая кислота — органическое соединение, высшая жирная кислота, имеющая формальное название — 12-гидрокси-9-цис-октадеценовая кислота. Относится к ненасыщенным Омега-9 жирным кислотам и оксикислотам. Является основным компонентом масла, получаемого из зрелых семян клещевины или из склероция спорыньи. Около 90 % жирных кислот в касторовом масле (касторке) — это триглицерид, образованный остатками рицинолевой кислоты. Образует соли — рицинолеаты, с щелочными и щелочноземельными металлами, а также…
Микроудобрения — удобрения, содержащие микроэлементы, вещества, потребляемые растениями в небольших количествах. Подразделяются на борные, медные, марганцевые, цинковые, кобальтовые и другие, а также полимикроудобрения, в составе которых 2 и более микроэлементов. В качестве микроэлементов применяют соли микроэлементов, отходы промышленности (шлаки, шламы), фритты (сплавы солей со стеклом).
Аллици́н — органическое соединение, сульфоксид, которое образуется при механическом разрушении клеток чеснока, обладающее бактерицидным и фунгицидным действием.
Уробилин или урохром это вещество жёлтого цвета, молекула которого относится к линейным тетрапирролам. Это вещество, и связанный с ним метаболит, уробилиноген, представляют собой продукты распада циклического тетрапиррола гема, и придают моче характерный жёлтый цвет.
Упоминания в литературе
Наилучшим всасыванием в желудочно-кишечном тракте при наименьшем риске образования камней характеризуется цитрат кальция (то есть кальциевая соль лимонной кислоты). Поэтому карбонат кальция советуют запивать лимонным соком. Цитрат кальция входит в ряд препаратов кальция, состоящих из смеси нескольких солей кальция.
Кальций и его соли обусловливают жесткость воды. Жесткость питьевой воды является существенным критерием, по которому население оценивает качество воды. В жесткой воде овощи и мясо плохо развариваются, так как соли кальция и белки пищевых продуктов образуют нерастворимые соединения, которые плохо усваиваются. Затруднена стирка белья, в нагревательных приборах образуется накипь (нерастворимый осадок). Экспериментальные исследования показали, что при питьевой воде с жесткостью 20 мг-экв/л частота и вес образования камней были значительно больше, чем при употреблении воды с жесткостью 10 мг-экв/л.
Кроме того, в химический состав злаковых растений входят в небольших количествах органические кислоты (яблочная, виннокаменная, виноградная), различные минеральные соли неорганических кислот, такие как соли кальция, магния, фосфора, железа. Также в малых количествах в состав входят микроэлементы, которые тем не менее имеют весьма большое значение в биологическом процессе (марганец, цинк, йод и др.). Витамины – органические вещества особого вида, имеющие различный химический состав, их употребление способствует нормальному функционированию организма. На сегодняшний день специалисты исследовали химический состав более чем 30 витаминных веществ, однако более 20 видов витаминов остаются еще не до конца изученными.
Минеральные вещества в меде представлены солями кальция, натрия, магния, железа, серы, хлора, фосфора.
Среди элементов, которые входят в состав нашего тела, кальций занимает пятое место после четырех главных элементов: углерода, кислорода, водорода и азота. Название кальцию дано от латинского слова «calke», что в переводе означает «известь» или «мягкий камень». В чистом виде кальций – металл белого цвета, ковкий и довольно твердый. В наружной оболочке атома кальция находятся два валентных электрона, которые очень непрочно связаны с ядром, поэтому в чистом виде кальций в природе не найти. Чаще он встречается в виде карбоната, сульфата, фосфата кальция. Мрамор, известняк, мел – это карбонат кальция. Сталактиты и сталагмиты – тоже разновидность карбоната кальция. Нет в мире речки, моря или ручейка, где бы не были растворены соли кальция. Из известняка и других элементов сооружены египетские пирамиды, Великая китайская стена и белокаменная Москва.
Связанные понятия (продолжение)
Ацетоба́ктер (лат. Acetobacter) — род бактерий из семейства Acetobacteraceae класса альфа-протобактерий, характеризующийся умением окислять этанол до уксусной кислоты, ацетат и лактат — до CO2 и H2O.
Оксалат калия — соль калия и щавелевой кислоты с формулой K2C2O4. Образует бесцветные кристаллы. Растворяется в воде. Образует кристаллогидрат состава K2C2O4•H2O.
Кротоновое масло (лат. Oleum crotonis) — растительное масло, получаемое из растения кротон слабительный (лат. Cróton tíglium), растущего в Индокитае. Обладает слабительным и раздражающим действием.
Гидросульфи́т на́трия или бисульфи́т на́трия — химическое соединение, кислая соль натрия и сернистой кислоты с химической формулой NaHSO3.
Альдиты (альдитолы) — ациклические полиолы общей формулы HOCH2nCH2OH, формально являющиеся продуктами восстановления альдегидной группы альдоз. Простейшим альдитом является глицерин.
Инвертаза (шифр КФ 3.2.1.26; пищевая добавка E1103) (систематическое имя: бета-фруктофуранозидаза) — фермент, который катализирует гидролиз (распад) сахарозы (сахара). Полученные в результате фруктоза и глюкоза называются инвертным сахаром. Близкими к инвертазам являются сахаразы. Инвертазы расщепляют O-C(фруктоза) связь, тогда как сахаразы расщепляют O-C(глюкоза) связь.
Хлорамин — неорганическое соединение, хлорпроизводное аммиака, бесцветная маслянистая жидкость, растворимая в холодной воде, разлагается при температурах выше −40°С.
Сахара́зы — обширная группа гликозил-гидролаз, способных расщеплять молекулы сахарозы на глюкозу и фруктозу. Часто имеют более широкую субстратную специфичность. В зависимости от узнаваемой в молекуле субстрата группы сахаразы подразделяют на β-фруктозидазы и α-глюкозидазы. Сахараза синтезируется поджелудочной железой и слизистой тонкого кишечника.
Подробнее: Сахараза
Ионон — ненасыщенный кетон, обладающий приятным цветочным запахом. Используются в качестве компонента парфюмерных изделий, отдушек для мыла и вкусовых добавок в пищевой промышленности. В природе содержится в некоторых эфирных маслах.
Изоэвгенол (2-метокси-4-пропенилфенол) C10H12O2 — вещество класса фенолов, относится к душистым веществам.
Филлохинон — сложное органическое соединение, производное 2-метил-1,4-нафтохинона.
Дуби́льная кислота́ — сложная органическая кислота, одна из форм танинов. Синтезируется большим количеством растений. Также её называют галлодуби́льной кислото́й, тани́новой кислото́й (англ. tannic acid) и просто тани́ном.
Метантио́л (метилмеркапта́н) CH3SH — простейший представитель гомологического ряда тиолов, бесцветный ядовитый газ с сильным отвратительным запахом, при малых концентрациях напоминающий запах гнилой капусты.
Целлюлаза — фермент, принадлежащий к классу гидролаз, катализирующий гидролиз β(1,4)-гликозидных связей в целлюлозе с образованием глюкозы или дисахарида целлобиозы.
Анисовый альдегид, п-метоксибензальдегид — органическое вещество, производное бензальдегида и метоксибензола (анизола). Бесцветная маслянистая жидкость с пряным запахом, напоминающим запах цветов боярышника.
Металлический вкус — вкусовое ощущение от некоторых химических веществ, которое обычно связывают с наличием таких агентов, как ионы меди, или некоторых других веществ и соединений. Металлический вкус не относится к числу основных вкусов, и часто рассматривается как привкус.
Нитратредуктаза — один из ключевых ферментов азотного обмена. Его функция заключается в восстановлении нитрат-иона до нитрит-иона. Сам белок состоит из нескольких доменов: первый — ФАД-содержащий домен предназначен для принятия электронов и их дальнейшего переноса на цитохром b557, с которого они в свою очередь попадают на молибдоптерин (молибден-содержащий кофермент). При этом атом молибдена меняет свою степень окисления с +6 на +4, а затем, снова окисляясь, он отдаёт два электрона нитрат-иону…
Цианамид кальция — кальциевая соль амида циановой кислоты (цианамида) с формулой CaCN2.
Гиппу́ровая кислота́ (от от ἵππος — лошадь и лат. urina — моча) — N-бензоилглицин, бесцветные кристаллы, слаборастворимые в холодной воде и хорошо растворимые в горячей воде и этаноле. Гиппуровая кислота содержится в моче травоядных и человека, впервые обнаружена в моче лошади, благодаря чему и получила своё название.
Цинхонин — органическое соединение с химической формулой C19H22N2O. Алкалоид, содержащийся в некоторых растениях вида семейства мареновых, например, в хинном дереве и в ремиджии. Обычно встречается вместе с хинином. Обладает противомалярийным действием, но значительно более слабым, чем у хинина. Применяется в органической химии для разделения рацемических смесей кислот.
Кислые соли — это соли, содержащие два вида катионов: катион металла (или аммония) и катион водорода, и многозарядный анион кислотного остатка. Катион водорода даёт к названию соли приставку «гидро», например, гидрокарбонат натрия.
Кадавери́н (от лат. cadaver — труп), α, ε-пентаметилендиамин — химическое соединение, имеющее формулу NH2(CH2)5NH2.
Изотиоцианаты (горчичные масла) — органические соединения, содержащие функциональную группу группу —N=C=S, сернистые аналоги изоцианатов R—N=C=O.
Диэтаноламин — органическое соединение, представитель класса аминоспиртов, густая маслянистая жидкость, смешивается с водой во всех отношениях, обладает сильными основными свойствами.
Ураты — соли мочевой кислоты. Мочевая кислота двухосновная (рКа 5,75 и 10,3), образует кислые и средние соли.
Миндальная кислота или фенилгликолевая кислота — первый представитель жирно-ароматических гидроксикислот. Существует в двух энантиомерных оптически деятельных формах (R и S), а также в рацемической оптически недеятельной (RS) форме (известной как параминдальная кислота). Последняя была получена Винклером, получившим её при нагревании сырого горько-миндального масла с соляной кислотой.
Бета-гидроксимáсляная кислотá (также β-гидроксибутират, β-оксимасляная кислота, сокр. БОМК) — представляет собой органическое соединение с формулой СН3СН(ОН)CH2COOH, одноосновная карбоновая гидроксикислота. БОМК является хиральным соединением, имеющим два энантиомера, L(S)-3-гидроксимасляная кислота и D(R)-3-гидроксимасляная кислота (продукт метаболизма животных, включая человека). Её окисленные и полимерные производные широко распространены в природе.
Подробнее: Бета-гидроксимасляная кислота
Перхлора́т на́трия (также, ПХН) — химическое соединение NaClO4, натриевая соль хлорной кислоты. Сильный окислитель. При кристаллизации из водных растворов при температурах выше 51 градуса Цельсия выпадает безводная соль, ниже 51 градуса Цельсия моногидрат NaClO4·H2O, ниже −13 градусов — дигидрат. Как безводная соль, так и кристаллогидраты очень гигроскопичны, поэтому перхлорат натрия в основном используется как сырьё для получения других перхлоратов обменными реакциями.
Аминоспирты, аминоалкоголи — алифатические органические соединения, содержащие —NH2 или —NR1R2 и —ОН группы у разных атомов углерода в молекуле. Низшие аминоспирты представляют собой высококипящие маслянистые жидкости со свойствами оснований.
Фототоксичность вещества — способность веществ понижать устойчивость клеток к неблагоприятному воздействию света. Наиболее часто понятие используется в отношении действия солнечных лучей, преимущественно ультрафиолетового диапазона, на кожу.
Протравители — ядохимикаты (фунгициды, бактерициды, инсектициды), применяемые для обработки семян с целью предохранения их от поражения грибами, бактериями и от повреждений вредителями, обитающими в почве. К протравителям относятся гранозан, меркуран, гексахлорбензол, формалин и некоторые другие.
Птомаи́ны (от греч. πτώμα — труп), или тру́пные я́ды — устаревший термин, использовавшийся для обозначения биогенных диаминов, получающихся в результате гнилостных процессов — частичного разложения белка и декарбоксилирования его аминокислот. Основные птомаины — путресцин и кадаверин, а также спермидин, спермин и нейрин. Имеют характерный отвратительный «сладковатый» (типичный трупный) запах. Однако острая токсичность птомаи́нов (в опытах на крысах) сравнительно невелика: путресцин — 2000 мг/кг…
Декстран — полисахарид, разветвлённый полимер глюкозы со средней массой цепей от 3 до 20000 кДа. Главная цепь состоит из молекул, связанных связью α-1,6, а боковые ветви присоединены связями α-1,3. Декстран синтезируется из сахарозы некоторыми уксуснокислыми бактериями. В качестве наиболее известных видов можно привести Leuconostoc mesenteroides и Streptococcus mutans. Крайне обильно декстраны представлены в зубном налёте.
Лепидин (4-метилхинолин, γ-метилхинолин) — гетероциклическое соединение ряда хинолинов. Содержится в каменноугольнной смоле; возможно получение из цинхонина перегонкой с гидроксидом калия. Применяется как промежуточный продукт для синтеза красителей и лекарств.
Тунговое масло, древесное масло — растительное масло, получаемое из семян (орешков) тунгового дерева, содержащего до 70% тунгового масла (на сухую массу ядра орешка).
Клюквенный сок — сок, полученный из ягод клюквы. Термин используется в отношении не только натурального (без добавления сладкого), но, как правило, применяется для обозначения подслащённой версии. Указанные в справочной литературе сведения, касающиеся содержания сахара, актуальны только для версии несладкого клюквенного сока.
Параформальдеги́д (англ. PFA, также параформ) — продукт полимеризации формальдегида, состоящий из 8—100 мономеров — остатков формальдегида. Параформальдегид обычно имеет легкий запах формальдегида из-за деполимеризации. Параформальдегид является полуацеталем.
Смола Меррифилда — твердофазный носитель, предназначенный для иммобилизации соединений, содержащих карбоксильные и спиртовые группы, с целью последующего синтеза соединений, содержащих эти группы. Широкое применение смола нашла в синтезе пептидов, а также для получения разных производных смол.
Ами́лопекти́н (от др.-греч. ἄμυλος — «пирог из тонкой муки», πηκτός — «сбитый», «сплочённый») — один из основных полисахаридов, составляющих крахмал. Образован разветвлёнными цепочками остатков глюкозы, соединённых гликозидными связями α-(1→4) и α-(1→6).
Фуранокумарины (фурокумарины) — класс кислородсодержащих гетероциклических соединений, преимущественно природного происхождения, в которых фурановый цикл конденсирован с бензольным циклом кумаринового ядра линейно (производные псоралена) или ангулярно (производные ангелицина и аллопсоралена)…
Осно́вные соли (гидроксосоли) — это продукты неполного замещения гидроксидных групп в молекулах многокислотных оснований кислотными остатками.
Гелиотропи́н (пиперона́ль, 3,4-метилендиоксибензальдеги́д) — ароматический альдегид C8H6O3. В чистом виде представляет бесцветные кристаллы с запахом гелиотропа — промежуточным, между запахом ванили и корицы.
Со́ли аммо́ния — соли, содержащие аммоний, NH4+; по строению, цвету и другим свойствам похожи на соответствующие соли натрия. Все соли аммония хорошо растворимы в воде и полностью диссоциируют в водном растворе. Соли аммония проявляют общие свойства солей. При действии на них щёлочи выделяется газообразный аммиак. Все соли аммония при нагревании разлагаются.
Бро́мная вода — водный раствор брома (содержит HBrO и HBr). На свету постепенно выделяет кислород в результате разложения присутствующей в ней бромноватистой кислоты.
Сульфат лития — соль щелочного металла лития и серной кислоты. Химическая формула Li2SO4.
Упоминания в литературе (продолжение)
Минеральные соли кальция, фосфора, магния, железа и калия в цветной капусте являются легкоусвояемыми. Содержатся в ней также пектины, лимонная и яблочная кислоты. Особое значение имеет тартроновая кислота, которая предотвращает превращение сахаров в жир. Последнее позволяет использовать цветную капусту в качестве одного из основных компонентов диетического питания.
Кальций и его соли обуславливают жесткость воды. Жесткость питьевой воды является существенным критерием, по которому население оценивает качество воды. В жесткой воде овощи и мясо плохо развариваются, так как соли кальция и белки пищевых продуктов образуют нерастворимые соединения, которые плохо усваиваются. Затруднена стирка белья, в нагревательных приборах образуется накипь (нерастворимый осадок). Экспериментальные исследования показали, что при питьевой воде с жесткостью 20 мг. экв/л частота и вес образования камней были значительно больше, чем при употреблении воды с жесткостью 10 мг. экв/л. Влияние воды с жесткостью 7 мг. экв на л на развитие уролитиаза не было обнаружено. Все это позволяет считать обоснованным принятый норматив жесткости в питьевой воде – 7 мг экв на л.
Внесение в молоко хлорида кальция. При пастеризации молока часть солей кальция переходит из растворимого в нерастворимое состояние, что приводит к ухудшению сычужной свертываемости молока и получению более дряблого, непрочного сгустка.
Своими пищевыми и лечебными достоинствами крапива обязана богатому содержанию биологически и физиологически активных веществ. У крапивы двудомной в листьях содержится от 20 до 600 мг% витамина С, до 8 мг% витамина К, а также витамины группы В, органические кислоты. Богат минеральный состав крапивы, в ней содержится 41 мг% железа, 1,3 мг% меди, 8,2 мг% марганца, 2,7 мг% титана, 4,3 мг% бора и до 0,03 мг% никеля. В крапиве также найдены соли ванадия, хрома, алюминия, кремния, цинка, кобальта, стронция и молибдена, йода. Некоторые исследователи отмечают, что крапива обладает способностью избирательно поглощать и накапливать большое количество меди и хрома. В крапиве содержатся дубильные вещества, хлорофилл, ситостерии, гистамин, фитонциды, соли кальция.
Жесткость воды определяется наличием в ней растворенных солей кальция и магния. Суммарное содержание солей этих металлов называют общей жесткостью, которая выражается в миллиграммах-эквивалентах на литр (мг-экв/л). Чем больше в воде растворенных соединений кальция и магния, тем она жестче. Жесткость воды бывает четырех типов: мягкая, средняя, жесткая и очень жесткая.
Обычно воду из-под крана мы кипятим и этим уничтожаем содержащиеся в воде бактерии и уменьшаем содержание легколетучих компонентов. Однако из-за выкипания воды происходит увеличение концентрации в ней нелетучих примесей (например, солей тяжелых металлов). А полезные вещества, вроде солей кальция и магния, оседают на стенках чайника в виде твердого белого налета.
Соли кальция. Сравнительно много их содержится в капусте, салате, горохе, петрушке, кизиле, абрикосах. Соли кальция входят в состав всех клеток и плазмы крови, способствуют образованию костной ткани, необходимы для свертывания крови. Ионизированный кальций требуется для поддержания нормальной нервно-мышечной возбудимости. Соли магния содержатся почти во всех пищевых продуктах, но, несмотря на большое содержание их в продуктах питания, организм часто удовлетворяет потребность в магниевых солях не в полном объеме. Это происходит из-за того, что в некоторых продуктах они трудно усваиваются, поэтому организм не получает их в требуемом количестве. К сожалению, в золотом усе содержание солей магния невелико, тем не менее, они легко усваиваются организмом. В среднем суточная норма солей магния для организма взрослого здорового человека составляет 0,5 г, и при употреблении разнообразной пищи она полностью удовлетворяется. Роль магния в организме очень важна: он входит в состав ряда ферментных систем, а также участвует в процессах углеводного и фосфорного обмена веществ, входит в небольших количествах в состав зубов и костей. Также магний необходим для нормальной возбудимости нервной системы человека.
Воде свойственна жесткость, обусловленная содержанием в ней солей кальция и магния. Нагревание такой жидкости сопровождается выпадением специфического осадка. Ее обычно смягчают в процессе кипячения или путем добавления реагентов. Дождевая вода считается самой мягкой.
Гипс – водная сернокислая соль кальция – CaSO4·2H2O. В почве образуется путем осаждения из почвенных растворов в результате испарения почвенной влаги. Источники образования гипса – подток к поверхности почв грунтовых вод, содержащих сульфаты, образованные при разложении растительных и животных остатков, разрушении горных пород и минералов. Гипс может образовываться при взаимодействии находящихся в почвенном растворе сульфатов натрия и магния с карбонатом кальция, а также с обменным кальцием. Гипс находится в почве в виде прожилок, скоплений мелких кристаллов, конкреций, крупных сростков; иногда гипс образует корочку и выцветы на поверхности почвы. Содержание гипса в почве может достигать 20 % и более.
Кальций участвует во всех жизненных процессах организма. Нормальная свертываемость крови происходит только в присутствии солей кальция. Кальций играет важную роль в нервно-мышечной возбудимости тканей. При увеличении в крови концентрации ионов кальция и магния нервно-мышечная возбудимость уменьшается, а при увеличении концентрации ионов натрия и калия – повышается. Кальций играет определенную роль и в нормальной ритмической работе сердца.
Соли фосфора необходимы почти вдвое больше, чем соли кальция, хотя кальций и фосфор – «неразлучные» минеральные вещества, они не могут друг без друга. Фосфор, так же как и кальций, является составной частью костной ткани. Необходимо постоянно поддерживать соотношение этих двух минеральных веществ, иначе организм для своего «выживания» вынужден брать кальций из зубов, ногтей, крупных суставов. Так, очень часто человек жалуется на боль в костях, считая, что у него идут процессы отложения солей, в то время как он должен позаботиться о правильном питании. Витамин D регулирует в организме фосфорно-кальциевый баланс. Человек, который в свой рацион вводит достаточное количество продуктов, содержащих фосфор и кальций, может не бояться переломов костей, заболеваний суставов, кожи, костей, нервов.
ЛИМОННИК. Плоды лимонника содержат органические кислоты (особенно лимонную и яблочную); сахара; эфирное масло; витамины; аскорбиновую кислоту; белковые вещества; соли кальция, железа, марганца, фосфора, а также эфиры полиоксифенолов – схизандрин и схизандрол. По-видимому, наличие последних и обусловливает стимулирующее и тонизирующее действие лимонника.
Существенное влияние на организм оказывают соли кальция и магния, обусловливающие природную жесткость воды. В жесткой воде плохо развариваются овощи и мясо, настаивается чай, мылится мыло. Жесткость определяет отложение накипи на посуде. У лиц с чувствительной тонкой кожей жесткая вода приводит к закупорке протоков сальных желез и вызывает болезненную сухость и раздражение. При систематическом употреблении воды с высокой жесткостью (выше 10 мг·экв/л) у человека повышается риск развития мочекаменной болезни. Оптимальная жесткость питьевой воды составляет 1,5–7 мг·экв/л.
Соли кальция входят в состав клеток плазмы крови и костей.
Магний – элемент, обеспечивающий всасываемость кальция. Его дефицит приводит к болям в суставах, усиленному отложению солей кальция на стенках артерий, в сердечной мышце и почках. Зачастую при недостатке магния развиваются бессонница и утренняя усталость, появляются спазматические боли в желудке и грудной клетке, наблюдаются перебои в работе сердца.
Составьте формулы солей кальция
-
CaCl2 — хлорид кальция
CaSO4 — сульфат кальция
CaCO3 — карбонат кальция
CaF2 — фторид кальция
CaSiO3 — силикат кальция
Ca3 (PO4) 2 — фосфат кальция
Ca (NO3) 2 — нитрат кальция
- Комментировать
- Жалоба
- Ссылка
Найдите правильный ответ на вопрос ✅ «Составьте формулы солей кальция …» по предмету 📘 Химия, а если вы сомневаетесь в правильности ответов или ответ отсутствует, то попробуйте воспользоваться умным поиском на сайте и найти ответы на похожие вопросы.
Смотреть другие ответы
Главная » Химия » Составьте формулы солей кальция

Кальций является наиболее распространенным минералом в организме и в сочетании с фосфором образует фосфат кальция в костях и зубах. Он необходим для нормального функционирования нервов и мышц и играет важную роль в свертывании крови (как фактор IV) и во многих ферментативных процессах.
Металлический кальций: получают, главным образом, электролитическим способом; электролизу обычно подвергают расплав хлорида кальция. Получающийся металл содержит примесь СаСl2. Поэтому его переплавляют, а для получения высокочистого кальция перегоняют; оба процесса проводят в вакууме.
Некоторое количество кальция получают алюминотермическим методом. Разработан также способ получения кальция термической диссоциацией карбида кальция СаС2.
Кальций представляет собой ковкий, довольно твердый белый металл. На воздухе он быстро покрывается слоем оксида, а при нагревании сгорает ярким красноватым пламенем. С холодной водой кальций реагирует сравнительно медленно, но из горячей воды быстро вытесняет водород, образуя гидроксид :
Ca+2H2O→ Ca(OH)2+H2
Кальций — очень активный металл, легко соединяющийся с галогенами :
Ca+Cl2→CaCl2
При нагревании с серой образуется сульфид:
Ca+S→ CaS
При нагревании в струе водорода металлический кальций соединяется с водородом, образуя гидрид :
Ca+H2→CaH2
Гидрид кальция СаН2 — белое солеобразное вещество, бурно реагирующее с водой с выделением водорода:
CaH2 + 2Н2О = Ca(OH)2 + 2H2
Ввиду способности выделять большое количество водорода( при разложении 1 кг гидрида кальция с водой образуется около 1000л водорода) гидрид кальция применяется иногда для получения этого газа. Его используют также в качестве эффективного Осушителя, способного отнимать воду даже от кристаллогидратов.
Взаимодействием кальция с азотом при высокой температуре можно получить нитрид кальция:
3Ca+N2→Ca3N2
При соприкосновении с водой нитрид кальция подвергается гидролизу с образованием аммиака и гидроксида кальция:
Ca3N2+6H2O→3Ca(OH)2+2NH3
Область применения кальция: химическая, металлургическая промышленность. Лабораторное дело.
Форма выпуска : порошок, гранулы, стружка.
Средства индивидуальной защиты: респиратор; защитные очки; перчатки;
Клиническая картина острого отравления : определяется продуктами трансформации.
Першение в горле, кашель, насморк, стеснение и боль в груди, нарушение ритма дыхания, изъязвление и ожоги кожи, слизистой оболочки глаз, полости рта, носа, пищевода и желудка; слюнотечение, тошнота, рвота, диарея, боли в области живота.
Наиболее поражаемые органы и системы: определяется продуктами трансформации.
Дыхательная, сердечно-сосудистая системы, желудочно-кишечный тракт, кожа, глаза.
Раздражающее действие: на кожу: да. На глаза: да.
Первая помощь при отравлениях : при вдыхании – свежий воздух, покой, тепло. При оста-новке дыхания – искусственное дыхание методом «изо рта в рот». При попадании через рот – обильное питье воды, питье глотками растительного масла до 100 мл. Рвоту не вызывать. При попадании на кожу – смыть проточной водой в течение 15 минут. При попадании в глаза – промыть проточной водой в течение 15 минут.
ПДК рыб.хоз-180мг/дм3, класс опасности IV.
Оксид кальция
Хлорид кальция, кальций хлористый
Гидроксид кальция
Карбонат кальция
Сульфат кальция
Нитрат кальция
Карбид кальция
Химический анализ воды, определение кальция в природных и очищенных сточных водах.
ГОСТ10091 Реактивы. Кальций фосфорно-кислый однозамещенный 1-водный.ТУ.
ГОСТ 23999-80 Кальция фосфат кормовой. Технические условия
В уроке 25 «Соли» из курса «Химия для чайников» узнаем, как правильно называть соли, их состав и научимся составлять химические формулы солей.
Как отмечалось в предыдущем уроке, в реакциях кислот с металлами выделяется простое вещество водород Н2. Кроме водорода, образуются и сложные вещества: ZnCl2, MgSO4 и др. Это представители класса широко распространенных в химии соединений — солей (рис. 102).
Здесь же мы рассмотрим состав солей, научимся составлять их формулы, узнаем, как называть соли.
Cостав солей
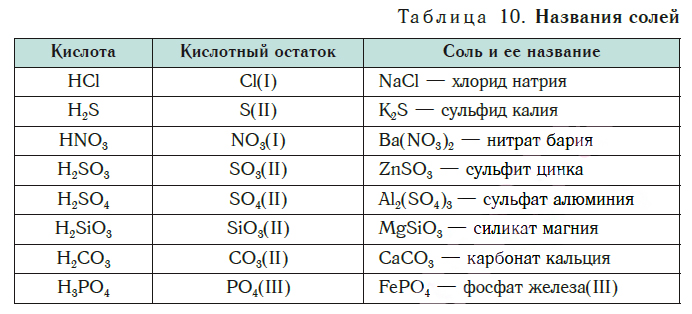
Сравним формулы кислот HCl и H2SO4 c формулами солей ZnCl2 и FeSO4. Мы видим, что в этих формулах одинаковые кислотные остатки Cl(I) и SO4(II). Но в молекулах кислот они соединены с атомами водорода Н, а в формульных единицах солей — с атомами цинка Zn и железа Fe. Значит, эти и другие соли можно рассматривать как продукты замещения атомов водорода в молекулах кислот на атомы металлов. Вещества, подобные ZnCl2 и FeSO4, относят к классу солей.
Соли — это сложные вещества, состоящие из атомов металлов и кислотных остатков.
В солях кислотные остатки соединяются с атомами металлов в соответствии с их валентностью. Для составления химической формулы соли необходимо знать валентность атома металла и валентность кислотного остатка. При этом пользуются тем же правилом, что и при составлении формул бинарных соединений. Для солей это правило следующее: сумма единиц валентности всех атомов металла должна быть равна сумме единиц валентности всех кислотных остатков.
Для примера составим формулу соли, в которую входят атомы кальция и кислотный остаток фосфорной кислоты PO4(III). Кальций проявляет постоянную валентность II, а валентность кислотного остатка PO4 равна III.
Названия солей
Соли образованы атомами разных металлов и различными кислотными остатками. Поэтому состав солей самый разнообразный. Давайте научимся давать им правильные названия.
Название соли состоит из названия кислотного остатка и названия металла в родительном падеже. Например, соль состава NaCl называют «хлорид натрия».
Если входящий в формульную единицу соли атом металла имеет переменную валентность, то она указывается римской цифрой в круглых скобках после его названия. Так, соль FeCl3 называют «хлорид железа(III)», а cоль FeCl2 — «хлорид железа(II)».
В таблице 10 приведены названия некоторых солей.
Соли — это вещества немолекулярного строения. Поэтому их состав выражают с помощью формульных единиц. В них отражено соотношение атомов металлов и кислотных остатков. Например, в формульной единице NaCl на один атом Na приходится один кислотный остаток Cl.
По химической формуле соли можно вычислить ее относительную формульную массу Mr, а также молярную массу M, например:
К солям относится не только поваренная соль (NaCl), но и мел, мрамор (СаСО3), сода (Na2CO3), марганцовка (KMnO4) и др.
Краткие выводы урока:
- Соли — сложные вещества, которые состоят из атомов металлов и кислотных остатков.
- Соли образуются при замещении атомов водорода в молекулах кислот на атомы металлов.
- Соли — вещества немолекулярного строения.
Надеюсь урок 25 «Соли» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Физические свойства
Карбонат кальция CaCO3 — соль кальция и угольной кислоты. Белый, при прокаливании разлагается, плавится без разложения под избыточным давлением CO2. Практически не растворяется в воде.
Относительная молекулярная масса Mr = 100,09; относительная плотность для тв. и ж. состояния d= 2,93; tпл = 1242º C при избыточном давлении.
Способ получения
1. Карбонат кальция можно получить путем взаимодействия хлорида кальция и карбоната кальция, образуется карбонат кальция и хлорид натрия:
CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl
2. В результате взаимодействия при комнатной температуре оксида кальция и углекислого газа происходит образование карбоната кальция:
CaO + CO2 = CaCO3
3. Гидроксид кальция вступает в взаимодействие с углекислым газом и образует карбонат кальция и воду:
Ca(OH)2 + СO2 = CaСO3 + H2O
Качественная реакция
Качественная реакция на карбонат кальция — взаимодействие его с раствором сильных кислот. В результате реакции происходит бурное выделение углекислого газа, образование которого можно проверить, если пропустить его через известковую воду, которая мутнеет из-за образования осадка:
1. При взаимодействии с хлороводородной кислотой, карбонат кальция образует хлорид кальция, углекислый газ и воду:
CaCO3 + 2HCl = CaCl2 + CO2↑ + H2O
Химические свойства
1. Карбонат кальция разлагается при температуре выше 900 — 1200º С, с образованием оксида кальция и углекислого газа:
CaCO3 = CaO + CO2
2. Карбонат кальция вступает в реакцию со многими сложными веществами:
2.1. Карбонат кальция реагирует с оксидами:
2.1.1. Карбонат лития вступает в взаимодействие с оксидом кремния при 800º С и образует на выходе силикат кальция и углекислый газ:
CaCO3 + SiO2 = CaSiO3 + CO2
2.2. Карбонат кальция реагирует с кислотами:
2.2.1. При взаимодействии с разбавленной хлороводородной кислотой карбонат кальция образует хлорид кальция, углекислый газ и воду:
CaCO3 + 2HCl = CaCl2 + CO2↑ + H2O
2.2.2. Карбонат кальция реагирует с разбавленной плавиковой кислотой. Взаимодействие карбоната кальция с плавиковой кислотой приводит к образованию фторида кальция, воды и углекислого газа:
CaCO3 + 2HF = CaF2↓ + CO2↑ + H2O
2.2.3. Карбонат кальция взаимодействует с сероводородной кислотой при 900º С и образует сульфид кальция, воду и углекислый газ:
CaCO3 + H2S = CaS + H2O + CO2
3. Карбонат кальция реагирует с простыми веществами:
3.1. Карбонат кальция при 800 — 850º С вступает в реакцию с углеродом (коксом) образуя оксид кальция и угарный газ:
CaCO3 + C = CaO + 2CO